
Beriplex P/n 500

Consulta con un médico sobre la receta médica de Beriplex P/n 500

Cómo usar Beriplex P/n 500
Hoja de instrucciones para el paciente
Beriplex P/N 500
Polvere y disolvente para la preparación de una solución inyectable
Complejo de protrombina humana
Es importante leer las instrucciones antes de tomar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario
- Debe consultar a su médico o farmacéutico si tiene alguna duda adicional
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros.
- El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si aparecen efectos adversos, incluidos todos los posibles efectos adversos no mencionados en la hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es Beriplex P/N 500 y para qué se utiliza
- 2. Información importante antes de tomar Beriplex P/N 500
- 3. Cómo tomar Beriplex P/N 500
- 4. Posibles efectos adversos
- 5. Cómo conservar Beriplex P/N 500
- 6. Contenido del envase y otra información
1. Qué es Beriplex P/N 500 y para qué se utiliza
Qué es Beriplex P/N 500
Beriplex P/N 500 está disponible como polvo con un disolvente adjunto. Es un polvo blanco o ligeramente coloreado o una masa cristalina quebradiza. La solución preparada está destinada a inyecciones intravenosas.
Beriplex P/N 500 se produce a partir de plasma humano (la parte líquida de la sangre) y contiene factores de coagulación humanos II, VII, IX y X. Los concentrados que contienen estos factores de coagulación se llaman productos del complejo de protrombina. Los factores de coagulación dependientes de la vitamina K (II, VII, IX y X) desempeñan un papel importante en el proceso de coagulación. La falta de cualquiera de estos factores de coagulación hace que la sangre no se coagule tan rápido como debería y aumenta el riesgo de sangrado. La administración de factores de coagulación II, VII, IX y X a través de Beriplex P/N 500 restaurará el mecanismo de coagulación.
Para qué se utiliza Beriplex P/N 500
Beriplex P/N 500 se utiliza para prevenir (durante operaciones quirúrgicas) y tratar sangrados causados por deficiencia adquirida o congénita de factores de coagulación dependientes de la vitamina K (II, VII, IX y X), cuando no está disponible un medicamento que contenga un factor de coagulación específico y purificado.
2. Información importante antes de tomar Beriplex P/N 500
En el siguiente punto se presentan informaciones con las que el paciente y el médico deben familiarizarse antes de tomar Beriplex P/N 500.
Cuándo NO tomar Beriplex P/N 500:
si el paciente es alérgico a los principios activos o a alguno de los demás componentes de este medicamento (enumerados en el punto 6).
Debe informar a su médico sobre cualquier alergia a medicamentos o alimentos.
si existe un mayor riesgo de formación de coágulos (pacientes con riesgo de coagulación intravascular diseminada)
en caso de reacción alérgica a la heparina que cause una disminución del número de plaquetas (trombocitopenia inducida por heparina, TIH tipo II).
Debe informar a su médico o farmacéutico si padece alguna de estas enfermedades.
Precauciones y advertencias
Antes de comenzar a tomar Beriplex, debe discutirlo con su médico o farmacéutico.
- En caso de deficiencia adquirida de factores de coagulación dependientes de la vitamina K. Esto puede deberse a la ingesta de medicamentos que bloquean la acción de la vitamina K. Beriplex P/N 500 solo debe administrarse en caso de necesidad de una corrección rápida del nivel de factores de coagulación del complejo de protrombina, por ejemplo, en caso de sangrados importantes o operaciones quirúrgicas de emergencia.
- En caso de deficiencia congénita de alguno de los factores de coagulación dependientes de la vitamina K, siempre que sea posible, debe administrarse un medicamento que contenga el factor de coagulación específico.
- En caso de reacción alérgica o anafiláctica (reacción alérgica grave que causa problemas respiratorios graves o mareos):
Debe detenerse inmediatamente la administración de Beriplex P/N 500 (por ejemplo, detener la inyección).
- Si existe un mayor riesgo de formación de coágulos en los vasos sanguíneos (trombosis), especialmente en los siguientes casos:
- en pacientes que han sufrido un ataque al corazón (con enfermedad coronaria diagnosticada o infarto de miocardio)
- en pacientes con enfermedades hepáticas
- en pacientes justo antes y después de operaciones quirúrgicas
- en recién nacidos
- en pacientes con mayor riesgo de formación de coágulos (pacientes con riesgo de tromboembolismo o coagulación intravascular diseminada, o deficiencia de inhibidores de la coagulación)
- Si existe un mayor riesgo de trastornos de la coagulación causados por un aumento en el consumo de plaquetas o factores de coagulación. El tratamiento con Beriplex P/N 500 puede iniciarse después de que se haya completado el tratamiento de la enfermedad subyacente.
- Disminución de la producción de plaquetas inducida por heparina (trombocitopenia inducida por heparina, TIH tipo II). La heparina, una proteína que actúa disolviendo los coágulos sanguíneos, es un componente de Beriplex. Una disminución significativa del número de plaquetas puede estar asociada con:
- formación de coágulos en los vasos sanguíneos de las extremidades inferiores,
- aumento de la tendencia a formar coágulos,
- en algunos casos, con erupciones cutáneas en el sitio de inyección,
- moretones y
- aparición de heces negras. En estos casos, la acción de la heparina puede verse afectada (tolerancia a la heparina). Si aparecen estos síntomas, debe detenerse inmediatamente la administración del medicamento y consultar a su médico. En el futuro, no debe tomar medicamentos que contengan heparina.
- Una forma especial de inflamación renal se ha informado después del tratamiento de pacientes con hemofilia B con inhibidores del factor IX. En estos pacientes, se habían producido reacciones alérgicas en el pasado.
El médico debe considerar los beneficios del tratamiento con Beriplex P/N 500 en relación con el riesgo de aparición de las complicaciones mencionadas.
Seguridad antiviral
Cuando los medicamentos se obtienen de la sangre o el plasma humano, se utilizan varios métodos para evitar la transmisión de agentes infecciosos al paciente. Estos incluyen:
- selección adecuada de donantes de sangre y plasma para evitar la transmisión de agentes infecciosos,
- análisis de donantes individuales y de pools de plasma para detectar la presencia de virus y otras infecciones,
- incorporación de etapas en el proceso de fabricación para inactivar o eliminar los virus.
A pesar de la implementación de estas medidas de seguridad, no se puede excluir completamente el riesgo de contraer enfermedades infecciosas al tomar medicamentos obtenidos de la sangre o el plasma humano. Esto se aplica también a patógenos desconocidos y otros tipos de infecciones.
Los métodos utilizados se consideran efectivos contra virus como el virus de la inmunodeficiencia humana (VIH, que causa el SIDA), el virus de la hepatitis B, el virus de la hepatitis C (hepatitis viral) y el virus de la hepatitis A (hepatitis viral) y el parvovirus B19.
El médico puede recomendar la vacunación contra la hepatitis A y B si se toman regularmente medicamentos obtenidos del plasma humano.
Es muy importante que, en cada administración de Beriplex P/N 500, se anote en la historia clínica el nombre y el lote del medicamento para documentar los lotes utilizados.
Beriplex P/N 500 y otros medicamentos
- Debe informar a su médico o farmacéutico sobre todos los medicamentos que está tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar.
- Beriplex P/N 500 puede inhibir la acción de los antagonistas de la vitamina K. No se conocen interacciones con otros medicamentos.
- No debe mezclar Beriplex P/N 500 con otros medicamentos, excepto aquellos mencionados en el punto 6.
Embarazo, lactancia y fertilidad
- Si está embarazada, en período de lactancia o si sospecha que está embarazada, o si planea quedarse embarazada, debe consultar a su médico o farmacéutico antes de tomar este medicamento.
- En mujeres embarazadas o en período de lactancia, Beriplex P/N 500 solo debe administrarse si es absolutamente necesario.
- No hay datos disponibles sobre el efecto en la fertilidad.
Conducción de vehículos y uso de máquinas
No hay estudios adecuados que documenten el efecto del medicamento en la conducción de vehículos y el uso de máquinas.
Beriplex P/N 500 contiene sodio
Beriplex P/N 500 contiene hasta 343 mg de sodio (aproximadamente 15 milimoles) en 100 ml. Esta cantidad debe tenerse en cuenta en pacientes con dieta controlada de sodio.
3. Cómo tomar Beriplex P/N 500
El tratamiento debe iniciarse bajo la supervisión de un médico con experiencia en el tratamiento de este tipo de trastornos.
Dosis
La dosis recomendada de factores II, VII, IX y X, así como la duración del tratamiento, dependen de varios factores, como el peso corporal, la gravedad y el curso de la enfermedad, la ubicación y la intensidad del sangrado, así como la necesidad de prevenir sangrados durante operaciones o procedimientos diagnósticos (véase el punto "Información destinada exclusivamente al personal médico").
Si tiene alguna duda sobre la administración del medicamento, debe consultar a su médico o farmacéutico.
Sobredosis
Durante el tratamiento, el médico debe controlar regularmente los parámetros de coagulación.
La administración de grandes dosis de concentrado de factores de coagulación del complejo de protrombina se ha asociado con la aparición de infarto de miocardio, coagulación intravascular diseminada y formación de coágulos en los vasos sanguíneos en pacientes con mayor riesgo de desarrollar estos trastornos.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Los siguientes efectos adversos se han observado frecuentemente(en menos de 1 de cada 10 pacientes):
- Riesgo de aumento de la formación de coágulos (véase el punto 2)
- Dolor de cabeza
- Fiebre
Los siguientes efectos adversos se han observado con poca frecuencia(en menos de 1 de cada 100 pacientes):
- Sensibilidad o reacciones alérgicas (véase el punto 2)
La frecuencia de aparición de los siguientes efectos adversos es desconocida(no puede determinarse con los datos disponibles):
- Sangrados graves como resultado de una coagulación excesiva
- Reacciones anafilácticas con shock incluido (véase el punto 2)
- Formación de anticuerpos circulantes que inhiben uno o más factores de coagulación
Niños y adolescentes
No hay datos disponibles sobre el uso de Beriplex en niños y adolescentes.
Notificación de efectos adversos
Si aparecen efectos adversos, incluidos todos los posibles efectos adversos no mencionados en la hoja de instrucciones, debe informar a su médico o farmacéutico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad.
La notificación de efectos adversos también puede hacerse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Beriplex P/N 500
- El medicamento debe conservarse en un lugar donde no pueda ser visto ni alcanzado por los niños.
- No debe tomar Beriplex P/N 500 después de la fecha de caducidad indicada en el etiquetado y el envase.
- No debe conservar a una temperatura superior a 25°C.
- No debe congelar.
- El frasco debe conservarse en el envase exterior para protegerlo de la luz.
- Beriplex P/N 500 no contiene conservantes, por lo que el producto reconstituido debe usarse de inmediato.
6. Contenido del envase y otra información
Qué contiene Beriplex P/N 500?
Beriplex P/N 500 contiene 400-620 UI de factor IX humano en un frasco.
El principio activo es:
Concentrado de factores de coagulación humanos II, VII, IX y X, proteínas C y S.
Los demás componentes son:
Antitrombina III humana, heparina, albúmina humana, cloruro de sodio, citrato de sodio, HCl o NaOH (en cantidades pequeñas, para ajustar el pH).
Disolvente: Agua para inyección.
Cómo se presenta el medicamento y qué contiene el envase?
Beriplex P/N 500 es un polvo blanco o ligeramente coloreado y se suministra con agua para inyección como disolvente. El polvo debe reconstituirse en 20 ml de agua para inyección.
La solución reconstituida debe ser transparente o ligeramente opalescente, lo que significa que puede tener un brillo cuando se observa bajo la luz, y no debe contener partículas sólidas.
Envases disponibles
El envase que contiene 500 UI de medicamento incluye:
- 1 frasco con polvo
- 1 frasco con 20 ml de agua para inyección
- 1 sistema de transferencia 20/20 con filtro
Nombre y dirección del titular de la autorización de comercialización y del fabricante:
CSL Behring GmbH
Emil-von-Behring-Str. 76
35041 Marburg
Alemania
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres
Nombres y direcciones de los titulares de la autorización de comercialización en cada país
Austria
Beriplex P/N 500 I.E. Polvo y disolvente para solución inyectable
Bélgica
Confidex 500 I.E., polvo y disolvente para solución inyectable
Bulgaria
Croacia
República Checa
Dinamarca
Beriplex P/N 500, 500 UI, polvo y disolvente para solución inyectable
Beriplex P/N 500 UI polvo y disolvente para solución inyectable
Beriplex 500 UI
Confidex
Finlandia
Confidex 500 UI polvo y disolvente para solución inyectable
Francia
Confidex 500 UI, polvo y disolvente para solución inyectable
Alemania
Beriplex P/N 500
Grecia
Beriplex P/N
Polvere y disolvente para solución inyectable 500 UI/vial
Hungría
Irlanda
Beriplex P/N 500 polvo y disolvente para solución inyectable
Beriplex P/N 500 UI, polvo y disolvente para solución inyectable
Italia
Confidex 500
Luxemburgo
Confidex 500 UI polvo y disolvente para solución inyectable
Malta
Países Bajos
Beriplex P/N 500, polvo y disolvente para solución inyectable
Beriplex P/N 500 IE, polvo y disolvente para solución inyectable
Noruega
Polonia
Confidex 500 UI polvo y disolvente para solución inyectable
Beriplex P/N 500
Portugal
Beriplex 500 UI polvo y disolvente para solución inyectable
Rumania
Eslovaquia
Eslovenia
España
Beriplex P/N 500 UI polvo y disolvente para solución inyectable
Beriplex 500 UI
Beriplex P/N 500 i.e. polvo y disolvente para solución inyectable
Beriplex 500 UI polvo y disolvente para solución inyectable
Suecia
Confidex 500 IE, polvo y disolvente para solución inyectable
Reino Unido
Beriplex P/N 500 UI, polvo y disolvente para solución inyectable
Fecha de la última revisión de la hoja de instrucciones:
Información destinada exclusivamente al personal médico
Composición cualitativa y cuantitativa
Beriplex P/N 500 contiene nominalmente las siguientes cantidades de UI de factores de coagulación humanos, como se indica en la tabla a continuación:
| Nombre del componente | Contenido después de la reconstitución (UI/ml) | Contenido en un frasco de Beriplex P/N 500 (UI) |
| Principios activos | ||
| Factor II humano |
|
|
| Factor VII humano |
| 200 -500 |
| Factor IX humano |
|
|
| Factor X humano |
|
|
| Principios activos adicionales | ||
| Proteína C |
|
|
| Proteína S |
|
|
El contenido de proteína total después de la reconstitución es de 6-14 mg/ml en la solución.
La actividad específica del factor IX es de 2,5 UI por mg de proteína total.
La actividad de todos los factores de coagulación, así como la de las proteínas C y S (antígenos), se ha determinado de acuerdo con los estándares internacionales actuales de la OMS.
Dosis y vía de administración Dosis
A continuación, se presentan solo las reglas generales de dosificación.
La cantidad de dosis y la frecuencia de administración deben calcularse individualmente para cada paciente. Los intervalos entre dosis deben adaptarse a los valores del período de semivida de los factores de coagulación del complejo de protrombina. La dosis individual se determina en función de la determinación regular de la actividad en suero de los factores de coagulación individuales, o en función de los resultados de los análisis de laboratorio que evalúan en general la actividad del complejo de protrombina (INR, relación de Quick) y mediante el monitoreo continuo del estado clínico del paciente.
En el caso de intervenciones quirúrgicas mayores, es necesario un monitoreo preciso del tratamiento de reemplazo (pruebas para factores de coagulación individuales y pruebas generales para factores de coagulación del complejo de protrombina).
- Sangrados y profilaxis de sangrados durante el tratamiento con antagonistas de la vitamina K::
La dosis del medicamento depende del valor de la relación de Quick antes del inicio del tratamiento y del valor de la relación de Quick que el paciente debe alcanzar. La relación de Quick antes del tratamiento debe medirse en el momento más cercano posible antes de la administración del medicamento para permitir el cálculo de la dosis adecuada del producto.
La siguiente tabla indica las dosis aproximadas (ml/kg de peso corporal de producto reconstituido y UI de factor IX/kg de peso corporal) para normalizar la relación de Quick (es decir, relación de Quick ≤ 1,3) en función de los valores iniciales de la relación de Quick.
| Valor de la relación de Quick antes del tratamiento | 2,0 – 3,9 | 4,0 – 6,0 | >6,0 |
| Dosis aproximada en ml/kg de peso corporal | 1 |
| 2 |
| Dosis aproximada en UI de factor IX/kg de peso corporal | 25 | 35 | 50 |
La dosis se calcula en función del peso corporal, siempre que no supere los 100 kg. En pacientes con un peso corporal superior a 100 kg, la dosis máxima única (UI de factor IX) no debe superar los 2500 UI para una relación de Quick de 2,0-3,9; 3500 UI para una relación de Quick de 4,0-6,0 y 5000 UI para una relación de Quick > 6,0.
La normalización de los trastornos de la hemostasia causados por los antagonistas de la vitamina K suele lograrse aproximadamente 30 minutos después de la inyección. La administración concomitante de vitamina K debe considerarse en pacientes que reciben Beriplex para la reversión urgente de los antagonistas de la vitamina K, ya que el efecto de la vitamina K suele lograrse en 4-6 horas.
La administración repetida de Beriplex en pacientes que requieren la reversión urgente de los antagonistas de la vitamina K no está respaldada por estudios clínicos y, por lo tanto, no se recomienda.
Estas recomendaciones se basan en estudios clínicos realizados en un número limitado de personas.
Es necesario monitorear el valor de la relación de Quick durante el tratamiento, ya que la eficacia y la duración del efecto pueden variar entre pacientes.
- Sangrados y profilaxis de sangrados en pacientes con deficiencia congénita de algún factor de coagulación dependiente de la vitamina K, cuando no es posible la administración de un medicamento que contenga el factor de coagulación específico
El cálculo de la dosis necesaria de concentrado de factores de coagulación del complejo de protrombina se basa en estudios clínicos:
- 1 UI de factor IX por kg de peso corporal produce un aumento esperado de la actividad del factor IX en suero del 1,3% (0,013 UI/ml) con respecto a la normalidad,
- 1 UI de factor VII por kg de peso corporal produce un aumento de la actividad del factor VII en suero del 1,7% con respecto a la normalidad (0,017 UI/ml),
- 1 UI de factor II por kg de peso corporal aumenta la actividad del factor II en suero del 1,9% con respecto a la normalidad (0,019 UI/ml),
- 1 UI de factor X por kg de peso corporal aumenta la actividad del factor X en suero del 1,9% con respecto a la normalidad (0,019 UI/ml).
La dosis de cada factor de coagulación se expresa en unidades internacionales (UI), de acuerdo con el estándar vigente para cada factor de coagulación aprobado por la Organización Mundial de la Salud (OMS). La actividad del factor de coagulación en suero se expresa como porcentaje (con respecto al suero humano normal) o en unidades internacionales (de acuerdo con el estándar internacional para el factor de coagulación específico en suero).
Una unidad internacional (UI) de actividad del factor de coagulación es igual a la actividad de ese factor contenida en 1 ml de suero humano normal.
Por ejemplo, el cálculo de la dosis necesaria de factor X se basa en la observación empírica de que 1 UI de factor X por kg de peso corporal aumenta la actividad del factor X en suero en 0,019 UI/ml.
La dosis necesaria se calcula utilizando la siguiente fórmula:
Número de unidades necesarias = peso corporal [kg] x aumento deseado de la actividad del factor X [UI/ml] x 53,
donde 53 (ml/kg) es el recíproco del valor estimado de recuperación.
Es importante tener en cuenta que estos cálculos se basan en datos de pacientes que reciben antagonistas de la vitamina K. Los cálculos basados en datos de personas sanas proporcionarían un valor más bajo de la dosis necesaria.
Si se conoce el valor individual de recuperación, debe utilizarse para los cálculos.
Los datos del producto están disponibles en función de estudios clínicos realizados en voluntarios sanos (N = 15), en la reversión de los antagonistas de la vitamina K en el tratamiento de sangrados agudos importantes o en la profilaxis de sangrados quirúrgicos (N = 98, N = 43)
Niños y adolescentes
La seguridad y eficacia del medicamento Beriplex P/N 500 en niños y adolescentes no se han establecido en estudios clínicos controlados.
Personas mayores
La dosis y la vía de administración en personas mayores (> 65 años) son las mismas que las recomendaciones generales.
Vía de administración Instrucciones generales
- La solución debe ser transparente o ligeramente opalescente. Después de la filtración y la extracción de la solución reconstituida (véase a continuación), antes de su administración, debe comprobarse que no contenga partículas visibles a simple vista o decoloración. No deben administrarse soluciones turbias o que contengan sedimento o partículas.
- La reconstitución y la extracción del frasco deben realizarse en condiciones asépticas.
Reconstitución
Calentar el disolvente a temperatura ambiente.
Asegurarse de que los tapones de los frascos con polvo y con disolvente estén retirados, frotar las tapas de goma con un líquido aséptico y dejar que las tapas se sequen antes de abrir el envase Mix2Vial.
1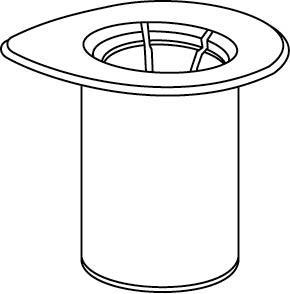 |
|
2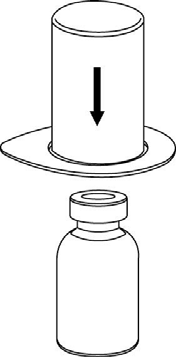 |
|
3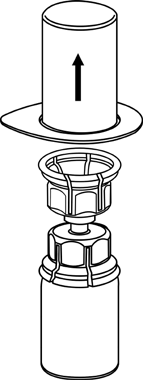 |
|
4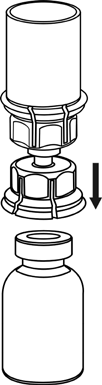 |
|
Extracción y administración
8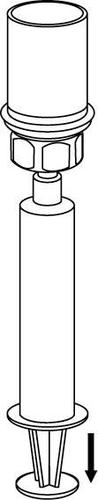 |
|
9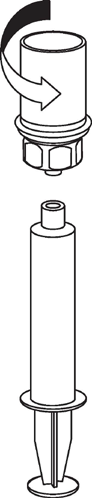 |
|
Debe tener cuidado de que la sangre no entre en la jeringa llena de producto. Esto puede causar una reacción de los factores de coagulación presentes en el producto y la formación de coágulos de fibrina, que pueden ser administrados al paciente.
Si se requiere la administración de más de un frasco de producto Beriplex, existe la posibilidad de combinar varios frascos para administrar como una infusión única mediante un conjunto de administración disponible en el mercado.
No debe diluir la solución del producto Beriplex.
La solución reconstituida debe administrarse por vía intravenosa (no más rápido que 8 ml/min*).
Todo el producto no utilizado o los desechos deben eliminarse de acuerdo con las regulaciones locales.
Precauciones y advertencias especiales para la administración.
No hay datos clínicos disponibles sobre el uso de Beriplex P/N 500 en el caso de sangrados posparto debido a deficiencia de vitamina K en recién nacidos.
_________________________________________________
*En los estudios clínicos de Beriplex, los pacientes que pesaban menos de 70 kg tenían una dosis recomendada con una velocidad máxima de infusión de 0,12 ml/kg/min (por debajo de 8 ml/min).
Observaciones sobre el control de la cuenta de plaquetas:
Debe monitorear estrechamente la cuenta de plaquetas.
Interacciones con otros medicamentos y otros tipos de interacciones
En el caso de realizar pruebas de coagulación sensibles a la presencia de heparina en pacientes que reciben altas dosis de factores de coagulación del complejo de protrombina, en los resultados de las pruebas debe tenerse en cuenta la dosis de heparina contenida en el producto.
- País de registro
- Principio activo
- Requiere recetaSí
- ImportadorCSL Behring GmbH
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Beriplex P/n 500Forma farmacéutica: Polvo, 1000 UIPrincipio activo: Coagulation factor IX, II, VII and X in combinationRequiere recetaForma farmacéutica: Polvo, 250 UIPrincipio activo: Coagulation factor IX, II, VII and X in combinationRequiere recetaForma farmacéutica: Polvo, 500 UIPrincipio activo: Coagulation factor IX, II, VII and X in combinationRequiere receta
Alternativas a Beriplex P/n 500 en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Beriplex P/n 500 en España
Alternativa a Beriplex P/n 500 en Ucrania
Médicos online para Beriplex P/n 500
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Beriplex P/n 500 – sujeta a valoración médica y normativa local.














