
Antitirombin Iii Nf Takeda

Consulta con un médico sobre la receta médica de Antitirombin Iii Nf Takeda

Cómo usar Antitirombin Iii Nf Takeda
Hoja de instrucciones incluida en el paquete: información para el usuario
Antithrombin III NF Shire, 50 UI/ml, polvo y disolvente para la preparación de una solución para infusión
Humana antitrombina III procedente de plasma
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de tomar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico o farmacéutico.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Antithrombin III NF Shire y para qué se utiliza
- 2. Información importante antes de tomar Antithrombin III NF Shire
- 3. Cómo tomar Antithrombin III NF Shire
- 4. Posibles efectos adversos
- 5. Cómo conservar Antithrombin III NF Shire
- 6. Contenido del paquete y otra información
1. Qué es Antithrombin III NF Shire y para qué se utiliza
Antithrombin III NF Shire se presenta en forma de polvo o sustancia blanquecina con un disolvente para la preparación de una solución para infusión.
Antithrombin III NF Shire pertenece a un grupo farmacoterapéutico llamado agentes anticoagulantes.
Antithrombin III NF Shire se utiliza para el tratamiento de la deficiencia congénita o adquirida de antitrombina III, donde la deficiencia adquirida puede ocurrir en el curso de varios trastornos clínicos.
2. Información importante antes de tomar Antithrombin III NF Shire
Cuándo no tomar Antithrombin III NF Shire:
- si el paciente es alérgico a la antitrombina III o a cualquier otro componente de este medicamento (enumerado en el punto 6)
- en pacientes con trombocitopenia inducida por heparina (es decir, disminución del número de plaquetas) en su historial
Precauciones y medidas de precaución
- Debe informar a su médico si experimenta los primeros síntomas de una reacción alérgica (por ejemplo, urticaria, incluida la urticaria generalizada, presión en el pecho, respiración silbante, hipotensión y shock anafiláctico). Los síntomas graves pueden requerir tratamiento de emergencia.
- Debe informar a su médico si está tomando o ha tomado recientemente medicamentos que contengan heparina (por ejemplo, para el tratamiento de la trombosis), ya que el efecto de la antitrombina se ve significativamente aumentado por la heparina.
- Antithrombin III NF Shire se produce a partir de plasma humano. En el caso de medicamentos obtenidos a partir de sangre o plasma humano, no se puede excluir completamente el riesgo de transmisión de agentes infecciosos. Esto también se aplica a patógenos desconocidos hasta ahora. Sin embargo, el riesgo de transmisión de agentes infecciosos se reduce mediante la selección cuidadosa de los donantes y el plasma, las pruebas de los bancos de plasma y los procedimientos de inactivación/eliminación de virus.
Niños
No se debe administrar este medicamento a niños menores de 6 años, ya que no se ha determinado la seguridad ni la eficacia en este grupo de edad.
3. Cómo tomar Antithrombin III NF Shire
Antithrombin III NF Shire se administrará exclusivamente bajo supervisión médica. La dosis dependerá del peso corporal y de las necesidades individuales del paciente. El médico determinará la dosis que debe administrarse. Antithrombin III NF Shire se administrará en infusión intravenosa.
Uso de una dosis mayor que la recomendada de Antithrombin III NF Shire
No se han notificado síntomas de sobredosis de antitrombina.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentan.
- Sensibilidad o reacciones alérgicas como: angioedema, ardor y picazón en el lugar de la infusión, escalofríos, sofocos, urticaria generalizada, dolor de cabeza, erupción cutánea pruriginosa, hipotensión, somnolencia, náuseas, ansiedad, taquicardia, sensación de opresión en el pecho, parestesia, vómitos, respiración silbante, que se han observado raramente, pero pueden convertirse en una reacción anafiláctica grave (incluido el shock).
- En casos raros, se ha observado fiebre.
- En casos raros, puede ocurrir trombocitopenia (es decir, disminución del número de plaquetas), cuyo mediador son los anticuerpos inducidos por la heparina. Se ha observado una disminución del número de plaquetas por debajo de 100.000/µl o una disminución del número de plaquetas en un 50%.
Notificación de efectos adversos
Si se producen efectos adversos, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad:
Al. Jerozolimskie 181C
02-222 Varsovia
Tel.: +48 22 49 21 301
Fax: +48 22 49 21 309
Correo electrónico: [email protected]
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
Gracias a la notificación de los efectos adversos, se puede recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Antithrombin III NF Shire
El medicamento debe conservarse en un lugar inaccesible para los niños.
Conservar en refrigerador (2°C a 8°C). No congelar.
Conservar en el embalaje original para protegerlo de la luz.
No usar Antithrombin III NF Shire después de la fecha de caducidad indicada en la etiqueta y el embalaje de cartón. La fecha de caducidad es el último día del mes indicado.
No usar Antithrombin III NF Shire si la solución es turbia o contiene depósitos.
No desechar los medicamentos por el desagüe ni en los contenedores de basura doméstica. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se necesitan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Antithrombin III NF Shire?
- El principio activo del medicamento es la antitrombina humana procedente de plasma
- Los demás componentes son glucosa, cloruro de sodio, citrato de sodio dihidratado y Tris(hidroximetil)aminometano
Cómo se presenta Antithrombin III NF Shire y qué contiene el paquete?
Antithrombin III NF Shire se presenta en forma de polvo para la preparación de una solución para infusión que contiene nominalmente 500 UI (o 1000 UI) de antitrombina procedente de plasma humano en una ampolla y disolvente.
Después de la reconstitución en 10 ml (o 20 ml) de agua para inyección, el medicamento contiene aproximadamente 50 UI/ml (500 UI/10 ml o 1000 UI/20 ml) de antitrombina humana procedente de plasma.
Antithrombin III NF Shire es un polvo o sustancia blanquecina.
Cada paquete también contiene:
- 1 aguja de transferencia
- 1 aguja con filtro
- 1 aguja de ventilación
- 1 aguja de un solo uso
- 1 conjunto para infusión
Titular de la autorización de comercialización y fabricante
Titular de la autorización de comercialización
Shire Polska Sp. z o.o.
Plac Europejski 1
00-844 Varsovia
Fabricante
Baxter AG
Industriestrasse 67
A-1220 Viena, Austria
Fecha de la última actualización de la hoja de instrucciones:
Información destinada exclusivamente al personal médico especializado:
Dosificación y administración
El tratamiento debe realizarse bajo la supervisión de un médico con experiencia en el tratamiento de pacientes con deficiencia de antitrombina.
Dosificación
En la deficiencia congénita de antitrombina, la dosis debe determinarse individualmente para cada paciente y tener en cuenta el historial familiar de eventos trombóticos, los factores de riesgo actuales y los resultados de las pruebas de laboratorio.
La dosis y la duración de la terapia de sustitución en la deficiencia adquirida dependen del nivel de antitrombina en el plasma, la presencia de síntomas de consumo aumentado, la causa del trastorno y la gravedad del estado clínico del paciente. En cada caso, la dosis y la frecuencia de administración deben determinarse según los resultados de las pruebas de laboratorio y la evaluación del estado clínico del paciente y su respuesta al tratamiento.
La corrección de la dosis debe tener en cuenta tanto el consumo aumentado de antitrombina como los resultados de las pruebas de laboratorio y los síntomas clínicos. Durante el tratamiento, la actividad de la antitrombina debe mantenerse por encima del 80%, a menos que las condiciones clínicas requieran un nivel diferente.
La dosis inicial en la deficiencia congénita es de 30-50 UI/kg de peso corporal.
Posteriormente, la dosis y la frecuencia de administración, así como la duración del tratamiento, deben adaptarse a los resultados de las pruebas de laboratorio y al estado clínico del paciente.
Niños y adolescentes
No se ha determinado la seguridad ni la eficacia de Antithrombin III NF Shire en niños menores de 6 años. Por lo tanto, no se recomienda el uso de este medicamento en este grupo de pacientes.
Forma de administración
Administrar por vía intravenosa. La velocidad máxima de infusión es de 5 ml/min.
Medidas especiales de precaución para la eliminación y preparación del medicamento para su administración
Antithrombin III NF Shire debe reconstituirse justo antes de la administración.
Debe utilizarse solo el conjunto de infusión proporcionado. Durante la preparación de la solución, deben seguirse técnicas asépticas. La solución preparada debe usarse inmediatamente después de la preparación (ya que no contiene conservantes).
Antes de la administración, debe comprobarse si el medicamento reconstituido contiene partículas insolubles o ha cambiado de color. La solución debe ser transparente o ligeramente opalescente. No deben administrarse soluciones que estén turbias o contengan depósitos.
Todos los residuos del medicamento o sus desechos deben eliminarse de acuerdo con las regulaciones locales.
Preparación de la solución:
- 1. Llevar la ampolla cerrada que contiene el disolvente (agua para inyección) a la temperatura ambiente (máximo 37°C).
- 2. Retirar las cápsulas protectoras de las ampollas que contienen el polvo y el disolvente (fig. A) y desinfectar los tapones de goma de ambas ampollas.
- 3. Retirar la cubierta protectora de un extremo de la aguja de transferencia, girando y tirando (fig. B). Introducir el extremo descubierto de la aguja en el tapón de goma de la ampolla que contiene el disolvente (fig. C).
- 4. Retirar la cubierta protectora del otro extremo de la aguja de transferencia, teniendo cuidado de no tocar la parte descubierta.
- 5. Invertir la ampolla que contiene el disolvente y introducir el extremo libre de la aguja de transferencia en el tapón de la ampolla que contiene el polvo (fig. D). El disolvente se absorberá en la ampolla que contiene el polvo por succión.
- 6. Separar las dos ampollas retirando la aguja de transferencia de la ampolla que contiene el polvo (fig. E). Agitar suavemente la ampolla para acelerar la disolución.
- 7. Después de la disolución completa del polvo, introducir la aguja de ventilación proporcionada (fig. F), y la espuma se asentará. Retirar la aguja de ventilación.
Administración:
- 8. Retirar la cubierta de la aguja con filtro proporcionada, girando y tirando, y colocarla en una jeringa estéril de un solo uso. Aspirar la solución en la jeringa (fig. G).
- 9. Retirar la aguja con filtro de la jeringa y, después de colocar la aguja de un solo uso proporcionada (o el conjunto de infusión proporcionado), administrar la solución lentamente por vía intravenosa (velocidad máxima de administración: 5 ml/min).
Si el medicamento no se ha filtrado durante la reconstitución, debe utilizarse un conjunto de infusión de un solo uso con un filtro adecuado (velocidad máxima de infusión: 5 ml/min).
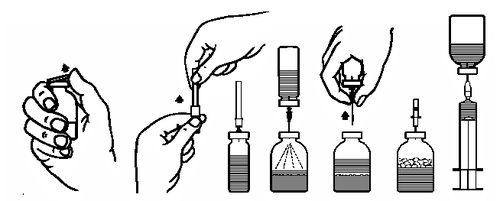
fig. A fig. B
fig. C fig. D
fig. E fig. F fig. G
Incompatibilidades farmacéuticas
No debe mezclarse este medicamento con otros medicamentos.
Precauciones y medidas de precaución especiales para la administración
Al igual que con otros medicamentos que contienen proteínas administrados por vía intravenosa, la administración de Antithrombin III NF Shire puede causar reacciones de hipersensibilidad de tipo alérgico. Durante la infusión, los pacientes deben ser monitorizados de cerca y observados atentamente para detectar cualquier efecto adverso. Debe informar a los pacientes sobre los primeros síntomas de una reacción de hipersensibilidad, como erupción cutánea pruriginosa, urticaria generalizada, sensación de opresión en el pecho, respiración silbante, hipotensión y shock anafiláctico. Si estos síntomas ocurren después de la administración del medicamento, el paciente debe ponerse en contacto con su médico.
En caso de shock, debe aplicarse el tratamiento estándar.
Shire es una marca registrada de Shire Pharmaceutical Holdings Ireland Limited o sus empresas filiales.
- País de registro
- Principio activo
- Requiere recetaNo
- Fabricante
- ImportadorTakeda Manufacturing Austria AG
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Antitirombin Iii Nf TakedaForma farmacéutica: Polvo, 500 UIPrincipio activo: Antitrombina iiiFabricante: Instituto Grifols S.A.No requiere recetaForma farmacéutica: Polvo, 1000 UIPrincipio activo: Antitrombina iiiFabricante: Instituto Grifols S.A.No requiere recetaForma farmacéutica: Polvo, 50 UI/ml; 500 UIPrincipio activo: Antitrombina iiiFabricante: Takeda Manufacturing Austria AGNo requiere receta
Alternativas a Antitirombin Iii Nf Takeda en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Antitirombin Iii Nf Takeda en Україна
Alternativa a Antitirombin Iii Nf Takeda en Іспанія
Médicos online para Antitirombin Iii Nf Takeda
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Antitirombin Iii Nf Takeda – sujeta a valoración médica y normativa local.














