
NUWIQ 1500 IU POWDER AND SOLVENT FOR INJECTABLE SOLUTION

How to use NUWIQ 1500 IU POWDER AND SOLVENT FOR INJECTABLE SOLUTION
Translated with AI
This page provides general information and does not replace a doctor’s consultation. Always consult a doctor before taking any medication. Seek urgent medical care if symptoms are severe.
Show translationContents of the leaflet
Introducción
- PROSPECTO
Prospecto: información para el usuario
Nuwiq 250 UI polvo y disolvente para solución inyectable
Nuwiq 500 UI polvo y disolvente para solución inyectable
Nuwiq 1000 UI polvo y disolvente para solución inyectable
Nuwiq 1500UI polvo y disolvente para solución inyectable
Nuwiq 2000 UI polvo y disolvente para solución inyectable
Nuwiq 2500 UI polvo y disolvente para solución inyectable
Nuwiq 3000 UI polvo y disolvente para solución inyectable
Nuwiq 4000 UI polvo y disolvente para solución inyectable
simoctocog alfa (factor VIII de coagulación humano recombinante)
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Nuwiq y para qué se utiliza
- Qué necesita saber antes de empezar a usar Nuwiq
- Cómo usar Nuwiq
- Posibles efectos secundarios
- Conservación de Nuwiq
- Contenido del envase e información adicional
1. Qué es Nuwiq y para qué se utiliza
Nuwiq contiene el principio activo factor VIII de coagulación humano recombinante (simoctocog alfa). El factor VIII es necesario para que la sangre forme coágulos y detenga la hemorragia. En pacientes con hemofilia A (deficiencia congénita del factor VIII), el factor VIII falta o no actúa correctamente.
Nuwiq reemplaza el factor VIII que falta y se utiliza para el tratamiento y la prevención de hemorragias en pacientes con hemofilia A y se puede usar en todos los grupos de edad.
2. Qué necesita saber antes de empezar a usar Nuwiq
No use Nuwiq:
- si es alérgico al principio activo simoctocog alfa o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
Si no está seguro de ello, pregunte a su médico.
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Nuwiq.
Existe una rara posibilidad de que experimente una reacción anafiláctica (una súbita reacción alérgica grave) a Nuwiq. Debe poder reconocer los síntomas tempranos de las reacciones alérgicas, que se incluyen en la sección 4 "Reacciones alérgicas".
Si se produce cualquiera de estos síntomas, detenga la inyección de inmediato y póngase en contacto con su médico.
La formación de inhibidores (anticuerpos) es una complicación conocida que se puede producir durante el tratamiento con todos los medicamentos compuestos por factor VIII. Estos inhibidores, en especial en grandes cantidades, impiden que el tratamiento funcione de forma correctam, por lo que a usted y a su hijo se les controlará cuidadosamente por si desarrollan dichos inhibidores. Si su hemorragia o la de su hijo no se controla con Nuwiq, consulte a su médico de manera inmediata.
Acontecimientos cardiovasculares
En pacientes con presencia de factores de riesgo cardiovascular, el tratamiento restitutivo con FVIII puede incrementar el riesgo cardiovascular.
Complicaciones asociadas a los catéteres
Si usted requiere un dispositivo de acceso venoso central (CVAD), hay que tener en cuenta el riesgo de complicaciones asociadas al CVAD, incluidas las infecciones localizadas, la presencia de bacterias en la sangre y la trombosis en el lugar de implantación del catéter.
Es importante llevar un registro del número de lote de Nuwiq. Por consiguiente, cada vez que reciba un nuevo envase de Nuwiq, anote la fecha y el número de lote (indicado en el envase después de Lote) y conserve esta información en un lugar seguro.
Otros medicamentos y Nuwiq
Informe a su médico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento.
Conducción y uso de máquinas
Nuwiq no influye sobre la capacidad para conducir y utilizar máquinas.
Nuwiq contiene sodio
Este medicamento contiene 18,4 mg de sodio (componente principal de la sal de mesa/para cocinar) en cada vial. Esto equivale al 0,92 % de la ingesta diaria máxima de sodio recomendada para un adulto.
3. Cómo usar Nuwiq
El tratamiento con Nuwiq será iniciado por un médico con experiencia en el cuidado de pacientes con hemofilia A. Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o enfermero. En caso de duda, consulte de nuevo a su médico o enfermero.
Nuwiq se inyecta normalmente en una vena (intravenosamente) por su médico o un enfermero con experiencia en el cuidado de pacientes con hemofilia A. Usted mismo u otra persona también podrían inyectarle Nuwiq pero solo después de haber recibido la formación adecuada.
Su médico calculará su dosis de Nuwiq (en Unidades Internacionales = UI) dependiendo de su estado y peso corporal y de si se está utilizando como prevención o como tratamiento de las hemorragias. La frecuencia con que necesitará una inyección dependerá de lo bien que actúe Nuwiq en usted. Normalmente, el tratamiento de la hemofilia A es un tratamiento de por vida.
Prevención de las hemorragias
La dosis habitual de Nuwiq es de 20 a 40 UI por kg de peso corporal, suministradas cada 2 a 3 días. Sin embargo, en algunos casos, especialmente en los pacientes más jóvenes, podrían ser necesarias inyecciones más frecuentes o dosis más altas.
Tratamiento de las hemorragias
La dosis de Nuwiq se calcula dependiendo de su peso corporal y de los niveles de factor VIII que se deben alcanzar. Los niveles objetivos de factor VIII dependerán de la gravedad y localización de las hemorragias.
Si tiene la impresión de que el efecto de Nuwiq es insuficiente, consulte a su médico. Su médico le hará los análisis de laboratorio pertinentes para asegurarse de que tenga los niveles adecuados de factor VIII. Esto es de especial importancia si le van a someter a una cirugía mayor.
Pacientes que desarrollan inhibidores del factor VIII
Si su factor VIII plasmático no consigue alcanzar los niveles esperados con Nuwiq, o si no se consiguen controlar las hemorragias adecuadamente, se podría deber al desarrollo de inhibidores del factor VIII. Su médico lo comprobará. Puede que necesite una dosis más alta de Nuwiq o un producto diferente para controlar las hemorragias. No aumente la dosis total de Nuwiq para controlar sus hemorragias sin consultar a su médico.
Uso en niños y adolescentes
La forma en la que se utiliza Nuwiq en niños y adolescentes no difiere de la forma en la que se utiliza en los adultos. Puesto que es posible tener que administrar los medicamentos de factor VIII con más frecuencia en los niños y adolescentes, puede que sea necesario acoplar un dispositivo de acceso venoso central (CVAD). Un CVAD es un conector externo que permite el acceso al flujo sanguíneo mediante un catéter sin inyección a través de la piel
Si usa más Nuwiq del que debe
No se ha notificado ningún síntoma de sobredosis. Si ha inyectado más Nuwiq del que debe, informe a su médico.
Si olvidó usar Nuwiq
No tome una dosis doble para compensar las dosis olvidadas. Proceda a administrar la siguiente dosis inmediatamente y prosiga con las recomendaciones de su médico.
Si interrumpe el tratamiento con Nuwiq
No interrumpa el tratamiento con Nuwiq sin consultar a su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Deje de usar este medicamento inmediatamente y solicite atención médica urgente si:
- nota síntomas de reacciones alérgicas
Las reacciones alérgicas pueden incluir erupción cutánea, habones, urticaria (erupción pruriginosa), incluida urticaria generalizada, hinchazón de los labios y de la lengua, dificultad para respirar, “pitos” al respirar (sibilancias), opresión torácica, vómitos, inquietud, hipotensión arterial y mareo. Estos síntomas pueden ser síntomas tempranos de un shock anafiláctico. Si se producen reacciones alérgicas intensas súbitas (anafilácticas) (muy raras: pueden afectar a hasta 1 de cada 10.000 personas), debe detener inmediatamente la inyección y debe ponerse en contacto de inmediato con su médico. Los síntomas intensos requieren tratamiento de emergencia urgente.
- nota que el medicamento deja de actuar correctamente (las hemorragias no se detienen o se hacen frecuentes)
En los niños y adolescentes que no han recibido tratamiento previo con medicamentos compuestos por factor VIII se pueden producir anticuerpos inhibidores (ver sección 2) de manera muy frecuente (más de 1 de cada 10 pacientes).
Sin embargo, en los pacientes que han recibido tratamiento previo con factor VIII (más de 150 días de tratamiento), el riesgo es poco frecuente (menos de 1 de cada 100 pacientes). Si esto sucede, los medicamentos que toman usted o su hijo pueden dejar de funcionar correctamente y usted o su hijo pueden sufrir una hemorragia persistente. En ese caso, contacte con su médico de manera inmediata.
Efectos adversos frecuentes que pueden afectar hasta 1 de cada 10personas
Hipersensibilidad, fiebre.
Efectos adversos poco frecuentes que pueden afectar hasta a 1 de cada 100 pacientes
Cosquilleo o entumecimiento (parestesia), dolor de cabeza, mareos, vértigo, disnea, sequedad de boca, dolor de espalda, inflamación y/o dolor en la zona de la inyección, una vaga sensación de malestar corporal (malestar general), anemia hemorrágica, resultados positivos para la formación de anticuerpos no neutralizantes (en pacientes tratados previamente).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Nuwiq
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en la etiqueta del vial después de EXP. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2 °C y 8 °C). No congelar. Conservar el vial en el embalaje original para protegerlo de la luz.
Antes de que Nuwiq polvo se reconstituya, se puede conservar a temperatura ambiente (hasta 25 °C) durante un único periodo no superior a 1 mes. Anote la fecha en la que empiece a conservar Nuwiq a temperatura ambiente en la caja del medicamento. No conserve de nuevo Nuwiq en la nevera, tras haber sido conservado a temperatura ambiente.
Usar la solución reconstituida inmediatamente después de la reconstitución.
Advertencias con respecto a ciertos signos visibles de deterioro
No utilice este medicamento si observa indicios visibles de deterioro del precinto del envase, especialmente de la jeringa y/o del vial.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Nuwiq
Polvo:
- El principio activo es Factor VIII de coagulación humano recombinante (simoctocog alfa).
Cada vial de polvo contiene 250, 500, 1000, 1500, 2000, 2500, 3000 o 4000 UI de simoctocog alfa. Cada solución reconstituida contiene aproximadamente 100, 200, 400, 600, 800, 1000, 1200 o 1600 UI/mL de simoctocog alfa.
- Los demás componentes son sacarosa, cloruro de sodio, cloruro de calcio dihidratado, clorhidrato de arginina, citrato de sodio dihidratado y poloxamer 188. Ver sección 2, "Nuwiq contiene sodio".
Disolvente:
Agua para preparaciones inyectables
Aspecto del producto y contenido del envase
Nuwiq se suministra como polvo y disolvente para solución inyectable. El polvo es de color entre blanco y blanquecino en un vial de vidrio. El disolvente es agua para preparaciones inyectables en una jeringa de vidrio precargada.
Una vez reconstituida, la solución es transparente, incolora y libre de partículas extrañas.
Cada envase de Nuwiq contiene:
- 1 vial de polvo con 250, 500, 1000, 1500, 2000, 2500, 3000 o 4000 UI de simoctocog alfa
- 1 jeringa precargada con 2,5 mL de agua para inyectables
- 1 adaptador de vial
- 1 aguja de mariposa
- 2 toallitas con alcohol
Titular de la autorización de comercialización y responsable de la fabricación
Octapharma AB, Lars Forssells gata 23, 112 75 Estocolmo, Suecia
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien Octapharma Benelux (Belgium) Tél/Tel: +32 2 3730890 | Lietuva Octapharma Nordic AB (Sweden) Tel: +46 8 56643000 |
???????? Octapharma Nordic AB (Sweden) Te?.: +46 8 56643000 | Luxembourg/Luxemburg Octapharma Benelux (Belgium) Tél/Tel: +32 2 3730890 |
Ceská republika Octapharma CZ s.r.o. Tel: +420 266 793 510 | Magyarország Octapharma Nordic AB (Sweden) Tel: +46 8 56643000 |
Danmark Octapharma Nordic AB (Sweden) Tlf: +46 8 56643000 | Malta Octapharma Nordic AB (Sweden) Tel: +46 8 56643000 |
Deutschland Octapharma GmbH Tel: +49 2173 9170 | Nederland Octapharma Benelux (Belgium) Tel: +32 2 3730890 |
Eesti Octapharma Nordic AB (Sweden) Tel: +46 8 56643000 | Norge Octapharma AS Tlf: +47 63988860 |
Ελλ?δα Octapharma Hellas SA Τηλ: +30 210 8986500 | Österreich Octapharma Handelsgesellschaft m.b.H. Tel: +43 1 610321222 |
España Octapharma S.A. Tel: +34 91 6487298 | Polska Octapharma Poland Sp. z o.o. Tel: +48 22 2082734 |
France Octapharma France Tél: +33 1 41318000 | Portugal Octapharma Produtos Farmacêuticos Lda. Tel: +351 21 8160820 |
Hrvatska Octapharma Nordic AB (Sweden) Tel: +46 8 56643000 | România Octapharma Nordic AB (Suedia) Tel: +46 8 56643000 |
Ireland Octapharma AB (Sweden) Tel: +46 8 56643000 | Slovenija Octapharma Nordic AB (Sweden) Tel: +46 8 56643000 |
Ísland Octapharma AS (Norway) Sími: +47 63988860 | Slovenská republika Octapharma AG, o.z.z.o. Tel: +421 2 54646701 |
Italia Kedrion S.p.A. Tel: +39 0583 767507 | Suomi/Finland Octapharma Nordic AB Puh/Tel: +358 9 85202710 |
Κ?προς Octapharma Nordic AB (Sweden) Τηλ: +46 8 56643000 | Sverige Octapharma Nordic AB Tel: +46 8 56643000 |
Latvija Octapharma Nordic AB (Sweden) Tel: +46 8 56643000 | United Kingdom (Northern Ireland) Octapharma Limited Tel: +44 161 8373770 |
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
---------------------------------------------------------------------------------------------------------------------------
Esta información está destinada únicamente a profesionales sanitarios:
Tratamiento a demanda
La dosis a administrar y la frecuencia de administración debe siempre estar orientada a la eficacia clínica en cada caso individual.
En el caso de los episodios hemorrágicos siguientes, la actividad del factor VIII no debe ser inferior al nivel de actividad plasmática dada (en % de lo normal o UI/dL) en el periodo correspondiente. La siguiente tabla se puede utilizar como guía de dosificación en cirugía y en episodios hemorrágicos.
Grado de hemorragia /tipo de procedimiento quirúrgico | Nivel de Factor VIII requerido (%) (UI/dL) | Frecuencia de las dosis (horas) / duración del tratamiento (días) |
Hemorragia | ||
Hemartrosis incipiente, hemorragia muscular u oral | 20–40 | Repetir cada 12 a 24 horas. Al menos 1 día hasta que el episodio hemorrágico, según indique el dolor, se resuelva o se logre la curación. |
Hemartrosis más extensa, hemorragia muscular o hematoma | 30-60 | Repetir la perfusión cada 12 a 24 horas, entre 3 y 4 días o más, hasta que cese el dolor y la discapacidad aguda. |
Hemorragia potencialmente mortal | 60-100 | Repetir la perfusión cada 8 a 24 horas hasta que se supere el peligro |
Cirugía | ||
Cirugía menorIncluyendo extracción dental | 30-60 | Cada 24 horas, al menos 1 día, hasta lograr la curación. |
Cirugía mayor | 80-100 (pre y postoperatorio) | Repetir la perfusión cada 8-24 horas hasta que se consiga una cicatrización adecuada de la herida, y después al menos durante otros 7 días de tratamiento para mantener una actividad de factor VIII del 30% al 60% (UI/dL). |
INSTRUCCIONES PARA LA PREPARACIÓN Y ADMINISTRACIÓN
- Deje que la jeringa de disolvente (agua para preparaciones inyectables) y el polvo alcancen la temperatura ambiente en el vial cerrado. Puede hacerlo sujetándolos con las manos hasta que tengan la misma temperatura que las manos. No caliente de ninguna otra manera el vial y la jeringa precargada. Esta temperatura debe mantenerse durante la reconstitución.
- Retire la cápsula de cierre de plástico de tipo flip-off del vial de polvo para dejar al descubierto las partes centrales del tapón de goma. No retire el tapón gris ni la anilla metálica que rodea la parte superior del vial.
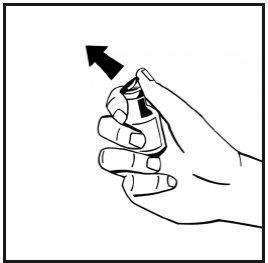
- Limpie la parte superior del vial con una toallita con alcohol. Deje que se seque el alcohol.
- Retire la cubierta de papel del envase del adaptador del vial. No saque el adaptador de su envase.
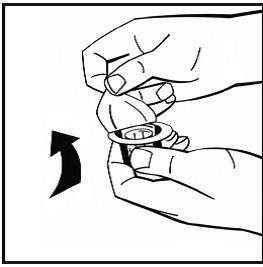
- Coloque el vial de polvo en una superficie plana y sujételo. Tome el envase del adaptador y coloque el adaptador del vial sobre el centro del tapón de goma del vial de polvo. Presione el envase del adaptador firmemente hacia abajo hasta que la punta del adaptador atraviese el tapón de goma. El adaptador se acoplará al vial cuando esté hecho.
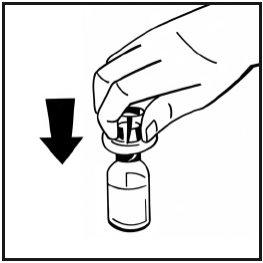
- Retire la cubierta de papel del envase de la jeringa precargada. Sujete la varilla del émbolo de la jeringa por el extremo y no toque el eje. Fije el extremo con rosca de la varilla del émbolo al émbolo de la jeringa de disolvente. Gire la varilla del émbolo en el sentido de las agujas del reloj hasta que note una ligera resistencia.
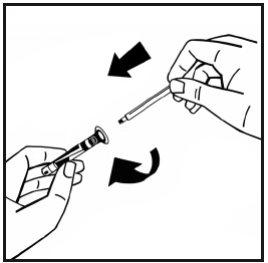
- Rompa el precinto de la punta de plástico de protección de la jeringa de disolvente partiendo la perforación de la cápsula de cierre. No toque el interior de la cápsula de cierre ni la punta de la jeringa. En caso de no usar la solución inmediatamente, cierre la jeringa llena con la punta de protección de plástico para almacenarla.
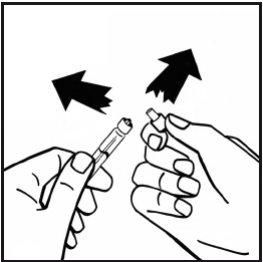
- Retire el embalaje del adaptador y deséchelo.
- Acople firmemente la jeringa de disolvente al adaptador del vial girando en el sentido de las agujas del reloj hasta que note una ligera resistencia.
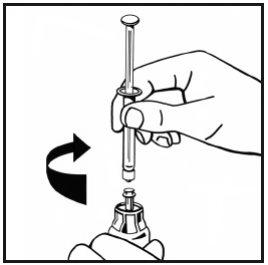
- Inyecte lentamente todo el disolvente en el vial de polvo presionando la varilla del émbolo hacia abajo.
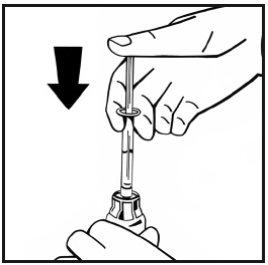
- Sin retirar la jeringa, mueva suavemente o en círculos el vial unas cuantas veces para disolver el polvo. No agitar. Espere hasta que todo el polvo se disuelva completamente.
- Fíjese en si la solución final tiene partículas antes de administrarla. La solución debe ser transparente e incolora, prácticamente libre de partículas visibles. No use soluciones turbias o con sedimentos.
- Dé la vuelta al vial acoplado a la jeringa, y lentamente extraiga la solución a la jeringa. Asegúrese de transferir todo el contenido del vial a la jeringa.
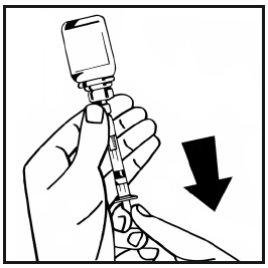
- Separe la jeringa llena del adaptador del vial girando en sentido contrario a las agujas del reloj y deseche el vial vacío.
- La solución estará preparada para su uso inmediato. No refrigerar.
- Limpie la parte elegida para la inyección con una de las toallitas con alcohol suministradas.
- Acople el kit de inyección suministrado a la jeringa.Introduzca la aguja del kit de inyección en la vena elegida. Si ha utilizado un torniquete para hacer la vena más visible, deberá estar aflojado antes de empezar a inyectar la solución.No deberá entrar sangre en la jeringa debido al riesgo de formación de coágulos de fibrina.
- Inyecte la solución en la vena despacio, no más rápido de 4 mL por minuto.
Si usa más de un vial de polvo para un tratamiento, podrá usar la misma aguja de nuevo. El adaptador del vial y la jeringa son de un solo uso.
- Country of registration
- Active substance
- Prescription requiredYes
- Manufacturer
- This information is for reference only and does not constitute medical advice. Always consult a doctor before taking any medication. Oladoctor is not responsible for medical decisions based on this content.
- Alternatives to NUWIQ 1500 IU POWDER AND SOLVENT FOR INJECTABLE SOLUTIONDosage form: INJECTABLE, 1,000 IUActive substance: coagulation factor VIIIManufacturer: Takeda Manufacturing Austria AgPrescription requiredDosage form: INJECTABLE, 1500 IUActive substance: coagulation factor VIIIManufacturer: Takeda Manufacturing Austria AgPrescription requiredDosage form: INJECTABLE, 1000 IU - after reconstitution in 2 ml of water for injections, the dose is 500 IU/mlActive substance: coagulation factor VIIIManufacturer: Takeda Manufacturing Austria AgPrescription required
Online doctors for NUWIQ 1500 IU POWDER AND SOLVENT FOR INJECTABLE SOLUTION
Discuss questions about NUWIQ 1500 IU POWDER AND SOLVENT FOR INJECTABLE SOLUTION, including use, safety considerations and prescription review, subject to medical assessment and local regulations.
Frequently Asked Questions















