HEXYON Injectable Suspension in Pre-filled Syringe

How to use HEXYON Injectable Suspension in Pre-filled Syringe
Translated with AI
This page provides general information and does not replace a doctor’s consultation. Always consult a doctor before taking any medication. Seek urgent medical care if symptoms are severe.
Show originalContents of the leaflet
Introduction
Package Leaflet: Information for the User
Hexyon injectable suspension in a pre-filled syringe
Vaccine against diphtheria, tetanus, pertussis (acellular component), hepatitis B (rDNA), poliomyelitis (inactivated), and Haemophilus influenzae type b conjugate (adsorbed)
Read all of this leaflet carefully before your child is vaccinated because it contains important information.
- Keep this leaflet, you may need to read it again.
- If you have any further questions, ask your doctor, pharmacist, or nurse.
- If your child experiences any side effects, consult your doctor, pharmacist, or nurse, even if they are not listed in this leaflet. See section 4.
Contents of the pack
- What Hexyon is and what it is used for
- What you need to know before your child is given Hexyon
- How to use Hexyon
- Possible side effects
- Storage of Hexyon
- Contents of the pack and other information
1. What Hexyon is and what it is used for
Hexyon (DTaP-IPV-HB-Hib) is a vaccine used to protect against infectious diseases.
Hexyon helps to protect against diphtheria, tetanus, pertussis, hepatitis B, poliomyelitis, and serious diseases caused by Haemophilus influenzae type b. Hexyon is given to children from 6 weeks of age.
The vaccine works by making the body produce its own protection (antibodies) against the bacteria and viruses that cause these different infections:
- Diphtheria is an infectious disease that usually affects the throat first. In the throat, the infection causes pain and swelling that can lead to suffocation. The bacterium that causes this disease also produces a toxin (poison) that can damage the heart, kidneys, and nerves.
- Tetanus usually occurs when the tetanus bacterium enters a deep wound. The bacterium produces a toxin (poison) that causes muscle spasms, leading to an inability to breathe and the possibility of suffocation.
- Pertussis (also known as whooping cough) is a highly contagious disease that affects the respiratory tract. This causes severe coughing attacks that can lead to respiratory problems. The coughing attacks often present with a "whooping" sound. Pertussis can also cause ear infections, chest infections (bronchitis), which can last for a long time, lung infections (pneumonia), seizures, brain damage, and even death.
- Hepatitis B is caused by the hepatitis B virus. This causes the liver to become inflamed (inflammation). In some people, the virus can remain in the body for a long time and eventually cause serious liver problems, including liver cancer.
- Poliomyelitis (also known as polio) is caused by viruses that affect the nerves. It can lead to paralysis or muscle weakness, most often in the legs. Paralysis of the muscles that control breathing and swallowing can be fatal.
- Haemophilus influenzae type b (Hib) infections are serious bacterial infections and can cause meningitis (inflammation of the membranes that surround the brain), which can cause brain damage, deafness, epilepsy, or partial blindness. The infection can also cause inflammation and swelling of the throat, leading to difficulty swallowing and breathing. The infection can affect other parts of the body, such as the blood, lungs, skin, bones, and joints.
Important information about the protection provided
- Hexyon will only help to prevent these diseases if they are caused by the bacteria or viruses for which the vaccine is intended. Your child may still contract diseases with similar symptoms caused by other bacteria or viruses.
- The vaccine does not contain any live bacteria or virus and cannot cause any of the infectious diseases it protects against.
- This vaccine does not protect against infections caused by other types of Haemophilus influenzae or against meningitis caused by other microorganisms.
- Hexyon will not protect against infectious hepatitis caused by other agents such as hepatitis A, hepatitis C, and hepatitis E.
- Because the symptoms of hepatitis B take a long time to develop, it is possible that an unidentified hepatitis B infection may be present at the time of vaccination. In such cases, the vaccine may not prevent hepatitis B infection.
- As with any other vaccine, it is possible that Hexyon may not protect 100% of vaccinated children.
2. What you need to know before your child is given Hexyon
In order to ensure that Hexyon is suitable for your child, it is important that you inform your doctor or nurse if your child has any of the following characteristics. If there is anything you do not understand, consult your doctor, pharmacist, or nurse.
Do not use Hexyon if your child:
- has had a respiratory disorder or swelling of the face (anaphylactic reaction) after administration of Hexyon.
- has had an allergic reaction
- to the active substances,
- to any of the other components listed in section 6,
- to glutaraldehyde, formaldehyde, neomycin, streptomycin, and polymyxin B, as these substances are used during the manufacturing process,
- after previous administration of Hexyon or any other vaccine that contains diphtheria, tetanus, pertussis, poliomyelitis, hepatitis B, or Hib.
- has had a severe reaction that affects the brain (encephalopathy) within 7 days of administration of a previous dose of a pertussis vaccine (acellular or whole cell).
- has an uncontrolled or severe disease that affects the brain and nervous system (uncontrolled neurological disorder) or uncontrolled epilepsy.
Warnings and precautions
Before vaccination, consult your doctor, pharmacist, or nurse if your child:
- has a moderate or high temperature or an acute illness (fever, sore throat, cough, cold, or flu). It may be necessary to delay vaccination with Hexyon until your child feels better.
- has experienced any of the following adverse events after receiving a pertussis vaccine, the decision to administer further doses of vaccine containing the pertussis component should be carefully evaluated:
- fever of 40°C or higher within 48 hours of vaccination that was not due to another identifiable cause.
- collapse or shock-like state with hypotonic-hyporesponsive episode (weakness) within 48 hours of vaccination.
- prolonged crying, lasting 3 hours or more, within 48 hours of vaccination.
- seizures, with or without fever, within 3 days of vaccination.
- has previously had Guillain-Barré syndrome (temporary inflammation of the nerves that causes pain, paralysis, and sensory disturbances) or brachial neuritis (severe pain and reduced mobility in the arm and shoulder) after administration of a vaccine that contains tetanus toxoid (a form of inactivated tetanus toxoid). In this case, your doctor will evaluate the decision to administer any vaccine that contains tetanus toxoid.
- is receiving treatment that suppresses their immune system (the body's natural defenses) or has any disease that causes immunodeficiency. In these cases, the immune response to the vaccine may be reduced. Therefore, it is recommended to delay vaccination until the end of treatment or disease. However, children with long-term problems with their immune system, such as HIV infection (AIDS), may be given Hexyon, but protection may not be as good as in children with a healthy immune system.
- has a chronic or acute disease, including chronic renal failure or renal impairment.
- has any undiagnosed or uncontrolled brain disease or epilepsy. Your doctor will evaluate the potential benefits of vaccination.
- has any blood disorder that causes easy bruising or prolonged bleeding after minor cuts. Your doctor will advise on the suitability of administering Hexyon to your child.
Use of Hexyon with other vaccines or medicines
Tell your doctor or nurse if your child is using, has recently used, or might use any other medicine or vaccine.
Hexyon can be administered at the same time as other vaccines, such as pneumococcal vaccines, measles-mumps-rubella vaccines, varicella vaccines, rotavirus vaccines, or meningococcal vaccines.
When administered at the same time as other vaccines, Hexyon should be given at a different injection site.
Fainting can occur after, or even before, any injection with a needle. Therefore, tell your doctor or nurse if your child has fainted with a previous injection.
Hexyon contains phenylalanine, potassium, and sodium
Hexyon contains 85 micrograms of phenylalanine per 0.5 ml dose. Phenylalanine may be harmful if you have phenylketonuria (PKU), a rare genetic disorder in which phenylalanine accumulates because the body cannot eliminate it properly.
Hexyon contains less than 1 mmol of potassium (39 mg) and less than 1 mmol of sodium (23 mg) per dose, i.e., it is essentially "potassium-free" and "sodium-free".
3. How to use Hexyon
Hexyon will be administered to your child by a doctor or nurse who is properly trained in the use of vaccines and equipped to respond to any rare, severe allergic reaction that may occur after injection (see section 4 "Possible side effects").
Hexyon is administered by injection into a muscle (intramuscularly, IM) in the upper leg or arm of your child. The vaccine should never be administered into a blood vessel or under the skin.
The recommended dose is as follows:
Primary vaccination cycle (primary vaccination)
Your child will receive two injections administered at an interval of two months or three injections administered at an interval of one to two months (at least four weeks apart). This vaccine should be used in accordance with the local vaccination schedule.
Additional injections (booster vaccination)
After the primary vaccination cycle, your child will receive a booster dose, according to local recommendations, at least 6 months after the last dose of the primary vaccination cycle. Your doctor will advise on when this dose should be administered.
If your child misses a dose of Hexyon
If your child misses a scheduled injection, it is important that you inform your doctor or nurse, they will decide when to administer the missed dose.
It is important to follow the doctor's or nurse's instructions to ensure your child completes the vaccination cycle. Otherwise, your child may not be fully protected against the diseases.
If you have any further questions on the use of this medicine, ask your doctor, pharmacist, or nurse.
4. Possible side effects
Like all medicines, this vaccine can cause side effects, although not everybody gets them.
Severe allergic reactions (anaphylactic reaction)
If any of the following symptoms occur after leaving the place where your child received the injection, you should consult a doctor IMMEDIATELY:
- difficulty breathing
- bluish discoloration of the tongue or lips
- rash
- swelling of the face or throat
- sudden and severe discomfort with a drop in blood pressure that causes dizziness and loss of consciousness, rapid heartbeat associated with respiratory disorders
When these signs and symptoms (signs or symptoms of an anaphylactic reaction) occur, they usually develop rapidly after administration of the injection and while the child is still in the clinic or doctor's office.
The possibility of severe allergic reactions occurring after receiving this vaccine is rare (may affect up to 1 in 1,000 people).
Other side effects
If your child experiences any of the following side effects, consult your doctor, nurse, or pharmacist.
- Very common side effects (may affect more than 1 in 10 people) are:
- loss of appetite (anorexia)
- crying
- sleepiness (somnolence)
- vomiting
- fever (temperature of 38°C or higher)
- irritability
- pain, redness, or swelling at the injection site
- Common side effects (may affect up to 1 in 10 people) are:
- abnormal crying (prolonged crying)
- diarrhea
- hardening at the injection site (induration)
- Uncommon side effects (may affect up to 1 in 100 people) are:
- allergic reaction
- high fever (temperature of 39.6°C or higher)
- lump (nodule) at the injection site
- Rare side effects (may affect up to 1 in 1,000 people) are:
- rash
- extensive reactions at the injection site (larger than 5 cm), including extensive swelling of a limb that extends from the injection site beyond one or both joints. These reactions start within 24-72 hours after vaccination, may be associated with redness, heat, pain, or swelling at the injection site, and resolve within 3-5 days without treatment.
- seizures, with or without fever.
- Very rare side effects (may affect up to 1 in 10,000 people) are:
- episodes in which your child enters a shock-like state or becomes pale, weak, and unresponsive for a period (hypotonic-hyporesponsive episodes, HHE).
Possible side effects
Other side effects have been reported occasionally with other vaccines that contain diphtheria, tetanus, pertussis, poliomyelitis, hepatitis B, or Hib, and not directly with Hexyon:
- Guillain-Barré syndrome (temporary inflammation of the nerves that causes pain, paralysis, and sensory disturbances), severe pain, and reduced mobility in the arm and shoulder (brachial neuritis) have been reported after administration of a vaccine that contains tetanus toxoid.
- Temporary inflammation of the nerves that causes sensory disturbances or weakness in the arms and/or legs (polyradiculoneuritis), facial paralysis, visual disturbances, blindness, or sudden loss of vision (optic neuritis), inflammatory disease of the brain and spinal cord (demyelination of the central nervous system, multiple sclerosis) have been reported after administration of vaccines that contain the hepatitis B antigen.
- Brain inflammation (encephalopathy/encephalitis).
- In children born very prematurely (at 28 weeks of gestation or less), longer pauses between breaths than normal may occur for 2-3 days after vaccination.
- Swelling or inflammation of the brain (encephalopathy/encephalitis).
- Swelling of one or both feet and lower limbs. This may occur with bluish discoloration of the skin (cyanosis), redness, small areas of bleeding under the skin (transient purpura), and severe crying, after administration of vaccines that contain Haemophilus influenzae type b. If this reaction occurs, it will mainly happen after the first injections and will be observed in the first hours after vaccination. All symptoms will resolve completely within 24 hours without treatment.
Reporting of side effects
If your child experiences any side effects, consult your doctor, pharmacist, or nurse, even if they are not listed in this leaflet. You can also report side effects directly through the national reporting system listed in Appendix V. By reporting side effects, you can help provide more information on the safety of this medicine.
5. Storage of Hexyon
Keep this medicine out of the sight and reach of children.
Do not use this medicine after the expiry date which is stated on the carton and label after EXP. The expiry date refers to the last day of the month shown.
Store in a refrigerator (between 2°C and 8°C).
Do not freeze.
Keep the container in the outer carton to protect from light.
Medicines should not be disposed of via wastewater or household waste. Ask your pharmacist how to dispose of medicines no longer required. These measures will help protect the environment.
6. Container Contents and Additional Information
Composition of Hexyon
The active principles per dose (0.5 ml)1 are:
Diphtheria toxoid | not less than 20 UI2,4 (30 Lf) |
Tetanus toxoid | not less than 40 UI3,4 (10 Lf) |
Bordetella pertussisantigens | |
Pertussis toxoid | 25 micrograms |
Filamentous hemagglutinin | 25 micrograms |
Inactivated poliovirus5 | |
Type 1 (Mahoney) | 29 units of antigen D6 |
Type 2 (MEF-1) | 7 units of antigen D6 |
Type 3 (Saukett) | 26 units of antigen D6 |
Hepatitis B virus surface antigen7 | 10 micrograms |
Haemophilus influenzaetype b polysaccharide (polyribosylribitol phosphate) | 12 micrograms |
conjugated with tetanus protein | 22-36 micrograms |
1Adsorbed on hydrated aluminum hydroxide (0.6 mg Al3+)
2As lower confidence limit (p=0.95) and not less than 30 UI as mean value
3As lower confidence limit (p=0.95)
4Or equivalent activity determined by immunogenicity assessment
5Grown in Vero cells
6These antigen quantities are strictly the same as those previously expressed as 40-8-32 units of antigen D, for virus types 1, 2, and 3 respectively, when measured by another suitable immunochemical method.
7Produced in Hansenula polymorpha yeast cells using recombinant DNA technology
The other components are:
Disodium hydrogen phosphate, potassium dihydrogen phosphate, trometamol, sucrose, essential amino acids including L-phenylalanine, sodium hydroxide and/or acetic acid and/or hydrochloric acid (for pH adjustment) and water for injectable preparations.
The vaccine may contain traces of glutaraldehyde, formaldehyde, neomycin, streptomycin, and polymyxin B.
Product Appearance and Container Contents
Hexyon is supplied as an injectable suspension in a pre-filled syringe (0.5 ml).
Hexyon is available in packs of 1, 10, or 50 pre-filled syringes without a fixed needle.
Hexyon is available in packs of 1 or 10 pre-filled syringes with 1 separate needle.
Hexyon is available in packs of 1 or 10 pre-filled syringes with 2 separate needles.
Hexyon is available in a multi-pack of 5 packs, each containing 10 pre-filled syringes without a fixed needle.
Hexyon is available in packs of 1 or 10 pre-filled syringes with 1 or 10 separate safety needles.
Only some pack sizes may be marketed.
After shaking, the normal appearance of the vaccine is a turbid white suspension.
Marketing Authorization Holder and Manufacturer
Marketing Authorization Holder:
Sanofi Winthrop Industrie, 82 Avenue Raspail, 94250 Gentilly, France
Manufacturer:
Sanofi Winthrop Industrie, 1541 avenue Marcel Mérieux, 69280 Marcy l'Etoile, France
Sanofi Winthrop Industrie, Voie de L’Institut - Parc Industriel d'Incarville, B.P 101, 27100 Val de Reuil, France
For further information about this medicinal product, please contact the local representative of the Marketing Authorization Holder:
België/ Belgique /Belgium Sanofi Belgium Tel: +32 2 710.54.00 | Lietuva Swixx Biopharma UAB Tel: +370 5 236 91 40 |
| Luxembourg/Luxemburg Sanofi Belgium Tel: +32 2 710.54.00 |
Ceská republika Sanofi s.r.o. Tel: +420 233 086 111 | Magyarország SANOFI-AVENTIS Zrt Tel: +36 1 505 0055 |
Danmark Sanofi A/S Tel: +45 4516 7000 | Malta Sanofi S.r.l. Tel: +39 02 39394 275 |
Deutschland Sanofi-Aventis Deutschland GmbH Tel: 0800 54 54 010 Tel. from abroad: +49 69 305 21 130 | Nederland Sanofi B.V. Tel: +31 20 245 4000 |
Eesti Swixx Biopharma OÜ Tel: +372 640 10 30 | Norge Sanofi-aventis Norge AS Tel: + 47 67 10 71 00 |
Ελλάδα ΒΙΑΝΕΞ Α.Ε. Τηλ.: +30.210.8009111 | Österreich Sanofi-Aventis GmbH Tel: +43 (1) 80185-0 |
España sanofi-aventis, S.A. Tel: +34 93 485 94 00 | Polska Sanofi sp. z o. o. Tel: +48 22 280 00 00 |
France Sanofi Winthrop Industrie Tel: 0 800 222 555 Call from abroad: +33 1 57 63 23 23 | Portugal Sanofi – Produtos Farmacêuticos, Lda. Tel: + 351 21 35 89 400 |
Hrvatska Swixx Biopharma d.o.o. Tel: +385 1 2078 500 | România Sanofi Romania SRL Tel: +40 21 317 31 36 |
Ireland sanofi-aventis Ireland T/A SANOFI Tel: + 353 (0) 1 4035 600 | Slovenija Swixx Biopharma d.o.o Tel: +386 235 51 00 |
Ísland Vistor Tel: +354 535 7000 | Slovenská republika Swixx Biopharma s.r.o. Tel: +421 2 208 33 600 |
Italia Sanofi S.r.l. Tel: 800536389 | Suomi/Finland Sanofi Oy Tel: +358 (0) 201 200 300 |
Κύπρος C.A. Papaellinas Ltd. Τηλ.: +357 22 741741 | Sverige Sanofi AB Tel: +46 8-634 50 00 |
Latvija Swixx Biopharma SIA Tel: +371 6 6164 750 | United Kingdom (Northern Ireland) sanofi-aventis Ireland Ltd. T/A SANOFI Tel: +44 (0) 800 035 2525 |
Date of Last Revision of this Leaflet:
Other Sources of Information
Detailed information on this medicinal product is available on the European Medicines Agency website: http://www.ema.europa.eu.
The most recent approved information on this vaccine is available at the following URL: https://hexyon.info.sanofi or by scanning the QR code with your mobile phone (smartphone):
[QR code to be included]
-----------------------------------------------------------------------------------------------------------------------------
This information is intended for healthcare professionals only:
- Shake the pre-filled syringe to make the contents homogeneous.
- Hexyon must not be mixed with other medicinal products.
- Hexyon should be administered by the intramuscular route. The recommended injection sites are the anterolateral upper thigh (preferred site) or the deltoid muscle in older children (possibly from 15 months of age). The intradermal or intravenous routes must not be used. Do not administer by intravascular injection: ensure that the needle has not penetrated a blood vessel.
- Do not use the pre-filled syringes if the carton is damaged.
Preparation for Administration
The syringe with the suspension for injection should be inspected visually before administration. In the event of foreign particles, leaks, premature plunger activation, or defective tip sealing, discard the pre-filled syringe.
The syringe is designed for single use and must not be reused.
Instructions for Use of the Luer Lock Pre-filled Syringe
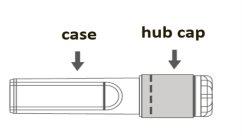
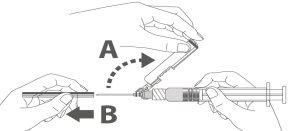
Image A: Luer Lock Syringe withtip cap
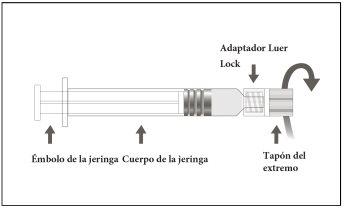
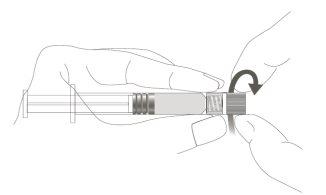
Step 1:Holding the Luer Lock adapter with one hand (avoid holding the plunger or syringe body), unscrew the tip cap by twisting it. |
|
Step 2:To attach the needle to the syringe, gently twist the needle onto the Luer Lock adapter of the syringe until you feel a slight resistance. |
|
<Instructions for Use of the Safety Needle with the Luer Lock Syringe
Image B: Safety Needle (inside the bar) | Image C: Components of the Safety Needle (prepared for use) |
|
|
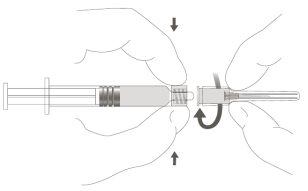
Follow steps 1 and 2 described above to prepare the Luer Lock syringe and attach the needle.
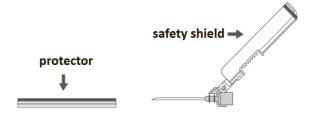
Step 3:Remove the protector from the safety needle. The needle is covered by the safety device and the protector. Step 4: A:Separate the safety device from the needle towards the syringe body at the shown angle. B:Remove the protector in a straight line. |
|
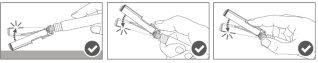
Step 5:After completing the injection, lock (activate) the safety device using one of the three illustrated techniques (3) with one hand: activation against a surface, with the thumb, or with the index finger. Note: Activation is confirmed by a "click" sound and/or tactile feedback. |
|
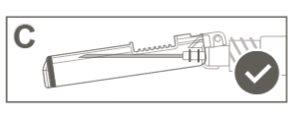
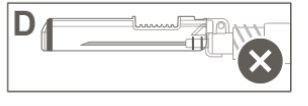
Step 6:Visually inspect the activation of the safety device. The safety device must be completely locked (activated)as shown in figure C. Note: When completely locked (activated), the needle should be at an angle with the safety device. Figure D shows that the safety device is NOT completely locked (not activated). |
|
Caution: Do not attempt to unlock (deactivate) the safety device by forcing the needle out of the safety device. |
>
Disposal of unused medicinal products and all materials that have come into contact with them should be done in accordance with local regulations.
- Country of registration
- Active substance
- Prescription requiredYes
- Manufacturer
- This information is for reference only and does not constitute medical advice. Always consult a doctor before taking any medication. Oladoctor is not responsible for medical decisions based on this content.
- Alternatives to HEXYON Injectable Suspension in Pre-filled SyringeDosage form: INJECTABLE, 0.5 mLManufacturer: Sanofi Winthrop IndustriePrescription requiredDosage form: INJECTABLE, 0.5 mlManufacturer: Sanofi Winthrop IndustriePrescription requiredDosage form: INJECTABLE, 0.5 mlManufacturer: Sanofi Winthrop IndustriePrescription required
Online doctors for HEXYON Injectable Suspension in Pre-filled Syringe
Discuss questions about HEXYON Injectable Suspension in Pre-filled Syringe, including use, safety considerations and prescription review, subject to medical assessment and local regulations.
Frequently Asked Questions