
Виллфацт 2000 й.м.
Спросите врача о рецепте на Виллфацт 2000 й.м.

Инструкция по применению Виллфацт 2000 й.м.
ИНСТРУКЦИЯ, ПРИЛОЖЕННАЯ К УПАКОВКЕ: ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Willfact 500 МЕ
порошок и растворитель для приготовления раствора для инъекций
Willfact 1000 МЕ порошок и растворитель для приготовления раствора для инъекций
Willfact 2000 МЕ порошок и растворитель для приготовления раствора для инъекций
человеческий фактор фон Виллебранда
Прежде чем использовать лекарство, необходимо внимательно ознакомиться с содержанием инструкции, поскольку она содержит важную информацию для пациента.
- Необходимо сохранить эту инструкцию, чтобы иметь возможность повторно прочитать ее при необходимости.
- В случае любых сомнений необходимо обратиться к врачу, фармацевту или медсестре.
- Это лекарство было назначено конкретному пациенту. Не следует передавать его другим. Лекарство может нанести вред другому человеку, даже если симптомы его заболевания идентичны.
- Если у пациента出现ают любые нежелательные реакции, включая те, которые не перечислены в этой инструкции, необходимо сообщить об этом врачу, фармацевту или медсестре. См. пункт 4.
Содержание инструкции
- 1. Что такое лекарство Willfact и для чего оно используется
- 2. Важная информация перед использованием лекарства Willfact
- 3. Как использовать лекарство Willfact
- 4. Возможные нежелательные реакции
- 5. Как хранить лекарство Willfact
- 6. Состав упаковки и другие сведения
1. Что такое лекарство Willfact и для чего оно используется
Лекарство Willfact производится из человеческой плазмы (жидкой части крови) и содержит активное вещество под названием человеческий фактор фон Виллебранда (vWF).
Фактор vWF участвует в свертывании крови. Отсутствие этого фактора, как, например, при болезни фон Виллебранда, приводит к тому, что кровь не свертывается так быстро, как должно, и, следовательно, возникает повышенная склонность к кровотечениям. Замена vWF лекарством Willfact временно восстанавливает механизмы свертывания крови.
Лекарство Willfact показано для профилактики кровотечений, связанных с хирургическими операциями, и других кровотечений, а также для лечения их у пациентов с диагнозом болезнь фон Виллебранда, если лечение только десмопрессином (DDAVP) неэффективно или противопоказано.
Лекарство Willfact может быть использовано во всех возрастных группах.
Лекарство Willfact не должно быть использовано для лечения гемофилии типа А.
2. Важная информация перед использованием лекарства Willfact
Когда не использовать лекарство Willfact
- Если пациент имеет аллергическую реакцию на человеческий фактор фон Виллебранда или любой другой компонент этого лекарства (перечисленный в пункте 6).
- Если у пациента диагностирована гемофилия типа А.
Предостережения и меры предосторожности
Лечение лекарством Willfact должно всегда контролироваться врачомс опытом лечения нарушений свертывания крови.
Если у пациента возникают сильные кровотечения, и анализ крови подтверждает снижение количества фактора VIII, пациент получает препарат фактора свертывания VIII и дополнительно препарат vWF в течение первых 12 часов.
Аллергические реакции
Могут возникать реакции повышенной чувствительности аллергического характера,подобные тем, которые возникают после введения других белковых внутривенных препаратов, полученных из человеческой крови или плазмы.
Пациент будет находиться под наблюдением во время введения для обнаружения ранних признаков повышенной чувствительности.
Эти признаки включают в себя сыпь (крапивница или общая крапивница), чувство сжатия в груди, свистящее дыхание, снижение артериального давления (гипотония) и тяжелые аллергические реакции (анाफилаксия).
Врач проинформирует пациента о предупреждающих признаках, указывающих на возникновение аллергической реакции.
В случае возникновения объективных или субъективных признаков повышенной чувствительности необходимо прекратить лечение и немедленно обратиться за медицинской помощью.
Вирусная безопасность
При производстве препаратов из человеческой крови или плазмы принимаются определенные меры, предотвращающие передачу инфекций пациентам. К ним относятся:
- тщательный отбор доноров крови и плазмы, позволяющий исключить лиц, находящихся в группе риска заражения,
- исследование каждой партии и пула плазмы на наличие вирусов/инфекций,
- введение в процесс обработки крови или плазмы шагов, позволяющих инактивировать или удалить вирусы.
Несмотря на принятие этих мер, при введении препаратов, произведенных из человеческой крови или плазмы, нельзя полностью исключить возможность передачи инфекции. Это относится также к неизвестным или новым вирусам или инфекциям другого типа.
Принимаемые меры считаются эффективными в случае вирусов с оболочкой, таких как вирус иммунодефицита человека (ВИЧ, вызывающий СПИД), вирус гепатита В и вирус гепатита С.
Принимаемые меры имеют ограниченную ценность в случае вирусов без оболочки, таких как вирус гепатита А и парвовирус В19. Заражение парвовирусом В19 может быть тяжелым у беременных женщин (поскольку существует риск заражения нерожденного ребенка) и пациентов с ослабленной иммунной системой или определенным типом анемии (например, серповидно-клеточной анемии или гемолитической анемии).
Вакцинация
Врач может рекомендовать пациенту пройти вакцинацию против вирусного гепатита А и В, если пациент регулярно/повторно получает произведенный из плазмы человеческий фактор фон Виллебранда.
Регистрация номера серии
Рекомендуется записывать имя и фамилию пациента, а также номер серии препарата при каждом введении, чтобы документировать, какие серии препарата были введены.
Риск тромбозов
Может возникнуть блокирование кровеносных сосудов тромбами (тромбоз). Риск особенно высок у пациентов с определенными факторами риска. В таких случаях состояние пациента будет находиться под тщательным наблюдением на предмет ранних признаков тромбоза. Необходимо также назначить препараты, предотвращающие блокирование кровеносных сосудов тромбами (профилактика).
Врач, назначающий фактор свертывания VIII, содержащий фактор фон Виллебранда, должен помнить, что продолжение лечения может привести к чрезмерному увеличению активности фактора VIII. Если пациент получает препарат vWF, содержащий фактор свертывания VIII, врач должен регулярно контролировать активность фактора VIII в плазме. Это защитит пациента от чрезмерной активности фактора VIII в плазме, которая может увеличить риск возникновения тромботических событий.
Ограничение эффективности
У пациентов с болезнью фон Виллебранда (особенно типа 3) могут образовываться белки, нейтрализующие действие фактора фон Виллебранда. Такие белки называются нейтрализующими антителами или ингибиторами. Врач проверит, образуются ли ингибиторы vWF у пациента, если результаты лабораторных исследований покажут отсутствие нормального восстановления концентраций vWF или если кровотечения не уменьшатся несмотря на использование соответствующей дозы препарата Willfact. Если существует высокая концентрация ингибиторов, лечение vWF может быть неэффективным. В таких случаях необходимо рассмотреть другие методы лечения. Новую терапию проведет врач с опытом лечения нарушений свертывания крови.
Лекарство Willfact и другие лекарства
Необходимо сообщить врачу или фармацевту о всех лекарствах, которые пациент принимает в настоящее время или принимал недавно, а также о лекарствах, которые пациент планирует принимать.
Беременность и грудное вскармливание
Лекарство Willfact можно использовать у беременных или кормящих женщин только в случае, когда это явно показано.
Не проводились контролируемые клинические исследования, оценивающие безопасность использования препарата Willfact у беременных и кормящих женщин, а исследования на животных не достаточно, чтобы подтвердить безопасность использования в контексте фертильности, беременности и развития ребенка во время беременности и после родов.
Если пациентка беременна или кормит грудью, предполагает, что может быть беременной, или планирует иметь ребенка, она должна проконсультироваться с врачом или фармацевтом перед использованием этого лекарства.
Вождение транспортных средств и эксплуатация машин
Не было обнаружено влияния на способность управлять транспортными средствами или эксплуатировать машины.
Лекарство Willfact содержит натрий
Одна ампула с 5 мл (500 МЕ) препарата Willfact содержит 0,15 ммоль (3,4 мг) натрия.
Это соответствует 0,17% рекомендуемой максимальной суточной нормы потребления натрия для взрослого человека.
Одна ампула с 10 мл (1000 МЕ) препарата Willfact содержит 0,3 ммоль (6,9 мг) натрия.
Это соответствует 0,35% рекомендуемой максимальной суточной нормы потребления натрия для взрослого человека.
Одна ампула с 20 мл (2000 МЕ) препарата Willfact содержит 0,6 ммоль (13,8 мг) натрия.
Это соответствует 0,69% рекомендуемой максимальной суточной нормы потребления натрия для взрослого человека.
3. Как использовать лекарство Willfact
Лечение должно начинаться и контролироваться врачом с опытом лечения кровотечений.
Если врач считает, что пациент может вводить лекарство дома, он соответствующим образом проинструктирует пациента.
Дозирование
Этот препарат всегда должен приниматься в соответствии с рекомендациями врача. В случае сомнений необходимо обратиться к врачу.
Лучше всего, если препарат Willfact вводит врач или медсестра. Если же пациент получил препарат Willfact для использования дома, врач убедится, что пациент проинформирован о способе выполнения инъекции и правильной дозе препарата. Необходимо соблюдать рекомендации врача и попросить о помощи в случае проблем с использованием шприца. Шприц может быть использован только обученным лицом.
Врач рассчитает правильную дозу препарата Willfact (выраженную в международных единицах — МЕ).
Доза зависит от:
- массы тела,
- места кровотечения,
- тяжести кровотечения,
- клинического состояния пациента,
- необходимости проведения операции,
- активности vWF в крови после операции,
- тяжести заболевания.
Доза находится в диапазоне 40–80 МЕ/кг массы тела.
Врач порекомендует проведение во время лечения анализов крови для:
- концентрации фактора VIII (FVIII:C),
- концентрации фактора фон Виллебранда (vWF:RCo),
- наличия ингибиторов,
- первичных признаков образования тромбов — у пациентов в группе риска возникновения таких осложнений.
На основе результатов этих анализов врач может скорректировать частоту инъекций и вводимую дозу.
В некоторых случаях может быть необходимо использование препарата фактора VIII (другого белка с коагуляционным действием) в дополнение к препарату Willfact, чтобы обеспечить более быстрое лечение или предотвратить кровотечение (в ситуациях, требующих срочного вмешательства, или при остром кровотечении).
Препарат Willfact также может быть использован для длительной профилактики, в этом случае доза также устанавливается индивидуально. Введение препарата Willfact в дозе 40–60 МЕ/кг массы тела 2–3 раза в неделю снижает количество эпизодов кровотечения.
Если пациент считает, что препарат Willfact действует слишком сильно или слишком слабо, необходимо обратиться к врачу.
Использование у детей и подростков
Дозирование у детей и подростков основано на массе тела. В некоторых случаях, особенно у более молодых пациентов (до 6 лет), может быть необходимо использование более высоких доз (до 100 МЕ/кг массы тела).
Способ введения
Подробные инструкции по реconstitution и введению препарата приведены в конце инструкции.
Использование более высокой, чем рекомендуемая, дозы препарата Willfact
Не было зарегистрировано случаев передозировки препарата Willfact, однако при введении большой дозы не можно исключить риск тромбоза.
Пропуск введения препарата Willfact
В случае пропуска введения препарата Willfact необходимо обратиться к врачу.
Не следует использовать двойную дозу для компенсации пропущенной дозы.
В случае любых дальнейших сомнений, связанных с использованием этого препарата, необходимо обратиться к врачу, фармацевту или медсестре.
4. Возможные нежелательные реакции
Как и любой препарат, этот препарат может вызывать нежелательные реакции, хотя они не возникают у каждого пациента.
Необходимо немедленно обратиться к врачу в следующих случаях:
- Возникновение признаков повышенной чувствительности или аллергических реакций (наблюдаются не очень часто, могут затрагивать до 1 из 100 пациентов). В некоторых случаях такие реакции могут перерастать в тяжелую аллергическую реакцию (анafilаксию), включая анафилактический шок (наблюдаются с неизвестной частотой).
Предупреждающие признаки, указывающие на возникновение аллергической реакции, включают:
- затруднение дыхания и глотания,
- свистящее дыхание,
- чувство сжатия в груди,
- ускорение сердечного ритма,
- снижение артериального давления,
- обморок,
- чрезмерная усталость,
- тревога, нервозность,
- головная боль,
- озноб, чувство холода,
- приливы жара,
- отек различных частей тела,
- кожная сыпь, общая крапивница,
- чувство жжения и покалывания в месте введения,
- онемение,
- рвота,
- тошнота.
Если возникает один из этих признаков, необходимо немедленно прекратить лечение и сообщить врачу,чтобы начать соответствующее лечение, в зависимости от типа и тяжести реакции.
- Обнаружение снижения эффективности препарата (отсутствие контроля над кровотечением). Это может быть вызвано ингибированием фактора фон Виллебранда (наблюдаются с неизвестной частотой).
У пациентов с болезнью фон Виллебранда, особенно типа 3, возможно образование белков, нейтрализующих действие vWF. Такие белки называются нейтрализующими антителами или ингибиторами. Пациенты, леченные vWF, должны быть тщательно отслеживаемы врачом на предмет возникновения ингибиторов путем соответствующего клинического наблюдения и лабораторных исследований. В случае возникновения ингибиторов это состояние может проявляться возникновением недостаточной клинической реакции. Оно также может сочетаться с тяжелыми аллергическими реакциями.
- Обнаружение признаков нарушений кровообращения в конечностях (например, холодные и бледные конечности) или важных органах (например, сильная боль в груди). Это может быть вызвано образованием тромбов в кровеносных сосудах (наблюдаются с неизвестной частотой).
Существует риск образования тромбов (тромбоза), особенно у пациентов в группе риска. После коррекции дефицита фактора фон Виллебранда пациентов необходимо отслеживать на предмет ранних признаков тромбоза или диссеминированного внутрисосудистого свертывания и применять лечение, предотвращающее тромбоз, в ситуациях, когда риск его возникновения повышен (после операций, у пациентов, находящихся в постели, при дефиците ингибитора коагуляции или фибринолитического фермента).
Если пациент получает препараты vWF, содержащие FVIII, риск тромбоза может быть выше из-за постоянно повышенных концентраций FVIII в плазме.
Ниже перечисленные нежелательные реакции наблюдались часто(могут затрагивать до 1 из 10 пациентов):
- реакции в месте введения инфузии.
Ниже перечисленные нежелательные реакции наблюдались не очень часто(могут затрагивать до 1 из 100 пациентов):
- головокружение,
- парестезия, онемение,
- приливы жара,
- зуд,
- чувство сжатия в груди,
- озноб, чувство холода.
Ниже перечисленные нежелательные реакции наблюдались с неизвестной частотой:
- лихорадка.
Сообщение о нежелательных реакциях
Если возникают любые нежелательные реакции, включая те, которые не перечислены в инструкции, необходимо сообщить об этом врачу или фармацевту, или медсестре. Нежелательные реакции можно сообщать напрямую в Департамент мониторинга нежелательных реакций лекарственных препаратов Управления по регистрации лекарственных препаратов, медицинских изделий и биоцидных препаратов:
Ал. Ерозолимских 181С
02-222 Варшава
Тел.: + 48 22 49 21 301
Факс: + 48 22 49 21 309
Сайт: https://smz.ezdrowie.gov.pl
Нежелательные реакции также можно сообщать в уполномоченный орган.
Благодаря сообщению о нежелательных реакциях можно будет собрать больше информации о безопасности использования препарата.
5. Как хранить лекарство Willfact
Препарат должен храниться в месте, недоступном для детей.
Не использовать этот препарат после истечения срока годности, указанного на этикетке ампулы и упаковки.
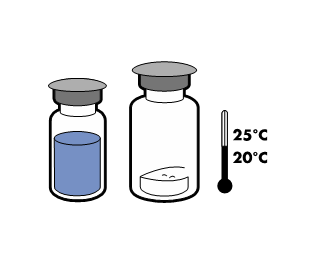
Не хранить при температуре выше 25°C. Хранить в оригинальной упаковке для защиты от света.
Не замораживать.
Для сохранения стерильности препарат должен быть использован сразу после реconstitution. Однако было показано, что химическая и физическая стабильность препарата сохраняется в течение 24 часов при 25°C.
Не использовать этот препарат, если обнаружено помутнение или частицы в растворе.
Препараты не должны выбрасываться в канализацию или домашние контейнеры для мусора. Необходимо спросить у фармацевта, как утилизировать препараты, которые больше не используются. Такое поведение поможет защитить окружающую среду.
6. Состав упаковки и другие сведения
Что содержит лекарство Willfact
Активным веществомявляется человеческий фактор фон Виллебранда (500 МЕ, 1000 МЕ, 2000 МЕ), выраженный в международных единицах активности кофактора ристоцетина (vWF:RCo).
После реconstitution с 5 мл (500 МЕ), 10 мл (1000 МЕ) или 20 мл (2000 МЕ) воды для инъекций одна ампула содержит примерно 100 МЕ/мл человеческого фактора фон Виллебранда.
До добавления альбумина специфическая активность раствора составляет не менее 60 МЕ vWF:RCo на 1 мг общего белка.
Другие компоненты:
Порошок: человеческая альбумина, аргинин хлорид, глицерин, натрий цитрат и кальций хлорид дигидрат.
Растворитель: вода для инъекций.
Как выглядит лекарство Willfact и что содержит упаковка
Лекарство Willfact поставляется в виде белого или светло-желтого порошка или хрупкого твердого вещества и прозрачного, бесцветного растворителя для приготовления раствора для инъекций после реconstitution с помощью системы для переноса.
Доступные размеры упаковки препарата Willfact — 500 МЕ/5 мл, 1000 МЕ/10 мл, 2000 МЕ/20 мл.
Раствор после реconstitution должен быть прозрачным или слегка опалесцирующим, бесцветным или слегка желтоватым.
Ответственное лицо и производитель
LFB-BIOMEDICAMENTS
3, авеню де Тропик,
ЗА де Куртабеф,
91940 ЛЕ УЛИС,
ФРАНЦИЯ
[email protected]
Производители
LFB-BIOMEDICAMENTS
3, авеню де Тропик,
ЗА де Куртабеф,
91940 ЛЕ УЛИС,
ФРАНЦИЯ
LFB-BIOMEDICAMENTS
59 Рю де Тревиз,
59000 ЛИЛЬ,
ФРАНЦИЯ
Этот препарат разрешен к обращению в странах-членах Европейского экономического пространства и в Великобритании (Северной Ирландии) под следующими названиями:
Австрия
Willfact
Чехия
WILLFACT
Дания
Willfact
Испания
Willfact
Германия
WILLFACT
Норвегия
Willfact
Польша
Willfact
Словакия
Willfact
Швеция
Willfact
Венгрия
Willfact
Великобритания (Северная Ирландия)
Willfact
Дата последнего обновления инструкции:
- 01.2024 ________________________________________________________________________________________
ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ:
Дозирование
В общем случае введение 1 МЕ/кг массы тела фактора фон Виллебранда приводит к увеличению активности циркулирующего vWF:RCo на примерно 0,02 МЕ/мл (2%).
Необходимо стремиться к достижению концентраций vWF:RCo не менее 0,6 МЕ/мл (60%) и FVIII:C не менее 0,4 МЕ/мл (40%).
Достижение гемостаза является неопределенным до тех пор, пока активность коагуляционного фактора VIII (FVIII:C) не достигнет 0,4 МЕ/мл (40%). Введение только фактора фон Виллебранда не приводит к максимальному увеличению активности FVIII:C в течение как минимум 6–12 часов. Оно не достаточно для немедленной нормализации активности FVIII:C. Поэтому, если начальная активность FVIII:C у пациента ниже критической величины, и необходимо быстрое корректирование гемостаза — как, например, при лечении кровотечения, тяжелой травмы или во время срочной операции — с первым введением фактора фон Виллебранда необходимо ввести фактор VIII, чтобы можно было достичь активности FVIII:C в плазме, обеспечивающей гемостазу.
Если же немедленное увеличение активности FVIII:C не является необходимым — например, при плановой операции — или если начальная активность FVIII:C позволяет поддерживать гемостазу, врач может принять решение о пропуске введения FVIII вместе с первым введением фактора фон Виллебранда.
- Начало лечения: Первая доза препарата Willfact составляет 40-80 МЕ/кг массы тела при лечении кровотечения или травмы. Она вводится в сочетании с необходимым количеством препарата, содержащего фактор VIII, рассчитанным на основе начальной активности FVIII:C в плазме пациента, позволяющим достичь необходимой активности FVIII:C в плазме, непосредственно перед операцией или как можно скорее после начала эпизода кровотечения или возникновения тяжелой травмы. При операции первое введение должно быть сделано за час до операции. Введение начальной дозы 80 МЕ/кг массы тела препарата Willfact может быть необходимо, особенно у пациентов с болезнью фон Виллебранда типа 3, при которой поддержание необходимой активности может потребовать более высоких доз, чем при других типах vWD.
При плановой операции первое введение препарата Willfact должно быть сделано за 12–24 часа до операции, а второе введение — непосредственно перед операцией. В таких случаях одновременное введение препарата фактора VIII не является необходимым, поскольку перед операцией концентрация эндогенного FVIII:C обычно достигает критической величины 0,4 МЕ/мл (40%). Однако это должно быть подтверждено у каждого пациента.
- Последующие введения: При необходимости необходимо продолжить лечение препаратом Willfact в монотерапии в дозе 40-80 МЕ/кг массы тела в сутки в 1 или 2 введениях в день в течение одного или нескольких дней. Доза и частота введений должны быть всегда скорректированы в зависимости от типа операции, клинического и биологического состояния (vWF:RCo и FVIII:C) пациента, а также от вида и тяжести эпизода кровотечения.
- Профилактика: Препарат Willfact может быть введен в качестве профилактики в дозе, скорректированной индивидуально для каждого пациента. Препарат Willfact в дозе 40-60 МЕ/кг массы тела, вводимый 2-3 раза в неделю, снижает количество эпизодов кровотечения.
- Амбулаторное лечение: С согласия врача, особенно при незначительном или умеренном кровотечении или при длительной профилактике кровотечений, можно начать домашнее лечение.
Дети и подростки
Размер дозы при каждом показании основан на массе тела. Дозу и продолжительность лечения необходимо скорректировать в зависимости от клинического состояния пациента и концентраций vWF:RCo и FVIII:C в плазме.
- Начало лечения
- У детей в возрасте до 6 лет начальная доза может быть установлена на основе приростного восстановления (IR) у пациента или, если данные IR не доступны, может быть необходима начальная доза, равная 60-100 МЕ/кг массы тела, для увеличения концентрации vWF:RCo у пациента до 100 МЕ/дл.
- У детей в возрасте старше 6 лет и подростков дозирование такое же, как у взрослых пациентов.
- Последующие введения: У детей и подростков последующие дозы должны быть установлены индивидуально в зависимости от клинического состояния и концентрации vWF:RCo и скорректированы в зависимости от клинической реакции.
Плановая операция
- У детей в возрасте до 6 лет после первой дозы, введенной за 12-24 часа до операции, повторную дозу можно ввести за 30 минут до операции.
- У детей в возрасте старше 6 лет и подростков дозирование такое же, как у взрослых пациентов.
- Профилактика: У детей и подростков дозу и частоту повторного введения необходимо установить индивидуально в зависимости от приростного восстановления и концентрации vWF:RCo у пациента и скорректировать в зависимости от клинической реакции.
Способ и путь введения
Внутривенное введение
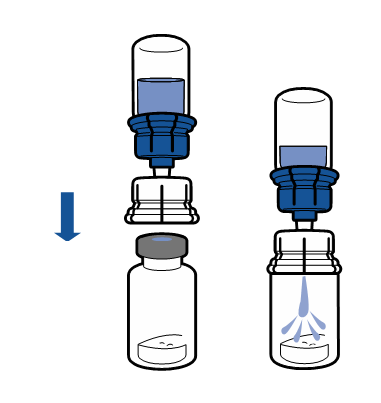
Реconstitution
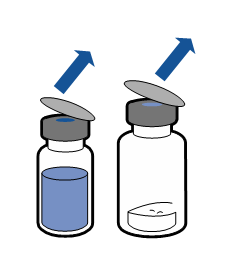
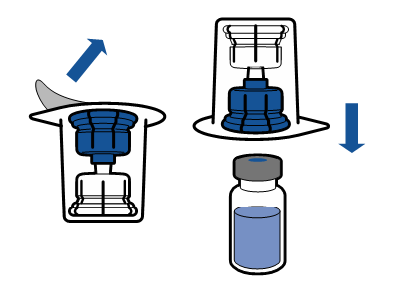
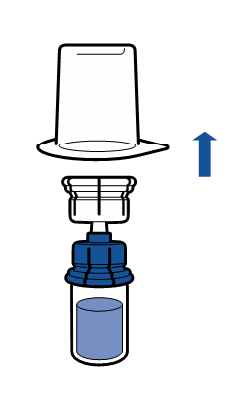
Необходимо соблюдать текущие рекомендации по аseптической технике работы. Систему для переноса необходимо использовать только для реconstitution препарата, как описано ниже. Система не предназначена для введения препарата пациенту.
  |
|
    |
|
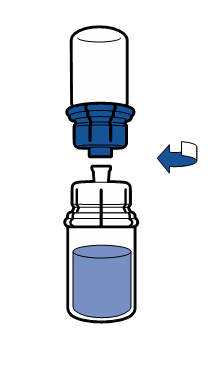
Порошок должен раствориться в течение времени, короче 5 минут, обычно растворяется сразу.
Полученный раствор должен быть прозрачным или слегка опалесцирующим, бесцветным или слегка желтоватым. Перед введением зреконструированный препарат необходимо визуально проверить на наличие частиц и изменений цвета.
Не использовать раствор, если он мутный или содержит осадок.
Не смешивать с другими препаратами.
Не разбавлять препарат после реconstitution.
Введение
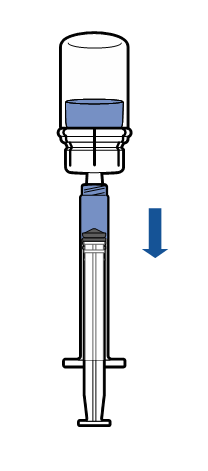 |
|
Хранение после реconstitution
Для сохранения стерильности препарат должен быть использован сразу после реconstitution. Однако было показано, что химическая и физическая стабильность препарата сохраняется в течение 24 часов при 25°C.
Все неиспользованные остатки препарата или его отходы должны быть утилизированы в соответствии с местными правилами.
- Страна регистрации
- Активное вещество
- Требуется рецептНет
- Производитель
- ИмпортерLFB-Biomedicamensts LFB-Biomedicaments
- Информация носит справочный характер и не является медицинской рекомендацией. Перед приемом любых препаратов проконсультируйтесь с врачом. Oladoctor не несет ответственности за медицинские решения, принятые на основе этого контента.
- Аналоги Виллфацт 2000 й.м.Форма выпуска: Порошок, 1000 МЕАктивное вещество: Фактор ВиллебрандаПроизводитель: LFB-Biomedicamensts LFB-BiomedicamentsНе требуется рецептФорма выпуска: Порошок, 500 МЕ/5 млАктивное вещество: Фактор ВиллебрандаПроизводитель: LFB-Biomedicamensts LFB-BiomedicamentsНе требуется рецептФорма выпуска: Порошок, 1000 МЕАктивное вещество: фактор свертывания крови VIIIПроизводитель: CSL Behring GmbHТребуется рецепт
Аналоги Виллфацт 2000 й.м. в других странах
Лучшие аналоги с тем же действующим веществом и терапевтическим эффектом.
Аналог Виллфацт 2000 й.м. в Hiszpania
Врачи онлайн по Виллфацт 2000 й.м.
Консультация по дозировке, побочным эффектам, взаимодействиям, противопоказаниям и продлению рецепта на Виллфацт 2000 й.м. – по решению врача и с учетом местных правил.














