
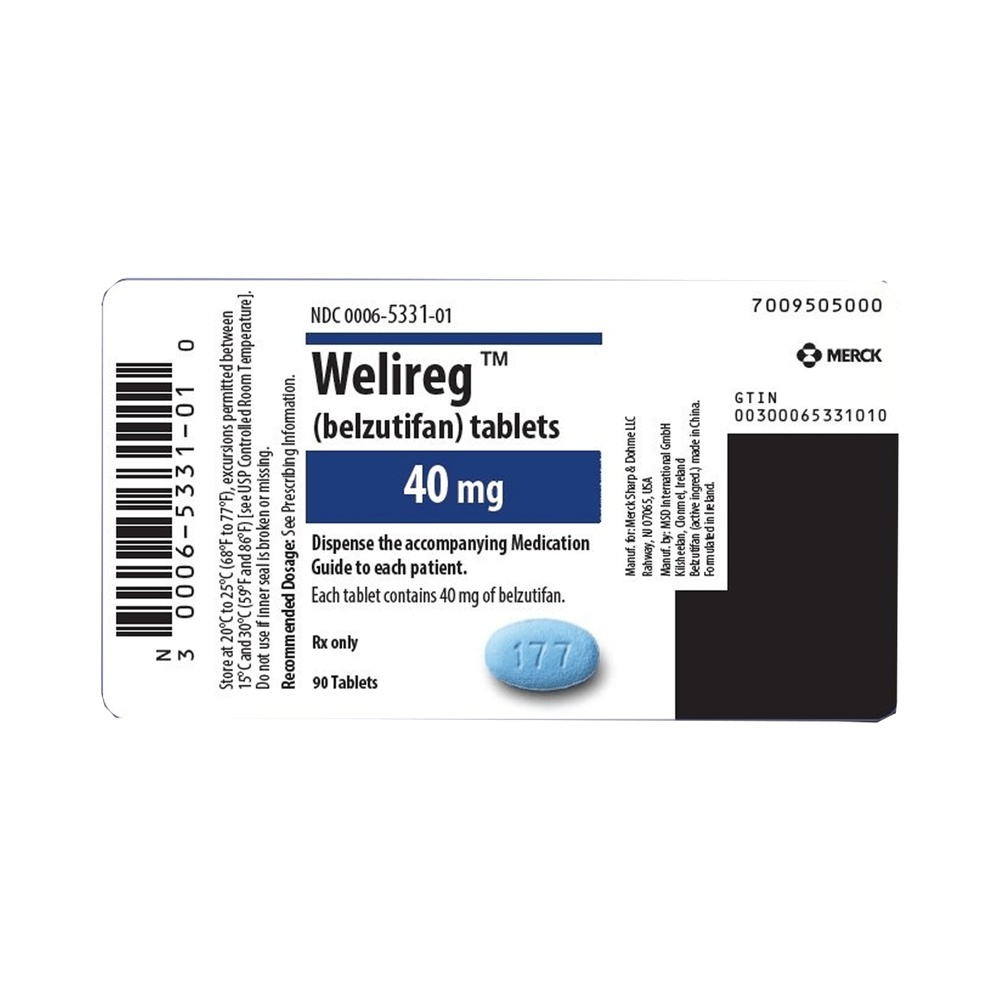
WELIREG 40 mg COMPRIMIDOS REVESTIDOS POR PELÍCULA


Como usar WELIREG 40 mg COMPRIMIDOS REVESTIDOS POR PELÍCULA
Introdução
Prospecto: informação para o paciente
WELIREG 40mg comprimidos revestidos com película
belzutifano
Este medicamento está sujeito a monitorização adicional, o que agilizará a detecção de nova informação sobre a sua segurança. Pode contribuir notificando os efeitos adversos que possa ter. A parte final da seção 4 inclui informação sobre como comunicar estes efeitos adversos.
Leia todo o prospecto atentamente antes de começar a tomar este medicamento, porque contém informação importante para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- O envase também contém uma carta de informação para a paciente destinada a mulheres que possam ficar grávidas. Por favor, leia-a, porque contém informação de segurança importante que precisa conhecer antes e durante o tratamento com WELIREG
- Este medicamento foi prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver seção 4.
Conteúdo do prospecto
- O que é WELIREG e para que é utilizado
- O que precisa saber antes de começar a tomar WELIREG
- Como tomar WELIREG
- Efeitos adversos possíveis
- Conservação de WELIREG
- Conteúdo do envase e informação adicional
1. O que é WELIREG e para que é utilizado
WELIREG é um medicamento para o cancro que contém o princípio ativo belzutifano.
WELIREG é utilizado para tratar adultos com:
- Carcinoma de células renais com um componente de células claras, um tipo de cancro de rim. É utilizado quando o cancro está avançado (estendeu-se) após tratamentos que atuam sobre o sistema imunológico (inibidores de PD-1 ou PD-L1) e os vasos sanguíneos do cancro (terapia dirigida a VEGF).
- Doença de Von Hippel-Lindau (uma doença genética que produz tumores e quistes que crescem em certas partes do corpo) que necessitam tratamento para o carcinoma de células renais, para tumores do cérebro e da medula espinhal chamados hemangioblastomas do sistema nervoso central, ou para um tipo de cancro de pâncreas chamado tumor neuroendócrino pancreático, e para os quais a cirurgia ou outros procedimentos locais não são adequados.
O princípio ativo de WELIREG, belzutifano, bloqueia uma proteína chamada fator induzível por hipóxia 2 alfa (HIF-2α). Esta proteína ajuda a controlar como crescem as células e os vasos sanguíneos, o que desempenha um papel importante no desenvolvimento e propagação de tumores no corpo.
2. O que precisa saber antes de começar a tomar WELIREG
Não tome WELIREG
- Se é alérgico a belzutifano ou a algum dos outros componentes deste medicamento (incluídos na seção 6). Fale com o seu médico ou farmacêutico se não tiver certeza disso.
- Se está grávida e precisa ser tratada da doença de Von Hippel-Lindau (ver seção “Gravidez”).
Advertências e precauções
Consulte o seu médico ou farmacêutico antes de começar a tomar WELIREG:
- se tem problemas respiratórios
- se tem níveis baixos de glóbulos vermelhos (anemia)
- se tem a doença de Von Hippel-Lindau e tumores no cérebro e medula espinhal
Níveis baixos de glóbulos vermelhos (anemia)
O tratamento com WELIREG pode causar anemia (níveis baixos de glóbulos vermelhos). Informe o seu médico se desenvolver algum dos seguintes sintomas:
- dificuldade para respirar
- sensação de cansaço (fadiga)
- tontura
- palidez da pele
O seu médico o controlará para detectar anemia antes de começar o tratamento com WELIREG e durante o tratamento. Se desenvolver anemia grave, o seu médico pode começar o tratamento com medicamentos que estimulam a produção de glóbulos vermelhos (agentes estimulantes da eritropoiese) e/ou transfusões de sangue e suspender o tratamento com WELIREG até que a anemia se resolva, ou pode interromper permanentemente o tratamento com WELIREG.
Níveis mais baixos de oxigénio no seu sangue (hipóxia)
O tratamento com WELIREG pode causar hipóxia. Informe o seu médico imediatamente se desenvolver algum dos seguintes sintomas:
- dificuldade para respirar
- batimentos do coração rápidos
- respiração rápida
- coloração azulada da pele ao redor da boca
- incapacidade para dizer frases completas sem tomar fôlego
- cansaço incomum
- confusão
O seu médico o controlará para detectar hipóxia antes de começar o tratamento com WELIREG e durante o tratamento. Se desenvolver hipóxia grave, o seu médico pode começar o tratamento com terapia de oxigénio ou suspender o tratamento com WELIREG. O tratamento com WELIREG será reiniciado a uma dose mais baixa. Se reaparecer, o seu médico suspenderá o tratamento com WELIREG.
Em alguns casos, se desenvolver hipóxia que seja muito grave, o seu médico pode interromper permanentemente o tratamento com WELIREG.
Sangramento no seu cérebro e medula espinhal (hemorragia do sistema nervoso central)
O tratamento com WELIREG para a doença de Von Hippel-Lindau pode causar sangramento no seu cérebro e medula espinhal se tiver tumores no cérebro e/ou medula espinhal. Informe o seu médico imediatamente se desenvolver algum dos seguintes sintomas:
- dor de cabeça grave
- problemas de visão
- sonolência grave
- fraqueza grave em um lado do seu corpo
- movimentos musculares descoordenados
- dor grave no pescoço ou nas costas
- perda de sensação de dor, temperatura e tacto
Crianças e adolescentes
Não se recomenda o uso de WELIREG em crianças e adolescentes menores de 18 anos de idade. Desconhece-se se WELIREG é seguro e eficaz nestes pacientes.
Outros medicamentos e WELIREG
Informa o seu médico ou farmacêutico se está a tomar, tomou recentemente ou pode ter que tomar qualquer outro medicamento. Isto deve-se a que WELIREG pode afetar o mecanismo de ação de outros medicamentos. Do mesmo modo, alguns outros medicamentos podem afetar o mecanismo de ação de WELIREG.
WELIREG pode afetar a forma como funcionam os anticoncepcionais hormonais. Enquanto estiver a tomar WELIREG e até pelo menos uma semana após a última dose deve:
- usar um método anticoncepcional não hormonal eficaz ou
- que o seu parceiro masculino utilize preservativo.
Gravidez
Não tome WELIREG para a doença de Von Hippel-Lindau se está grávida.
Se está grávida e precisa de tratamento para o carcinoma de células renais, fale com o seu médico sobre o uso de WELIREG.
WELIREG pode danificar o bebê e pode provocar um aborto espontâneo. Se está grávida, acha que pode estar grávida ou tem intenção de ficar grávida, consulte o seu médico ou farmacêutico antes de utilizar este medicamento.
O seu médico fará um teste de gravidez antes de começar a tomar WELIREG.
Não deve ficar grávida enquanto tomar WELIREG.
Se é mulher e pode ficar grávida:
- Os métodos anticoncepcionais que contêm hormonas, como píldoras anticoncepcionais, injeções ou adesivos transdérmicos, podem não funcionar tão bem enquanto estiver a tomar WELIREG.
- Enquanto estiver a tomar WELIREG e até pelo menos uma semana após a última dose deve:
- usar um método anticoncepcional não hormonal eficaz ou
- que o seu parceiro masculino utilize preservativo.
Fale com o seu médico ou farmacêutico sobre os métodos anticoncepcionais que podem ser adequados para si enquanto tomar WELIREG.
Fertilidade
WELIREG pode causar problemas de fertilidade em homens e mulheres, o que pode afetar a sua capacidade para ter filhos. Consulte o seu médico ou farmacêutico se isto o preocupa.
Amamentação
Informa o seu médico ou farmacêutico se está a amamentar ou tem intenção de o fazer.
Desconhece-se se WELIREG passa para o leite materno. Tomar este medicamento enquanto estiver a amamentar pode danificar o seu bebê.
Si e o seu médico devem decidir conjuntamente se vai tomar WELIREG ou se vai amamentar, mas não ambas as coisas ao mesmo tempo.
Se desejar começar a amamentar, espere pelo menos 1 semana após a última dose de WELIREG.
Condução e uso de máquinas
É possível que se sinta tonto ou cansado enquanto tomar WELIREG. Se assim for, não conduza nem utilize máquinas até que deixe de se sentir tonto ou cansado.
WELIREG contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por comprimido revestido com película; isto é, é essencialmente “isento de sódio”.
3. Como tomar WELIREG
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico ou farmacêutico. Em caso de dúvida, consulte novamente o seu médico ou farmacêutico.
Quantidade que deve tomar
- A dose recomendada é de 120 mg uma vez ao dia. Tome três comprimidos de 40 mg uma vez ao dia, aproximadamente à mesma hora todos os dias.
- O seu médico pode reduzir a dose ou suspender o tratamento, seja por pouco tempo ou de forma definitiva, se experimentar determinados efeitos adversos enquanto tomar WELIREG (ver seção 4).
Como tomar
Engula os comprimidos inteiros, não os parta. Desconhece-se se este medicamento funciona se os comprimidos não forem tomados inteiros.
Pode tomar WELIREG com ou sem alimentos.
Se tomar mais WELIREG do que deve
Se tomar demasiados comprimidos, consulte um médico ou acuda a um hospital.
Se esquecer de tomar WELIREG
Se esquecer de uma dose de WELIREG, tome a dose esquecida o mais cedo possível nesse mesmo dia. Tome a sua dose habitual de WELIREG no dia seguinte.
Se vomitar após tomar WELIREG, não tome outra dose. Tome a sua dose habitual de WELIREG no dia seguinte.
4. Efeitos adversos possíveis
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
WELIREG pode causar os seguintes efeitos adversos, que podem ser graves (ver seção 2):
- níveis reduzidos de glóbulos vermelhos (anemia) (muito frequentes, podem afetar mais de 1 em cada 10 pessoas)
- níveis mais baixos de oxigénio no seu sangue (hipóxia) (muito frequentes, podem afetar mais de 1 em cada 10 pessoas)
- ter dificuldade para respirar (dispneia) (muito frequentes, podem afetar mais de 1 em cada 10 pessoas)
Informa o seu médico se notar algum dos seguintes sintomas:
- sensação de cansaço (fadiga)
- palidez da pele
- falta de ar
- dificuldade para respirar
- dor no peito
- batimentos do coração rápidos
- ou tontura
Pode precisar de uma transfusão de sangue, se o seu recuento de glóbulos vermelhos for demasiado baixo. Pode precisar de administração de oxigénio se os seus níveis de oxigénio no sangue forem demasiado baixos.
O seu médico fará análises de sangue para comprovar o seu recuento de glóbulos vermelhos e medir o nível de oxigénio no sangue antes e durante o tratamento com WELIREG.
Outros efeitos adversos que podem ocorrer:
Muito frequentes (podem afetar mais de1 em cada 10pessoas):
- sensação de cansaço (fadiga)
- sensação de tontura
- sensação de mal-estar (náuseas)
- sangramento (hemorragia) (incluindo sangramento no seu cérebro e medula espinhal se tiver hemangioblastomas do sistema nervoso central associados à doença de Von Hippel-Lindau)
Frequentes (podem afetar até1 em cada 10pessoas):
- aumento de peso
Informa o seu médico ou farmacêutico se notar algum dos efeitos adversos mencionados anteriormente.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, pode contribuir para fornecer mais informação sobre a segurança deste medicamento.
5. Conservação de WELIREG
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece no blister e na caixa após "CAD". A data de validade é o último dia do mês que se indica.
Este medicamento não requer condições especiais de conservação.
Não utilize este medicamento se o envase estiver danificado ou mostrar sinais de manipulação.
Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de WELIREG
- O princípio ativo é belzutifano. Cada comprimido revestido com película contém 40 mg de belzutifano.
- Os demais componentes são croscarmelosa sódica (E 468) (ver “WELIREG contém sódio” na seção 2), succinato acetato de hipromelosa, estearato de magnésio (E 470b), manitol (E 421), celulosa microcristalina (E 460) e sílica coloidal anidra (E 551). O revestimento com película contém laca de alumínio carmim índigo (E 132), macrogol (E 1521), álcool polivinílico (E 1203), talco (E 553b) e dióxido de titânio (E 171).
Aspecto do produto e conteúdo do envase
WELIREG é um comprimido revestido com película, ovalado, de cor azul, com a inscrição "177" gravada em uma face e liso na outra. WELIREG é apresentado em blisteres de alumínio/alumínio. Cada envase contém 30 comprimidos revestidos com película. Cada envase múltiplo contém 90 comprimidos revestidos com película (3 caixas de 30). Pode ser que nem todos os tamanhos de envase estejam disponíveis no seu país.
Título da autorização de comercialização e responsável pela fabricação
Merck Sharp & Dohme B.V.
Waarderweg 39
2031 BN Haarlem
Países Baixos
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica MSD Bélgica Tel: +32(0)27766211 | Lituânia UAB Merck Sharp & Dohme Tel: + 370 5 278 02 47 dpoc_lituâ[email protected] |
| Luxemburgo MSD Bélgica Tel: +32(0)27766211 |
República Checa Merck Sharp & Dohme s.r.o. Tel: +420 233 010 111 dpoc_tchecoslová[email protected] | Hungria MSD Pharma Hungria Kft. Tel.: +36 1 888 5300 |
Dinamarca MSD Dinamarca ApS Tlf.: + 45 4482 4000 | Malta Merck Sharp & Dohme Chipre Limited Tel: 8007 4433 (+356 99917558) |
Alemanha MSD Sharp & Dohme GmbH Tel: +49 (0) 89 20 300 4500 | Países Baixos Merck Sharp & Dohme B.V. Tel: 0800 9999000 (+31 23 5153153) |
Estônia Merck Sharp & Dohme OÜ Tel: +372 6144 200 dpoc_estô[email protected] | Noruega MSD (Noruega) AS Tlf: +47 32 20 73 00 |
Grécia MSD Α.Φ.Ε.Ε Τηλ: +30 210 98 97 300 dpoc_gré[email protected] | Áustria Merck Sharp & Dohme Ges.m.b.H. Tel: +43 (0) 1 26 044 dpoc_á[email protected] |
Espanha Merck Sharp & Dohme de Espanha, S.A. Tel: +34 91 321 06 00 | Polônia MSD Polônia Sp. z o.o. Tel: +48 22 549 51 00 msdpolô[email protected] |
França MSD França Tél: + 33 (0) 1 80 46 40 40 | Portugal Merck Sharp & Dohme, Lda Tel: +351 21 4465700 |
Croácia Merck Sharp & Dohme d.o.o. Tel: + 385 1 6611 333 | Romênia Merck Sharp & Dohme Romênia S.R.L. Tel: +40 21 529 29 00 msdromê[email protected] |
Irlanda Merck Sharp & Dohme Irlanda (Saúde Humana) Limited Tel: +353 (0)1 2998700 | Eslovênia Merck Sharp & Dohme, inovativna zdravila d.o.o. Tel: +386 1 5204 201 msd.eslovê[email protected] |
Islândia Vistor hf. Sími: + 354 535 7000 | República Eslovaca Merck Sharp & Dohme, s. r. o. Tel: +421 2 58282010 dpoc_tchecoslová[email protected] |
Itália MSD Itália S.r.l. Tel: 800 23 99 89 (+39 06 361911) | Finlândia MSD Finlândia Oy Puh/Tel: +358 (0)9 804 650 |
Chipre Merck Sharp & Dohme Chipre Limited Τηλ.: 800 00 673 (+357 22866700) | Suécia Merck Sharp & Dohme (Suécia) AB Tel: +46 77 5700488 |
Letônia SIA Merck Sharp & Dohme Letônia Tel.: + 371 67025300 dpoc_letô[email protected] |
Data da última revisão deste prospecto:
Este medicamento foi autorizado com uma «autorização condicional». Esta modalidade de autorização significa que se espera obter mais informações sobre este medicamento.
A Agência Europeia de Medicamentos revisará as informações novas sobre este medicamento pelo menos uma vez ao ano e este prospecto será atualizado quando necessário.
Outras fontes de informação
A informação detalhada sobre este medicamento está disponível no site da Agência Europeia de Medicamentos: https://www.ema.europa.eu.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a WELIREG 40 mg COMPRIMIDOS REVESTIDOS POR PELÍCULAForma farmacêutica: CÁPSULA, 0.5 mgSubstância ativa: anagrelideFabricante: Aurovitas Spain, S.A.U.Requer receita médicaForma farmacêutica: CÁPSULA, 0.5 mgSubstância ativa: anagrelideFabricante: Bluefish Pharmaceuticals Ab (Publ)Requer receita médicaForma farmacêutica: CÁPSULA, 0.5 mgSubstância ativa: anagrelideFabricante: Glenmark Arzneimittel GmbhRequer receita médica
Alternativas a WELIREG 40 mg COMPRIMIDOS REVESTIDOS POR PELÍCULA noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a WELIREG 40 mg COMPRIMIDOS REVESTIDOS POR PELÍCULA em Ukraine
Médicos online para WELIREG 40 mg COMPRIMIDOS REVESTIDOS POR PELÍCULA
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de WELIREG 40 mg COMPRIMIDOS REVESTIDOS POR PELÍCULA – sujeita a avaliação médica e regras locais.






