VEINFIBRO 1% SOLUÇÃO INJETÁVEL

Pergunte a um médico sobre a prescrição de VEINFIBRO 1% SOLUÇÃO INJETÁVEL

Como usar VEINFIBRO 1% SOLUÇÃO INJETÁVEL
Introdução
Prospecto: Informação para o utilizador
Veinfibro 1% solução injetável
Tetradecilsulfato de sódio
Leia todo o prospecto atentamente antes de começar a usar este medicamento porque contém informações importantes para si.
- Conserva este prospecto, pois pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito apenas para si e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, pois pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto:
- O que é Veinfibro e para que é utilizado
- O que necessita saber antes de começar a usar Veinfibro
- Como usar Veinfibro
- Possíveis efeitos adversos
- Conservação de Veinfibro
- Conteúdo do envase e informações adicionais
1. O que é Veinfibro e para que é utilizado
Veinfibro é um medicamento que contém tetradecilsulfato de sódio.
Veinfibro é utilizado para o tratamento das varizes, vénulas grandes, médias ou pequenas e aranhas vasculares.
Veinfibro pertence a um grupo de medicamentos chamados esclerosantes. Os esclerosantes são agentes químicos que, quando injetados na veia afetada, provocam que a parede da veia inflame e que as paredes se unam. Isto detém o fluxo de sangue e a veia se converte em tecido cicatricial. Em algumas semanas, a veia deve desaparecer.
Veinfibro é de uso exclusivamente em adultos.
2. O que necessita saber antes de começar a usar Veinfibro
Não use Veinfibro se:
- é alérgico ao tetradecilsulfato de sódio ou a qualquer um dos outros componentes deste medicamento (incluídos na secção 6) ou tem uma doença alérgica.
- não pode andar por qualquer motivo ou está acamado.
- apresenta risco de desenvolver coágulos de sangue nas veias devido a:
- distúrbios sanguíneos hereditários, como a trombofilia
- tratamento anticonceptivo hormonal ou de substituição hormonal.
- sobrepeso significativo
- ser fumador
- imobilização de longa duração
- teve coágulos sanguíneos recentemente nas veias superficiais ou profundas ou nos pulmões
- foi operado recentemente
- tem veias varicosas (varizes) causadas por tumores pélvicos ou abdominais, a menos que o tumor tenha sido extirpado
- tem doenças não controladas, como a diabetes, hipertireoidismo, asma, anormalidade sanguínea, infecção da sangue ou problemas respiratórios ou cutâneos recentes
- tem inchaço ou uma zona vermelha da pele que se encontra quente ou sensível (celulite)
- possui algum tipo de infecção
- possui um cancro em evolução
- se lhe disseram que tem problemas com o fechamento de válvulas das veias profundas (incompetência valvular)
- tem alguma artéria obstruída
- Tem uma inflamação grave das veias nas pernas (flebite aguda)
- tem sintomas de uma cardiopatia congénita (só se o esclerosante for utilizado como espuma)
Advertências e precauções
Consulte o seu médico ou enfermeiro antes de começar a usar Veinfibro se:
- é alérgico a algum alimento ou medicamento ou se tem outras alergias. Deve comunicá-lo ao seu médico, pois é necessário administrar uma dose de teste 24 horas antes de que lhe administrem uma dose maior posteriormente.
- tem antecedentes de coágulos de sangue nas veias superficiais ou profundas ou nos pulmões
- tem um buraco no coração assintomático (se o esclerosante for utilizado em forma de espuma)
- tem um buraco no coração sintomático ou assintomático (se o esclerosante for utilizado em forma de líquido)
- sofre enxaqueca
- tem problemas com as veias das pernas associados a uma doença prolongada que causa inflamação dos tecidos corporais (linfedema). Veinfibro pode piorar a dor e a inflamação locais por alguns dias ou por várias semanas.
- tem antecedentes de hipertensão pulmonar
- tem antecedentes de um ataque isquémico transitório (AIT), acidente vascular cerebral grave
- lhe disseram que tem alguma doença nas artérias ou veias (arteriosclerose)
- possui inflamações graves e coágulos das artérias e veias que o afetam nas mãos e pés (doença de Buerger)
- tem alguma dificuldade respiratória controlada (asma)
Veinfibro deve ser administrado por um médico quando as diretrizes nacionais o permitam. Veinfibro pode ser administrado por profissionais de saúde devidamente qualificados, com experiência em anatomia das veias e familiarizados com a técnica de injeção apropriada sob a supervisão de um médico. Antes de usar esta injeção, pode ser necessário fazer-lhe testes para ver se tem algum problema com o fechamento de válvulas nas suas veias.
O seu médico fará perguntas sobre a sua saúde e informá-lo-á sobre os possíveis efeitos secundários deste procedimento.
Durante o tratamento
O seu médico fará um acompanhamento durante e após a escleroterapia por si aparecerem sinais de hipersensibilidade (vermelhidão, picazón, tosse) ou sintomas neurológicos (distúrbios visuais, enxaqueca, formigamento, entorpecimento).
Pedir-lhe-á que volte para uma visita de acompanhamento.
Crianças e adolescentes
Não foi estabelecida a segurança nem a eficácia de Veinfibro em crianças nem em adolescentes.
Outros medicamentos e Veinfibro
Se está a tomar anticonceptivos hormonais (a pílula) ou substituição hormonal pode ter risco de desenvolver coágulos sanguíneos nas veias (ver “Não use Veinfibro se”). Deve notificar ao seu médico ou enfermeiro.
Informar ao seu médico ou enfermeiro se está a tomar ou tomou recentemente algum outro medicamento, incluindo aqueles obtidos sem receita.
Gravidez e amamentação
Deve notificar ao seu médico se:
- está grávida ou acha que pode estar
- planeia ficar grávida
- está em período de amamentação
Não há informações adequadas sobre o uso de Veinfibro em mulheres grávidas. Não se deve utilizar Veinfibro durante a gravidez a menos que seja claramente necessário. O seu médico decidirá se este tratamento é apropriado para si ou não.
Não se sabe se Veinfibro é excretado no leite materno. Se está em período de amamentação, o médico decidirá se se pode utilizar Veinfibro.
Condução e uso de máquinas
Após o tratamento com esta injeção, pode ser recomendado que use um penso e/ou meias de compressão para ajudar a reduzir a inflamação e a pigmentação da pele, o que poderia afetar a sua capacidade para conduzir.
Veinfibro contém sódio, potássio e álcool benzílico
Este medicamento contém:
- menos de 1 mmol de sódio (23 mg) por frasco ou ampola, ou seja, basicamente “isento de sódio”.
- menos de 1 mmol de potássio (39 mg) por frasco ou ampola, ou seja, basicamente “isento de potássio”.
- 40 mg de álcool benzílico em cada ampola de 2 ml ou 100 mg de álcool benzílico em cada frasco de 5 ml, o que equivale a 20 mg/ml. O álcool benzílico pode causar reações alérgicas. Consulte o seu médico ou farmacêutico se está grávida, em período de amamentação ou se padece de alguma doença hepática ou renal. Isto deve-se ao facto de que se podem acumular grandes quantidades de álcool benzílico no seu organismo e provocar efeitos adversos (acidose metabólica).
3. Como usar Veinfibro
Não tenteinjetar-se Veinfibro sozinho. Deve ser tratado sempre por um médico experiente e familiarizado com a técnica de injeção.
A terapia envolve a injeção do medicamento na veia afetada utilizando as agulhas mais pequenas possíveis e deve ser injetado devagar e com um cuidado extremo para que o conteúdo dessas veias seja expulso. O medicamento pode ser misturado manualmente com ar usando duas seringas e um conector para criar espuma que ajude a expulsar a sangue nas veias maiores. Neste caso, deve ser administrado por um médico formado na correcta geração e administração da espuma.
O seu médico deve guiar-se mediante técnica de ultrassons no tratamento de veias varicosas não visíveis para administrar o esclerosante em espuma.
O seu médico decidirá sobre as áreas a tratar e a dose correcta para si. As doses recomendadas são as seguintes:
Adultos e idosos
A dose varia entre 0,1 e 2 ml para cada injeção. Pode ser utilizado um máximo de 10 ml das três injeções de menor concentração, no entanto não se usa mais de 4 ml quando se utiliza a injeção de maior concentração.
Devido ao volume limitado de esclerosante autorizado, pode ser necessário realizar sessões repetidas de escleroterapia.
Após ter sido tratado com Veinfibro, deve seguir os conselhos do seu médico. Pode ser aconselhado a usar um penso ou meias de compressão para ajudar a reduzir a inflamação e a pigmentação da pele.
Se tiver alguma dúvida sobre o uso deste medicamento, consulte o seu médico, farmacêutico ou enfermeiro.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Pode experimentar efeitos adversos graves. Pare o tratamento com Veinfibro e dirija-se ao seu médico ou acuda a um serviço de urgências de hospital imediatamente se tiver o seguinte:
Pouco frequentes (pode afectar até 1 de cada 100 doentes):
- Coágulos de sangue nas veias profundas (trombose das veias profundas possivelmente devida a uma doença subjacente). Os sintomas podem incluir dor, inflamação, sensibilidade em uma das pernas (por norma a panturrilha), um dor intenso na área afetada, pele quente na área do coágulo ou pele avermelhada, especialmente na parte posterior da perna por baixo do joelho.
Raro (pode afectar até 1 de cada 1.000 doentes):
- Morte tissular local da pele e, mais invulgarmente, dos nervos. Os sintomas incluem dor, decoloração da pele (vermelhidão), inflamação ou acumulação de líquido, bolhas (podem estar cheias de líquido claro ou sangue), a pele se torna de cor vermelha escura, púrpura ou preta, sensação anormal (formigamento, picazón, queimadura), entorpecimento ou perda de sensação.
Muito raro (pode afectar até 1 de cada 10.000 doentes):
- Uma reacção alérgica muito grave (choque anafiláctico), que pode causar dificuldades para respirar ou uma queda repentina da pressão arterial, fazendo-o sentir-se mareado ou fazendo-o perder a consciência. É muito raro, mas deve ser tratado imediatamente, pois pode ser mortal.
- Obstrução de uma artéria devida a um coágulo que pode causar:
- um acidente vascular cerebral ou uma interrupção do suprimento sanguíneo ao cérebro ou olho (acidente isquémico transitório). Os sintomas podem incluir fraqueza, entorpecimento, paralisia na face, braço ou perna, por norma num lado do corpo, fala mal articulada ou ininteligível ou dificuldade para compreender os outros, cegueira num ou dois olhos ou visão dupla.
- um coágulo nos pulmões. Os sintomas podem incluir dificuldade para respirar que pode manifestar-se de repente, um dor torácico agudo e repentino que pode piorar com a respiração profunda ou tosse, frequência cardíaca rápida ou respiração rápida.
Para evitar este acontecimento grave e muito raro, não deve ser administrado este medicamento a doentes com alto risco de formação de coágulos nas veias e artérias (risco de trombose).
- Insuficiência da circulação sanguínea. Os sintomas podem incluir fadiga, perda de consciência, desmaios, dor torácica, dificuldade para respirar, fraqueza, mareio, vómito e palpitações.
- Morte do tecido após uma injeção intra-arterial. Os sintomas podem variar dependendo da quantidade de medicamento injetado e da rapidez com que se recebe atenção médica. Os sintomas podem incluir desde dor sem dano a longo prazo, até perda de grandes áreas de tecido, incluindo o pé, resultando em amputação.
Outros efeitos secundários que se podem experimentar são:
Muito frequentes (podem afectar mais de 1 de cada 10 doentes):
- Inflamação superficial da veia
Frequentes (podem afectar até 1 de cada 10 doentes):
- Dor ou queimadura (curto prazo no local da injeção),
- Decoloração da pele
- Crescimento de aranhas vasculares muito finas na área a tratar (capilarização)
Pouco frequentes (podem afectar até 1 de cada 100 doentes):
- Reacções locais alérgicas e não alérgicas da pele, como vermelhidão, picazón, erupções, inflamação da pele.
- Perturbações visuais
- Enxaqueca
Raros (podem afectar até 1 de cada 1.000 doentes):
- Tosse, dificuldade para respirar, sensação de pressão, opressão no peito
- Ardor, picazón, formigamento ou coceira da pele
- Dor de cabeça e sensação de desmaio
- Confusão, mareio e perda de consciência
Muito raros (podem afectar até 1 de cada 10.000 doentes):
- Febre, sofocos, picazón e vermelhidão da pele (urticária)
- Náuseas, vómitos, diarreia, sensação de inflamação na língua, boca seca
- Inflamação dos vasos sanguíneos,.
Comunicação de efeitos adversos
Se experimentar algum tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do Sistema Español de Farmacovigilância de Medicamentos de Uso Humano: https://www.notificaram.es. Mediante a comunicação de efeitos adversos, pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Veinfibro
Mantenha este medicamento fora da vista e do alcance das crianças.
- Este medicamento não requer nenhuma temperatura especial de conservação
- Não congelar.
- Conservar o envase no embalagem exterior para protegê-lo da luz
- Não utilize este medicamento após a data de validade que aparece na etiqueta ou caixa de cartão. A data de validade é o último dia do mês que se indica.
Para um só uso. Uma vez aberto o envase, deve utilizar o conteúdo imediatamente. Elimine qualquer porção não utilizada do produto.
Os medicamentos não devem ser deitados fora pelos esgotos nem para o lixo. Deposite os envases e os medicamentos que não precisa no Ponto SIGRE da farmácia. Em caso de dúvida, pergunte ao seu farmacêutico como se livrar dos envases dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Veinfibro
O princípio ativo é tetradecilsulfato de sódio.
Cada ml de solução injetável contém 10 mg de tetradecilsulfato de sódio.
Cada ampola de 2 ml contém 20 mg de tetradecilsulfato de sódio.
Os demais componentes são: álcool benzílico (20 mg/ml), fosfato de disódio dodecahidratado, fosfato dihidrogênio de potássio, água para preparações injetáveis, hidróxido de sódio (para ajustar o pH). Ver seção 2, ”Veinfibro contém sódio e potássio”.
Aspecto de Veinfibro e conteúdo do envase
Este medicamento apresenta-se como solução injetável em frascos ou ampolas de vidro transparente.
A solução é transparente, incolor, estéril e livre de partículas visíveis.
Envases de 5 ampolas de 2 ml.
Pode ser que apenas alguns tamanhos de envases sejam comercializados.
Titular da autorização
STD Pharmaceutical (Irlanda) Limited,
Block 1, Blanchardstown Corporate Park,
Ballycoolen Road, Blanchardstown,
Dublin 15, D15 AKK1,
Irlanda
Responsável pela fabricação:
Medipha Santé
Les Fjords-Immeuble Oslo
19 Avenue de Norvège
91953 Courtaboeuf CEDEX
França
Ou
Chemische Fabrik Kreussler & Co. GmbH
Rheingaustrasse 87-93
65203 Wiesbaden,
Alemanha
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local titular da autorização de comercialização:
Representante local:
Logsa Endomedical S.L.
C/ Escritora Carmen Martín Gaite, 2,
Local 2, 29196 Málaga. Espanha
Este medicamento está autorizado nos estados membros doEspaço Económico Europeusob os seguintes nomes:
Alemanha, Bulgária, França, Irlanda, Países Baixos, Polônia, República Checa, Romênia Fibrovein
Áustria, Espanha Veinfibro
Data da última revisão deste prospecto: 05/2024
A seguinte informação está destinada unicamente a profissionais do setor sanitário
Veinfibro 1% solução injetável
Para mais informações, ver a Ficha Técnica
Posologia e forma de administração
Posologia
Veinfibro deve ser administrado unicamente por via intravenosa. A concentração necessária dependerá do tamanho e do grau de varicosidade. As aranhas vasculares devem ser tratadas com a solução a 0,2% e as veias reticulares com a solução a 0,5%. A solução a 1% é mais útil para varizes pequenas ou médias e a solução de 3% para varizes grandes. O tamanho das varizes não visíveis deve ser medido por meio de uma ecografia.
O esclerosante deve ser administrado por via intravenosa em pequenas alíquotas em múltiplos pontos ao longo da veia a tratar Veinfibro 0,2 % e 0,5 % devem ser administrados em forma de líquido. As soluções de Veinfibro 1 % e 3 % podem ser administradas, bem como líquido ou como mistura de esclerosante/ar (espuma) como se detalha na tabela abaixo. O objetivo é lograr a destruição óptima da parede do vaso com a menor concentração de esclerosante necessária para um resultado clínico. Se a concentração for muito alta, pode produzir necrose ou outras sequelas adversas.
Adultos
Concentração | Volume normal injetado intravenosamente no local adequado por sessão | Volume total máximo injetado por sessão | ||
Líquido | Espuma* | Líquido | Espuma* | |
Veinfibro 1% | 0,1 a 1,0 ml | 0,5 a 2,0 ml | 10 ml | 16ml |
- O volume é a soma dos componentes de líquido e ar.
Quando se requer especial precaução, recomenda-se administrar uma dose de teste de 0,25 a 0,5 ml de Veinfibro e observar o paciente durante várias horas antes de administrar uma segunda dose ou uma dose maior.
Como o volume a injetar está limitado por sessão, são frequentemente necessárias sessões repetidas (2 a 4 em média). Para prevenir uma possível reação alérgica, recomenda-se dar uma pequena dose de teste de Veinfibro no início de cada sessão.
Quando o esclerosante é administrado como espuma.
Veinfibro 1 % e 3 % podem ser convertidos em espuma para ser usado no tratamento de veias maiores. A espuma deve ser preparada justo antes de ser usada e administrada por um médico formado adequadamente na correta preparação e administração da espuma. Idealmente, deve ser administrado sob a guia de uma ecografia.
População de idade avançada
Não é aplicável nenhuma recomendação de dose específica.
População pediátrica
Não foi estabelecida a segurança nem a eficácia de Veinfibro em crianças e adolescentes. Não se dispõe de dados.
Forma de administração
Consulte a seguir as instruções para a preparação da espuma. Descreve-se o método Tessari de preparação da espuma. Podem ser utilizadas outras técnicas (p. ex., DSS, Easyfoam, Sterivein).
Para ver o método de preparação da espuma, consultar o final desta seção. Podem ser utilizadas outras técnicas (por exemplo DSS, Easyfoam, Sterivein).
Deve-se manter uma técnica estritamente asséptica durante o manuseio de Veinfibro. Veinfibro é um medicamento parenteral de um único uso. Uma vez aberto o envase, utilizar imediatamente e descartar qualquer porção não utilizada.
Inspeccione visualmente antes de utilizar que não haja partículas visíveis. As soluções que contêm partículas visíveis não devem ser usadas.
Quando o esclerosante é administrado como espuma, deve ser administrado idealmente guiado por técnica de ultrassom. Deve ser administrado por um médico formado na correta geração e administração de espuma.
Incompatibilidades
Este medicamento é incompatível com a heparina.
Nausência de estudos de compatibilidade, este medicamento não deve ser misturado com outros medicamentos.
Advertências e precauções especiais
Veinfibro deve ser administrado unicamente por um médico quando as diretrizes nacionais o permitam. Veinfibro pode ser administrado por profissionais de saúde devidamente qualificados, com experiência na anatomia venosa e no diagnóstico e tratamento de doenças que afetam o sistema venoso e que estejam familiarizados com uma técnica de injeção correta sob a supervisão de um médico.
Foram relatadas reações alérgicas, incluindo anafilaxia, e o médico deve estar preparado para tratá-las de forma adequada. Deve haver um equipamento de reanimação de emergência disponível. Como precaução, deve-se tratar o paciente no hospital.
Os efeitos adversos locais graves, incluindo necrose do tecido, podem ocorrer após a extravasação; portanto, o emprego de um cuidado extremo na colocação intravenosa da agulha e o uso do volume efetivo mínimo em cada local de injeção são importantes. A solução deve ser injetada lentamente.
É necessário ter precaução para não injetar a solução em uma artéria, pois isso pode provocar a morte do tecido (necrose do tecido) e pode provocar a morte da extremidade.
Deve-se ter precaução ao injetar no pé e na zona acima e abaixo do tornozelo (área maleolar) devido ao risco para uma das artérias. Deve-se aplicar compressão ao tratar pequenas veias, pois pode ocorrer pigmentação se o sangue for expulso na zona da injeção.
Preparação e manipulação
Indicações gerais
A qualidade da espuma depende de critérios específicos:
- A concentração do produto: a espuma só pode ser preparada com concentrações de 1 e 3 % de tetradecilsulfato de sódio.
- A proporção de líquido e ar: frequentemente, esta proporção é de 1 volume de líquido por 3 ou 4 volumes de ar.
- Número de passos para a frente e para trás: o médico deve seguir de forma precisa o número de movimentos definidos para cada técnica.
- A consistência macroscópica da espuma: a qualidade da espuma deve ser verificada fora da seringa antes de ser administrada. A espuma deve ser homogênea, suave e coesa sem grandes bolhas visíveis. Se houver grandes bolhas visíveis, a espuma deve ser descartada e uma nova espuma deve ser preparada.
- O tempo total de preparação da espuma: a preparação deve durar cerca de 10 segundos desde o primeiro ao último movimento de transferência.
- O tempo máximo entre a preparação e a injeção: a espuma esclerosante deve ser
usada nos sessenta segundos posteriores a ser produzida. Após sessenta
segundos, deve-se descartar toda espuma sobrante. Deve-se preparar mais espuma se necessário.
Preparar a espuma (técnica Tessari)
Deve-se manter uma técnica estritamente asséptica durante a preparação da espuma.
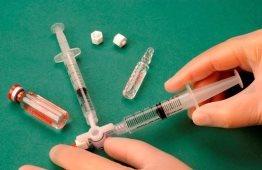
Para fazer a espuma, extrai-se 1 ml de líquido esclerosante para uma seringa estéril e recolhem-se 3 ml ou 4 ml de ar estéril em outra seringa estéril. O ar é recolhido através de um filtro de 0,2 micras para garantir sua esterilidade. Em seguida, conectam-se as seringas usando uma válvula estéril de três vias (Figura 1). Recomenda-se o uso de seringas Luer Lock e proteção ocular ao elaborar a espuma. A conexão com a válvula de três vias pode falhar sob pressão com as seringas Luer Slip, fazendo com que o produto saia a jorros sem controle.
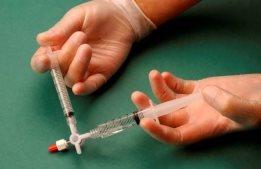
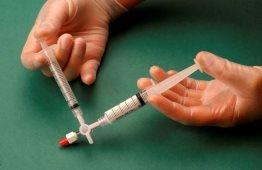
Em seguida, força-se o passo da mistura de ar e esclerosante de uma seringa para outra através da válvula de 3 vias, pelo menos 20 vezes para produzir uma espuma suave e consistente (Figuras 2 e 3).
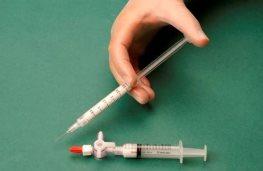
Então, retira-se a seringa que contém a espuma e injeta-se na veia imediatamente (Figura 4).
A espuma esclerosante deve ser usada nos sessenta segundos posteriores a ser produzida. Após sessenta segundos, deve-se descartar toda espuma sobrante. Deve-se preparar mais espuma se necessário.
A qualidade da espuma deve ser verificada antes de ser administrada. Deve ter um aspecto homogêneo, cor branca e sem grandes bolhas perceptíveis a olho nu.
Figura 1 |
Figura 2 |
Figura 3 |
Figura 4 |
Excipientes
Este medicamento contém:
- Menos de 1 mmol de sódio (23 mg) por frasco/ampola, ou seja, basicamente “isento de sódio”.
- Menos de 1 mmol de potássio (39 mg) por frasco/ampola, ou seja, basicamente “isento de potássio”.
- 40 mg de álcool benzílico em cada ampola de 2 ml ou 100 mg de álcool benzílico em cada frasco de 5 ml, o que equivale a 20 mg/ml. O álcool benzílico pode causar reações alérgicas. Pode causar acidose metabólica em pacientes grávidas, em período de lactação ou com doença hepática ou renal.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a VEINFIBRO 1% SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 0.5%Substância ativa: sodium tetradecyl sulfateFabricante: Std Pharmaceutical (Ireland) LimitedRequer receita médicaForma farmacêutica: INJETÁVEL, 3%Substância ativa: sodium tetradecyl sulfateFabricante: Std Pharmaceutical (Ireland) LimitedRequer receita médicaForma farmacêutica: Solution for injection, 2 mgSubstância ativa: sodium tetradecyl sulfateFabricante: Std Pharmaceutical (Ireland) LimitedRequer receita médica
Alternativas a VEINFIBRO 1% SOLUÇÃO INJETÁVEL noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a VEINFIBRO 1% SOLUÇÃO INJETÁVEL em Polónia
Médicos online para VEINFIBRO 1% SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de VEINFIBRO 1% SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.