
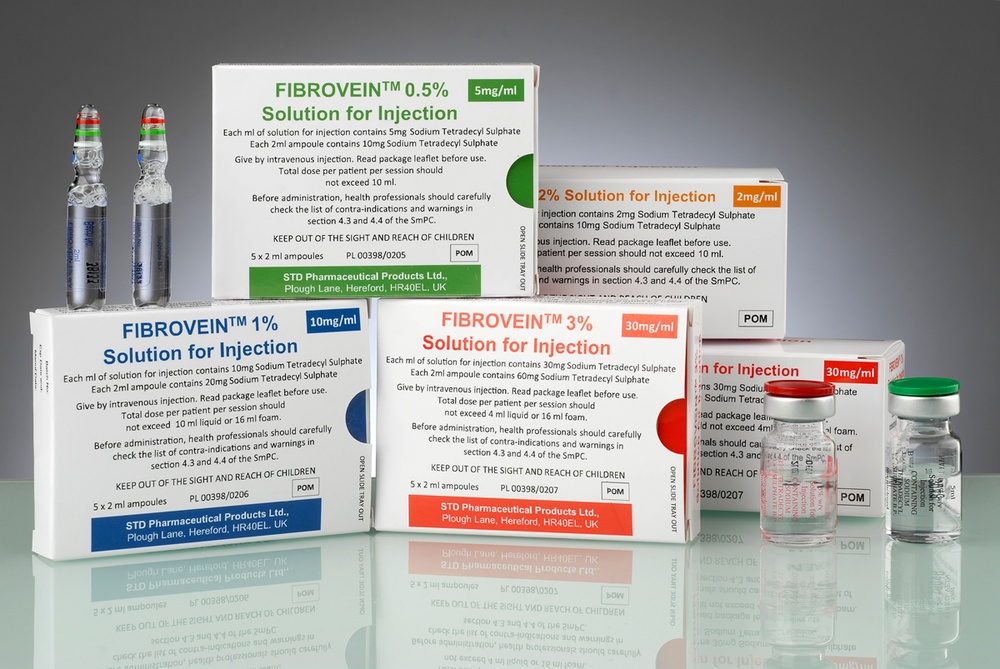
Fibrovein

Pergunte a um médico sobre a prescrição de Fibrovein

Como usar Fibrovein
Folheto informativo: informação para o doente
Fibrovein, 0,2%, 0,5%, 1% e 3%, solução injectável
Tetradecilsulfato de sódio
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
Deve guardar este folheto, para que possa relê-lo se necessário.
Caso tenha alguma dúvida, deve consultar um médico ou enfermeira.
Se o doente apresentar algum efeito adverso grave, incluindo qualquer efeito adverso não mencionado neste folheto, deve informar o médico ou enfermeira.
Ver ponto 4.
Índice do folheto
- 1. O que é o medicamento Fibrovein e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Fibrovein
- 3. Como tomar o medicamento Fibrovein
- 4. Efeitos adversos possíveis
- 5. Como conservar o medicamento Fibrovein
- 6. Conteúdo da embalagem e outras informações
1. O que é o medicamento Fibrovein e para que é utilizado
O medicamento Fibrovein contém a substância ativa tetradecilsulfato de sódio.
O medicamento Fibrovein está disponível em diferentes concentrações e é utilizado no tratamento de varizes, veias dilatadas grandes, médias e pequenas e aranhas vasculares.
A substância ativa do medicamento pertence a uma classe de medicamentos chamados de esclerosantes. Os esclerosantes são substâncias químicas que, quando injectadas numa veia doente, causam inchaço da superfície interior da veia e aderência das suas paredes. O fluxo sanguíneo através da veia torna-se impossível e, eventualmente, ocorre a formação de tecido cicatricial. Após algumas semanas, a veia geralmente deixa de ser visível.
O medicamento Fibrovein é destinado exclusivamente a adultos.
2. Informações importantes antes de tomar o medicamento Fibrovein
Quando não tomar o medicamento Fibrovein:
- se o doente tiver alergia ao tetradecilsulfato de sódio ou a qualquer outro componente do medicamento (listados no ponto 6) ou se o doente tiver doença alérgica;
- se o doente não puder caminhar por qualquer motivo ou estiver acamado;
- se o doente tiver risco de formação de coágulos sanguíneos nos vasos sanguíneos devido a:
- doença sanguínea hereditária, por exemplo, trombofilia;
- uso de medicamentos anticoncepcionais hormonais ou terapia hormonal de substituição;
- obesidade grave;
- fumar;
- imobilização prolongada;
- se o doente tiver tido coágulos sanguíneos recentemente nos vasos sanguíneos superficiais ou profundos ou nos pulmões;
- se o doente foi operado recentemente;
- se o doente tiver veias tortuosas (varizes nas pernas) causadas por tumores na pélvis ou na cavidade abdominal, a menos que o tumor tenha sido removido;
- se o doente tiver doença sistémica descontrolada, como diabetes, hipertireoidismo, asma, anormalidades no exame de sangue, infecção sanguínea ou doenças de pele ou dificuldades respiratórias recentes;
- se o doente tiver inchaço ou vermelhidão da pele, quente ou sensível ao toque (inflamação do tecido conjuntivo);
- se o doente tiver qualquer infecção;
- se o doente tiver câncer em progressão;
- se o doente tiver fechamento anormal das válvulas das veias profundas (insuficiência valvar);
- se o doente tiver embolia arterial;
- se o doente tiver flebite aguda (inflamação aguda das veias das pernas);
- se o doente tiver uma comunicação entre as câmaras do coração (comunicação interventricular, apenas no caso de uso do esclerosante na forma de espuma).
Precauções e advertências
Antes de iniciar o tratamento com o medicamento Fibrovein, o doente deve discutir com o médico se:
o doente é alérgico a qualquer alimento ou medicamento, ou se tem qualquer outra alergia, antes de tomar o medicamento, deve consultar o médico, para que possa ser administrada uma dose de teste 24 horas antes do tratamento;
o doente teve coágulos sanguíneos nas veias superficiais ou profundas, ou nos pulmões;
o doente tem uma comunicação entre as câmaras do coração (comunicação interventricular, no caso de uso do esclerosante na forma de espuma).
o doente tem enxaqueca;
o doente tem doença venosa nas pernas, que está associada a um estado prolongado, causando inchaço dos tecidos do corpo (linfedema). O medicamento Fibrovein pode aumentar a dor e a inflamação local por alguns dias ou semanas;
o doente teve hipertensão pulmonar no passado;o doente teve um ataque transitório de isquemia cerebral (AIT), acidente vascular cerebral ou um incidente cerebral grave;
o doente foi diagnosticado com doença arterial ou venosa (aterosclerose);
o doente foi diagnosticado com coágulos e inflamação das artérias e veias das mãos e pés (doença de Buerger);
o doente tem dificuldades respiratórias, que são controladas com tratamento (asma).
O medicamento Fibrovein só deve ser administrado por um médico, e se as diretrizes nacionais o permitirem, o medicamento pode ser administrado sob supervisão médica por pessoal médico qualificado, com experiência em anatomia do sistema venoso e familiarizado com a técnica de injeção adequada.
Antes de realizar a injeção, o médico pode realizar uma avaliação da função valvar das veias do doente.
Antes de iniciar o tratamento, o médico perguntará ao doente sobre o seu estado de saúde e fornecerá informações sobre os possíveis efeitos adversos associados ao tratamento.
Durante o tratamento
O médico monitorará o doente durante e após a escleroterapia para detectar sinais de sensibilidade (vermelhidão, coceira, tosse) ou sintomas neurológicos (alterações visuais, enxaqueca, formigamento ou dormência).
O médico recomendará ao doente que retorne para uma consulta de follow-up.
Crianças e adolescentes
A segurança e eficácia do medicamento Fibrovein não foram estabelecidas em crianças e adolescentes.
Interacções com outros medicamentos
Se a doente estiver tomando medicamentos anticoncepcionais hormonais (pílulas) ou estiver em terapia hormonal de substituição, pode ocorrer um risco de formação de coágulos sanguíneos nas veias (ver "Quando não tomar o medicamento Fibrovein").
Deve informar o médico ou enfermeira sobre todos os medicamentos que o doente está tomando atualmente ou recentemente, bem como sobre os medicamentos que o doente planeja tomar, incluindo os que são vendidos sem receita médica.
Gravidez e amamentação
A doente deve informar o médico se:
está grávida ou suspeita que possa estar grávida;
planeja engravidar;
está amamentando.
A segurança do uso do medicamento Fibrovein durante a gravidez não foi estabelecida. O medicamento Fibrovein não deve ser usado em mulheres grávidas, a menos que seja absolutamente necessário. O médico decidirá se o uso do medicamento Fibrovein é apropriado para o doente.
Não se sabe se o Fibrovein passa para o leite materno. Se a doente estiver amamentando, o médico decidirá se o Fibrovein é um medicamento apropriado para ela.
Condução de veículos e operação de máquinas
Após a administração do medicamento Fibrovein, para reduzir o risco de inflamação e pigmentação da pele, o médico pode recomendar o uso de bandagens ou meias de compressão nas pernas, o que pode afetar a capacidade de conduzir veículos.
O medicamento Fibrovein contém sódio, potássio e álcool benzílico
Este medicamento contém:
menos de 1 mmol (23 mg) de sódio por frasco/ampola, ou seja, o medicamento é considerado "livre de sódio".
menos de 1 mmol (39 mg) de potássio por frasco/ampola, ou seja, o medicamento é considerado "livre de potássio".
40 mg de álcool benzílico em cada ampola de 2 ml ou 100 mg de álcool benzílico em cada frasco de 5 ml, o que corresponde a 20 mg/ml. O álcool benzílico pode causar reações alérgicas. Em caso de gravidez, amamentação ou doença hepática ou renal, deve-se consultar um médico ou farmacêutico. Isso ocorre porque o álcool benzílico pode se acumular no organismo, causando efeitos adversos (chamados de "acidose metabólica").
3. Como tomar o medicamento Fibrovein
Nãodeve tentar auto-injectar o medicamento Fibrovein. O tratamento deve ser sempre realizado por um médico experiente, treinado em técnicas de injeção adequadas.
O tratamento consiste na injeção muito cuidadosa e lenta do medicamento, usando as agulhas mais finas possíveis, nas veias afetadas, o que permite a remoção do sangue delas. O medicamento pode ser misturado manualmente usando duas seringas e um conector, para criar uma mistura com ar e produzir uma espuma, que ajuda a remover o sangue das veias maiores. Nesse caso, o medicamento deve ser administrado ao doente por um médico treinado em técnicas de produção e administração do medicamento na forma de espuma.
No caso do tratamento de varizes invisíveis nas pernas e escleroterapia com espuma, o procedimento deve ser realizado sob controle de ultrassom.
O médico decidirá qual concentração do medicamento Fibrovein usar e quais áreas tratar. As doses recomendadas são:
Adultos e idosos
- de 0,1 ml a 2 ml do medicamento Fibrovein por injeção. O médico pode injectar até 10 ml de três concentrações mais baixas do medicamento Fibrovein, mas não mais de 4 ml no caso do uso da concentração mais alta.
Devido às limitações da dose diária máxima do esclerosante, pode ser necessário repetir o procedimento várias vezes.
Após o tratamento com o medicamento Fibrovein, o doente deve seguir as instruções do médico. O médico pode recomendar o uso de bandagens ou meias de compressão nas pernas, para reduzir o risco de inflamação e pigmentação da pele.
Se o doente tiver alguma dúvida adicional sobre o uso deste medicamento, deve consultar um médico ou enfermeira.
4. Efeitos adversos possíveis
Como qualquer medicamento, o medicamento Fibrovein pode causar efeitos adversos, embora não todos os doentes os experimentem.
Pode ocorrer efeitos adversos graves. Deve interromper o tratamento com o medicamento Fibrovein e procurar imediatamente um médico ou ir ao departamento de emergência do hospital mais próximo, se ocorrer algum dos seguintes sintomas:
Não muito frequentes (podem ocorrer em até 1 em 100 doentes)
- Coágulos sanguíneos nas veias profundas (trombose venosa profunda, provavelmente devido à doença subjacente). Os sintomas incluem dor, inchaço e sensibilidade na perna (geralmente na panturrilha), dor forte na área afetada, aumento da temperatura da pele na área do coágulo ou vermelhidão da pele, especialmente na parte de trás da perna abaixo do joelho.
Raros (podem ocorrer em até 1 em 1.000 doentes)
- Necrose local da pele ou, mais raramente, dos nervos. Os sintomas incluem dor, alteração da cor da pele (vermelhidão), inchaço ou acúmulo de líquido, bolhas na pele (que podem estar cheias de líquido incolor ou sangue), cor da pele marrom-avermelhado, roxo ou preto, sensações anormais (formigamento, picada, queimadura), dormência ou perda de sensação
Muito raros (podem ocorrer em até 1 em 10.000 doentes)
- A reação adversa mais grave é uma reação alérgica grave (choque anafilático), que pode causar dificuldade respiratória ou uma queda abrupta da pressão arterial, causando sensação de desmaio ou perda de consciência. O choque anafilático é raro, mas pode ser fatal, por isso, se ocorrer, deve-se administrar tratamento imediatamente.
- Obstrução da artéria devido a um coágulo, o que pode levar a:
o
acidente vascular cerebral ou interrupção do fluxo sanguíneo para o cérebro ou olho (ataque isquêmico transitório).
Os sintomas podem incluir fraqueza, dormência ou paralisia do rosto, braço ou perna, geralmente de um lado do corpo, fala confusa ou dificuldade em entender os outros, cegueira em um ou ambos os olhos ou visão dupla.
o
embolia pulmonar. Os sintomas podem incluir falta de ar súbita, dor aguda no peito, que pode piorar com a respiração profunda ou tosse, batimento cardíaco rápido ou respiração acelerada.
Para proteger os doentes contra este efeito adverso muito raro, não deve ser usado em doentes com risco aumentado de formação de coágulos sanguíneos nos vasos sanguíneos e artérias (risco de trombose).
- Insuficiência cardíaca. Os sintomas podem incluir sensação de fadiga, tontura, desmaio, dor no peito, falta de ar, fraqueza, tontura, vômitos e palpitações.
- Necrose do tecido devido à injeção na artéria. Os sintomas podem variar dependendo da quantidade de medicamento injectado, local da injeção e rapidez com que a assistência médica é obtida. Podem incluir dor, mas sem dano duradouro, até perda de grandes áreas de tecido, incluindo o pé, o que pode levar à necessidade de amputação do membro.
Outros efeitos adversos que podem ocorrer incluem:
Muito frequentes (podem ocorrer em mais de 1 em 10 doentes):
- Flebite superficial.
Frequentes (podem ocorrer em até 1 em 10 doentes)
- Dor ou queimadura (temporária no local da injeção);
- Pigmentação da pele;
- Expansão dos vasos capilares subcutâneos no local da injeção (chamado de "matting").
Não muito frequentes (podem ocorrer em até 1 em 100 doentes):
- Reações alérgicas ou não alérgicas da pele, como vermelhidão, coceira, erupção cutânea ou inchaço;
- Alterações visuais;
- Enxaqueca.
Raros (podem ocorrer em até 1 em 1.000 doentes):
- Tosse, falta de ar, sensação de aperto ou pressão no peito;
- Queimadura, formigamento, picada ou coceira da pele;
- Dor de cabeça, sensação de desmaio;
- Desorientação, tontura, perda de consciência.
Muito raros (podem ocorrer em até 1 em 10.000 doentes):
- Febre, ondas de calor, pele vermelha e coçosa (urticária);
- Náuseas, vômitos, diarreia, sensação de língua inchada ou aumento do volume da língua, secura na boca;
- Flebite.
Notificação de efeitos adversos
Se ocorrerem qualquer efeito adverso, incluindo qualquer efeito adverso não mencionado neste folheto, deve-se informar o médico ou enfermeira. Os efeitos adversos podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Adversos de Produtos Farmacêuticos da Agência Reguladora de Produtos Farmacêuticos, Equipamentos Médicos e Produtos Biocidas, Al. Jerozolimskie 181 C, 02-222 Varsóvia, Tel.: +48 22 49 21 301, Fax: + 48 22 49 21 309, Site: https://smz.ezdrowie.gov.pl
Os efeitos adversos também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos adversos pode ajudar a coletar mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento Fibrovein
O medicamento deve ser conservado em local não visível e inacessível a crianças.
Não há recomendações especiais para a temperatura de conservação do medicamento.
- Não congelar.
- Os frascos e ampolas devem ser conservados na embalagem exterior, para proteger contra a luz.
- Não usar este medicamento após a data de validade impressa na caixa de cartão após "Data de validade (EXP)". A data de validade é o último dia do mês indicado.
Apenas para uso único. O conteúdo da embalagem deve ser usado imediatamente após a abertura.
Qualquer resíduo do produto não utilizado deve ser eliminado.
Os medicamentos não devem ser jogados na canalização ou em recipientes de lixo doméstico. Deve-se perguntar ao farmacêutico como eliminar os medicamentos que não são mais usados. Isso ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento Fibrovein
A substância ativa do medicamento é o tetradecilsulfato de sódio.
No caso da concentração de 0,2%
Cada ml da solução injectável contém 2 mg de tetradecilsulfato de sódio.
Cada frasco de 5 ml contém 10 mg de tetradecilsulfato de sódio.
No caso da concentração de 0,5%
Cada ml da solução injectável contém 5 mg de tetradecilsulfato de sódio.
Cada ampola de 2 ml contém 10 mg de tetradecilsulfato de sódio.
No caso da concentração de 1%
Cada ml da solução injectável contém 10 mg de tetradecilsulfato de sódio.
Cada ampola de 2 ml contém 20 mg de tetradecilsulfato de sódio.
No caso da concentração de 3%
Cada ml da solução injectável contém 30 mg de tetradecilsulfato de sódio.
Cada ampola de 2 ml contém 60 mg de tetradecilsulfato de sódio.
Cada frasco de 5 ml contém 150 mg de tetradecilsulfato de sódio.
Os outros componentes do medicamento são: álcool benzílico (20 mg/ml), fosfato dissódico dodecahidratado, fosfato de potássio monohidratado, água para injeção, hidróxido de sódio (para ajuste do pH). Ver ponto 2 "O medicamento Fibrovein contém sódio e potássio".
Como é o medicamento Fibrovein e que conteúdo tem a embalagem
O medicamento Fibrovein é uma solução injectável contida em ampolas ou frascos de vidro. A solução é transparente, incolor, estéril, sem partículas sólidas visíveis.
Fibrovein, 0,2%: a embalagem contém 2, 5 ou 10 frascos de 5 ml.
Fibrovein, 0,5%: a embalagem contém 5 ampolas de 2 ml.
Fibrovein, 1%: a embalagem contém 5 ampolas de 2 ml.
Fibrovein, 3%: a embalagem contém 5 ampolas de 2 ml ou 2, 5 ou 10 frascos de 5 ml.
Nem todos os tamanhos de embalagem precisam estar disponíveis.
Titular da autorização de comercialização e fabricante:
Titular da autorização de comercialização:
STD Pharmaceutical (Ireland) Limited
Bloco 1, Blanchardstown Corporate Park, Ballycoolen Road, Blanchardstown, Dublin 15
D15 AKK1, Irlanda
+353 1588 6916
Fabricante:
Medipha Sante
Les Fjords-Immeuble Oslo
19 Avenue de Norvege
91953 Courtaboeuf CEDEX
França
Chemische Fabrik Kreussler & Co. GmbH
Rheingaustrasse 87-93
65203 Wiesbaden,
Alemanha
Este medicamento está autorizado para comercialização nos países membros da Área Econômica Europeia sob os seguintes nomes:
Fibrovein
Bulgária, República Tcheca, França, Alemanha, Irlanda, Holanda, Polônia, Romênia
Áustria, Espanha
Veinfibro
Data da última atualização do folheto:05/2024Outras fontes de informação:
Informações detalhadas sobre este medicamento estão disponíveis no site da Agência Reguladora de Produtos Farmacêuticos, Equipamentos Médicos e Produtos Biocidas
www.urpl.gov.pl
Informações destinadas exclusivamente ao pessoal médico:
Fibrovein, 0,2%, solução injectável
Fibrovein, 0,5%, solução injectável
Fibrovein, 1%, solução injectável
Fibrovein, 3%, solução injectável
Informações adicionais sobre este produto estão disponíveis na Característica do Produto Farmacêutico (CPF).
Posologia e modo de administração
Posologia
O medicamento Fibrovein é destinado exclusivamente à administração intravenosa. Dependendo do tamanho e gravidade das lesões venosas, é necessário usar diferentes concentrações. As aranhas vasculares devem ser tratadas apenas com a concentração de 0,2%, e as varizes em rede com 0,5%. A concentração de 1% é mais eficaz para varizes pequenas e médias, e a concentração de 3% para lesões venosas maiores. O tamanho das varizes invisíveis deve ser determinado sob controle de ultrassom.
O esclerosante deve ser administrado intravenosamente em pequenas porções iguais ao longo do curso da veia afetada. O Fibrovein nas concentrações de 0,2% e 0,5% deve ser administrado na forma de líquido.
O Fibrovein nas concentrações de 1% e 3% pode ser administrado na forma de líquido ou como uma mistura de esclerosante com ar (forma de espuma) de acordo com a descrição na tabela abaixo. O objetivo do procedimento é obter a destruição óptima das paredes do vaso com a concentração mínima eficaz do medicamento necessária para o tratamento eficaz. Uma concentração muito alta do medicamento pode levar à formação de necrose tecidual ou outras complicações.
Adultos
| Concentração | Dose padrão para injeção intravenosa no local do procedimento | Dose total máxima para injeção no procedimento | ||
| Líquido | Espuma* | Líquido | Espuma* | |
| Fibrovein, 0,2% e 0,5% | de 0,1 a 1,0 ml | Não se aplica | 10 ml | Não se aplica |
| Fibrovein, 1% | de 0,1 a 1,0 ml | de 0,5 a 2,0 ml | 10 ml | 16 ml |
| Fibrovein, 3% | de 0,5 a 2,0 ml | de 0,5 a 2,0 ml | 4 ml | 16 ml |
*Soma dos volumes de líquido e ar
Ao preparar o medicamento Fibrovein para administração, deve-se manter condições assépticas rigorosas.
O medicamento Fibrovein é destinado a uso único e administração parenteral. Após a abertura do frasco ou ampola, o produto deve ser usado imediatamente, e o líquido não utilizado deve ser eliminado.
Antes de usar, deve-se realizar uma inspeção visual para detectar a presença de partículas sólidas. Se o líquido contiver partículas sólidas, não deve ser usado.
É recomendável que o procedimento de escleroterapia com espuma seja realizado sob controle de ultrassom. Nesse caso, o produto deve ser administrado por um médico treinado em técnicas de produção e administração do medicamento na forma de espuma.
Incompatibilidades farmacêuticas
Este medicamento não deve ser misturado com heparina.
Não misturar o medicamento com outros medicamentos, pois não foram realizados estudos de compatibilidade.
Advertências e precauções especiais
O medicamento Fibrovein deve ser administrado apenas por um médico, e se as diretrizes nacionais o permitirem, o medicamento pode ser administrado sob supervisão médica por pessoal médico qualificado, que tenha experiência em anatomia do sistema venoso, diagnóstico e tratamento de doenças venosas, e que conheça a técnica de injeção adequada.
Foram relatados casos de reações alérgicas, incluindo choque anafilático, por isso o médico que administra o medicamento deve estar preparado para aplicar tratamento anti-choque.
Durante o procedimento, o médico deve ter acesso direto a equipamentos de ressuscitação.
Devido à necessidade de precaução, o doente deve ser tratado em um hospital.
Em caso de extravasamento, podem ocorrer efeitos adversos locais graves, incluindo necrose tecidual, por isso deve-se ter cuidado ao inserir a agulha e injectar a dose mínima eficaz em cada local de injeção. A solução deve ser injectada lentamente.
Deve-se ter cuidado para não injectar a solução na artéria, pois isso pode causar necrose tecidual, que pode levar à necessidade de amputação do membro.
Deve-se ter cuidado ao realizar injeções no pé e acima e abaixo do tornozelo (malleolo) devido ao risco para uma das artérias. No tratamento de veias de menor calibre, deve-se aplicar compressão, pois a probabilidade de pigmentação pode ser maior se ocorrer extravasamento de sangue no local da injeção.
Preparação da espuma e administração
Recomendações gerais
A qualidade da espuma depende de condições específicas:
Concentração do medicamento: A espuma pode ser preparada apenas com o tetradecilsulfato de sódio nas concentrações de 1% a 3%.
Proporção de líquido para ar: Geralmente, a relação é de 1 volume de líquido para 3 a 4 volumes de ar.
Número de vezes que a mistura é bombeada de uma seringa para outra: O médico deve seguir o número de bombeadas especificado para cada técnica.
Consistência macroscópica da espuma: Antes da administração, deve-se verificar a qualidade da espuma fora da seringa. A espuma deve ser uniforme, macia e coesa, sem bolhas grandes visíveis. Se a espuma contiver bolhas grandes, deve ser descartada e uma nova espuma preparada.
Tempo total de preparação da espuma: A preparação da espuma deve levar cerca de 10 segundos, desde a primeira até a última bombeada do líquido de uma seringa para outra.
Tempo máximo entre a preparação e a administração da espuma: A espuma do esclerosante deve ser usada dentro de 60 segundos após a preparação. Após 60 segundos, os resíduos da espuma não utilizada devem ser eliminados. Se necessário, mais espuma pode ser preparada.
Antes da administração, deve-se verificar a qualidade da espuma. A espuma deve ter uma consistência uniforme, ser branca e não conter bolhas grandes visíveis.
Preparação da espuma (técnica de Tessari)
Ao preparar a espuma, deve-se manter condições assépticas rigorosas.
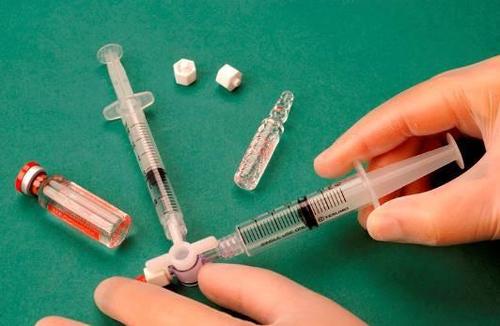
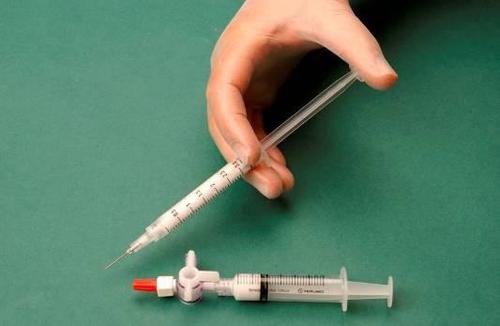
Para preparar a espuma para uma seringa estéril, retira-se 1 ml do esclerosante líquido, e para outra seringa estéril, retira-se 3 ml ou 4 ml de ar estéril. O ar é aspirado para a seringa através de um filtro esterilizante de 0,2 μm, garantindo sua esterilidade. As seringas são conectadas usando um conector/três-vias estéril (figura 1). Ao preparar a espuma, é recomendável usar seringas do tipo Luer Lock e proteger os olhos. A conexão da seringa com conector do tipo Luer slip ao conector três-vias sob pressão pode falhar, levando a um vazamento não controlado do produto.
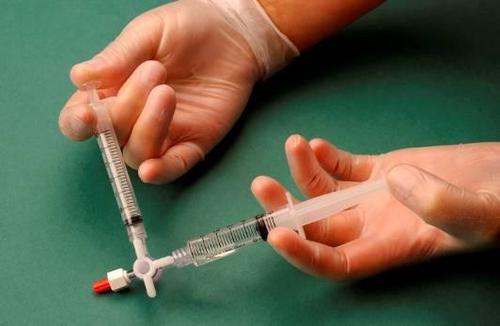
Após conectar as seringas, a mistura esclerosante/ar é bombeada dinamicamente cerca de 20 vezes de uma seringa para outra através do conector três-vias, até obter uma espuma de consistência uniforme e lisa (figuras 2 e 3).
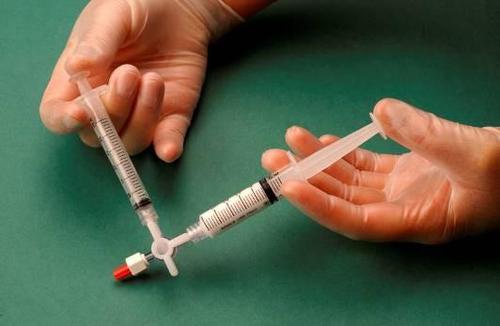
A seringa contendo a espuma é removida do conector e usada para realizar a punção venosa, através da qual a espuma é administrada ao vaso (figura 4).
A espuma do esclerosante deve ser usada dentro de 60 segundos após a preparação. Após 60 segundos, os resíduos da espuma não utilizada devem ser eliminados. Se necessário, mais espuma pode ser preparada.
Antes da administração, deve-se verificar a qualidade da espuma. A espuma deve ter uma consistência uniforme, ser branca e não conter bolhas grandes visíveis.
Excipientes
Este medicamento contém:
menos de 1 mmol (23 mg) de sódio por frasco/ampola, ou seja, o medicamento é considerado "livre de sódio".
menos de 1 mmol (39 mg) de potássio por frasco/ampola, ou seja, o medicamento é considerado "livre de potássio".
40 mg de álcool benzílico em cada ampola de 2 ml ou 100 mg de álcool benzílico em cada frasco de 5 ml, o que corresponde a 20 mg/ml. O álcool benzílico pode causar reações alérgicas. Em caso de gravidez, amamentação ou doença hepática ou renal, deve-se consultar um médico ou farmacêutico. Isso ocorre porque o álcool benzílico pode se acumular no organismo, causando efeitos adversos (chamados de "acidose metabólica").
- País de registo
- Substância ativa
- Requer receita médicaNão
- ImportadorChemische Fabrik Kreussler Co.GmbH Medipha Sante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a FibroveinForma farmacêutica: Solução, 0,2% (2 mg/ml)Substância ativa: sodium tetradecyl sulfateNão requer receita médicaForma farmacêutica: Solução, 0,5% (5 mg/ml)Substância ativa: sodium tetradecyl sulfateNão requer receita médicaForma farmacêutica: Solução, 1% (10 mg/ml)Substância ativa: sodium tetradecyl sulfateNão requer receita médica
Alternativas a Fibrovein noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Fibrovein em Espanha
Médicos online para Fibrovein
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Fibrovein – sujeita a avaliação médica e regras locais.














