
UPSTAZA 2,8 × 10^11 VETORES GENÉTICOS (VG)/0,5 ML SOLUÇÃO PARA PERFUSÃO

Pergunte a um médico sobre a prescrição de UPSTAZA 2,8 × 10^11 VETORES GENÉTICOS (VG)/0,5 ML SOLUÇÃO PARA PERFUSÃO

Como usar UPSTAZA 2,8 × 10^11 VETORES GENÉTICOS (VG)/0,5 ML SOLUÇÃO PARA PERFUSÃO
Introdução
Prospecto: informação para o paciente
Upstaza 2,8 × 1011genomas vetoriais/0,5 ml solução para perfusão
eladocagén exuparvovec
Este medicamento está sujeito a seguimento adicional, o que agilizará a detecção de nova informação sobre a sua segurança. Pode contribuir comunicando os efeitos adversos que você ou seu filho possam ter. A parte final da seção 4 inclui informação sobre como comunicar estes efeitos adversos.
Leia todo o prospecto detenidamente antes de que você ou seu filho sejam submetidos a este medicamento, porque contém informação importante para você.
- Conserva este prospecto, porque pode ter que relê-lo.
- Se tiver alguma dúvida, consulte o médico ou enfermeiro.
- Se você ou seu filho experimentarem efeitos adversos, consulte o médico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver seção 4.
Conteúdo do prospecto
- O que é Upstaza e para que é utilizado
- O que você precisa saber antes de que você ou seu filho sejam submetidos a Upstaza
- Como é administrado Upstaza a você ou a seu filho
- Efeitos adversos possíveis
- Conservação de Upstaza
- Conteúdo do envase e informação adicional
1. O que é Upstaza e para que é utilizado
O que é Upstaza
Upstaza é um medicamento de terapia genética que contém o princípio ativo eladocagén exuparvovec.
Para que é utilizado Upstaza
Upstaza é utilizado para o tratamento de pacientes de 18 meses e mais, com uma deficiência da proteína chamada L-aminoácido aromático descarboxilase (AADC). Esta proteína é essencial para fabricar certas substâncias que o sistema nervoso do corpo precisa para funcionar corretamente.
A deficiência de AADC é uma afecção hereditária causada por uma mutação (mudança) no gene que controla a produção de AADC (também chamado gene da dopa descarboxilase ou DDC). Esta afecção impede o desenvolvimento do sistema nervoso da criança, o que significa que muitas das funções do corpo não se desenvolvem corretamente durante a infância, como o movimento, a alimentação, a respiração, a fala e a capacidade mental.
Como funciona Upstaza
O princípio ativo de Upstaza, eladocagén exuparvovec, é um tipo de vírus chamado vírus adenoassociado que foi modificado para incluir uma cópia do gene DDC que funciona corretamente. Upstaza é administrado por perfusão (gotejamento) em uma zona do cérebro chamada putamen, onde é fabricado o AADC. O vírus adenoassociado permite que o gene DDC passe para as células do cérebro. Dessa maneira, Upstaza permite que as células produzam AADC para que o organismo possa fabricar as substâncias que o sistema nervoso precisa.
O vírus adenoassociado utilizado para administrar o gene não provoca doenças nos seres humanos.
2. O que você precisa saber antes de que você ou seu filho sejam submetidos a Upstaza
Você ou seu filho não receberão o tratamento com Upstaza:
- se você ou seu filho forem alérgicos a eladocagén exuparvovec ou a algum dos outros componentes deste medicamento (incluídos na seção 6).
Advertências e precauções
- Os movimentos espasmódicos incontroláveis leves ou moderados (também chamados discinesia) ou os distúrbios do sono (insônia) podem aparecer ou piorar 1 mês após o tratamento com Upstaza e persistir durante vários meses mais. O médico decidirá se você ou seu filho precisam de tratamento para estes efeitos.
- O médico monitorizará você ou seu filho para detectar complicações do tratamento com Upstaza, como derrames do líquido que rodeia o cérebro, meningite ou encefalite.
- Durante os dias seguintes à intervenção, o médico vigiará seu filho para detectar possíveis complicações como consequência da intervenção e da anestesia geral. Alguns dos sintomas da doença podem ser amplificados durante esse período.
- Alguns sintomas específicos da deficiência de AADC podem persistir após o tratamento, alguns exemplos desses sintomas podem ser as repercussões no estado de ânimo, a sudorese e a temperatura corporal.
- Após o tratamento, algo do medicamento pode passar para os líquidos corporais ou para os de seu filho (p. ex., lágrimas, sangue, secreções nasais e líquido cefalorraquídeo); isso é conhecido como “disseminação”. Você ou seu filho e a pessoa que o cuida (especialmente se estiver grávida, amamentando ou imunodeprimida) devem usar luvas e colocar os curativos usados e outros materiais de descarte com lágrimas e secreções nasais em bolsas seladas antes de jogá-los fora. Deve seguir essas precauções durante 14 dias.
- Você ou seu filho não devem doar sangue, órgãos, tecidos ou células para transplantes após o tratamento com Upstaza, pois Upstaza é um medicamento de terapia genética.
Crianças e adolescentes
Upstaza não foi estudado em crianças menores de 18 meses de idade. A experiência é escassa em crianças maiores de 12 anos.
Outros medicamentos e Upstaza
Informa ao seu médico se você ou seu filho estão tomando, tomaram recentemente ou pudessem ter que tomar qualquer outro medicamento.
Você ou seu filho podem receber as vacinas infantis habituais com normalidade.
Gravidez, lactação e fertilidade
Desconhece-se os efeitos deste medicamento na gravidez e no feto.
Upstaza não foi estudado em mulheres em período de lactação.
Não há informação sobre o efeito de Upstaza na fertilidade masculina ou feminina.
Upstaza contém sódio e potássio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por dose; isto é, essencialmente “isento de sódio”.
Este medicamento contém menos de 1 mmol de potássio (39 mg) por dose; isto é, essencialmente “isento de potássio”.
3. Como é administrado Upstaza a você ou a seu filho
- Você ou seu filho receberão Upstaza no quarto de operações por parte de neurocirurgiões com experiência em cirurgia cerebral.
- Upstaza é administrado sob anestesia. O neurocirurgião falará com você sobre a anestesia e como é administrada.
- Antes de administrar Upstaza, o neurocirurgião fará dois orifícios pequenos no seu crânio ou no de seu filho, um de cada lado.
- Em seguida, será injetado Upstaza através desses orifícios em quatro pontos do seu cérebro ou no de seu filho, em uma zona denominada putamen.
- Após a perfusão, serão fechados os dois orifícios e você ou seu filho serão submetidos a um exame cerebral.
- Você ou seu filho terão que permanecer no hospital ou perto dele durante alguns dias para supervisionar a recuperação e verificar se há efeitos secundários da intervenção cirúrgica ou da anestesia.
- O médico verá você ou seu filho no hospital duas vezes, uma aproximadamente uma semana após a intervenção cirúrgica, e outras três semanas após esta, para fazer um seguimento da recuperação e verificar se há algum efeito secundário da intervenção cirúrgica e do tratamento.
Se você ou seu filho forem administrados mais Upstaza do que o devido
Como este medicamento é administrado a você ou a seu filho por um médico, é pouco provável que você ou seu filho recebam uma quantidade excessiva. Se isso ocorrer, o médico tratará os sintomas, conforme necessário.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico.
4. Efeitos adversos possíveis
Assim como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Podem aparecer os seguintes efeitos adversos relacionados com Upstaza:
Muito frequentes (podem afetar mais de 1 de cada 10 pessoas)
- Discinesia (movimentos espasmódicos incontroláveis)
- Insônia (dificuldade para dormir), irritabilidade
Frequentes (podem afetar até 1 de cada 10 pessoas):
- Aumento da produção de saliva
Podem aparecer os seguintes efeitos adversos relacionados com a intervenção cirúrgica para administrar Upstaza:
Muito frequentes (podem afetar mais de 1 de cada 10 pessoas)
- Nível baixo de glóbulos vermelhos (anemia)
- Derrame do líquido que rodeia o cérebro (chamado líquido cefalorraquídeo) (os possíveis sintomas são dor de cabeça, náuseas e vômitos, dor ou rigidez de pescoço, mudanças na audição, sensação de desequilíbrio, tonturas ou vertigem)
Os seguintes efeitos secundários podem produzir-se nas duas semanas seguintes à intervenção cirúrgica para administração de Upstaza, devido à anestesia ou aos efeitos pós-operatórios:
Muito frequentes (podem afetar mais de 1 de cada 10 pessoas)
- Hemorragia gastrointestinal, diarreia
- Febre, ruídos respiratórios anormais
- Pneumonia
- Nível baixo de potássio no sangue
- Irritabilidade
- Hipotensão (pressão arterial baixa)
Frequentes (podem afetar até 1 de cada 10 pessoas):
- Cianose (coloração azulada da pele causada pela falta de oxigênio no sangue)
- Ulceramento da boca
- Hipotermia (temperatura corporal baixa)
- Gastroenterite
- Discinesia (movimentos espasmódicos incontroláveis)
- Insuficiência respiratória
- Úlcera por pressão, dermatite do fraldão, erupção cutânea
- Extração de dentes
- Choque hipovolêmico (perda grave de sangue ou líquidos corporais)
Comunicação de efeitos adversos
Se você ou seu filho experimentarem qualquer tipo de efeito adverso, consulte o médico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informação sobre a segurança deste medicamento.
5. Conservação de Upstaza
A seguinte informação está destinada apenas aos médicos.
Upstaza será conservado no hospital. Deve ser conservado e transportado congelado a temperatura ≤ -65 ºC. É descongelado antes de ser usado e, uma vez descongelado, tem que ser usado antes de 6 horas. Não deve ser recongelado.
Não utilize este medicamento após a data de validade que aparece no envase após CAD.
6. Conteúdo do envase e informação adicional
Composição de Upstaza
- O princípio ativo é o eladocagén exuparvovec. Cada 0,5 ml de solução contém 2,8 × 10^11 genomas vectoriais de eladocagén exuparvovec.
Os outros componentes são cloreto de potássio, cloreto de sódio, dihidrogênio fosfato de potássio, hidrogênofosfato de disódio, poloxâmero 188 e água para preparações injetáveis (ver seção 2 “Upstaza contém sódio e potássio”).
Aspecto do produto e conteúdo do envase
Upstaza é uma solução para perfusão, clara ou ligeiramente opalescente, incolor ou branca tenue, que se apresenta em um frasco de vidro transparente.
Cada envase contém 1 frasco.
Titular da autorização de comercialização
PTC Therapeutics International Limited
70 Sir John Rogerson's Quay
Dublín 2
Irlanda
Responsável pela fabricação
Almac Pharma Services (Irlanda) Limited
Finnabair Industrial Estate
Dundalk, Co. Louth, A91 P9KD
Irlanda
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
AT, BE, BG, CY, CZ, DK, DE, EE, EL, ES, HR, HU, IE, IS, IT, LT, LU, LV, MT, NL, NO, PL, PT, RO, SI, SK, FI, SE, UK (NI) PTC Therapeutics International Ltd. (Irlanda) +353 (0)1 447 5165 | FR PTC Therapeutics France Tel: +33(0)1 76 70 10 01 |
Data da última revisão deste prospecto.
Este medicamento foi autorizado em “circunstâncias excepcionais”. Esta modalidade de aprovação significa que devido à rareza desta doença não foi possível obter informações completas sobre este medicamento.
A Agência Europeia de Medicamentos revisará anualmente as novas informações sobre este medicamento que possam estar disponíveis e este prospecto será atualizado quando necessário.
Outras fontes de informação
A informação detalhada sobre este medicamento está disponível no site da Agência Europeia de Medicamentos: http://www.ema.europa.eu.
Esta informação está destinada apenas a profissionais de saúde:
Instruções sobre preparação, administração, medidas tomadas em caso de exposição acidental e eliminação de Upstaza
Cada frasco é para um único uso. Este medicamento só deve ser injetado com a cânula ventricular SmartFlow.
Precauções que se devem tomar antes de manipular ou administrar o medicamento
Este medicamento contém vírus modificados geneticamente. Durante a preparação, administração e eliminação, deve-se usar equipamento de proteção individual (que inclua bata, óculos de segurança, máscara e luvas) quando se manipularem eladocagén exuparvovec e os materiais que tenham estado em contato com a solução (resíduos sólidos e líquidos).
Descongelamento na farmácia do hospital
- Upstaza é entregue à farmácia congelado e deve ser conservado no embalagem exterior a temperatura ≤ -65 ºC até que seja preparado para uso.
- Upstaza deve ser manipulado de forma asséptica e sob condições estéreis.
- Deixe que o frasco congelado de Upstaza se descongele em posição vertical a temperatura ambiente até que o conteúdo esteja completamente descongelado. Inverta suavemente o frasco cerca de 3 vezes, NÃO agite.
- Examine Upstaza após misturar. Se forem observadas partículas, turbidez ou mudança de cor, não utilize o produto.
Preparação antes da administração
- Transfira o frasco, a seringa, a agulha, o capuchão da seringa, as bolsas estéreis ou os envoltórios estéreis respeitando o procedimento do hospital para a transferência e o uso da seringa cheia no quirófano previsto, e etiquetando-o na cabine de segurança biológica (BSC). Use luvas estéreis e outros equipamentos de proteção individual (que inclua bata, óculos de segurança e máscara) segundo o procedimento normal de trabalho para BSC.
- Abra a seringa de 5 ml (seringa de polipropileno de 5 ml com êmbolo de elastômero sem látex, lubricado com óleo de silicone de grau médico) e etiquete-a adequadamente como seringa cheia de produto segundo o procedimento da farmácia e as normativas locais.
- Acople a agulha de calibre 18 ou 19 com filtro (agulhas com filtro de 5 µm de aço inoxidável de 1,5 polegadas e calibre 18 ou 19) à seringa.
- Introduza todo o volume do frasco de Upstaza na seringa. Inverta o frasco e a seringa e retire parcialmente ou incline a agulha conforme necessário para maximizar a recuperação do produto.
- Aspire ar na seringa para que a agulha se esvazie de produto. Retire com cuidado a agulha da seringa de 5 ml que contém Upstaza. Purgue o ar da seringa até que não haja nenhuma bolha de ar e, em seguida, tape com um capuchão de seringa.
- Envuelva a seringa em uma bolsa de plástico estéril (ou em várias bolsas segundo o procedimento hospitalar habitual) e coloque-a em um recipiente secundário adequado (por exemplo, uma geladeira de plástico duro) para levá-la ao quirófano a temperatura ambiente. O uso da seringa (ou seja, a conexão da seringa ao dispensador da seringa e o início do cebado da cânula) deve começar em um prazo de 6 horas desde o início do descongelamento do produto.
Administração no quirófano
- Acople firmemente a seringa que contém Upstaza à cânula ventricular SmartFlow.
- Insira a seringa de Upstaza em uma bomba de perfusão compatível com a seringa de 5 ml. Bombeie Upstaza a 0,003 ml/min até que a primeira gota de Upstaza possa ser vista na ponta da agulha. Detenha-se e espere até que esteja pronto para a perfusão.
Precauções que devem ser tomadas para a eliminação do medicamento e a exposição acidental
- Deve-se evitar a exposição acidental a eladocagén exuparvovec, incluindo o contato com a pele, os olhos e as membranas mucosas.
- Em caso de exposição à pele, a área afetada deve ser limpa a fundo com água e sabão durante pelo menos 5 minutos. Em caso de contato com os olhos, a área afetada deve ser enxaguada bem com água durante pelo menos 5 minutos.
- Em caso de lesão por picada, a área afetada deve ser limpa bem com água e sabão ou um desinfetante.
- Todo o eladocagén exuparvovec que não tenha sido usado ou os materiais residuais devem ser eliminados de acordo com as normativas locais sobre resíduos farmacêuticos.
- Os possíveis derramamentos devem ser limpos com uma gaze absorvente e desinfetados com uma solução de lixívia, seguida do uso de toalhetes com álcool.
- Após a administração, o risco de disseminação é considerado baixo. Recomenda-se aconselhar os cuidadores e os familiares dos pacientes para que sigam as precauções adequadas para a manipulação de líquidos corporais e resíduos do paciente durante os 14 dias posteriores à administração de eladocagén exuparvovec (ver seção 4.4 da ficha técnica/resumo das características do produto).
Posologia
O tratamento deve ser administrado em um centro especializado em neurocirurgia estereotáxica, por um neurocirurgião qualificado sob condições assépticas controladas.
Os pacientes receberão uma dose total de 1,8 × 10^11 vg administrada em quatro perfusões de 0,08 ml (0,45 × 10^11 vg) (duas por putamen).
A posologia é a mesma para toda a população contemplada na indicação.
Forma de administração
Via intraputaminal.
A administração de Upstaza pode provocar um derrame de líquido cefalorraquídeo após a intervenção cirúrgica. Deve-se fazer um seguimento minucioso dos pacientes que recebem tratamento com Upstaza após sua administração.
Administração neurocirúrgica
Upstaza é um frasco de uso único administrado mediante injeção intraputaminal bilateral em uma sessão cirúrgica em dois pontos do putamen. São aplicadas quatro injeções distintas de volumes iguais no putamen anterior direito, o putamen posterior direito, o putamen anterior esquerdo e o putamen posterior esquerdo.
Siga os passos seguintes para administrar Upstaza:
- Os pontos de perfusão alvo são definidos de acordo com a prática neurocirúrgica estereotáxica de referência. Upstaza é administrado como perfusão bilateral (2 perfusões por putamen) com uma cânula intracraniana. Os 4 pontos finais de cada trajetória devem ser definidos como 2 mm em direção posterior (acima) dos pontos alvo anteriores e posteriores no plano médio-horizontal (Figura 1).
Figura 1 Quatro locais desejados para os pontos de injeção
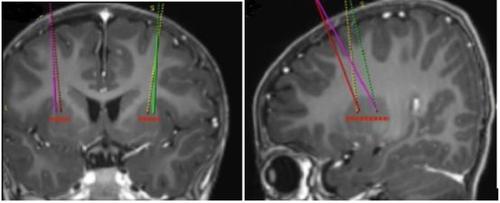
- Uma vez completado o registro estereotáxico, deve-se marcar o ponto de entrada no crânio. Deve-se realizar o acesso cirúrgico através do osso do crânio e da dura-máter.
- A cânula de perfusão é colocada no ponto designado do putamen com meios estereotáxicos a partir das trajetórias previstas. Cabe destacar que se coloca a cânula de perfusão e se realiza a perfusão por separado para cada putamen.
- Upstaza é injetado a uma velocidade de 0,003 ml/min em cada um dos 2 pontos alvo de cada putamen; são injetados 0,08 ml de Upstaza por ponto do putamen, o que dá lugar a 4 perfusões com um volume total de 0,320 ml (ou 1,8 × 10^11 vg).
- Começando pelo primeiro ponto alvo, a cânula é inserida através de um orifício de trepanação no putamen e, em seguida, é retirada lentamente, distribuindo os 0,08 ml de Upstaza ao longo da trajetória prevista para otimizar a distribuição no putamen.
- Após a primeira perfusão, a cânula é retirada e reinserida no próximo ponto alvo, repetindo o mesmo procedimento para os outros 3 pontos alvo (anterior e posterior de cada putamen).
- Após os procedimentos de fechamento neurocirúrgico habituais, o paciente é submetido a um exame de imagem por tomografia computadorizada pós-operatória para verificar se não há complicações pós-operatórias (por exemplo, hemorragias).
- O paciente deve ser alojado nas proximidades do hospital em que a intervenção foi realizada, pelo menos durante as primeiras 48 horas após a intervenção. O paciente pode voltar para casa após a intervenção, segundo o critério do médico responsável. A atenção pós-tratamento deve ser dirigida pelo neurólogo pediátrico de referência e pelo neurocirurgião. Será realizado um seguimento do paciente 7 dias após a intervenção para verificar se não surgiram complicações. Duas semanas mais tarde, terá lugar uma segunda visita de seguimento, ou seja, 3 semanas após a intervenção para supervisionar a recuperação pós-cirúrgica e a presença de eventos adversos.
- Os pacientes serão oferecidos a possibilidade de se inscreverem em um registro para continuar avaliando a segurança e a eficácia a longo prazo do tratamento em condições normais da prática clínica.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a UPSTAZA 2,8 × 10^11 VETORES GENÉTICOS (VG)/0,5 ML SOLUÇÃO PARA PERFUSÃOForma farmacêutica: SOLUÇÃO INJETÁVEL PARA PERFUSÃO, 100 USubstância ativa: laronidaseFabricante: Sanofi B.V.Requer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 30 mg/mlSubstância ativa: cerliponase alfaFabricante: Biomarin International LimitedRequer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, DesconhecidaSubstância ativa: imigluceraseFabricante: Sanofi B.V.Requer receita médica
Médicos online para UPSTAZA 2,8 × 10^11 VETORES GENÉTICOS (VG)/0,5 ML SOLUÇÃO PARA PERFUSÃO
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de UPSTAZA 2,8 × 10^11 VETORES GENÉTICOS (VG)/0,5 ML SOLUÇÃO PARA PERFUSÃO – sujeita a avaliação médica e regras locais.














