TAKHZYRO 300 mg SOLUÇÃO INJETÁVEL

Pergunte a um médico sobre a prescrição de TAKHZYRO 300 mg SOLUÇÃO INJETÁVEL

Como usar TAKHZYRO 300 mg SOLUÇÃO INJETÁVEL
Introdução
Prospecto: informação para o utilizador
TAKHZYRO300mg solução injetável em frasco
lanadelumab
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi-lhe prescrito apenas a si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é TAKHZYRO e para que é utilizado
- O que precisa saber antes de começar a usar TAKHZYRO
- Como usar TAKHZYRO
- Posíveis efeitos adversos
- Conservação de TAKHZYRO
- Conteúdo do envase e informação adicional
- Instruções de uso
1. O que é TAKHZYRO e para que é utilizado
TAKHZYRO contém o princípio ativo lanadelumab.
Para que é utilizado TAKHZYRO
TAKHZYRO é um medicamento que é utilizado em doentes a partir de 2 anos de idade com angioedema hereditário (AEH) para prevenir as crises de angioedema.
O que é o angioedema hereditário (AEH)
O AEH é uma doença hereditária dentro de uma mesma família. Quando se tem esta doença, não há no sangue uma quantidade suficiente de uma proteína chamada «inibidor C1» ou quando o inibidor C1 não funciona corretamente. Isto leva a um excesso de «calicreína plasmática», o que por sua vez produz níveis mais altos de «bradicinina» no torrente sanguíneo. Demasiada bradicinina provoca sintomas de AEH, como inchação e dor em:
- as mãos e os pés
- a face, as pálpebras, os lábios ou a língua
- as cordas vocais (laringe), o que pode fazer com que lhe custe respirar
- os genitais
Como actua TAKHZYRO
TAKHZYRO é um tipo de proteína que bloqueia a actividade da calicreína plasmática, o que ajuda a reduzir a quantidade de bradicinina presente no torrente sanguíneo e previne os sintomas do AEH.
2. O que precisa saber antes de começar a usar TAKHZYRO
Não use TAKHZYRO
Se é alérgico ao lanadelumab ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
Advertências e precauções
- Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a usar TAKHZYRO.
- Se tiver uma reacção alérgica grave a TAKHZYRO com sintomas como erupção, opressão no peito, silvos ao respirar ou batimentos cardiacos rápidos, informe o seu médico, farmacêutico ou enfermeiro imediatamente.
Manter um registo
Recomenda-se encarecidamente que, cada vez que se administre uma dose de TAKHZYRO, anote o nome e o número do lote do medicamento, para que tenha um registo dos lotes utilizados.
Provas analíticas
Informa ao seu médico se está a usar TAKHZYRO antes de se submeter a provas analíticas para avaliar a coagulação sanguínea, porque a presença de TAKHZYRO no sangue pode interferir com certas provas analíticas e dar lugar a resultados inexatos.
Crianças e adolescentes
Não se recomenda o uso de TAKHZYRO em crianças menores de 2 anos, porque não foi estudado neste grupo etário.
Outros medicamentos e TAKHZYRO
Informa ao seu médico ou farmacêutico se está a tomar, tomou recentemente ou pode ter que tomar qualquer outro medicamento.
Não se sabe que TAKHZYRO afecte outros medicamentos nem que seja afectado por outros medicamentos.
Gravidez e amamentação
Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico ou farmacêutico antes de utilizar TAKHZYRO. A informação sobre a segurança do uso de TAKHZYRO durante a gravidez e a amamentação é limitada. Como medida de precaução, é preferível evitar o uso de lanadelumab durante a gravidez e a amamentação. O médico analisará com si os riscos e benefícios de receber este medicamento.
Condução e uso de máquinas
A influência deste medicamento sobre a capacidade para conduzir e utilizar máquinas é nula ou insignificante.
TAKHZYRO contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por frasco; isto é, é essencialmente “isento de sódio”.
3. Como usar TAKHZYRO
TAKHZYRO é apresentado em frascos de uso único como solução pronta para usar. Um médico com experiência na atenção de doentes com AEH iniciará e supervisionará o seu tratamento.
Siga exactamente as instruções de administração do medicamento contidas neste prospecto ou as indicadas pelo seu médico, farmacêutico ou enfermeiro. Em caso de dúvida ou outras perguntas sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
Quantos TAKHZYRO utilizar
Para adultos e adolescentes de 12 anos a menos de 18 anos de idade:
- A dose de início recomendada é de 300 mg de lanadelumab cada 2 semanas. Se não teve nenhuma crise durante um período de tempo prolongado, o médico pode modificar a dose para 300 mg de lanadelumab cada 4 semanas, especialmente se o seu peso corporal for baixo.
- Em doentes com um peso corporal inferior a 40 kg, também pode ser considerada uma dose de início de 150 mg de lanadelumab cada 2 semanas. Se não teve crises durante um período de tempo prolongado, o médico pode mudar a dose para 150 mg de lanadelumab cada 4 semanas.
Para crianças de 2 anos a menos de 12 anos de idade, a dose de início recomendada baseia-se no peso corporal:
Peso corporal (kg) | Dose de início recomendada | Ajuste de dose |
10 a menos de 20 kg | 150 mg de lanadelumab cada 4 semanas | Pode ser considerado um aumento da dose para 150 mg de lanadelumab cada 3 semanas em doentes com controlo insuficiente dos ataques |
20 a menos de 40 kg | 150 mg de lanadelumab cada 2 semanas | Pode ser considerado reduzir a dose para 150 mg de lanadelumab cada 4 semanas em doentes estáveis e sem crises sob tratamento |
40 kg ou mais | 300 mg de lanadelumab cada 2 semanas | Pode ser considerado reduzir a dose para 300 mg de lanadelumab cada 4 semanas em doentes estáveis e sem crises sob tratamento |
- Em doentes com um peso corporal de 20 a menos de 40 kg que não tenham tido nenhuma crise durante um período de tempo prolongado, o médico pode permitir que o seu filho ou a criança que está ao seu cuidado continue a receber a mesma dose ao atingir os 12 anos de idade.
Como injetar TAKHZYRO
Se se auto-injeta TAKHZYRO ou se o injeta o seu cuidador, si ou o seu cuidador devem ler e seguir atentamente as instruções que aparecem na secção7, «Instruções de uso».
- TAKHZYRO é injetado sob a pele («injeção subcutânea»).
- A injeção pode ser administrada por si ou um cuidador em doentes a partir de 12 anos de idade.
- A injeção pode ser administrada por um profissional de saúde ou por um cuidador em doentes de 2 anos a menos de 12 anos de idade.
- Um médico, farmacêutico ou enfermeiro deve ensinar-lhe a preparar e injetar TAKHZYRO correctamente antes de o usar pela primeira vez. Não se injete nem injete a outra pessoa até que lhe tenham ensinado a injetar-se o medicamento.
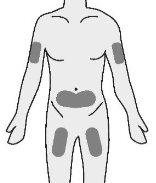
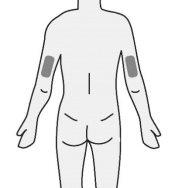
- Insira a agulha no tecido adiposo do estômago (abdomen), coxa ou parte superior do braço.
- Injete o medicamento num local diferente cada vez.
- Use cada frasco de TAKHZYRO apenas uma vez.
Se usa mais TAKHZYRO do que deve
Informa ao seu médico, farmacêutico ou enfermeiro se se administrou uma dose de TAKHZYRO maior do que a recomendada.
Se esqueceu de usar TAKHZYRO
Se saltou uma dose de TAKHZYRO, injete a dose o mais breve possível. A administração das seguintes doses pode requerer um ajuste segundo a frequência de dosificação desejada, assegurando-se de:
- deixar passar pelo menos 10 dias entre uma dose e outra em doentes com um regime de dosificação cada 2 semanas,
- deixar passar pelo menos 17 dias entre uma dose e outra em doentes com um regime de dosificação cada 3 semanas,
- deixar passar pelo menos 24 dias entre uma dose e outra em doentes com um regime de dosificação cada 4 semanas.
Se não tem a certeza de quando se injetar TAKHZYRO após ter saltado uma dose, pergunte ao seu médico, farmacêutico ou enfermeiro.
Se interromper o tratamento com TAKHZYRO
É importante que continue a injetar-se TAKHZYRO como lhe foi indicado pelo médico, mesmo que se sinta melhor.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Posíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Se tiver uma reacção alérgica grave a TAKHZYRO com sintomas como erupção, opressão no peito, silvos ao respirar ou batimentos cardiacos rápidos, informe o seu médico, farmacêutico ou enfermeiro imediatamente.
Informa ao seu médico, farmacêutico ou enfermeiro se nota algum dos seguintes efeitos adversos.
Muito frequentes (podem afectar mais de 1de cada 10pessoas):
- Reacções no local de administração da injeção: os sintomas são dor, rubor da pele, equimoses, molestias, inchação, sangramento, picazón, endurecimento da pele, formigueiro, calor e erupção.
Frequentes (podem afectar até 1de cada 10pessoas):
- Reacções alérgicas, como picazón, molestias e formigueiro na língua
- Tonturas, sensação de desmaio
- Erupção cutânea abultada
- Dor muscular
- Resultados de provas analíticas que mostram alterações no fígado
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, si pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de TAKHZYRO
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na etiqueta e na caixa após CAD. A data de validade é o último dia do mês que se indica.
Conservar em frigorífico (entre 2 ?C e 8 ?C). Não congelar. Conservar o frasco no embalagem exterior para protegê-lo da luz.
Os frascos podem ser conservados por debaixo de 25 ?C por um único período de 14 dias, mas sem ultrapassar a data de validade.
Após a conservação a temperatura ambiente, não volte a refrigerar TAKHZYRO para a sua conservação.
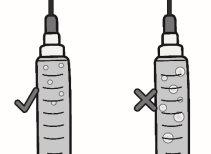
Não utilize este medicamento se observar sinais de deterioração, como partículas no frasco ou uma alteração de cor na solução para injeção.
Os medicamentos não devem ser deitados fora por meio dos esgotos nem para o lixo. Pergunte ao seu farmacêutico como se livrar dos invólucros e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de TAKHZYRO
- O princípio ativo é lanadelumab. Cada frasco contém 300 mg de lanadelumab em 2 ml de solução.
- Os outros componentes são fosfato disódico diidratado, ácido cítrico monoidratado, histidina, cloreto de sódio, polissorbato 80 e água para preparações injetáveis; ver seção 2 «TAKHZYRO contém sódio».
Aspecto do produto e conteúdo do envase
TAKHZYRO é apresentado sob a forma de solução injetável transparente de incolora a amarelo pálido em um frasco de vidro.
TAKHZYRO está disponível como embalagem unitária que contém um frasco de 2 ml e como embalagens múltiplas que contêm 2 ou 6 caixas intermediárias, de 1 frasco cada.
É possível que nem todos os tamanhos de embalagens sejam comercializados.
Cada embalagem também contém os seguintes componentes:
- Seringa de 3 ml vazia
- Agulha de acesso ao frasco de calibre 18 com ponta romba
- Agulha para administração (injeção) de 27 G x 13 mm com ponta afiada
Título da autorização de comercialização e responsável pela fabricação
Título da autorização de comercialização
Takeda Pharmaceuticals International AG Ireland Branch
Block 2 Miesian Plaza
50-58 Baggot Street Lower
Dublín 2
D02 HW68
Irlanda
Responsável pela fabricação
Takeda Pharmaceuticals International AG Ireland Branch
Block 2 Miesian Plaza
50-58 Baggot Street Lower
Dublín 2
D02 HW68
Irlanda
Shire Pharmaceuticals Ireland Limited
Blocks 2 & 3 Miesian Plaza
50-58 Baggot Street Lower
Dublín 2
Irlanda
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica Takeda Belgium NV Tel: +32 2 464 06 11 | Lituânia Takeda, UAB Tel: +370 521 09 070 |
| Luxemburgo Takeda Belgium NV Tel: +32 2 464 06 11 |
República Checa Takeda Pharmaceuticals Czech Republic s.r.o. Tel: + 420 234 722 722 | Hungria Takeda Pharma Kft. Tel.: +36 1 270 7030 |
Dinamarca Takeda Pharma A/S Tlf: +45 46 77 10 10 | Malta Drugsales Ltd Tel: +356 21419070 |
Alemanha Takeda GmbH Tel: +49 (0)800 825 3325 | Países Baixos Takeda Nederland B.V. Tel: +31 20 203 5492 |
Estônia Takeda Pharma OÜ Tel: +372 6177 669 | Noruega Takeda AS Tlf.: +47 800 800 30 |
Grécia Takeda ΕΛΛΑΣ Α.Ε. Tel: +30 210 6387800 | Áustria Takeda Pharma Ges.m.b.H. Tel: +43 (0) 800-20 80 50 |
Espanha Takeda Farmacéutica España, S.A. Tel: +34 917 90 42 22 | Polônia Takeda Pharma Sp. z o.o. Tel.: +48223062447 |
França Takeda France SAS Tel: + 33 1 40 67 33 00 | Portugal Takeda Farmacêuticos Portugal, Lda. Tel: + 351 21 120 1457 |
Croácia Takeda Pharmaceuticals Croatia d.o.o. Tel: +385 1 377 88 96 | Romênia Takeda Pharmaceuticals SRL Tel: +40 21 335 03 91 |
Irlanda Takeda Products Ireland Ltd Tel: 1800 937 970 | Eslovênia Takeda Pharmaceuticals farmacevtska družba d.o.o. Tel: + 386 (0) 59 082 480 |
Islândia Vistor ehf. Sími: +354 535 7000 | Eslováquia Takeda Pharmaceuticals Slovakia s.r.o. Tel: +421 (2) 20 602 600 |
Itália Takeda Italia S.p.A. Tel: +39 06 502601 | Finlândia Takeda Oy Puh/Tel: 0800 774 051 |
Chipre Proton Medical (Cyprus) Ltd Tel: +357 22866000 | Suécia Takeda Pharma AB Tel: 020 795 079 |
Letônia Takeda Latvia SIA Tel: +371 67840082 | Reino Unido (Irlanda do Norte) Takeda UK Ltd Tel: +44 (0) 3333 000 181 |
Data da última revisão deste prospecto:
Outras fontes de informação
A informação detalhada sobre este medicamento está disponível no site da Agência Europeia de Medicamentos: https://www.ema.europa.eu. Também existem links para outros sites sobre doenças raras e medicamentos órfãos.
- Instruções de uso
Certifique-se de ler, entender e seguir as instruções passo a passo para injetar TAKHZYRO. Entre em contato com seu médico, farmacêutico ou enfermeiro se tiver alguma dúvida.
Além do frasco, cada embalagem de TAKHZYRO também contém:
|
|
É usada para extrair a solução do frasco para a seringa. |
|
É usada para injetar sob a pele (via subcutânea). |
|
Use apenas as seringas, agulhas de acesso ao frasco com ponta romba e agulhas para injeção com ponta afiada que vêm nesta embalagem ou que seu médico tenha prescrito.
Use uma única vez as seringas, agulhas de acesso ao frasco com ponta romba e agulhas para injeção com ponta afiada. Coloque todas as seringas e agulhas usadas em um contenedor para objetos perfurocortantes.
Não use uma seringa, agulha de acesso ao frasco com ponta romba ou agulha para injeção com ponta afiada que pareça estar danificada.
Também precisará:
- Gasas com álcool
- Um contenedor para objetos perfurocortantes para colocar os frascos, agulhas e seringas usados
Pode obter esses itens de seu médico, farmacêutico ou enfermeiro.
A injeção de TAKHZYRO pode ser resumida em 5 passos:
- Preparação do frasco de TAKHZYRO
- Acoplamento à seringa da agulha de acesso ao frasco com ponta romba
- Transferência de TAKHZYRO para a seringa e troca para a agulha de injeção com ponta afiada
- Seleção e preparação do local de injeção
- Injeção de TAKHZYRO
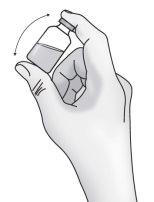
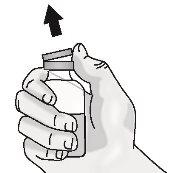
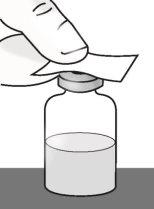
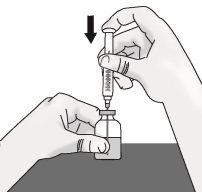
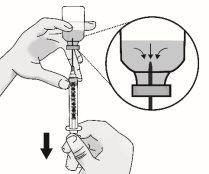
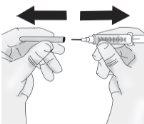
Passo 1: Preparação do frasco de TAKHZYRO
|
|
|
|
|
|
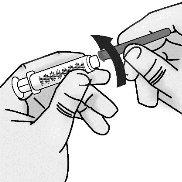
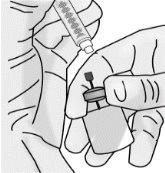
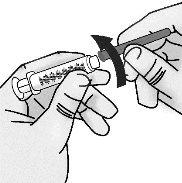
Passo 2: Acoplamento à seringa da agulha de acesso ao frasco com ponta romba
|
|
|
|
|
|
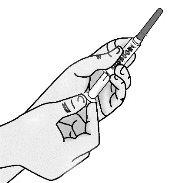
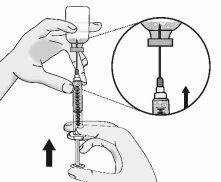
Passo 3: Transferência de TAKHZYRO para a seringa e troca para a agulha de injeção com ponta afiada
|
|
|
|
|
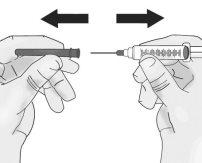
Pressione o êmbolo lentamente deixando que o ar volte ao frasco até que a solução chegue ao extremo da seringa. Repita esses passos até que as bolhas grandes sejam eliminadas. |
|
Voltar a colocar a seringa na posição vertical. |
|
|
|
|
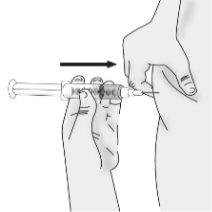
Passo 4: Seleção e preparação do local de injeção
|
|
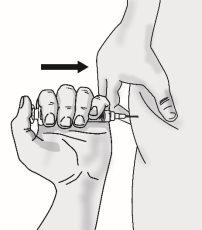
Passo 5: Injeção de TAKHZYRO
|
|
|
|
|
|
|
|
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a TAKHZYRO 300 mg SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 150 mgSubstância ativa: lanadelumabRequer receita médicaForma farmacêutica: INJETÁVEL, 300 mgSubstância ativa: lanadelumabRequer receita médicaFabricante: Csl Behring GmbhRequer receita médica
Médicos online para TAKHZYRO 300 mg SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de TAKHZYRO 300 mg SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.