

SOFTACORT 3,35 mg/ml COLÍRIO EM SOLUÇÃO EM EMBALAGENS UNIDOSE

Pergunte a um médico sobre a prescrição de SOFTACORT 3,35 mg/ml COLÍRIO EM SOLUÇÃO EM EMBALAGENS UNIDOSE

Como usar SOFTACORT 3,35 mg/ml COLÍRIO EM SOLUÇÃO EM EMBALAGENS UNIDOSE
Introdução
Prospecto:informação para o utilizador
Softacort 3,35 mg/ml colírio em solução em envases unidose
Hidrocortisona fosfato de sódio
Leia todo o prospecto detenidamente antes de começar a usar este medicamento,porque contém informações importantes para si.
- Conservar este prospecto, pois pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi-lhe prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, pois pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto:
- O que é Softacort e para que é utilizado
- O que precisa saber antes de começar a usar Softacort
- Como usar Softacort
- Posíveis efeitos adversos
- Conservação de Softacort
- Conteúdo do envase e informação adicional
1. O que é Softacort e para que é utilizado
Este medicamento é um colírio em solução em envases unidose que contém uma substância chamada hidrocortisona. Esta substância é um corticosteroide que inibe os sintomas da inflamação.
É utilizado para tratar afecções alérgicas ou inflamatórias leves da parte superficial do seu olho ou dos seus olhos (conjuntivas).
O olho não deve estar infectado (ver Não use Softacort).
2. O que precisa saber antes de começar a usar Softacort
Não use Softacort
- Se é alérgico ao princípio ativo (hidrocortisona) ou a qualquer um dos outros componentes deste medicamento (incluídos na secção 6).
- Se tem a pressão do olho alta (hipertensão ocular), que se sabe que pode estar associada ao uso de glucocorticoides (família dos corticosteroides) ou a outras causas.
- Se tem infecções víricas agudas causadas pelo vírus do herpes e na maioria das outras doenças víricas em fase de ulceração (a menos que a infecção esteja sendo tratada com um tratamento anti-infeccioso para o vírus do herpes).
- Se tem conjuntivite com inflamação ulcerativa da córnea (queratite) mesmo na fase inicial.
- Se tem uma infecção bacteriana no olho (infecção aguda purulenta, conjuntivite, blefarite e orzuelo).
- Se tem uma infecção no olho por fungos (micose ocular).
- Se tem uma infecção bacteriana chamada tuberculose que afeta o seu olho (tuberculose ocular).
Advertências e precauções
- Consulte o seu médico,farmacêutico ou enfermeiro antes de começar a usar este medicamento.
- Se tem um olho vermelho que não foi diagnosticado, não use este medicamento.
- Se tem uma infecção vírica do olho (herpes), apenas use este medicamento se a infecção estiver sendo tratada com um tratamento anti-infeccioso e se requer uma monitorização estreita dos seus olhos.
- Se tem uma doença que causa o adelgaçamento da parte externa do seu olho (córnea e esclerótica), pode haver um maior risco de perfuração devido ao uso de corticosteroides tópicos aplicados no olho.
- Se esteve usando um medicamento corticosteroide durante muito tempo e tem uma ferida no olho (úlcera corneal), pode suspeitar-se a existência de uma infecção fúngica.
- Durante o seu tratamento é necessário um controlo estreito e regular dos seus olhos. O uso prolongado de corticosteroides demonstrou que causa um aumento da pressão no interior do olho e o início do glaucoma, especialmente em pacientes que já sofrem de pressão intraocular alta ou que estão em risco de desenvolver tal afecção com o tratamento local com esteroides (ver Posíveis efeitos adversos) e causar opacidade da lente no seu olho (catarata), em particular em crianças e em população de idade avançada.
- O uso de corticosteroides pode causar infecções oculares oportunistas. Além disso, os corticosteroides oculares tópicos podem promover, agravar ou mascarar sinais e sintomas de infecções oculares oportunistas.
- Deve evitar usar lentes de contato durante o tratamento com este medicamento.
- Entre em contacto com o seu médico se apresentar visão borrosa ou outras alterações visuais.
Crianças
Não há dados de segurança e eficácia em crianças.
O tratamento contínuo com corticosteroides a longo prazo pode produzir supressão suprarrenal.
O aumento da pressão ocular em crianças ocorre com maior frequência, com maior severidade e com maior rapidez do que em adultos.
Uso de Softacort com outros medicamentos
Informar o seu médico ou farmacêutico se está utilizando, utilizou recentemente ou poderia ter que utilizar qualquer outro medicamento, incluindo medicamentos que se obtêm sem receita médica.
Alguns medicamentos podem aumentar os efeitos de Softacort e o seu médico pode desejar controlá-lo cuidadosamente se está utilizando estes medicamentos (incluindo alguns medicamentos para o VIH: ritonavir, cobicistat).
Gravidez e lactação
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico ou farmacêutico antes de utilizar este medicamento.
- Não se recomenda o uso deste medicamento durante a gravidez, excepto quando o seu médico o considere necessário e sob estrita supervisão.
Desconhece-se se este medicamento passa para o leite materno. O seu médico decidirá se pode usar ou não este medicamento durante a lactação.
Condução e uso de máquinas
Pode notar visão borrosa imediatamente após a aplicação de Softacort. Não conduza nem utilize máquinas até que este efeito tenha desaparecido.
Softacort contém fosfato
Este medicamento contém 0,227 mg de fosfatos em cada gota.
3. Como usar Softacort
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico ou farmacêutico. Em caso de dúvida, consulte novamente o seu médico ou farmacêutico.
A dose recomendada é de 2 gotas no (nos) olho(s) afetado(s), de 2 a 4 vezes ao dia, segundo prescrição médica. Recomenda-se uma redução gradual da dose para evitar uma recaída. A duração do tratamento pode variar de alguns dias até um máximo de 14 dias.
Utiliza-se a mesma dose tanto para adultos como para os pacientes de idade avançada.
Uso em crianças
Não foi estabelecida a eficácia e segurança em crianças.
Instruções de uso
Este medicamento está destinado a ser administrado no olho.
Para utilizar o colírio, por favor siga estas instruções:
- Lave as mãos e sente-se ou permaneça confortavelmente de pé.
- Abra o sobro que contém 10 envases unidose. Anote a data de primeira abertura no sobro.
- Separe um envase unidose da tira.
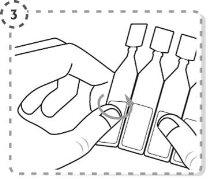
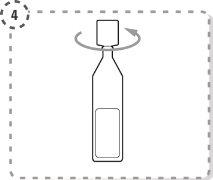
- Gire a ponta do envase unidose tal como se mostra. Não toque a ponta após abrir o envase.
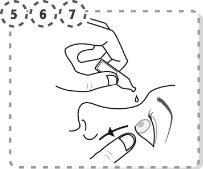
- Utilize o seu dedo para separar suavemente a pálpebra inferior do olho afetado.
- Coloque a ponta do frasco unidose perto do olho, mas sem chegar a tocá-lo.
- Pressione suavemente o envase unidose de forma que caíam duas gotas no olho e luego retire o dedo da pálpebra inferior.
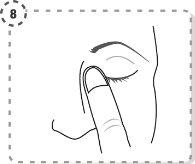
- Pressione com o dedo o extremo do olho afetado, na parte próxima ao nariz. Exerça a pressão durante 1 minuto, mantendo o olho fechado.
- Repita a operação no outro olho, se o seu médico o indicou. Cada envase unidose contém quantidade suficiente para os dois olhos.
- Elimine o envase unidose após utilizá-lo. Não o guarde para utilizá-lo novamente.
- Coloque os envases unidose sem abrir dentro do sobro. Coloque o sobro aberto dentro da caixa. Os envases sem abrir podem ser utilizados dentro do mês seguinte à abertura do sobro.
Se usar qualquer outro colírio, espere pelo menos 5 minutos entre cada aplicação.
Se usar mais Softacort do que deve
Esclarez o olho com água estéril se se administrar demasiado produto no olho e tiver irritação prolongada.
Entre em contacto imediatamente com o seu médico ou farmacêutico.
Se esquecer de usar Softacort
Não deve aplicar-se uma gota adicional no olho para compensar a dose esquecida.
Se interromper o tratamento com Softacort
Não deixe de usar o tratamento de maneira repentina. Sempre consulte o seu médico se está considerando suspender o tratamento.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Posíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Frequência não conhecida:não pode ser estimada a partir dos dados disponíveis
- molestias oculares transitórias (ardor, escozor) após a aplicação.
Os seguintes efeitos adversos foram notificados com medicamentos do mesmo grupo (corticosteroides) quando foram utilizados para tratar patologias oculares.
Frequência desconhecida:não pode ser estimada a partir dos dados disponíveis
- reações alérgicas
- retardamento na cicatrização de feridas
- opacidade da lente do olho (catarata capsular posterior)
- infecções oportunistas (víricas tipo herpes, infecção por fungos)
- aumento da pressão no seu olho (glaucoma)
- dilatação da pupila (midriase)
- pálpebras caídas (ptose)
- inflamação dentro do seu olho (uveíte)
- alterações no espessamento da parte frontal do olho (córnea)
- inflamação da córnea (queratopatia cristalina)
- visão borrosa
Se sofrer de dano grave na camada transparente da parte frontal do olho (córnea), o tratamento com fosfatos, em casos muito raros, pode provocar manchas nubladas na córnea devido ao cálcio.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: https//: notificaram.es. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Softacort
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na caixa, no sobro e no envase unidose após CAD ou EXP. A data de validade é o último dia do mês que se indica.
Conservar abaixo de 25°C.
Após a primeira abertura do sobro:utilize o envase unidose no prazo de um mês.
Mantenha os envases unidose dentro do sobro para protegê-los da luz.
Escreva a data de primeira abertura do sobro.
Após a primeira abertura do envase unidose:utilize imediatamente e elimine o envase unidose após utilizá-lo.
A esterilidade não pode ser mantida após abrir um envase unidose, por isso deve abrir um novo envase antes de cada uso.
Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Deposite os envases e os medicamentos que não precisa no Ponto SIGRE da farmácia. Em caso de dúvida, pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição deSoftacort
- O princípio ativo é hidrocortisona fosfato sódio.
1 ml de colírio em solução contém 3,35 mg de hidrocortisona fosfato sódio.
- Os demais componentes são fosfato disódico dodecahidratado, dihidrogenofosfato sódio monohidratado, cloreto de sódio, edetato de disódio, ácido clorídrico (para ajustar o pH), água para preparações inyectáveis.
Aspecto do produto e conteúdo do envase
Este medicamento apresenta-se como um colírio em solução, em envases unidose.
A solução é praticamente transparente, incolora a ligeiramente amarela, praticamente livre de partículas, apresentados no interior de um sobro com 10 unidades, cada envase unidose contém 0,4 ml de colírio em solução.
As caixas contêm 10 (1 x 10), 20 (2 x 10), 30 (3 x 10) ou 60 (6 x 10) envases unidose.
Pode ser que apenas alguns tamanhos de envases estejam comercializados.
Titular da autorização de comercialização e responsável pela fabricação
Titular da autorização de comercialização
LABORATOIRES THEA
12 RUE LOUIS BLERIOT
63017 CLERMONT-FERRAND CEDEX 2
FRANÇA
Fabricante
LABORATOIRES UNITHER
1 rue de l’Arquerie
50200 Coutances
FRANÇA
ou
LABORATOIRES THEA
12, rue Louis Blériot
63017 CLERMONT-FERRAND Cedex 2
FRANÇA
Representante local
LABORATORIOS THEA, S.A.
C/ Enric Granados nº 86-88, 2ª planta
08008 – BARCELONA
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu com os seguintes nomes:
Alemanha, Áustria, Bulgária, Chipre, Croácia, Dinamarca, Eslovênia, Espanha, Finlândia, França, Grécia, Islândia, Noruega, Polônia, Portugal, República Checa, República Eslovaca, Reino Unido, Romênia, Suécia Softacort
Bélgica, Holanda, Luxemburgo Softacor
Irlanda Zoftazot
Itália Sofacor
Data da última revisão deste prospecto: Outubro 2023
A informação detalhada deste medicamento está disponível na página web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.gob.es/.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a SOFTACORT 3,35 mg/ml COLÍRIO EM SOLUÇÃO EM EMBALAGENS UNIDOSEForma farmacêutica: POMADA OFTÁLMICA, 15 mg/gSubstância ativa: hydrocortisoneFabricante: Omnivision GmbhRequer receita médicaForma farmacêutica: COLÍRIO, 1 mg/mlSubstância ativa: dexamethasoneFabricante: Pharmaselect International Beteiligungs GmbhRequer receita médicaForma farmacêutica: COLÍRIO, 0,1 %Substância ativa: dexamethasoneFabricante: Fidia Farmaceutici S.P.A.Requer receita médica
Alternativas a SOFTACORT 3,35 mg/ml COLÍRIO EM SOLUÇÃO EM EMBALAGENS UNIDOSE noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a SOFTACORT 3,35 mg/ml COLÍRIO EM SOLUÇÃO EM EMBALAGENS UNIDOSE em Польща
Alternativa a SOFTACORT 3,35 mg/ml COLÍRIO EM SOLUÇÃO EM EMBALAGENS UNIDOSE em Україна
Médicos online para SOFTACORT 3,35 mg/ml COLÍRIO EM SOLUÇÃO EM EMBALAGENS UNIDOSE
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de SOFTACORT 3,35 mg/ml COLÍRIO EM SOLUÇÃO EM EMBALAGENS UNIDOSE – sujeita a avaliação médica e regras locais.














