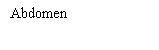Como usar OMVOH 100 mg SOLUÇÃO INJETÁVEL EM CANETA PREENCHIDA
Introdução
Prospecto: informação para o paciente
Omvoh 100 mg solução injetável em caneta pré-carregada
mirikizumab
Este medicamento está sujeito a acompanhamento adicional, o que agilizará a detecção de nova informação sobre sua segurança. Pode contribuir comunicando os efeitos adversos que possa ter. A parte final da seção 4 inclui informação sobre como comunicar esses efeitos adversos.
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informação importante para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver seção 4.
Conteúdo do prospecto
- O que é Omvoh e para que é utilizado
- O que precisa saber antes de começar a usar Omvoh
- Como usar Omvoh
- Posíveis efeitos adversos
- Conservação de Omvoh
- Conteúdo do envase e informação adicional
1. O que é Omvoh e para que é utilizado
Omvoh contém o princípio ativo mirikizumab, um anticorpo monoclonal. Os anticorpos monoclonais são proteínas que identificam e se unem especificamente a certas proteínas alvo do organismo. Omvoh atua unindo-se e bloqueando uma proteína do organismo chamada IL-23 (interleucina-23), que está implicada na inflamação. Ao bloquear a ação da IL-23, Omvoh reduz a inflamação e outros sintomas associados à colite ulcerosa.
Colite ulcerosa
A colite ulcerosa é uma doença inflamatória crônica do intestino grosso. Se padece colite ulcerosa, primeiro lhe serão administrados outros medicamentos. Se não responder suficientemente bem ou não puder tolerar esses medicamentos, pode ser que lhe sejam administrados Omvoh para reduzir os sinais e sintomas da colite ulcerosa, como diarreia, dor abdominal, urgência e sangramento retal.
2. O que precisa saber antes de começar a usar Omvoh
Não use Omvoh
- se é alérgico a mirikizumab ou a algum dos outros componentes deste medicamento (incluídos na seção 6). Se acredita que possa ser alérgico, consulte o seu médico antes de utilizar Omvoh.
- se tem infecções ativas importantes (tuberculose ativa).
Advertências e precauções
- Consulte o seu médico ou farmacêutico antes de começar a usar este medicamento.
- Seu médico verificará como se encontra antes do tratamento.
- Certifique-se de informar o seu médico sobre qualquer doença que sofra antes do tratamento.
Infecções
- Omvoh pode potencialmente causar infecções graves. Não se deve iniciar o tratamento com Omvoh se tiver uma infecção ativa até que a infecção desapareça.
- Depois de começar o tratamento, informe o seu médico imediatamente se tiver algum sintoma de infecção, como:
|
|
|
|
|
|
|
|
- Informe também o seu médico se esteve recentemente perto de alguém que pudesse ter tuberculose.
- Seu médico o examinará e fará um teste para a detecção da tuberculose antes de usar Omvoh.
- Se o seu médico acredita que você está em risco de padecer tuberculose ativa, pode ser que lhe sejam administrados medicamentos para tratar a tuberculose.
Vacinas
Seu médico verificará se precisa de alguma vacina antes de iniciar o tratamento. Informe o seu médico, farmacêutico ou enfermeiro se se vacinou recentemente ou se vai se vacinar. Alguns tipos de vacinas (vacinas vivas) não devem ser administrados enquanto se usa Omvoh.
Reações alérgicas
- Omvoh pode causar potencialmente reações alérgicas graves.
- Deixe de usar Omvoh e busque atenção médica imediatamente se apresentar qualquer um dos seguintes sintomas de uma reação alérgica grave:
|
|
|
|
|
|
Exames de sangue do fígado
Seu médico fará um exame de sangue antes de iniciar o tratamento com Omvoh e durante o mesmo para verificar se o seu fígado funciona com normalidade. Se os exames de sangue forem anormais, o seu médico pode interromper o tratamento com Omvoh e realizar exames adicionais no fígado para determinar a causa.
Crianças e adolescentes
Não se recomenda o uso de Omvoh em crianças e adolescentes menores de 18 anos, pois não foi estudado nesse grupo de idade.
Outros medicamentos e Omvoh
Informe o seu médico, farmacêutico ou enfermeiro
- se está utilizando, utilizou recentemente ou pode ter que utilizar qualquer outro medicamento.
- se foi vacinado recentemente ou vai se vacinar. Não se devem administrar determinados tipos de vacinas (vacinas vivas) enquanto se utiliza Omvoh.
Gravidez e amamentação
Se está grávida, acredita que possa estar grávida ou tem intenção de ficar grávida, consulte o seu médico antes de utilizar este medicamento. É preferível evitar o uso de Omvoh na gravidez. Desconhece-se os efeitos de Omvoh em mulheres grávidas. Se é uma mulher em idade fértil, aconselha-se que evite ficar grávida e que utilize um método anticonceptivo adequado enquanto estiver utilizando Omvoh e durante pelo menos 10 semanas após a última dose de Omvoh.
Se está amamentando, ou tem intenção de amamentar, consulte o seu médico antes de utilizar este medicamento.
Condução e uso de máquinas
É pouco provável que Omvoh influencie a sua capacidade para conduzir e utilizar máquinas.
Omvoh contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por dose; isto é, é essencialmente “isento de sódio”.
Omvoh contém polissorbato
Este medicamento contém 0,3 mg/ml de polissorbato 80 em cada caneta equivalente a 0,6 mg para a dose de manutenção para tratar a colite ulcerosa. Os polissorbatos podem causar reações alérgicas. Informe o seu médico se tiver alguma alergia conhecida.
3. Como usar Omvoh
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico ou enfermeiro. Em caso de dúvida, consulte novamente o seu médico, enfermeiro ou farmacêutico.
Qual a quantidade de Omvoh que se administra e durante quanto tempo
Seu médico decidirá a quantidade de Omvoh que precisa e a duração do tratamento. Omvoh é para tratamento a longo prazo. Seu médico ou enfermeiro monitorizará periodicamente o seu estado para verificar se o tratamento está tendo o efeito desejado.
Colite ulcerosa
- Início do tratamento: a primeira dose de Omvoh é de 300 mg e o seu médico a administrará mediante perfusão intravenosa (gotejamento em uma veia do braço) durante pelo menos 30 minutos.
Depois da primeira dose, receberá outra dose de 300 mg de Omvoh 4 semanas depois e novamente, após mais 4 semanas.
Se não tiver uma resposta terapêutica adequada após essas 3 perfusões, o seu médico pode considerar continuar com as perfusões intravenosas nas semanas 12, 16 e 20.
- Tratamento de manutenção: 4 semanas após a última perfusão intravenosa, será administrada uma dose de manutenção de 200 mg de Omvoh mediante injeção sob a pele (“por via subcutânea”) e depois, a cada 4 semanas. A dose de manutenção de 200 mg será administrada mediante 2 injeções de 100 mg de Omvoh cada.
Se perder a resposta após receber a dose de manutenção de Omvoh, o seu médico pode decidir administrar-lhe 3 doses de Omvoh mediante perfusões intravenosas.
Seu médico ou enfermeiro lhe indicarão quando mudar para as injeções subcutâneas.
Durante o tratamento de manutenção, você e o seu médico ou enfermeiro devem decidir se deve se injetar Omvoh você mesmo após receber formação na técnica de injeção subcutânea. É importante que não tente se injetar você mesmo até que o seu médico ou enfermeiro o tenham ensinado. Seu médico ou enfermeiro lhe proporcionarão a formação necessária. Um cuidador também pode administrar-lhe a injeção de Omvoh após a formação adequada.
Use um método de lembrete, como notas em um calendário ou diário, para ajudá-lo a lembrar quando administrar a próxima dose para evitar omitir ou repetir a dose.
Se receber mais Omvoh do que deve
Se recebeu mais Omvoh do que deve ou a dose foi administrada antes do prescrito, informe o seu médico.
Se esquecer de usar Omvoh
Se esqueceu de se injetar uma dose de Omvoh, injete-a o mais rápido possível. A partir de então, retome a administração a cada 4 semanas.
Se interromper o tratamento com Omvoh
Não deve interromper o tratamento com Omvoh sem consultar antes o seu médico. Se interromper o tratamento, os sintomas da colite ulcerosa podem voltar a aparecer.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Posíveis efeitos adversos
Assim como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Muito frequentes(podem afetar mais de 1 em cada 10 pessoas):
- Reações no local de injeção (p. ex.: vermelhidão da pele, dor)
Frequentes(podem afetar até 1 em cada 10 pessoas):
- Infecções do trato respiratório superior (infecções de nariz e garganta)
- Dor nas articulações
- Dor de cabeça
- Erupção cutânea
Pouco frequentes(podem afetar até 1 em cada 100 pessoas):
- Herpes
- Reação alérgica relacionada à perfusão (p. ex.: coceira, urticária)
- Aumento do nível de enzimas hepáticas no sangue.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informação sobre a segurança deste medicamento.
5. Conservação de Omvoh
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na etiqueta e no embalagem exterior após “CAD”. A data de validade é o último dia do mês que se indica.
Conservar em geladeira (entre 2 ºC e 8 ºC). Não congelar.
Nãoaqueça as canetas no micro-ondas, não as molhe com água quente, nem as exponha à luz solar direta.
Nãoagite a caneta pré-carregada.
Conservar no embalagem original para protegê-lo da luz.
Omvoh pode ser armazenado sem refrigeração até 2 semanas a uma temperatura não superior a 30 ºC.
Se ultrapassar essas condições, deve-se descartar Omvoh.
Não utilize este medicamento se observar que a caneta pré-carregada está danificada, ou o medicamento está turvo, consideravelmente marrom, ou tem partículas.
Este medicamento é para uso único.
Os medicamentos não devem ser jogados nos esgotos. Pergunte ao seu médico, enfermeiro ou farmacêutico como se livrar dos embalagens e dos medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de Omvoh
- O princípio ativo é mirikizumab.
Cada pluma precargada contém 100 mg de mirikizumab em 1 ml de solução.
- Os demais componentes são histidina; monoclorhidrato de histidina; cloreto de sódio; manitol (E 421); polissorbato 80 (E 433); água para preparações injetáveis.
Aspecto do produto e conteúdo do envase
Omvoh é uma solução em um cartucho de vidro transparente inserido em uma pluma descartável, para uso único. Sua cor pode variar de incolora a ligeiramente amarela.
Omvoh é apresentado em envases que contêm 2 plumas precargadas, em envases múltiplos de 2 cartonagens, que contêm cada uma 2 plumas precargadas e em envases múltiplos de 3 cartonagens, que contêm cada uma 2 plumas precargadas.
Pode ser que apenas alguns tamanhos de envases sejam comercializados.
Título da autorização de comercialização
Eli Lilly Nederland B.V.,
Papendorpseweg 83
3528 BJ Utrecht
Países Baixos
Responsável pela fabricação
Lilly France S.A.S.
Rue du Colonel Lilly
67640 Fegersheim
França
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica/Bélgica/Bélgica Eli Lilly Benelux S.A./N.V. Tel: + 32-(0)2 548 84 84 | Lituânia Eli Lilly Lituânia Tel: +370 (5) 2649600 |
| Luxemburgo/Luxemburgo Eli Lilly Benelux S.A./N.V. Tel: + 32-(0)2 548 84 84 |
República Tcheca ELI LILLY CR, s.r.o. Tel: + 420 234 664 111 | Hungria Lilly Hungária Kft. Tel: + 36 1 328 5100 |
Dinamarca Eli Lilly Dinamarca A/S Tlf.: +45 45 26 60 00 | Malta Charles de Giorgio Ltd. Tel: + 356 25600 500 |
Alemanha Lilly Deutschland GmbH Tel. + 49-(0) 6172 273 2222 | Países Baixos Eli Lilly Nederland B.V. Tel: + 31-(0) 30 60 25 800 |
Estônia Eli Lilly Nederland B.V. Tel: +372 6 817 280 | Noruega Eli Lilly Norge A.S. Tlf: + 47 22 88 18 00 |
Grécia ΦΑΡΜΑΣΕΡΒ-ΛΙΛΛΥ Α.Ε.Β.Ε. Τηλ: +30 210 629 4600 | Áustria Eli Lilly Ges.m.b.H. Tel: + 43-(0) 1 711 780 |
Espanha Lilly S.A. Tel: + 34-91 663 50 00 | Polônia Eli Lilly Polska Sp. z o.o. Tel: +48 22 440 33 00 |
França Lilly France Tél: +33-(0) 1 55 49 34 34 | Portugal Lilly Portugal Produtos Farmacêuticos, Lda Tel: + 351-21-4126600 |
Croácia Eli Lilly Croácia d.o.o. Tel: +385 1 2350 999 | Romênia Eli Lilly Romênia S.R.L. Tel: + 40 21 4023000 |
Irlanda Eli Lilly and Company (Irlanda) Limited Tel: + 353-(0) 1 661 4377 | Eslovênia Eli Lilly farmacêutica, d.o.o. Tel: +386 (0)1 580 00 10 |
Islândia Icepharma hf. Sími + 354 540 8000 | República Eslovaca Eli Lilly Eslováquia, s.r.o. Tel: + 421 220 663 111 |
Itália Eli Lilly Itália S.p.A. Tel: + 39- 055 42571 | Finlândia Oy Eli Lilly Finlândia Ab Puh/Tel: + 358-(0) 9 85 45 250 |
Chipre Phadisco Ltd Τηλ: +357 22 715000 | Suécia Eli Lilly Suécia AB Tel: + 46-(0) 8 7378800 |
Letônia Eli Lilly (Suíça) S.A. Parstavnieciba Letônia Tel: +371 67364000 |
Data da última revisão do prospecto:
Outras fontes de informação
A informação detalhada deste medicamento está disponível no site da Agência Europeia de Medicamentos: https://www.ema.europa.eu, e no site da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) (https://www.aemps.gob.es/).
Instruções de uso Omvoh 100mg solução injetável em pluma precargada mirikizumab 2plumas precargadas: 1 pluma de 100mg e 1 pluma de 100mg
|
Leia isso antes de injetar Omvoh. Siga todas as instruções passo a passo.
|
Também tenha em mente:
- Seu profissional de saúde deve ensinar-lhe como preparar e injetar Omvoh usando a pluma. Nãose injete você mesmo ou injete em outra pessoa até que lhe tenham mostrado como injetar Omvoh.
- Cada pluma de Omvoh é para uso único. Não compartilhe ou reutilize sua pluma. Pode transmitir ou que lhe transmitam uma infecção.
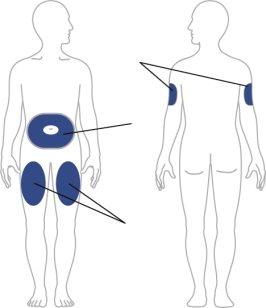
- Seu profissional de saúde pode ajudá-lo a decidir em que zona do seu corpo injetar sua dose. Também pode ler nestas instruções a seção “Escolha seu local de injeção” para ajudá-lo a escolher que zona pode ser melhor para você.
- Se tiver problemas de visão ou audição, não use a pluma de Omvoh sem a ajuda de um cuidador.
- Guarde as instruções de uso e releia-as se necessário.
Antes de usar as plumas de Omvoh, leia e siga de forma cuidadosa todas as instruções passo a passo.
Partes da pluma de Omvoh

100mg+100mg=1 dose completa
IMPORTANTE:
|
Preparação para injetar Omvoh
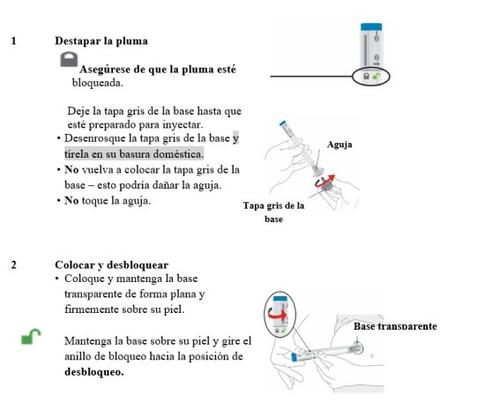
Retire as plumas da geladeira | Retire 2 plumas de Omvoh da geladeira. Deixe as tampas cinzas da base até que esteja preparado para injetar. Deixe as plumas em temperatura ambiente durante 30 minutos antes de injetar. Nãoaqueça as plumas no micro-ondas, não as molhe com água quente, nem as exponha à luz solar direta. Nãouse as plumas se o medicamento estiver congelado. Nãoagite. |
Reúna os elementos necessários | Elementos necessários:
|
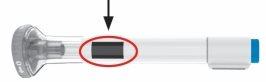
Inspeccione as plumas e o medicamento
| Certifique-se de que tem o medicamento correto. O medicamento dentro deve ser transparente. A cor pode variar de incolora a ligeiramente amarela. Nãouse as plumas, e elimine-as de acordo com as instruções do seu profissional de saúde se:
|
Prepare-se para injetar | Lave as mãos com água e sabão antes de injetar Omvoh. |
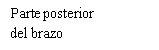
Escolha seu local de injeção
| Seu profissional de saúde pode ajudá-lo a escolher o melhor local de injeção para você.
Limpe o local de injeção com um toalhete com álcool. Deixe que a zona onde se vai injetar seque antes de injetar seu medicamento. |
Injetar Omvoh
| |||
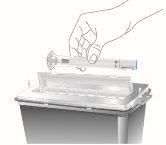
Descarte as plumas de Omvoh | |||
Elimine as plumas usadas
|
|
- Se não tiver um contenedor para descartar objetos pontiagudos, pode usar um recipiente doméstico que seja:
- de plástico resistente,
- possa ser fechado com uma tampa hermética, resistente a perfurações, sem que possam sair objetos cortantes,
- vertical e estável durante o uso,
- resistente a vazamentos,
- devidamente etiquetado para advertir da presença de resíduos perigosos no interior do contenedor.
- Quando seu contenedor para descartar objetos pontiagudos estiver quase cheio, deverá seguir as diretrizes de sua comunidade sobre a forma correta de se desfazer do mesmo. Pode haver regulamentações locais sobre como se devem descartar as agulhas e as plumas.
- Nãorecicle seu contenedor de eliminação de objetos pontiagudos usados.
- Para mais informações sobre como se desfazer do recipiente corretamente, pergunte ao seu profissional de saúde sobre as opções disponíveis em sua área.
Perguntas frequentes
- O que acontece se deixar minhas plumas atingirem a temperatura ambiente por mais de 30 minutos antes da injeção?
- Sua pluma pode permanecer em temperatura ambiente até 30 ºC durante um máximo de 2 semanas.
- O que acontece se vejo bolhas de ar na pluma?
- É normal que haja bolhas de ar na pluma. Não lhe prejudicarão nem afetarão sua dose.
- O que acontece se houver uma gota de líquido na ponta da agulha quando retiro a tampa cinza da base?
- Uma gota de líquido na ponta da agulha é normal. Não lhe prejudicará nem afetará sua dose.
- O que acontece se desbloqueio a pluma e pressiono o botão de injeção azul até que se complete a injeção?
- Nãoretire a tampa cinza da base. Nãouse a pluma. Consulte com seu médico ou farmacêutico para obter uma nova.
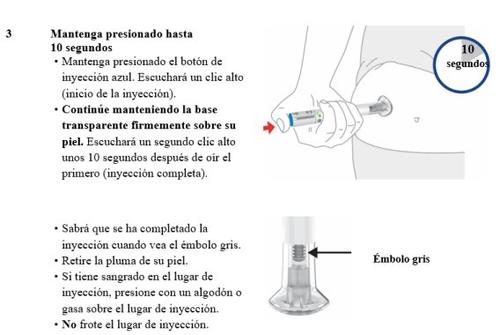
- Preciso manter pressionado o botão de injeção azul até que se complete a injeção?
- Nãoé necessário que mantenha pressionado o botão de injeção azul, mas pode ajudá-lo a manter a pluma estável e firme sobre sua pele.
- O que acontece se a agulha não se retrai após minha injeção?
- Nãotoque a agulha nem volte a colocar a tampa cinza da base. Guarde a pluma em um local seguro para evitar perfurações acidentais e entre em contato com seu médico, farmacêutico ou enfermeiro.
- O que acontece se houver uma gota de líquido ou sangue em minha pele após a injeção?
- Isso é normal. Pressione com um algodão ou gaze sobre o local de injeção. Nãoesfregue o local de injeção.
- O que acontece se ouvi mais de 2 cliques durante minha injeção - 2 cliques fortes e um suave? Recebi minha injeção completa?
- Alguns pacientes podem ouvir um clique suave justo antes do segundo clique forte. Isso é o funcionamento normal da pluma. Nãoretire a pluma de sua pele até que ouça o segundo clique forte.
- Como posso saber se minha injeção está completa?
- Após pressionar o botão de injeção azul, ouvirá 2 cliques fortes. O segundo clique forte lhe indica que sua injeção está completa. Também verá o êmbolo cinza na parte superior da base transparente.
Para saber mais sobre seu medicamento, leia o prospecto completo de Omvoh dentro deste envase.
Última revisão em

- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a OMVOH 100 mg SOLUÇÃO INJETÁVEL EM CANETA PREENCHIDAForma farmacêutica: INJETÁVEL, 100 mgSubstância ativa: mirikizumabFabricante: Eli Lilly Nederland B.V.Requer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 300 mgSubstância ativa: mirikizumabFabricante: Eli Lilly Nederland B.V.Requer receita médicaForma farmacêutica: PERFURAÇÃO INJETÁVEL, 130 mgSubstância ativa: ustekinumabFabricante: Accord Healthcare S.L.U.Requer receita médica
Médicos online para OMVOH 100 mg SOLUÇÃO INJETÁVEL EM CANETA PREENCHIDA
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de OMVOH 100 mg SOLUÇÃO INJETÁVEL EM CANETA PREENCHIDA – sujeita a avaliação médica e regras locais.