INFANRIX HEXA pó e suspensão para suspensão injetável

Pergunte a um médico sobre a prescrição de INFANRIX HEXA pó e suspensão para suspensão injetável

Como usar INFANRIX HEXA pó e suspensão para suspensão injetável
Introdução
Prospecto: informação para o utilizador
Infanrix hexa,Pó e suspensão para suspensão injectávelem seringa pré-carregada
Vacina antidiftérica (D), antitetânica (T), antipertussis (componente acelular) (Pa), antihepatite B (ADN recombinante) (VHB), antipoliomielítica (inactivada) (VPI), antiHaemophilus influenzaetipo b (Hib) conjugada (adsorvida).
Leia todo o prospecto detenidamente antes de o seu filho receber esta vacina, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Se o seu filho experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Infanrix hexa e para que é utilizado
- O que precisa saber antes de o seu filho receber Infanrix hexa
- Como administrar Infanrix hexa
- Possíveis efeitos adversos
- Conservação de Infanrix hexa
- Conteúdo do envase e informações adicionais
1. O que é Infanrix hexa e para que é utilizado
Infanrix hexa é uma vacina que é utilizada para proteger o seu filho contra seis doenças:
- Difteria: uma doença bacteriana grave que afeta principalmente as vias respiratórias e, algumas vezes, a pele, causando problemas respiratórios graves e, algumas vezes, asfixia. A bactéria também libera um veneno que pode causar dano nos nervos, problemas cardíacos e até a morte.
- Tétano: a bactéria do tétano, encontrada habitualmente no solo, na poeira, no esterco de cavalo e nas lascas de madeira, penetra no organismo através de cortes, arranhões ou feridas na pele e libera um veneno. Isso pode causar rigidez muscular, espasmos musculares dolorosos, convulsões e até a morte.
- Tosse ferina (pertussis): uma infecção bacteriana muito contagiosa que afeta as vias respiratórias, causando uma tosse duradoura que, muitas vezes, tem um som característico conhecido como “gallo”. Também pode causar infecções de ouvido, infecções de peito (bronquite), infecções pulmonares (pneumonia), convulsões, lesão cerebral ou até a morte.
- Hepatite B: está causada pelo vírus da hepatite B, que ataca ao fígado. O vírus pode causar uma infecção de por vida e pode derivar em cirrose e cancro do fígado.
- Poliomielite:uma infecção produzida por um vírus que, algumas vezes, causa lesão nos nervos e dano permanente, podendo fazer com que os músculos não se possam mover (paralisia), incluindo os músculos necessários para respirar e caminhar. Pode produzir dano permanente ou até a morte.
- Haemophilus influenzaetipo b (Hib): uma infecção bacteriana. Pode causar meningite (inflamação do cérebro), que pode causar lentidão mental (retardo), paralisia cerebral, surdez, epilepsia ou cegueira parcial. Também pode causar inchação da garganta, produzindo a morte por asfixia. Também pode infectar o sangue, o coração, os pulmões, os ossos, as articulações e os tecidos dos olhos e da boca.
Como funciona Infanrix hexa
- Infanrix hexa ajuda o organismo a desenvolver a sua própria proteção (anticorpos). Isso protegerá o seu filho contra estas doenças.
- Como com todas as vacinas, pode ser que Infanrix hexa não proteja completamente todos os meninos vacinados.
- A vacina não pode produzir as doenças de que protege o seu filho.
2. O que precisa saber antes de o seu filho receber Infanrix Hexa
Não se deve administrar Infanrix hexa
- se o seu filho é alérgico a:
- Infanrix hexa ou a qualquer um dos outros componentes desta vacina (incluídos na secção 6).
- Formaldeído.
- Neomicina ou polimixina (antibióticos).
Os sinais de uma reação alérgica podem incluir picazão da pele, erupção, diminuição da respiração e inchação da face ou da língua.
- se o seu filho teve uma reação alérgica a qualquer vacina contra as doenças: difteria, tétano, tosse ferina, hepatite B, poliomielite ou Haemophilus influenzaetipo b.
- se o seu filho teve problemas do sistema nervoso nos 7 dias seguintes à administração prévia de uma vacina contra a tosse ferina.
- se o seu filho tem uma infecção grave com febre (maior de 38 ºC). Uma infecção de pouca importância, como um resfriado, não deveria ser um problema para a vacinação, mas diga-o primeiro ao seu médico.
Não se deve administrar Infanrix hexa se alguma das situações anteriores afeta o seu filho. Se não está seguro, fale com o seu médico ou farmacêutico antes de o seu filho receber Infanrix hexa.
Advertências e precauções
Consulte o seu médico ou farmacêutico antes de o seu filho receber Infanrix hexa:
- se após uma administração anterior de Infanrix hexa ou de outra vacina contra a tosse ferina o seu filho teve qualquer problema, especialmente:
- febre (maior de 40 ºC) nas 48 horas posteriores à vacinação
- colapso ou estado semelhante ao “choque” nas 48 horas seguintes à vacinação
- choro inconsolável, persistente de 3 horas ou mais de duração, produzido nas 48 horas seguintes à vacinação
- ataques com ou sem febre nos 3 dias seguintes à vacinação
- se o seu filho tem uma doença cerebral não diagnosticada ou progressiva ou epilepsia não controlada. A vacina pode ser administrada uma vez controlada a doença
- se o seu filho tem algum problema hemorrágico ou se faz cardenais com facilidade
- se o seu filho tende a padecer ataques quando tem febre, ou se existem antecedentes familiares.
- se o seu filho deixa de responder ou apresenta convulsões (ataques) após a vacinação, contacte imediatamente o seu médico. Ver também secção 4 Posíveis efeitos adversos.
- se o seu bebê nasceu muito prematuramente (às 28 semanas de gestação ou antes) podem ocorrer-lhe pausas entre respirações mais longas do que o normal durante os 2-3 dias após a vacinação. Estes bebês podem requerer monitorização respiratória durante as 48-72 horas seguintes à administração das duas ou três primeiras doses de Infanrix hexa.
Se alguma das situações anteriores afeta o seu filho (ou não está seguro), fale com o seu médico ou farmacêutico antes de o seu filho receber Infanrix hexa.
Uso de Infanrix hexa com outros medicamentos
O seu médico pode pedir-lhe que administre ao seu filho um medicamento que reduza a febre (tal como paracetamol) antes ou imediatamente após a administração de Infanrix hexa. Isso pode ajudar a reduzir alguns dos efeitos adversos (reações febris) de Infanrix hexa.
Informe o seu médico ou farmacêutico se o seu filho está utilizando, utilizou recentemente, poderia ter que utilizar qualquer outro medicamento ou recebeu recentemente qualquer outra vacina.
Infanrix hexa contém neomicina, polimixina, ácido para-aminobenzoico, fenilalanina, sódio e potássio
Esta vacina contém neomicina e polimixina (antibióticos). Informe o seu médico se o seu filho teve uma reação alérgica a estes componentes.
Infanrix Hexa contém ácido para-aminobenzoico. Pode provocar reações alérgicas (possivelmente retardadas), e excepcionalmente broncoespasmo.
Esta vacina contém 0,0298 microgramas de fenilalanina em cada dose. A fenilalanina pode ser prejudicial em caso de padecer fenilcetonúria (FCN), uma doença genética rara em que a fenilalanina se acumula devido a que o organismo não é capaz de eliminá-la corretamente.
Esta vacina contém menos de 1 mmol de sódio (23 mg) por dose; isto é, essencialmente “isento de sódio”.
Esta vacina contém potássio, menos de 1 mmol (39 mg) por dose; isto é, essencialmente “isento de potássio”.
3. Como se administra Infanrix Hexa
Quanto se administra
- O seu filho receberá um total de duas ou três injeções com um intervalo de pelo menos 2 ou 1 mês(s) entre cada injeção.
- O médico ou enfermeiro dir-lhe-á quando deve voltar o seu filho para as próximas injeções.
- O médico informá-lo-á se são necessárias injeções adicionais (doses “de reforço”).
Como se administra a vacina
- Infanrix hexa é injectada num músculo.
- A vacina nunca se deve injectar num vaso sanguíneo nem na pele.
Se o seu filho se perder uma dose
- Se o seu filho se perder uma injeção prevista, é importante que acorde outra consulta.
- Certifique-se de que o seu filho finalize a série de vacinação completa. Em caso contrário, o seu filho poderia não ficar completamente protegido contra as doenças.
4. Possíveis efeitos adversos
Como todos os medicamentos, esta vacina pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Com esta vacina podem ocorrer os seguintes efeitos adversos:
Reações alérgicas
Se o seu filho tiver uma reação alérgica, acuda a um médico imediatamente. Os sinais podem incluir:
- erupções que podem produzir picazão ou vesículas
- inchação dos olhos e da face
- dificuldade em respirar ou em engolir
- baixa repentina da pressão da sangue e perda de consciência.
Estes sinais costumam começar pouco após receber a injeção. Fale com um médico imediatamente se isto ocorrer ao deixar a consulta.
Consulte imediatamente o seu médico se o seu filho tiver algum dos seguintes efeitos adversos graves:
- colapso
- ocasiões em que perde a consciência
- ataques (com ou sem febre).
Estes efeitos adversos ocorreram muito raramente tanto com Infanrix hexa como com outras vacinas contra a tosse ferina. Normalmente produzem-se nos 2 ou 3 dias seguintes à vacinação.
Outros efeitos adversos incluem:
Muito frequentes(podem ocorrer em mais de 1 de cada 10 doses da vacina): sonolência, perda de apetite, temperatura elevada de 38 ºC ou mais, inchação, dor, vermelhidão no local da injeção, choro anormal, sensação de irritabilidade ou inquietude.
Frequentes(podem ocorrer até com 1 de cada 10 doses da vacina): diarreia, vómitos, temperatura elevada de mais de 39,5 ºC, inflamação superior a 5 cm ou endurecimento no local da injeção, sensação de nervosismo.
Pouco frequentes(podem ocorrer até com 1 de cada 100 doses da vacina): infecção do trato respiratório superior, cansaço, tosse, inflamação extensa na extremidade em que se administrou a injeção.
Raros(podem ocorrer até com 1 de cada 1.000 doses da vacina): bronquite, erupção, inchação das glândulas do pescoço, axila e virilha (linfadenopatia), sangramento ou moratões com mais facilidade do que o normal (trombocitopenia), em crianças prematuras (nascidas às 28 semanas de gestação ou antes) os períodos entre respirações podem ser mais longos do que o normal durante os 2-3 dias após a vacinação, parada passageira da respiração (apneia), inflamação da face, lábios, boca, língua ou garganta que pode causar dificuldades para engolir ou respirar (angioedema), inflamação em toda a extremidade onde se aplicou a injeção, vesículas.
Muito raros(podem ocorrer até com 1 de cada 10.000 doses da vacina): picazão (dermatite).
Experiência com a vacina da hepatite B
Em casos extremamente raros foram comunicados os seguintes efeitos adversos com a vacina da hepatite B: paralisia, entorpecimento ou fraqueza dos braços e pernas (neuropatia), inflamação de alguns nervos, possivelmente com formigueiro ou perda de sensibilidade ou movimento normal (Síndrome de Guillian-Barré), inflamação ou infecção do cérebro (encefalopatia, encefalite), infecção ao redor do cérebro (meningite).
Não se estabeleceu a relação causal com a vacina.
O sangramento ou a formação de moratões com mais facilidade do que o normal (trombocitopenia) foram notificados com as vacinas da hepatite B.
Comunicação de efeitos adversos
Se o seu filho experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Infanrix Hexa
- Mantenha esta vacina fora da vista e do alcance das crianças.
- Não utilize esta vacina após a data de validade que aparece no envase. A data de validade é o último dia do mês que se indica.
- Conservar em frigorífico (entre 2 ºC e 8 ºC).
- Conservar no embalagem original para protegê-la da luz.
- Não congelar. A congelação destrói a vacina.
- Os medicamentos não se devem deitar pelos desgoues nem para o lixo. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que o seu filho já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do frasco e informações adicionais
Composição de Infanrix hexa
Os princípios ativos são:
Toxoide diftérico1 não menos de 30 Unidades Internacionais
Toxoide tetânico1 não menos de 40 Unidades Internacionais
Antígenos de Bordetella pertussis
Toxoide pertussóide1 25 microgramas
Hemaglutinina filamentosa1 25 microgramas
Pertactina1 8 microgramas
Antígeno de superfície do vírus da hepatite B2,3 10 microgramas
Vírus da poliomielite (inativados)
tipo 1 (cepa Mahoney)4 40 Unidades de antígeno D
tipo 2 (cepa MEF-1)4 8 Unidades de antígeno D
tipo 3 (cepa Saukett)4 32 Unidades de antígeno D
Polissacarídeo de Haemophilus influenzaetipo b 10 microgramas
(polirribosilribitol fosfato)3
conjugado com toxoide tetânico como proteína transportadora aprox. 25 microgramas
1adsorvido em hidróxido de alumínio hidratado (Al(OH)3) 0,5 miligramas Al3+
2produzido em células de levedura (Saccharomyces cerevisiae) por tecnologia de ADN recombinante
3adsorvido em fosfato de alumínio (AlPO4) 0,32 miligramas Al3+
4propagado em células VERO
Os demais componentes são:
Pó liofilizado de Hib: lactose anidra
Suspensão DTPa-VHB-VPI: cloreto de sódio (NaCl), meio 199 (contendo aminoácidos (incluindo fenilalanina), sais minerais (incluindo sódio e potássio), vitaminas (incluindo ácido para-aminobenzoico) e outras substâncias) e água para preparações injetáveis.
Aspecto do produto e conteúdo do frasco
- O componente antidiftérico, antitetânico, antipertussóide acelular, antihepatite B, antipoliomielítico inativado (DTPa-VHB-VPI) é um líquido branco, ligeiramente leitoso e se apresenta em uma seringa pré-carregada (0,5 ml).
- O componente Hib é um pó liofilizado branco e se apresenta em um frasco de vidro.
- Ambos os componentes se misturam justo antes de que seu filho receba a injeção. O aspecto da mistura é um líquido branco, ligeiramente leitoso.
- Infanrix hexa está disponível em frasco de 1 dose + seringa pré-carregada, tamanhos de embalagens de 1 e 10 com e sem agulhas separadas, e um embalagem múltipla de 5 embalagens, contendo cada uma 10 frascos (1 dose) e 10 seringas pré-carregadas (1 dose), sem agulhas separadas.
- Pode ser que apenas alguns tamanhos de embalagens sejam comercializados.
Título da autorização de comercialização e responsável pela fabricação
GlaxoSmithKline Biologicals s.a.
Rue de l´Institut 89
B-1330 Rixensart
Bélgica
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
Bélgica/Bélgica/ Bélgica GlaxoSmithKline Pharmaceuticals SA/NV Tel: + 32 10 85 52 00 | Lituânia GlaxoSmithKline Biologicals SA Tel: +370 80000334 |
| Luxemburgo/Luxemburgo GlaxoSmithKline Pharmaceuticals SA/NV Tel: + 32 10 85 52 00 |
República Tcheca GlaxoSmithKline s.r.o. Tel: + 420 22 2 00 11 11 | Hungria GlaxoSmithKline Biologicals SA Tel.: +36 80088309 |
Dinamarca GlaxoSmithKline Pharma A/S Tlf.: + 45 36 35 91 00 | Malta GlaxoSmithKline Biologicals SA Tel: +356 80065004 |
Alemanha GlaxoSmithKline GmbH & Co. KG Tel: + 49 (0)89 360448701 | Países Baixos GlaxoSmithKline BV Tel: + 31 (0)33 2081100 |
Estônia GlaxoSmithKline Biologicals SA Tel: +372 8002640 | Noruega GlaxoSmithKline AS Tlf: + 47 22 70 20 00 |
Grécia GlaxoSmithKline Μονοπρ?σωπη A.E.B.E. Τηλ: + 30 210 68 82 100 | Áustria GlaxoSmithKline Pharma GmbH. Tel: + 43 (0)1 97075 0 |
Espanha GlaxoSmithKline, S.A. Tel: + 34 900 202 700 | Polônia GSK Services Sp. z o.o. Tel.: + 48 (22) 576 9000 |
França Laboratoire GlaxoSmithKline Tél: + 33 (0) 1 39 17 84 44 Croácia GlaxoSmithKline Biologicals SA Tel: +385 800787089 | Portugal Smith Kline & French Portuguesa, Produtos Farmacêuticos, Lda. Tel: + 351 21 412 95 00 Romênia GlaxoSmithKline Biologicals SA Tel: +40 800672524 |
Irlanda GlaxoSmithKline (Irlanda) Ltd Tel: + 353 (0)1 495 5000 | Eslovênia GlaxoSmithKline Biologicals SA Tel: +386 80688869 |
Islândia Vistor hf. Sími: +354 535 7000 | República Eslovaca GlaxoSmithKline Biologicals SA. Tel: +421 800500589 |
Itália GlaxoSmithKline S.p.A. Tel:+ 39 (0)45 7741 111 | Finlândia GlaxoSmithKline Oy Puh/Tel: + 358 (0)10 30 30 30 |
Chipre GlaxoSmithKline Biologicals SA Τηλ: +357 80070017 | Suécia GlaxoSmithKline AB Tel: + 46 (0)8 638 93 00 |
Letônia GlaxoSmithKline Biologicals SA Tel: +371 80205045 | Reino Unido (Irlanda do Norte) GlaxoSmithKline Biologicals SA Tel: +44(0)800 221441 |
Data da última revisão deste prospecto:
Outras fontes de informação
A informação detalhada deste medicamento está disponível na página web da Agência Europeia de Medicamentos: https://www.ema.europa.eu/
Na página web da Agência Europeia de Medicamentos pode ser encontrada este prospecto em todas as línguas da União Europeia/Espaço Econômico Europeu.
-------------------------------------------------------------------------------------------------------------------
Esta informação está destinada apenas a profissionais do setor sanitário:
Após o armazenamento, pode ser observado um líquido transparente e um depósito branco na seringa pré-carregada que contém a suspensão DTPa-VHB-VPI. Isso é uma observação normal.
Deve-se agitar bem a seringa pré-carregada para obter uma suspensão branca, turva e homogênea.
A vacina é reconstituída adicionando todo o conteúdo da seringa pré-carregada ao frasco que contém o pó liofilizado. Deve-se agitar bem a mistura até que o pó liofilizado se dissolva completamente antes de sua administração.
A vacina reconstituída aparece como uma suspensão ligeiramente mais turva que o componente líquido sozinho. Isso é uma observação normal.
Deve-se examinar visualmente a suspensão da vacina antes e após a reconstituição para observar se existe alguma partícula estranha e/ou variação do aspecto físico. Se for observada alguma dessas circunstâncias, não administrar a vacina.
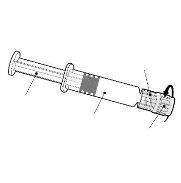
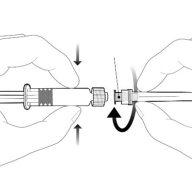
Instruções para a seringa pré-carregada
| Segure a seringa pelo corpo, não pelo êmbolo. Desenrosque a tampa da seringa girando-a no sentido contrário ao das agulhas do relógio. |
| Para inserir a agulha, conecte a base ao adaptador luer-locke gire-o um quarto de volta no sentido das agulhas do relógio até que sinta que se bloqueia. Reconstitua a vacina como indicado acima. Não retire o êmbolo da seringa do corpo. Se isso ocorrer, não administre a vacina. |
Eliminação de resíduos
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele, será realizada de acordo com a normativa local.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a INFANRIX HEXA pó e suspensão para suspensão injetávelForma farmacêutica: INJETÁVEL, 0.5 mLFabricante: Sanofi Winthrop IndustrieRequer receita médicaForma farmacêutica: INJETÁVEL, 0,5 mlFabricante: Sanofi Winthrop IndustrieRequer receita médicaForma farmacêutica: INJETÁVEL, 0.5 mlFabricante: Sanofi Winthrop IndustrieRequer receita médica
Alternativas a INFANRIX HEXA pó e suspensão para suspensão injetável noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a INFANRIX HEXA pó e suspensão para suspensão injetável em Україна
Médicos online para INFANRIX HEXA pó e suspensão para suspensão injetável
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de INFANRIX HEXA pó e suspensão para suspensão injetável – sujeita a avaliação médica e regras locais.