
CINRYZE 500 Unidades Pó e Solvente para Solução Injetável

Pergunte a um médico sobre a prescrição de CINRYZE 500 Unidades Pó e Solvente para Solução Injetável

Como usar CINRYZE 500 Unidades Pó e Solvente para Solução Injetável
Introdução
Prospecto: informação para o utilizador
Cinryze 500 UI pó e solvente para solução injectável
inibidor da esterase C1 humano
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Cinryze e para que é utilizado
- O que precisa saber antes de começar a usar Cinryze
- Como usar Cinryze
- Possíveis efeitos adversos
- Conservação de Cinryze
- Conteúdo do envase e informações adicionais
1. O que é Cinryze e para que é utilizado
Cinryze contém a proteína humana chamada “inibidor da esterase C1” como princípio ativo.
O inibidor da esterase C1 é uma proteína que se produz de forma natural e que normalmente está presente no sangue. Se o nível de inibidor da esterase C1 no sangue for baixo ou o inibidor da esterase C1 não funcionar bem, pode produzir-se um episódio de inchação (chamado angioedema). Os sintomas podem incluir dores de estômago e inchação de:
- mãos e pés
- cara, pálpebras, lábios ou língua
- laringe, que pode fazer com que lhe seja difícil respirar
- genitais
Em adultos e crianças, Cinryze pode aumentar a quantidade do inibidor da esterase C1 no sangue e evitar (antes de se submeter a um procedimento médico ou dental) que se produzam estes episódios de inchação ou detê-los uma vez produzidos.
Em adultos, adolescentes e crianças (de 6 anos de idade e em diante), Cinryze pode aumentar a quantidade de inibidor da esterase C1 no sangue e evitar de forma rotineira que se produzam episódios de inchação.
2. O que precisa saber antes de começar a usar Cinryze
Não use Cinryze
- se for alérgico ao inibidor da esterase C1 humano ou a algum dos outros componentes deste medicamento (incluídos na secção 6). É importante que informe o seu médico se acredita ter tido alguma vez uma reação alérgica a algum dos componentes de Cinryze.
Advertências e precauções
- Antes de iniciar o tratamento com Cinryze, é importante que informe o seu médico se tem, ou teve, problemas de coagulação do sangue (eventos trombóticos). Nesse caso, será vigiado de perto.
- Se começar a apresentar erupções cutâneas, opressão no peito, sibilâncias ou batimento cardíaco rápido uma vez que tenha utilizado Cinryze, informe o seu médico imediatamente. Ver secção 4.
- Quando se elaboram medicamentos a partir de sangue ou plasma humanos, há que tomar certas medidas para prevenir a transmissão de infecções aos pacientes. Entre estas medidas estão a seleção cuidadosa de doadores de plasma e sangue para estar seguros de excluir pessoas com risco de ser portadoras de infecções, e a análise de cada doação e mistura de plasma para detectar sinais de vírus/infecções. Os fabricantes destes produtos também incluem medidas no processamento do sangue ou do plasma que podem inativar e/ou eliminar os vírus. Apesar destas medidas, quando se administram medicamentos elaborados a partir de sangue ou plasma humanos, não se pode descartar por completo a possibilidade de transmitir uma infecção. Isto também é aplicável no caso de vírus desconhecidos ou emergentes, ou de outros tipos de infecções.
- As medidas tomadas são consideradas eficazes para vírus encapsulados, tais como o vírus da imunodeficiência humana (VIH), os vírus da hepatite B e hepatite C, e para os vírus não encapsulados da hepatite A e do parvovirus B19.
- O médico poderá recomendar que considere vacinar-se contra a hepatite A e B se receber habitualmente ou repetidamente produtos do inibidor da esterase C1 humano elaborados a partir de plasma humano.
- Com o objetivo de melhorar a rastreabilidade dos medicamentos biológicos, o médico ou o enfermeiro deve registrar claramente o nome e o número do lote do medicamento administrado.
Crianças
Cinryze não deve ser utilizado em crianças menores de 6 anos de idade para a prevenção de rotina de crises de angioedema.
Uso de Cinryze com outros medicamentos
Informa o seu médico se está a utilizar, utilizou recentemente ou pode ter que utilizar qualquer outro medicamento.
Gravidez e amamentação
Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico antes de utilizar este medicamento. A informação relativa à segurança do uso de Cinryze em mulheres grávidas e em período de amamentação é limitada. O seu médico informá-lo-á sobre os riscos e os benefícios de utilizar este medicamento.
Condução e uso de máquinas
A influência de Cinryze sobre a capacidade para conduzir e utilizar máquinas é pequena.
Cinryze contém sódio
Este medicamento contém 11,5 mg de sódio (componente principal do sal de mesa/para cozinhar) em cada frasco. Isto equivale a 0,5 % da ingestão diária máxima de sódio recomendada para um adulto.
3. Como usar Cinryze
O seu tratamento será iniciado e controlado sob supervisão de um médico com experiência no cuidado de pacientes com angioedema hereditário (AEH).
O seu médico ou enfermeiro poderão preparar e administrar-lhe a injeção de Cinryze. Se o seu médico decidir que si pode auto-administrar o medicamento, o seu médico ou enfermeiro ensinar-lhe-á a si ou a um membro da sua família a preparar e injetar Cinryze. O seu médico reverá periodicamente o processo de preparação e administração com si ou com um membro da sua família ou cuidador.
A dose recomendada de Cinryze para adultos, adolescentes, crianças, idosos ou pacientes com problemas de fígado ou de rim é a seguinte:
Uso em adultos e adolescentes (de 12 anos de idade e em diante)
Tratamento dos episódios de inchação
- Deverá ser injetada uma dose de 1 000 UI (dois frascos) de Cinryze com a aparência do primeiro sinal de um episódio de inchação.
- Poderá ser administrada uma segunda injeção de 1 000 UI se os sintomas não melhorarem após 60 minutos.
- Se apresentar uma crise severa, especialmente inchação da glote (laringe), ou se se retardar o início do tratamento, poderá ser administrada a segunda dose de 1 000 UI antes de que transcorram 60 minutos após a primeira dose, em função da sua resposta clínica.
- Cinryze será administrado por via intravenosa (na veia).
Prevenção rotineira dos episódios de inchação
- Deverá ser injetada uma dose de 1 000 UI (dois frascos) de Cinryze cada 3 ou 4 dias para a prevenção rotineira dos episódios de inchação.
- O seu médico poderá ajustar o intervalo de administração em função da sua resposta a Cinryze.
- Cinryze será administrado por via intravenosa (na veia).
Prevenção pré-operatória dos episódios de inchação
- Deverá ser injetada uma dose de 1 000 UI (dois frascos) de Cinryze até 24 horas antes de uma intervenção médica, dental ou cirúrgica.
- Cinryze será administrado por via intravenosa (na veia).
Uso em crianças
Tratamento das crises de angioedema | Prevenção pré-operatória das crises de angioedema | Prevenção rotineira das crises de angioedema |
2 a 11 anos, > 25kg: Deverá ser injetada uma dose de 1 000 UI (dois frascos) de Cinryze ao primeiro sinal de um episódio de inchação. Poderá ser administrada uma segunda injeção de 1 000 UI se os sintomas não melhorarem transcorridos 60 minutos. 2 a 11 anos, 10 - 25kg: Deverá ser injetada uma dose de 500 UI (um frasco) de Cinryze ao primeiro sinal de um episódio de inchação. Poderá ser administrada uma segunda injeção de 500 UI se os sintomas não melhorarem transcorridos 60 minutos. | 2 a 11 anos, > 25kg: Deverá ser injetada uma dose de 1 000 UI (dois frascos) de Cinryze até 24 horas antes de um procedimento médico, dental ou cirúrgico. 2 a 11 anos, 10 - 25kg: Deverá ser injetada uma dose de 500 UI (um frasco) de Cinryze até 24 horas antes de um procedimento médico, dental ou cirúrgico. | 6 a 11 anos: Deverá ser injetada uma dose de 500 UI (um frasco) de Cinryze cada 3 ou 4 dias para a prevenção rotineira de episódios de inchação. O seu médico pode ajustar o intervalo de administração em função da sua resposta a Cinryze. |
Reconstituição e forma de administração
Normalmente será o seu médico ou enfermeira quem lhe administrará a injeção de Cinryze em uma veia (via intravenosa). Si ou o seu cuidador também poderão encarregar-se da administração de Cinryze em uma injeção, mas apenas após terem recebido a formação adequada. Se administrar Cinryze si mesmo, siga sempre as instruções do seu médico com exatidão. Em caso de dúvida, pergunte ao seu médico. Se o seu médico decidir que si pode receber o tratamento domiciliário, dar-lhe-á instruções detalhadas. Ser-lhe-á pedido que complete um diário para documentar cada tratamento administrado em casa e que o leve a cada uma das consultas com o seu médico. Si/o seu cuidador se submeterão a revisões periódicas da técnica de injeção para se certificar de que manipulam o medicamento adequadamente.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou farmacêutico.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Isto pode incluir reações de tipo alérgico.
Informa o seu médico imediatamentese apresentar algum dos seguintes sintomas após usar este medicamento. Embora seja raro, os sintomas podem ser severos.
Sibilâncias repentinas, dificuldade respiratória, inchação dos párpados, cara ou lábios, erupção cutânea ou picar (especialmente quando afetam o corpo inteiro).
Efeitos adversos muito frequentes (podem afetar mais de 1 de cada 10 pessoas): dor de cabeça, náuseas.
Efeitos adversos frequentes (podem afetar até 1 de cada 10 pessoas): hipersensibilidade, tonturas, vómitos, erupção cutânea, picar ou vermelhidão, erupção ou dor no local de injeção, febre.
Efeitos adversos pouco frequentes (podem afetar até 1 de cada 100 pessoas): níveis altos de açúcar no sangue, coágulos de sangue, dor nas veias, sofocos, tos, dor de estômago, diarreia, descamação da pele, inchação e dor nas articulações, dor muscular e desconforto torácico.
É esperado que os efeitos adversos em crianças e adolescentes sejam semelhantes aos dos adultos.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, si pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Cinryze
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na caixa e nos frascos após “CAD”.
Conservar abaixo de 25 ºC. Não congelar. Conservar no embalagem original para proteger do luz.
Uma vez reconstituído, a solução de Cinryze deve ser utilizada imediatamente.
Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição deCinryze
O princípio ativo é o inibidor da esterase C1 humano elaborado a partir de plasma de doadores humanos. Cada frasco de pó é contém 500 UI de inibidor da esterase C1 humano. Depois da reconstituição, um frasco contém 500 UI de inibidor da esterase C1 humano por 5 ml, o que equivale a uma concentração de 100 UI/ml. Dois frascos de Cinryze reconstituído contêm 1 000 UI de inibidor da esterase C1 humano por 10 ml, o que equivale a uma concentração de 100 UI/ml.
O conteúdo total de proteína da solução reconstituída é de 15 ± 5 mg/ml.
Uma unidade internacional (UI) é equivalente à quantidade de inibidor da esterase C1 presente em 1 ml de plasma humano normal.
Os demais componentes são cloreto de sódio, sacarose, citrato de sódio, valina L, alanina L e treonina L (ver seção 2).
Veículo: água para preparações injetáveis.
Aspecto do produto e conteúdo do envase
Pó e veículo para solução injetável.
Cinryze é um pó branco que vem em um frasco.
Depois de sua dissolução em água para preparações injetáveis, a solução é transparente e incolor a ligeiramente azul.
Cada envase contém:
2 frascos de Cinryze 500 UI pó para solução injetável
2 frascos de água para preparações injetáveis (5 ml cada um)
2 transferidores com filtro
2 seringas descartáveis de 10 ml
2 equipamentos de venopunção
2 protetores
Utilize apenas uma seringa sem silicona (fornecida no envase) para a administração do medicamento.
Título da autorização de comercialização e responsável pela fabricação
Título da autorização de comercialização
Takeda Manufacturing Austria AG
Industriestrasse 67
1221 Viena
Áustria
Fabricação
Takeda Manufacturing Austria AG
Industriestrasse 67
1221 Viena
Áustria
Shire International Licensing B.V.
Mercuriusplein 11
2132 HA Hoofddorp
Países Baixos
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
Bélgica Takeda Belgium NV Tel: +32 2 464 06 11 | Lituânia Takeda, UAB Tel: +370 521 09 070 |
| Luxemburgo Takeda Belgium NV Tel: +32 2 464 06 11 |
República Checa Takeda Pharmaceuticals Czech Republic s.r.o. Tel: +420 234 722 722 | Hungria Takeda Pharma Kft. Tel.: +36 1 270 7030 |
Dinamarca Takeda Pharma A/S Tlf.: +45 46 77 10 10 | Malta Τakeda HELLAS S.A. Tel: +30 210 6387800 |
Alemanha Takeda GmbH Tel: +49 (0)800 825 3325 | Países Baixos Takeda Nederland B.V. Tel: +31 20 203 5492 |
Estônia Takeda Pharma OÜ Tel: +372 6177 669 | Noruega Takeda AS Tlf: +47 800 800 30 |
Grécia Τakeda ΕΛΛΑΣ Α.Ε. Tel: +30 210 6387800 | Áustria Takeda Pharma Ges.m.b.H. Tel: +43 (0) 800-20 80 50 |
Espanha Takeda Farmacéutica España S.A. Tel: +34 917 90 42 22 | Polônia Takeda Pharma Sp. z o.o. Tel.: +48223062447 |
França Takeda France SAS Tel: + 33 1 40 67 33 00 | Portugal Takeda Farmacêuticos Portugal, Lda. Tel: + 351 21 120 1457 |
Croácia Takeda Pharmaceuticals Croatia d.o.o. Tel: +385 1 377 88 96 | Romênia Takeda Pharmaceuticals SRL Tel: +40 21 335 03 91 |
Irlanda Takeda Products Ireland Ltd Tel: 1800 937 970 | Eslovênia Takeda Pharmaceuticals farmacevtska družba d.o.o. Tel: + 386 (0) 59 082 480 |
Islândia Vistor ehf. Sími: +354 535 7000 | Eslováquia Takeda Pharmaceuticals Slovakia s.r.o. Tel: +421 (2) 20 602 600 |
Itália Takeda Italia S.p.A. Tel: +39 06 502601 | Finlândia Takeda Oy Puh/Tel: 0800 774 051 |
Chipre Τakeda ΕΛΛΑΣ Α.Ε. Τηλ: +30 210 6387800 | Suécia Takeda Pharma AB Tel: 020 795 079 |
Letônia Takeda Latvia SIA Tel: +371 67840082 |
Data da última revisão deste prospecto:
Outras fontes de informação
A informação detalhada deste medicamento está disponível no site da Agência Europeia de Medicamentos: https://www.ema.europa.eu. Também existem links para outros sites sobre doenças raras e medicamentos órfãos.
____________________________________________________________________________
Esta informação é destinada apenas a profissionais de saúde:
Reconstituição e administração de Cinryze
A reconstituição, administração do produto e manipulação do equipamento de administração e das agulhas devem ser realizadas com cautela.
Utilize o transferidor com filtro que vem com Cinryze ou uma agulha de dupla ponta comercialmente disponível.
Utilize apenas uma seringa sem silicona (fornecida no envase) para a administração do medicamento.
Preparação e manipulação
Cinryze é indicado para administração intravenosa (na veia) após a reconstituição com água para preparações injetáveis.
O frasco de Cinryze é apenas para uso único.
Reconstituição
Para uma dose de 500 UI: é necessário 1 frasco de pó, 1 frasco de veículo, 1 transferidor com filtro, 1 seringa descartável de 10 ml, 1 equipamento de venopunção e 1 protetor. Guarde o frasco restante e o equipamento para a administração para a próxima dose.
Para uma dose de 1 000 UI: são necessários 2 frascos de pó, 2 frascos de veículo, 2 transferidores com filtro, 1 seringa descartável de 10 ml, 1 equipamento de venopunção e 1 protetor.
Deve-se reconstituir cada frasco de produto com 5 ml de água para preparações injetáveis.
Um frasco de Cinryze reconstituído corresponde a uma dose de 500 UI. Portanto, reconstitua apenas um frasco de Cinryze para uma dose de 500 UI.
Dois frascos de Cinryze reconstituído correspondem a uma dose de 1 000 UI. Portanto, para uma dose de 1 000 UI, combinam-se dois frascos.
- Trabalhe sobre o protetor fornecido e lave as mãos antes de realizar os seguintes procedimentos.
- Utilize uma técnica asséptica durante o procedimento de reconstituição.
- Certifique-se de que o frasco do pó e o frasco do veículo estejam à temperatura ambiente (15 ºC – 25 ºC).
- Retire a etiqueta do frasco do pó despregando a tira roxa que indica a seta.
- Retire os selos dos frascos de pó e de veículo.
- Limpe os tampões com um paninho desinfetante e deixe-os secar antes de usar.
- Retire o selo da parte superior do envase do transferidor. Não retire o dispositivo do envase.
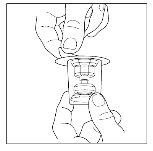
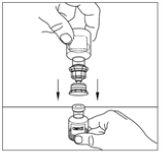
- Nota: o transferidor deve ser acoplado ao frasco do veículo antes de ser acoplado ao frasco do pó, para que não se perca o vácuo no frasco de pó. Coloque o frasco do veículo sobre uma superfície plana e insira o extremo azul do transferidor no frasco do veículo, empurrando-o para dentro até que o ponto penetre pelo centro do tampão do frasco do veículo e o dispositivo encaixe no lugar. O transferidor deve estar na vertical antes de penetrar o tampão.
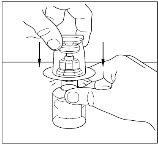
- Retire o selo do transferidor e descarte-o. Tenha cuidado para não tocar o extremo exposto do transferidor.
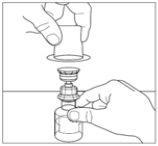
- Coloque o frasco do pó sobre uma superfície plana. Inverta o transferidor e o frasco do veículo que contém a água para preparações injetáveis, e insira o extremo transparente do transferidor no frasco do pó, empurrando-o para dentro até que o ponto penetre o tampão de borracha e o transferidor encaixe no lugar. O transferidor deve estar na vertical antes de penetrar o tampão do frasco do pó. O vácuo do frasco do pó extrairá o veículo. Se o frasco não tiver vácuo, não utilize o produto.
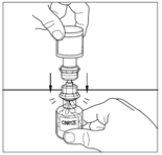
- Mova cuidadosamente o frasco do pó até que esteja bem dissolvido. Não agite o frasco do pó. Certifique-se de que se dissolveu bem todo o pó.
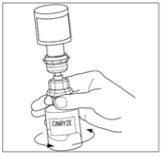
- Desconecte o frasco do veículo girando-o para a esquerda. Não retire o extremo transparente do transferidor do frasco do pó.
Um frasco de Cinryze reconstituído contém 500 UI do inibidor da esterase C1 humano em 5 ml, o que produz uma concentração de 100 UI/ml. Passe para o processo de administração se os pacientes receberem uma dose de 500 UI.
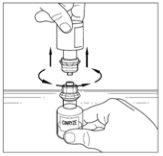
Devem ser reconstituídos dois frascos de pó de Cinryze para fazer uma dose (1 000 UI/10 ml). Portanto, será necessário repetir os passos 1 a 12 anteriores, utilizando um novo envase com um transferidor para reconstituir o segundo frasco de pó. Não reutilize o mesmo transferidor. Uma vez que os dois frascos tenham sido reconstituídos, passe para o processo de administração para uma dose de 1 000 UI.
Processo de administração para uma dose de 500 UI
- Deve utilizar uma técnica asséptica durante o procedimento de administração.
- Depois da reconstituição, as soluções de Cinryze são incolores a ligeiramente azuis e transparentes. Não utilize o produto se as soluções estiverem turvas ou tingidas.
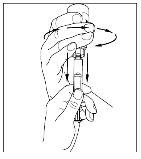
- Com uma seringa estéril e descartável de 10 ml, puxe o êmbolo para que entre aproximadamente 5 ml de ar na seringa.
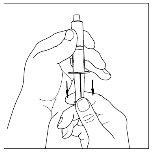
- Acople a seringa à parte superior do extremo transparente do transferidor girando-o para a direita.
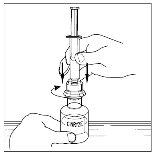
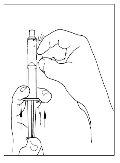
- Inverta com cuidado o frasco e injete ar na solução e, em seguida, extraia lentamente a solução reconstituída de Cinryze para a seringa.
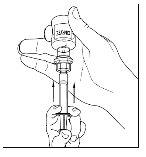
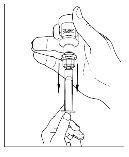
- Desconecte a seringa do frasco girando-o para a esquerda e soltando-o do extremo transparente do transferidor.
- Antes da administração, inspecione a solução reconstituída de Cinryze para verificar se apresenta partículas. Não utilize o medicamento se observar partículas.
- Acople o equipamento de venopunção à seringa que contém a solução de Cinryze e administre a injeção por via intravenosa (na veia) ao paciente. Administre 500 UI (reconstituídas em 5 ml de água para preparações injetáveis) de Cinryze por injeção intravenosa a uma velocidade de 1 ml por minuto durante 5 minutos.
Processo de administração para uma dose de 1 000 UI
- Deve utilizar uma técnica asséptica durante o procedimento de administração.
- Depois da reconstituição, as soluções de Cinryze são incolores a ligeiramente azuis e transparentes. Não utilize o produto se as soluções estiverem turvas ou tingidas.
- Com uma seringa estéril e descartável de 10 ml, puxe o êmbolo para que entre aproximadamente 5 ml de ar na seringa.
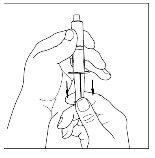
- Acople a seringa à parte superior do extremo transparente do transferidor girando-o para a direita.
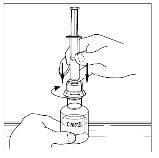
- Inverta com cuidado o frasco e injete ar na solução e, em seguida, extraia lentamente a solução reconstituída de Cinryze para a seringa.
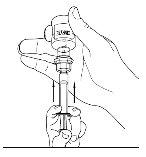
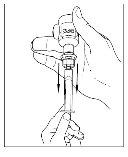
- Desconecte a seringa do frasco girando-o para a esquerda e soltando-o do extremo transparente do transferidor.
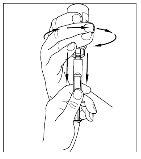
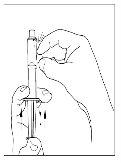
- Utilizando a mesma seringa, repita os passos 3 a 6 com o segundo frasco de Cinryze reconstituído para fazer uma dose completa de 10 ml.
- Antes da administração, inspecione a solução reconstituída de Cinryze para verificar se apresenta partículas. Não utilize o medicamento se observar partículas.
- Acople o equipamento de venopunção à seringa que contém a solução de Cinryze e administre a injeção por via intravenosa (na veia) ao paciente. Administre 1 000 UI (reconstituídas em 10 ml de água para preparações injetáveis) de Cinryze por injeção intravenosa (na veia) a uma velocidade de 1 ml por minuto durante 10 minutos.
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a regulamentação local.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a CINRYZE 500 Unidades Pó e Solvente para Solução InjetávelForma farmacêutica: INJETÁVEL, 1500 UISubstância ativa: c1-inhibitor, plasma derivedFabricante: Csl Behring GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 2000 UISubstância ativa: c1-inhibitor, plasma derivedFabricante: Csl Behring GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 3000 UISubstância ativa: c1-inhibitor, plasma derivedFabricante: Csl Behring GmbhRequer receita médica
Alternativas a CINRYZE 500 Unidades Pó e Solvente para Solução Injetável noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a CINRYZE 500 Unidades Pó e Solvente para Solução Injetável em Polónia
Alternativa a CINRYZE 500 Unidades Pó e Solvente para Solução Injetável em Ukraine
Médicos online para CINRYZE 500 Unidades Pó e Solvente para Solução Injetável
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de CINRYZE 500 Unidades Pó e Solvente para Solução Injetável – sujeita a avaliação médica e regras locais.















