

CABLIVI 10 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Pergunte a um médico sobre a prescrição de CABLIVI 10 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Como usar CABLIVI 10 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Introdução
Prospecto: informação para o utilizador
Cablivi 10 mg pó e dissolvente para solução injetável
caplacizumab
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi-lhe prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Cablivi e para que é utilizado
- O que necessita de saber antes de começar a usar Cablivi
- Como usar Cablivi
- Posíveis efeitos adversos
- Conservação de Cablivi
- Conteúdo do envase e informação adicional
1. O que é Cablivi e para que é utilizado
Cablivi contém o princípio ativo caplacizumab. É utilizado para tratar um episódio de púrpura trombocitopénica trombótica adquiridaem adultos e adolescentes a partir de 12 anos que pesam pelo menos 40 kg. Este é um distúrbio raro da coagulação do sangue em que se formam coágulos nos vasos sanguíneos pequenos. Estes coágulos podem bloquear os vasos sanguíneos e danificar o cérebro, o coração, os rins ou outros órgãos. Cablivi previne a formação destes coágulos de sangue ao impedir que as plaquetas do sangue se agrupem. Deste modo, Cablivi reduz o risco de sofrer outro episódio de púrpura trombocitopénica trombótica adquirida (PTTa) pouco depois do primeiro.
2. O que necessita de saber antes de começar a usar Cablivi
Não use Cablivi
- se é alérgico a caplacizumab ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
Advertências e precauções
Informa ao seu médico se:
- sangra excessivamente ou experimenta sintomas incomuns como dor de cabeça, dificuldade para respirar, cansaço ou desmaio que podem indicar um sangramento interno grave. O seu médico pode pedir-lhe que suspenda o tratamento. O médico dir-lhe-á quando pode começar o seu tratamento de novo.
- está a usar medicamentos que previnem ou tratam os coágulos sanguíneos como warfarina, heparina, rivaroxabán, apixabán. O seu médico decidirá como deve ser tratado.
- está a usar antiplaquetários como aspirina ou heparina de baixo peso molecular (que previnem a formação de coágulos sanguíneos). O seu médico decidirá como deve ser tratado.
- tem um distúrbio hemorrágico, como hemofilia. O seu médico decidirá como deve ser tratado.
- tem a função do fígado diminuída gravemente. O seu médico decidirá como deve ser tratado.
- vai ser submetido a uma operação ou tratamento dentário. O seu médico decidirá se pode ser adiado ou se deve ser suspenso Cablivi antes da cirurgia ou do tratamento dentário.
Crianças e adolescentes
Não se recomenda Cablivi em crianças menores de 12 anos e de menos de 40 kg de peso corporal.
Outros medicamentos e Cablivi
Informa ao seu médico ou farmacêutico se está a utilizar, utilizou recentemente ou pode ter que utilizar qualquer outro medicamento.
Também informa ao seu médico se está a usar medicamentos anticoagulantes como antagonistas da vitamina K, rivaroxabán ou apixabán, para o tratamento dos coágulos sanguíneos, ou antiplaquetários como aspirina ou heparina de baixo peso molecular, que previnem os coágulos sanguíneos.
Gravidez e amamentação
Informa ao seu médico se está grávida ou tem intenção de ficar grávida. Não se recomenda Cablivi durante a gravidez.
Informa ao seu médico se está em período de amamentação. O seu médico aconselhar-lhe-á se é necessário interromper a amamentação ou não usar Cablivi, tendo em conta o benefício da amamentação para o bebê e o benefício de Cablivi para si.
Condução e uso de máquinas
Não se espera que Cablivi influencie a capacidade para conduzir ou utilizar máquinas.
Cablivi contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por dose; isto é, é essencialmente “isento de sódio”.
3. Como usar Cablivi
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico ou farmacêutico. Em caso de dúvida, consulte de novo o seu médico ou farmacêutico.
O tratamento com Cablivi é iniciado por um médico com experiência em distúrbios sanguíneos.
O tratamentorecomendado é
- primeira dose
- 1 frasco injetado em uma veia por um profissional de saúde
- o medicamento será administrado antes de começar o intercâmbio de plasma.
- doses subsequentes
- 1 frasco uma vez ao dia como injeção subcutânea (debaixo da pele do abdômen)
- a injeção subcutânea será administrada após cada intercâmbio de plasma diário
- após o término do intercâmbio de plasma diário, o tratamento com Cablivi continuará por pelo menos 30 dias com uma injeção de 1 frasco uma vez ao dia
- o seu médico pode pedir-lhe que continue o tratamento diário até que se resolvam os sinais subjacentes da sua doença.
O seu médico pode decidir que você ou o seu cuidador ponham a injeção de Cablivi. Neste caso, o seu médico ou profissional de saúde treinará você ou o seu cuidador sobre como usar Cablivi.
Instruções de uso
A primeira injeção de Cablivi na sua veia deve ser administrada por um profissional de saúde. As instruções para os profissionais de saúde sobre como injetar Cablivi na veia encontram-se no final do prospecto.
Para cada injeção, use um envase novo para preparar a solução da injeção. Não tente pôr a injeção de Cablivi até que um profissional de saúde lhe tenha ensinado como fazer.
Paso 1- Limpeza
- Lave bem as mãos com água e sabão.
- Prepare uma superfície limpa e plana para colocar o conteúdo do envase.
- Certifique-se de ter à mão um recipiente para resíduos.
Paso 2 -Antes de usar
- Certifique-se de que o envase esteja completo.
- Verifique a data de validade. Não o use após a data de validade.
- Não use o envase se os componentes que contém estiverem danificados de alguma forma.
- Coloque todos os componentes do envase sobre a superfície limpa e plana.
- Se o envase não foi conservado à temperatura ambiente, espere até que o frasco e a seringa atinjam a temperatura ambiente (15 °C – 25 °C) deixando-os à temperatura ambiente durante alguns minutos. Não os aqueça de nenhuma outra forma.
Paso 3- Desinfecção do batoque de borracha
- Retire a tampa abatível de plástico do frasco. Não use o frasco se faltar a tampa de plástico verde.
- Limpe o batoque de borracha exposto com uma das toalhetas com álcool fornecidas e deixe que seque durante alguns segundos.
- Depois de limpá-lo, não toque no batoque de borracha nem deixe que toque em qualquer superfície.
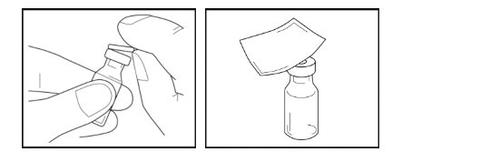
Paso 4- Colocação do adaptador
- Pegue o adaptador do frasco envasado e retire a cobertura de papel. Deixe o adaptador no envase de plástico aberto. Não toque no adaptador.
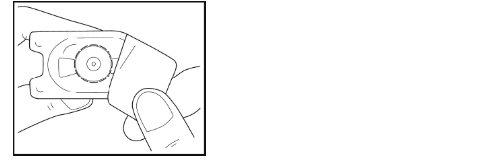
- Coloque o adaptador sobre o frasco, enquanto mantém o adaptador no seu envase de plástico.
- Pressione firmemente para baixo até que o adaptador encaixe no lugar, com a ponta do adaptador atravessando o batoque do frasco. Deixe o adaptador conectado ao frasco, todaviano seu envase exterior.
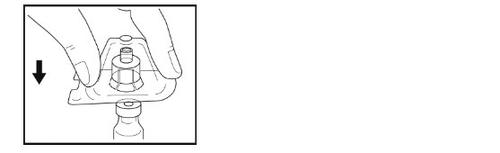
Paso 5- Preparação da seringa
- Segurando a seringa na sua mão, quebre a tampa branca com a outra mão.
- Não use a seringa se a tampa branca faltar, estiver solta ou estiver danificada.
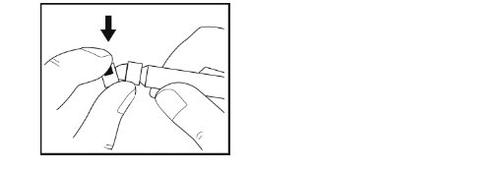
- Não toquena ponta da seringa nem deixe que toque em qualquer superfície.
- Coloque a seringa sobre a superfície limpa e plana.
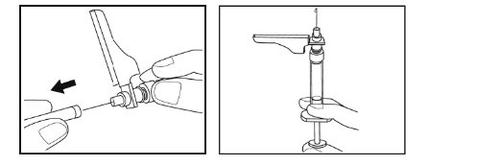
Paso 6– Conexão da seringa com o adaptador e o frasco
- Pegue o frasco com o adaptador conectado.
- Retire o envase de plástico do adaptador segurando o frasco com uma mão, pressionando os lados do envase do adaptador com a outra mão e luego levantando o envase para cima. Tenha cuidado para que o adaptador não saia do frasco.
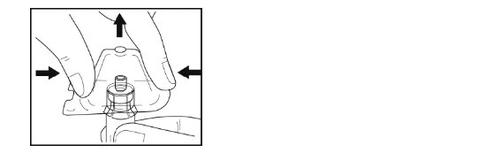
- Segure com uma mão o adaptador com o frasco conectado. Coloque a ponta da seringa na parte do conector do adaptador do frasco.
- Fixe suavemente a seringa no frasco girando-a no sentido dos ponteiros do relógio até que note resistência.
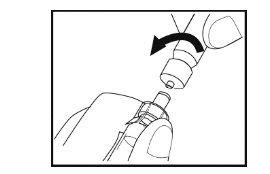
Paso 7- Preparação da solução
- Mantenha o frasco verticalmente na superfície com a seringa para baixo.
- Empurre lentamente o êmbolo da seringa para baixo até que a seringa esteja vazia. Não retire a seringa do frasco.
- Com a seringa ainda conectada ao adaptador do frasco, gire suavemente o frasco com a seringa conectada até que se dissolva o pó. Evite que se forme espuma. Não agiteo frasco.
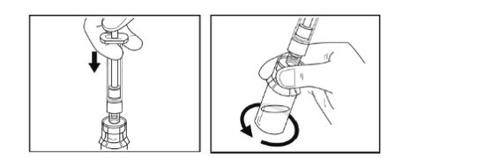
- Deixe que o frasco com a seringa conectada permaneça na superfície durante 5 minutosà temperatura ambiente para permitir que a solução se dissolva completamente. O êmbolo pode levantar-se por si só de novo; isto é normal.
- Vá para o passo 8 imediatamente após estes 5 minutos.
Paso 8- Extração da solução
- Verifique se a soluçãotem partículas. Deve ter-se dissolvido todo o pó e a solução deve ser transparente.
- Pressione lentamente o êmbolo da seringa totalmente para baixo.
- Gire por completo para baixo o frasco, o adaptador e a seringa.
- Enquanto o mantém na vertical, puxe lentamente o êmbolo para pôr toda a solução na seringa. Não o agite.

Paso 9 – Preparação da seringa para a administração
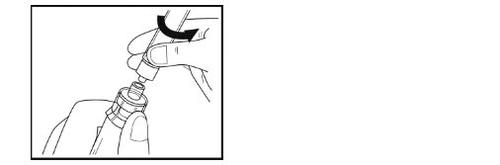
- Gire por completo para cima o frasco, o adaptador e a seringa (com a seringa na parte superior). Desconecte a seringa cheia do adaptador segurando o adaptador com uma mão e girando suavemente a seringa no sentido contrário ao dos ponteiros do relógio.
- Coloque o frasco e o adaptador conectado no recipiente para resíduos fornecido.
- Não toquena ponta da agulha nem permita que toque em qualquer superfície. Coloque a seringa sobre a superfície limpa e plana.
- Vá para o passo 10 para injetar caplacizumab debaixo da pele do abdômen. As instruções para os profissionais de saúde sobre como injetar Cablivi na veia encontram-se no final do prospecto.
Paso 10 -Inserção da agulha
- Retire a agulha quebrando a cobertura de papel do envase da agulha e retirando a agulha com a tampa protetora.
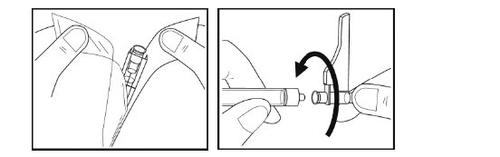
- Sem retirar o capuchão da agulha, insira a agulha na seringa girando no sentido dos ponteiros do relógio até que note resistência.
- Tire para trás o protetor de segurança da agulha.
- Verifique o conteúdo da seringa. Não utilize o medicamento se observar que está turvo, há grumos ou qualquer outra coisa que não pareça normal. Entre em contato com o seu médico ou pessoal de enfermagem se isto acontecer.
Paso 11- Preparação do local da injeção para a injeção debaixo da pele
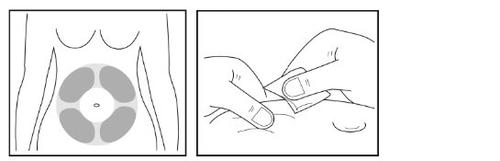
- Selecione um local apropriado (“local da injeção”) no seu abdômen para a injeção debaixo da pele.
Evite a área ao redor do umbigo. Selecione um local de injeção diferente do que usou no dia anterior para que a pele possa se recuperar após a injeção.
- Use a segunda toalheta com álcool para limpar o local da injeção que tenha escolhido.
Paso 12- Administração
- Retire com cuidado a tampa de proteção da agulha e jogue-a fora. Certifique-se de que a agulha não toque em nada antes da injeção.
- Mantenha a seringa ao nível dos olhos com a agulha apontando para cima.
- Elimine as bolhas de ar batendo o lado da seringa com o seu dedo para que as bolhas subam até a ponta. Em seguida, empurre lentamente o êmbolo até que saia uma pequena quantidade de líquido da agulha.
- Pegue suavemente a pele limpa entre os dedos polegar e índice para fazer um dobra.
- Mantenha este dobra da pele durante toda a injeção.
- Insira toda a agulha no dobra da pele com um ângulo como mostrado na ilustração.
- Pressione o êmbolo para baixo todo o que puder.

- Tire da agulha com o mesmo ângulo como a inseriu. Não friccione o local da injeção.
Paso 13- Após a administração
- Imediatamente após a injeção, coloque o protetor de segurança da agulha sobre a agulha, até que encaixe no lugar.
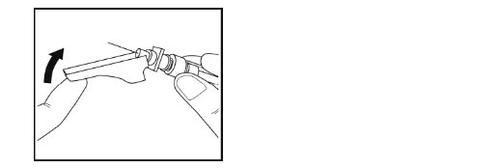
- Coloque a seringa com a agulha em um recipiente para resíduos.
Se usar mais Cablivi do que deve
Uma sobredose é pouco provável, já que um frasco contém apenas uma dose única. Informe ao seu médico se acredita que tenha tido uma sobredose.
Se esquecer de usar Cablivi
Se esquecer de uma dose, deve administrá-la se não passaram mais de 12 horas desde a hora programada. Se passaram mais de 12 horas desde que a dose deveria ter sido administrada, não administre a dose esquecida, mas injete a próxima dose à hora habitual.
Se interromper o tratamento com Cablivi
Para obter o maior benefício do seu tratamento, é importante usar Cablivi conforme foi prescrito e durante o tempo que o seu médico indicar que o use. Informe ao seu médico antes de suspender o tratamento, pois se o suspender muito cedo pode fazer com que a sua doença reapareça.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou farmacêutico.
4. Posíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Entre em contato como seu médicoimediatamentese ocorrer algum dos seguintes efeitos adversos graves.
Sangramento prolongado ou excessivo.
O seu médico pode decidir mantê-lo sob uma observação mais estreita ou mudar o seu tratamento.
Os efeitos adversos em um estudo clínico foram notificados com as seguintes frequências:
Muito frequentes:podem afetar mais de 1 em cada 10 pessoas
- sangramento das gengivas
- febre
- cansaço
- dor de cabeça
- sangramentos nasais
- erupção cutânea
Frequentes:podem afetar até 1 em cada 10 pessoas
sangramento ocular
- vômitos com sangue
- sangue nas fezes
- fezes negras e alcatrão
- sangramento do estômago
- hemorroides sangrantes
- sangramento retal
- reações no local da injeção: erupção, coceira e sangramento
- sangramento cerebral demonstrado por fortes dores de cabeça de início rápido, vômitos, diminuição do nível de consciência, febre, às vezes convulsões e rigidez de pescoço ou dor de pescoço
- dor muscular
- acidente cerebrovascular (AVC)
- sangue na urina
- sangramento excessivo durante os períodos
- sangramento vaginal
- tosse com sangue
- falta de ar
- equimose
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Espanhol de Farmacovigilância de medicamentos de Uso Humano: https://www.notificaram.es. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Cablivi
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na etiqueta e no envase após CAD/EXP. A data de validade é o último dia do mês que se indica.
Conservar em frigorífico (entre 2 ºC e 8 ºC). Não congelar.
Conservar no envase original para protegê-lo da luz.
Cablivi pode ser conservado a uma temperatura não superior a 25 °C durante um período único de até 2 meses, mas não após a data de validade. Cablivi não deve ser novamente conservado refrigerado após ter sido conservado a temperatura ambiente. Não exponha nunca a temperaturas superiores a 30 °C.
Não utilize Cablivi se observar partículas ou alteração do colorido antes da administração.
Os medicamentos não devem ser jogados pelos deságues nem na lixeira. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Conteúdo de Cablivi
- pó do frasco
- O princípio ativo é caplacizumab.
Cada frasco contém 10 mg de caplacizumab.
- Os demais componentes são sacarose, ácido cítrico anidro, citrato trissódico dihidratado (ver seção 2 “Cablivi contém sódio”) e polissorbato 80.
- seringa pré-carregada
A seringa pré-carregada contém 1 ml de água para preparações injetáveis.
Aspecto de Cablivi e conteúdo do envase
Cablivi é fornecido como:
- um pó branco para solução injetável em um frasco de vidro, e
- água para preparações injetáveis em uma seringa pré-carregada para dissolver o pó.
Depois de dissolver o pó no dissolvente, a solução é transparente, incolor ou ligeiramente amarelada.
Cablivi está disponível em
- envases individuais que contêm 1 frasco com pó de caplacizumab, 1 seringa pré-carregada com dissolvente, 1 adaptador para o frasco, 1 agulha e 2 toalhetas com álcool
- envases múltiplos que contêm 7 envases individuais
- envases multidose que contêm 7 frascos com pó de caplacizumab, 7 seringas pré-carregadas com dissolvente, 7 adaptadores para os frascos, 7 agulhas e 14 toalhetas com álcool.
Pode ser que apenas alguns tamanhos de envases sejam comercializados.
Titular da autorização de comercialização e Responsável pela fabricação
Ablynx NV
Technologiepark 21
9052 Zwijnaarde
Bélgica
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização.
Bélgica Sanofi Belgium Tel: +32 (0)2 710 54 00 | Lituânia Swixx Biopharma UAB Tel: +370 5 236 91 40 |
| Luxemburgo Sanofi Belgium Tel: +32 (0)2 710 54 00 (Bélgica) |
República Checa Sanofi s.r.o. Tel: +420 233 086 111 | Hungria SANOFI-AVENTIS Zrt. Tel.: +36 1 505 0050 |
Dinamarca Sanofi A/S Tlf: +45 45 16 70 00 | Malta Sanofi S.r.l. Tel: +39 02 39394275 |
Alemanha Sanofi-Aventis Deutschland GmbH Tel.: 0800 04 36 996 Tel. do exterior: +49 69 305 70 13 | Países Baixos Sanofi B.V. Tel: +31 20 245 4000 |
Estônia Swixx Biopharma OÜ Tel: +372 640 10 30 | Noruega sanofi-aventis Norge AS Tlf: +47 67 10 71 00 |
Grécia sanofi-aventis Μονοπρ?σωπη AEBE Τηλ: +30 210 900 16 00 | Áustria sanofi-aventis GmbH Tel: +43 1 80 185 – 0 |
Espanha sanofi-aventis, S.A. Tel: +34 93 485 94 00 | Polônia Sanofi Sp. z o.o. Tel.: +48 22 280 00 00 |
França Sanofi Winthrop Industrie Tél: 0 800 222 555 Chamada do exterior: +33 1 57 63 23 23 | Portugal Sanofi - Produtos Farmacêuticos, Lda. Tel: +351 21 35 89 400 |
Croácia Swixx Biopharma d.o.o. Tel: +385 1 2078 500 | Romênia Sanofi Romania SRL Tel: +40 (0) 21 317 31 36 |
Irlanda sanofi-aventis Ireland Ltd. T/A SANOFI Tel: +353 (0) 1 403 56 00 | Eslovênia Swixx Biopharma d.o.o. Tel: +386 1 235 51 00 |
Islândia Vistor hf. Sími: +354 535 7000 | Eslováquia Swixx Biopharma s.r.o. Tel: +421 2 208 33 600 |
Itália Sanofi S.r.l. Tel: 800 536389 | Finlândia Sanofi Oy Puh/Tel: +358 (0) 201 200 300 |
Chipre C.A. Papaellinas Ltd. Τηλ: +357 22 741741 | Suécia Sanofi AB Tel: +46 (0)8 634 50 00 |
Letônia Swixx Biopharma SIA Tel: +371 6 616 47 50 | Reino Unido (Irlanda do Norte) sanofi-aventis Ireland Ltd. T/A SANOFI Tel: +44 (0) 800 035 2525 |
Data da última revisão deste prospecto:
A informação detalhada sobre este medicamento está disponível no site da Agência Europeia de Medicamentos: http://www.ema.europa.eu/
--------------------------------------------------------------------------------------------------------------------
Esta informação é destinada apenas a profissionais do setor sanitário:
A injeção em bolo intravenosa de Cablivi administrada no início do tratamento deve ser administrada por um profissional sanitário. A preparação de uma dose de Cablivi para injeção intravenosa deve ser feita da mesma maneira que para uma injeção subcutânea (consulte as Instruções de uso, passo 1 a 9, na seção 3).
Cablivi pode ser administrado por via intravenosa conectando a seringa preparada a conexões Luer lock padrão de linhas intravenosas ou usando uma agulha adequada. A linha pode ser lavada com solução injetável de cloreto de sódio 9 mg/ml (0,9 %).
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a CABLIVI 10 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 1,5 mgSubstância ativa: fondaparinuxFabricante: Viatris Healthcare LimitedRequer receita médicaForma farmacêutica: INJETÁVEL, 2,5 mgSubstância ativa: fondaparinuxFabricante: Viatris Healthcare LimitedRequer receita médicaForma farmacêutica: INJETÁVEL, 5 mgSubstância ativa: fondaparinuxFabricante: Viatris Healthcare LimitedRequer receita médica
Médicos online para CABLIVI 10 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de CABLIVI 10 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL – sujeita a avaliação médica e regras locais.















