APRETUDE 600 mg SUSPENSÃO INJETÁVEL DE LIBERTAÇÃO PROLONGADA

Pergunte a um médico sobre a prescrição de APRETUDE 600 mg SUSPENSÃO INJETÁVEL DE LIBERTAÇÃO PROLONGADA

Como usar APRETUDE 600 mg SUSPENSÃO INJETÁVEL DE LIBERTAÇÃO PROLONGADA
Introdução
Prospecto: informação para o paciente
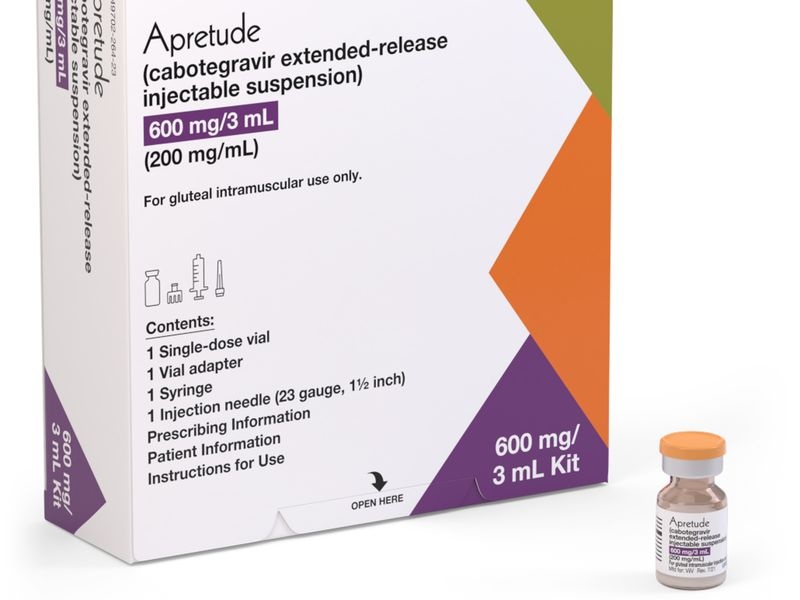
Apretude 600 mg suspensão injetável de libertação prolongada
cabotegravir
Este medicamento está sujeito a acompanhamento adicional, o que agilizará a detecção de nova informação sobre a sua segurança. Pode contribuir comunicando os efeitos adversos que possa ter. A parte final da seção 4 inclui informação sobre como comunicar estes efeitos adversos.
Leia todo o prospecto detenidamente antes de começar a usar este medicamento, porque contém informação importante para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou enfermeiro.
- Se experimentar efeitos adversos, consulte o seu médico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver seção 4.
Conteúdo do prospecto
- O que é Apretude e para que se utiliza
- O que precisa saber antes de que lhe administrem Apretude
- Como se administra Apretude
- Efeitos adversos possíveis
- Conservação de Apretude
- Conteúdo do envase e informação adicional
1. O que é Apretude e para que se utiliza
Apretude contém cabotegravir como princípio ativo. Cabotegravir pertence a um grupo de medicamentos antirretrovirais chamados inibidores da integrase (INI).
Apretude é usado para ajudar a prevenir a infecção por VIH-1 em adultos e adolescentes que pesam pelo menos 35 kg e apresentam um maior risco de infecção. Isto é denominado profilaxia pré-exposição: PrEP(ver seção 2).
Deve ser usado em combinação com práticas sexuais mais seguras, como o uso de preservativos.
2. O que precisa saber antes de que lhe administrem Apretude
Não use Apretude
- se já desenvolveu uma erupção cutânea grave, descamação da pele, bolhas e/ou úlceras na boca.
- se é alérgico(hipersensível) a cabotegravir ou a algum dos outros componentes deste medicamento (incluídos na seção 6).
- Se é VIH positivoou não sabe se é VIH positivo. Apretude só pode ajudar a reduzir o risco de adquirir VIH antes de se infectar. Deve fazer o testepara garantir que é VIH negativo antes de tomar Apretude.
- se está tomando algum dos seguintes medicamentos:
- carbamazepina, oxcarbazepina, fenitoína, fenobarbital(medicamentos para tratar a epilepsia e prevenir as convulsões).
- rifampicina ou rifapentina(medicamentos para tratar algumas infecções bacterianas, como a tuberculose).
Estes medicamentos reduzem a eficácia de Apretude ao diminuir a quantidade de Apretude no sangue.
Se achar que isto o afeta, ou se não tiver certeza, informe o seu médico.
Advertências e precauções
O uso de Apretude por si só pode não prevenir a infecção por VIH.
A infecção por VIH é transmitida por contacto sexual com alguém VIH positivo ou por transferência de sangue infectada. Embora Apretude reduza o risco de infecção, ainda pode contrair o VIH, apesar de estar a receber este medicamento.
Devem ser adotadas outras medidas para reduzir ainda mais o risco de infecção por VIH:
- Faça testespara outras doenças de transmissão sexual quando o seu médico o indicar. Estas infecções tornam mais fácil que possa se infectar com VIH.
- Use preservativosquando praticar sexo oral ou com penetração.
- Não compartilhe nem reutilize agulhas ou outro instrumental de injeção ou utensílios médicos.
- Não compartilhe artigos pessoais que possam conter sangue ou fluidos corporais (como lâminas de barbear ou escovas de dentes).
Consulte com o seu médico sobre quais precauções adicionais são necessárias para diminuir ainda mais o risco de infecção por VIH.
Reduza o risco de infecção por VIH:
Existe um certo risco de desenvolver resistência a este medicamento se se infectar com o VIH. Isto significa que o medicamento pode não o proteger de se infectar com o VIH. Para minimizar este risco e prevenir a infecção por VIH, é importante que:
- assista às suas consultas agendadaspara receber a injeção de Apretude. Informe o seu médico se está a pensar em interromper o tratamento, pois isto pode aumentar o risco de contrair uma infecção por VIH. Se deixar de receber a sua injeção de Apretude ou se atrasar, precisará tomar outros medicamentos ou precauções para reduzir o risco de infecção por VIH e possivelmente desenvolver resistência viral.
- faça o teste de VIHquando o seu médico o indicar. Deve fazer o teste regularmente para garantir que continua a ser VIH-1 negativo enquanto recebe Apretude.
- informe imediatamente o seu médicose achar que pode ter-se infectado com o VIH (pode ter uma doença semelhante à gripe). É possível que lhe seja necessário fazer mais testes para garantir que continua a ser VIH negativo.
Apretude injetável é um medicamento de ação prolongada
Se deixar de se injetar Apretude, cabotegravir pode permanecer no seu organismo até mais de um ano após a última injeção, mas isto não seria suficiente para protegê-lo de uma possível infecção.
É importante que assista às suas consultas agendadas para receber as injeções de Apretude. Fale com o seu médico se está a pensar em deixar a PrEP.
Uma vez que interrompa Apretude injetável, pode precisar tomar outros medicamentos para reduzir o risco de contrair uma infecção por VIH ou utilizar outras precauções como relações sexuais seguras.
Problemas hepáticos
Informe o seu médico se tiver problemas hepáticos. É possível que precise ser controlado mais de perto. (Ver também ‘Efeitos adversos pouco frequentes’ na seção 4).
Adolescentes
O seu médico falará com você sobre a sua saúde mental antes e enquanto receber Apretude. Informe o seu médico se tiver problemas de saúde mental. É possível que precise ser controlado mais de perto (Ver também a seção 4).
Reação cutânea grave
Foram notificadas muito raramente reações cutâneas graves, síndrome de Stevens-Johnson e necrólise epidérmica tóxica, em associação com Apretude. Se notar algum dos sintomas relacionados com estas reações cutâneas graves, não receba a próxima injeção de Apretude e procure atendimento médico imediatamente.
Leia a informaçãoda seção 4 deste prospecto (“Efeitos adversos possíveis”).
Reações alérgicas
Apretude contém cabotegravir, que é um inibidor da integrase. Os inibidores da integrase, incluindo cabotegravir, podem causar uma reação alérgica grave conhecida como reação de hipersensibilidade. Precisa conhecer quais são os sinais e sintomas importantes a que deve prestar atenção enquanto recebe Apretude.
Leia a informaçãoem ‘Efeitos adversos possíveis’ na seção 4 deste prospecto.
Crianças e adolescentes
Este medicamento não deve ser utilizado por crianças e adolescentes que pesem menos de 35 kg, pois não foi estudado nestes utilizadores.
Outros medicamentos e Apretude
Informe o seu médico se está a tomar, tomou recentemente ou possa tomar qualquer outro medicamento, incluindo outros medicamentos comprados sem prescrição.
Alguns medicamentos podem afetar o funcionamento de Apretude ou aumentar a probabilidade de que sofra efeitos adversos. Apretude também pode afetar a forma como outros medicamentos funcionam.
Apretude não deve ser administradocom outros medicamentos que possam afetar a eficácia do medicamento (ver ‘Não use Apretude’ na seção 2). Entre os que se incluem:
- carbamazepina, oxcarbazepina, fenitoína, fenobarbital(medicamentos para tratar a epilepsia e prevenir as convulsões).
- rifampicina ou rifapentina(medicamentos para tratar algumas infecções bacterianas, como a tuberculose).
Informe o seu médicose está a tomar:
- rifabutina(para tratar algumas infecções bacterianas, como a tuberculose). Pode precisar receber injeções de Apretude com maior frequência.
Informe o seu médico ou farmacêuticose está a tomar este medicamento. O seu médico pode decidir que precisa de controles adicionais.
Gravidez e amamentação
Se está grávida ou em período de amamentação, acha que pode estar grávida ou tem intenção de engravidar, consulte o seu médico antes de utilizar este medicamento.
Gravidez
Apretude não é recomendado durante a gravidez. Desconhece-se o efeito de Apretude sobre a gravidez. Consulte o seu médico: se pode estar grávida, se planeia ter um bebê ou se engravidar. Não pare de assinar as consultas para receber Apretude sem consultar o seu médico. O seu médico considerará o benefício para si e o risco para o seu bebê antes de começar a utilizar/continuar a utilizar Apretude.
Amamentação
Desconhece-se se os componentes de Apretude podem passar para o leite materno. No entanto, é possível que cabotegravir possa passar para o leite materno durante os 12 meses seguintes à última injeção de Apretude. Se está a amamentar ou pensa em amamentar, consulte o seu médico. O seu médico considerará o benefício e o risco de amamentar para si e o seu bebê.
Condução e uso de máquinas
Apretude pode causar-lhe tonturas e ter outros efeitos adversos que o façam estar menos atento.
Não conduza nem maneje máquinasa menos que esteja seguro de que não o afeta.
3. Como se administra Apretude
Este medicamento é administrado sob a forma de injeção de 600 mg. Um enfermeiro ou médico lhe administrará Apretude no músculo da sua nádega.
Deve fazer um teste de detecção do VIH e dar negativoantes de receber Apretude.
Receberá a sua primeira e segunda dose de Apretude com um mês de diferença. Após a segunda dose, receberá uma única injeção de Apretude cada 2 meses.
Antes de começar o tratamento com Apretude injetável, si e o seu médico podem decidir iniciar primeiro o tratamento com cabotegravir comprimidos (denominado período de indução oral). O período de indução oral permite-lhe a si e ao seu médico avaliar se é apropriado passar para as injeções.
Se decidir começar o tratamento com os comprimidos:
- Deve tomar um comprimido de Apretude de 30 mg uma vez ao dia, durante aproximadamente um mês.
- Deve receber a sua primeira injeção no mesmo dia que tomar o último comprimido ou como máximo 3 dias depois.
- Depois, receberá uma injeção cada 2 meses.
Esquema de injeção para a dosagem cada 2 meses
Quando | Que medicamento |
Primeira e segunda injeção, com um mês de diferença | Apretude 600 mg |
Terceira injeção em diante, cada dois meses | Apretude 600 mg |
Se lhe administrarem mais Apretude injetável do que deve
Este medicamento será administrado por um médico ou enfermeiro, por isso é pouco provável que lhe sejam administrados de mais. Se estiver preocupado, consulte o médico ou enfermeiro e receberá o tratamento necessário.
Se não assistir à consulta para receber uma injeção de Apretude
Entre em contato com o seu médico imediatamentepara agendar uma nova consulta.
É importante que vá às consultas agendadas habituais para receber a sua injeção e reduzir o risco de contrair VIH (ver seção 2). Fale com o seu médico se está a pensar em interromper Apretude.
Fale com o seu médico se achar que não vai poder receber a sua injeção de Apretude com a frequência habitual. O seu médico pode recomendar que tome cabotegravir comprimidos em seu lugar, até que possa receber a sua injeção de Apretude novamente.
Não deixe de receber injeções de Apretude sem o conselho do seu médico.
Continue a receber injeções de Apretude tanto tempo quanto o seu médico o recomendar. Não o deixe a menos que o seu médico o indique. Se interromper o tratamento e ainda estiver em risco de contrair o VIH, o seu médico deve iniciar um tratamento com outro medicamento para a PrEP durante os 2 meses posteriores à sua última injeção de Apretude.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou farmacêutico.
4. Efeitos adversos possíveis
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Não receba a próxima injeção de Apretude e procure atendimento médico imediatamentese notar algum dos seguintes sintomas:
- manchas vermelhas não elevadas, em forma de alvo ou circulares no tronco, muitas vezes com bolhas no centro, descamação da pele, úlceras na boca, garganta, nariz, genitais e olhos. Estas erupções cutâneas graves podem ser precedidas de febre e sintomas semelhantes aos da gripe (síndrome de Stevens-Johnson, necrólise epidérmica tóxica). Estas reações cutâneas graves são muito raras (podem afetar até 1 de cada 10000pessoas).
Reações alérgicas
Apretude contém cabotegravir, que é um inibidor da integrase. Os inibidores da integrase, incluindo cabotegravir, podem causar uma reação alérgica grave conhecida como reação de hipersensibilidade.
Se sofrer algum dos seguintes sintomas:
- reação cutânea
- temperatura elevada (febre)
- falta de energia (fadiga)
- inchaço, por vezes da face ou boca (angioedema), que pode causar dificuldade para respirar
- dores musculares ou articulares.
Procure atendimento médico imediatamente.O seu médico pode considerar necessário realizar testes para controlar o seu fígado, rins ou sangue e pode indicar que deixe de tomar Apretude.
Efeitos adversos muito frequentes(podem afetar mais de 1 de cada 10 pessoas)
- dor de cabeça
- diarreia
- reações no local da injeção
- muito frequentes: dor (que em raras ocasiões pode incluir dificuldade temporária ao caminhar) e desconforto, uma massa ou nódulo endurecido
- frequentes: vermelhidão (eritema), picazón (prurito), inchaço, calor, entorpecimento (anestesia) ou hematomas, (que podem incluir decoloração ou acumulação de sangue debaixo da pele)
- pouco frequentes: acumulação de pus (abscesso)
- sensação de calor (pirexia)
- alterações na função hepática (aumento das transaminases), medidas nos análises de sangue.
Efeitos adversos frequentes(podem afetar até 1 de cada 10 pessoas)
- depressão
- ansiedade
- sonhos anormais
- dificuldade para dormir (insónia)
- tonturas
- sentir-se doente (náuseas)
- vómitos
- dor de estômago (dor abdominal)
- gases (flatulência)
- erupção
- dor muscular (mialgia)
- falta de energia (fadiga)
- desconforto geral.
Efeitos adversos pouco frequentes(podem afetar até 1 de cada 100 pessoas)
- tentativa de suicídio e pensamentos suicidas (especialmente em utilizadores com antecedentes de depressão ou problemas de saúde mental)
- reação alérgica (hipersensibilidade)
- urticária
- inchaço, por vezes da face ou boca (angioedema), que pode causar dificuldade para respirar
- sensação de sonolência (sonolência)
- aumento de peso
- sensação de tontura, durante ou após uma injeção (reações vasovagais). Isto pode levar a desmaios
- danos hepáticos (hepatotoxicidade). Os sinais podem incluir coloração amarelada da pele e do branco dos olhos, perda de apetite, picazón, sensibilidade estomacal, fezes de cor clara ou urina anormalmente escura
- aumento da bilirrubina no sangue, um produto de degradação dos glóbulos vermelhos, medido nos análises de sangue.
Comunicação de efeitos adversos
Se experimentar algum tipo de efeito adverso, consulte o seu médico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informação sobre a segurança deste medicamento.
5. Conservação de Apretude
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na etiqueta e na caixa após CAD. A data de validade é o último dia do mês que se indica.
O médico ou enfermeiro é responsável por conservar este medicamento corretamente.
Não congele.
6. Conteúdo do envase e informação adicional
Composição de Apretude
- O princípio ativo é cabotegravir
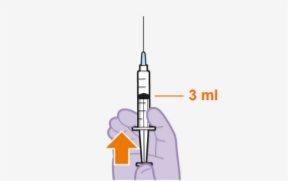
Cada frasco de 3 ml contém 600 mg de cabotegravir.
Os outros componentes são:
Manitol (E421)
Polissorbato 20 (E432)
Macrogol (E1521)
Água para preparações injetáveis
Aspecto do produto e conteúdo do envase
Cabotegravir é uma suspensão de cor branca a rosa claro, que se apresenta em um frasco de vidro cor topázio com tampa de borracha e um selo de alumínio com uma tampa abatível de plástico.
Título da autorização de comercialização
ViiV Healthcare BV
Van Asch van Wijckstraat 55H,
3811 LP Amersfoort
Países Baixos
Responsável pela fabricação
GlaxoSmithKline Manufacturing S.p.A.
Strada Provinciale Asolana 90
Torrile
PR
43056
Itália
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do título da autorização de comercialização:
Bélgica/Bélgica/Bélgica ViiV Healthcare srl/bv Tel: + 32 (0) 10 85 65 00 | Lituânia ViiV Healthcare BV Tel: + 370 80000334 |
Bulgária ViiV Healthcare BV Tel: + 359 80018205 | Luxemburgo/Luxemburgo ViiV Healthcare srl/bv Bélgica/Bélgica Tel: + 32 (0) 10 85 65 00 |
República Checa GlaxoSmithKline, s.r.o. Tel: + 420 222 001 111 | Hungria ViiV Healthcare BV Tel: + 36 80088309 |
Dinamarca GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00 | Malta ViiV Healthcare BV Tel: + 356 80065004 |
Alemanha ViiV Healthcare GmbH Tel: + 49 (0)89 203 0038-10 | Países Baixos ViiV Healthcare BV Tel: + 31 (0) 33 2081199 |
Estônia ViiV Healthcare BV Tel: + 372 8002640 | Noruega GlaxoSmithKline AS Tlf: + 47 22 70 20 00 |
Grécia GlaxoSmithKline Μονοπρóσωπη A.E.B.E. Τηλ: + 30 210 68 82 100 | Áustria GlaxoSmithKline Pharma GmbH Tel: + 43 (0)1 97075 0 |
Espanha Laboratorios ViiV Healthcare, S.L. Tel: + 34 900 923 501 | Polônia GSK Services Sp. z o.o. Tel: + 48 (0)22 576 9000 |
França ViiV Healthcare SAS Tel: + 33 (0)1 39 17 69 69 | Portugal VIIVHIV HEALTHCARE, UNIPESSOAL, LDA Tel: + 351 21 094 08 01 |
Croácia ViiV Healthcare BV Tel: + 385 800787089 | Romênia ViiV Healthcare BV Tel: + 40 800672524 |
Irlanda GlaxoSmithKline (Irlanda) Limited Tel: + 353 (0)1 4955000 | Eslovênia ViiV Healthcare BV Tel: + 386 80688869 |
Islândia Vistor hf. Sími: +354 535 7000 | República Eslovaca ViiV Healthcare BV Tel: + 421 800500589 |
Itália ViiV Healthcare S.r.l Tel: + 39 (0)45 7741600 | Finlândia GlaxoSmithKline Oy Puh/Tel: + 358 (0)10 30 30 30 |
Chipre ViiV Healthcare BV Τηλ: + 357 80070017 | Suécia GlaxoSmithKline AB Tel: + 46 (0)8 638 93 00 |
Letônia ViiV Healthcare BV Tel: + 371 80205045 | Reino Unido (Irlanda do Norte) ViiV Healthcare BV Tel: + 44 (0)800 221441 |
Data da última revisão deste prospecto:{MM/AAAA}.
Outras fontes de informação
A informação detalhada sobre este medicamento está disponível no site da Agência Europeia de Medicamentos: http://www.ema.europa.eu
Esta informação é destinada apenas a profissionais de saúde:
| |
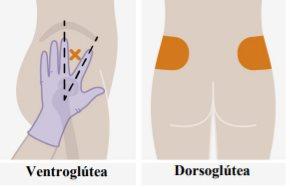
Descrição geral Em cada visita, é necessária uma injeção; 3 ml de cabotegravir (600 mg). Cabotegravir é uma suspensão que não precisa de diluição ou reconstituição adicional. Cabotegravir é apenas para uso intramuscular. Deve ser administrado na zona glútea. Nota:Recomenda-se a zona ventroglútea. | |
Informação de conservação | |
Nãocongelar. | |
Para preparar a injeção | |
| |
Para administrar a injeção | |
Observe a constituição do paciente e o critério médico para escolher a longitude de agulha apropriada. | |
Também necessitará | |
| |
Preparação | |
| |
|
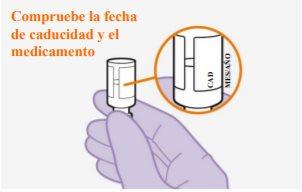
Não utilizese passou a data de validade
Nota:O frasco de cabotegravir é de vidro cor topázio. |
| |
|
|
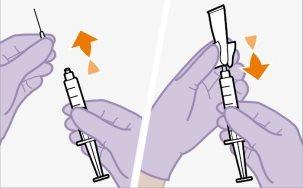
Não permitaque nada toque a tampa de borracha após limpá-la. | |
| |
|
|
| |
|
|
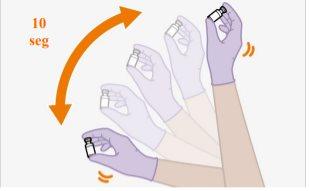
Nota:Verifique se a suspensão parece uniforme e de cor branca a rosa claro. | |
| |
|
|
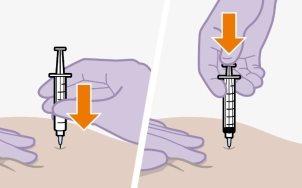
Injeção | |
| |
| As injeções devem ser administradas nos glúteos. Escolha entre as seguintes zonas para a injeção:
|
Nota:Apenas para uso intramuscular glúteo. Nãoo injete por via intravenosa. | |
| |
|
|
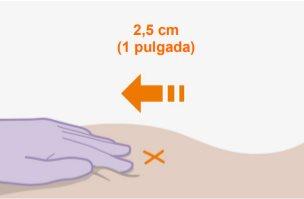
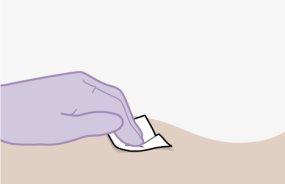
Nota:Limpe a zona de injeção com uma toalheta impregnada em álcool. Deixe que a pele seque ao ar antes de continuar. | |
| |
|
|
| |
|
|
| |
|
Nãomassageie a zona. |
Perguntas e respostas | |
Deve esperar pelo menos 15 minutos antes de administrar a injeção para que o medicamento atinja a temperatura ambiente. O ideal é deixar que o frasco atinja a temperatura ambiente naturalmente. No entanto, pode usar o calor das suas mãos para acelerar o tempo de aquecimento, mas certifique-se de que o frasco não ultrapasse os 30°C. Não utilize nenhum outro método de aquecimento.
O ideal é injetar o medicamento (a temperatura ambiente) o mais rápido possível após extrair. No entanto, o medicamento pode permanecer na seringa até 2 horas antes de injetá-lo. Se o medicamento permanecer na seringa por mais de 2 horas, a seringa cheia e a agulha devem ser descartadas.
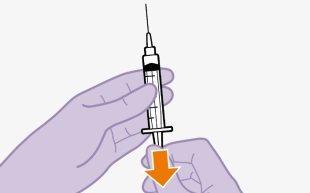
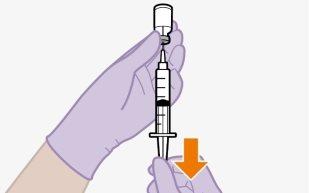
Injetar 1 ml de ar no frasco facilita a extração da dose com a seringa. Sem o ar, parte do líquido pode retornar ao frasco sem querer, deixando menos medicamento do que o previsto na seringa.
Recomenda-se a administração na zona ventroglútea, no músculo glúteo médio, porque está mais afastada dos principais nervos e vasos sanguíneos. Também é aceitável a administração na zona dorsoglútea, no músculo glúteo maior, se assim o preferir o profissional de saúde. A injeção não deve ser administrada em nenhuma outra zona. |
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a APRETUDE 600 mg SUSPENSÃO INJETÁVEL DE LIBERTAÇÃO PROLONGADAForma farmacêutica: COMPRIMIDO, 30 mgSubstância ativa: cabotegravirFabricante: Viiv Healthcare B.V.Requer receita médicaForma farmacêutica: COMPRIMIDO, 30 mgSubstância ativa: cabotegravirFabricante: Viiv Healthcare B.V.Requer receita médicaForma farmacêutica: INJETÁVEL, 600 mgSubstância ativa: cabotegravirFabricante: Viiv Healthcare B.V.Requer receita médica
Alternativas a APRETUDE 600 mg SUSPENSÃO INJETÁVEL DE LIBERTAÇÃO PROLONGADA noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a APRETUDE 600 mg SUSPENSÃO INJETÁVEL DE LIBERTAÇÃO PROLONGADA em Ukraine
Médicos online para APRETUDE 600 mg SUSPENSÃO INJETÁVEL DE LIBERTAÇÃO PROLONGADA
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de APRETUDE 600 mg SUSPENSÃO INJETÁVEL DE LIBERTAÇÃO PROLONGADA – sujeita a avaliação médica e regras locais.