
Varilrix
Pergunte a um médico sobre a prescrição de Varilrix

Como usar Varilrix
Folheto informativo: informação para o utilizador
VARILRIX, pó e diluente para solução injectável em seringa pré-cheia
Seringa
Vacina contra varicela (viva)
Deve ler atentamente o conteúdo do folheto antes de administrar a vacina, pois contém informações importantes para o doente.
- Deve conservar este folheto para que possa relê-lo se necessário.
- Em caso de dúvidas, deve consultar um médico, farmacêutico ou enfermeiro.
- A vacina foi prescrita para uma pessoa específica. Não deve ser transmitida a outros.
- Se o doente apresentar algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Ver ponto 4.
Índice do folheto:
- 1. O que é a vacina Varilrix e para que é utilizada
- 2. Informações importantes antes de administrar a vacina Varilrix
- 3. Como administrar a vacina Varilrix
- 4. Efeitos não desejados
- 5. Como conservar a vacina Varilrix
- 6. Conteúdo do pacote e outras informações
1. O que é a vacina Varilrix e para que é utilizada
A vacina Varilrix é utilizada em pessoas com idade a partir de 12 meses para prevenir a varicela. Em alguns casos, a vacina Varilrix também pode ser administrada a bebés com idade a partir de 9 meses.
Como funciona a vacina Varilrix
Após a vacinação com a vacina Varilrix, o sistema imunológico do doente (sistema de defesa natural do organismo) produz anticorpos que protegem contra a infecção pelo vírus da varicela.
2. Informações importantes antes de administrar a vacina Varilrix
Quando não administrar a vacina Varilrix
- se o doente sofre de alguma doença (como doenças do sangue, cancro, infecção por vírus da imunodeficiência humana (HIV) ou síndrome da imunodeficiência adquirida (AIDS)) ou está a tomar algum medicamento (incluindo grandes doses de corticosteroides) que possa enfraquecer o sistema imunológico. Se o doente receber a vacina, depende do nível da sua imunidade. Ver ponto 2
“Precauções e advertências”.
- se o doente já apresentou alguma reação alergica a algum componente da vacina (listado no ponto 6). Os sintomas de alergia incluem erupção cutânea pruriginosa, dificuldade em respirar, inchaço do rosto ou língua.
- se o doente já apresentou sintomas de sensibilidade ao neomicina (antibiótico). A dermatite de contacto (erupção cutânea em caso de contacto direto da pele com alérgenos, como a neomicina) não é contraindicação para a administração da vacina, mas deve ser consultado um médico.
- se o doente já apresentou sintomas de sensibilidade após a administração da vacina contra a varicela.
- se estiver grávida. Além disso, deve evitar a gravidez durante um mês após a vacinação.
Precauções e advertências
Antes de administrar a vacina Varilrix, deve discutir com o médico, farmacêutico ou enfermeiro:
- se o doente apresentar doença grave com febre. Pode ser necessário adiar a vacinação até que o doente se recupere. Infecção leve, como um resfriado, não deve ser motivo para adiar a vacinação, mas deve ser consultado um médico.
- se o doente tiver sistema imunológico enfraquecido devido a uma doença (como infecção por HIV) e/ou tratamento. O doente deve ser submetido a uma vigilância rigorosa, pois a resposta à vacina pode não ser suficiente para proteger contra a doença (ver ponto 2 “Quando não administrar a vacina Varilrix”).
- se o doente tiver tendência para sangramento ou formação de hematomas.
Após ou mesmo antes da administração de qualquer vacina injectável, pode ocorrer síncope (especialmente em adolescentes). Neste caso, deve informar o médico ou enfermeiro se o doente já apresentou síncope durante a administração de uma injeção.
Assim como com outras vacinas, a Varilrix pode não proteger completamente todos os indivíduos vacinados contra a varicela. No entanto, em indivíduos vacinados, o curso da doença é geralmente muito mais leve do que em indivíduos não vacinados.
Em casos raros, a forma atenuada do vírus pode ser transmitida de uma pessoa vacinada para outra. Isso geralmente ocorre quando a pessoa vacinada tem vesículas ou bolhas. Em pessoas saudáveis infectadas desta forma, geralmente aparece apenas uma erupção cutânea leve, que não é prejudicial.
Após a vacinação, a pessoa adulta ou criança deve, se possível, evitar o contacto próximo durante um período de até 6 semanas com as seguintes pessoas:
- pessoas com sistema imunológico enfraquecido;
- mulheres grávidas que nunca tiveram varicela ou nunca foram vacinadas contra a varicela;
- recém-nascidos de mães que nunca tiveram varicela ou nunca foram vacinadas contra a varicela.
Varilrix e outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que está a tomar atualmente ou recentemente, mesmo que sejam medicamentos de venda livre, bem como vacinas, e também sobre medicamentos que planeia tomar.
Deve informar o médico se está planeado realizar um teste de tuberculina no doente.
Se o teste for realizado dentro de 6 semanas após a vacinação com a vacina Varilrix, o resultado pode não ser fiável.
Em pessoas que receberam imunoglobulinas humanas ou que receberam transfusão de sangue, a vacinação deve ser adiada por um período de pelo menos 3 meses.
Durante 6 semanas após a administração da vacina Varilrix, deve evitar a ingestão de aspirina ou outros salicilatos (substâncias encontradas em alguns medicamentos utilizados para reduzir a febre e aliviar a dor), pois pode causar uma doença grave chamada síndrome de Reye, que pode afetar negativamente todos os órgãos do corpo.
A vacina Varilrix pode ser administrada ao mesmo tempo que outras vacinas. Diferentes vacinas devem ser injectadas em diferentes locais do corpo.
Gravidez, amamentação e fertilidade
A vacina Varilrix não deve ser administrada a mulheres grávidas.
Se a paciente estiver grávida ou amamentando, suspeita que possa estar grávida ou planeia ter um filho, deve consultar um médico ou farmacêutico antes de tomar esta vacina. Além disso, é importante que a paciente não fique grávida durante um mês após a vacinação. Neste período, deve utilizar um método anticoncepcional eficaz para evitar a gravidez.
Deve informar o médico se a paciente está amamentando ou planeia amamentar. O médico decidirá se a paciente pode ser vacinada com a vacina Varilrix.
Condução de veículos e utilização de máquinas
A vacina Varilrix não tem efeito ou tem um efeito insignificante na capacidade de conduzir veículos e utilizar máquinas. No entanto, alguns dos efeitos não desejados mencionados no ponto 4 “Efeitos não desejados” podem afetar temporariamente a capacidade de conduzir veículos e utilizar máquinas.
Varilrix contém sorbitol e fenilalanina
3. Como administrar a vacina Varilrix
A vacina Varilrix deve ser injectada subcutânea ou intramuscularmente, no braço superior ou na coxa externa.
Pessoas com idade a partir de 12 meses devem receber 2 doses da vacina Varilrix, com um intervalo de pelo menos 6 semanas. O intervalo entre a primeira e a segunda dose não podeser inferior a 4 semanas.
Em alguns casos, a primeira dose da vacina Varilrix pode ser administrada a bebés com idade a partir de 9 meses até 11 meses (inclusive). Nesses casos, devem ser administradas 2 doses da vacina, com um intervalo de pelo menos 3 meses.
Em pessoas com risco aumentado de varicela grave, ou seja, aquelas que estão a receber tratamento contra o cancro, pode ser necessário administrar doses adicionais da vacina. O intervalo entre as doses não podeser inferior a 4 semanas.
O número de doses e o momento da administração serão determinados pelo médico com base nas recomendações oficiais.
Administração de uma dose maior da vacina Varilrix do que a recomendada
A administração de uma dose maior da vacina Varilrix do que a recomendada é muito improvável, pois a vacina é fornecida em uma ampola com uma dose única e é administrada por um médico ou enfermeiro. Foram relatados alguns casos de administração acidental da vacina, e apenas em alguns deles foram observados sintomas anormais, como sonolência e convulsões.
Omissão da administração de uma dose subsequente da vacina Varilrix
Deve contactar o médico, que decidirá se é necessário administrar uma dose subsequente da vacina e determinará o momento da administração.
4. Efeitos não desejados
Como qualquer medicamento, a vacina Varilrix pode causar efeitos não desejados, embora não em todos os doentes.
Após a vacinação, podem ocorrer os seguintes efeitos não desejados:
- Muito frequentes (podem ocorrer em pelo menos 1 em cada 10 doentes):
- dor e vermelhidão no local da injeção
- Frequentes (podem ocorrer em menos de 1 em cada 10 doentes):
- erupção cutânea (vesículas e/ou bolhas)
- inchaço no local da injeção da vacina*
- febre de 38°C ou superior (medida no recto)*
- Pouco frequentes (podem ocorrer em menos de 1 em cada 100 doentes):
- infecção das vias respiratórias superiores
- dor de garganta e desconforto ao engolir (faringite)
- increção do tamanho dos gânglios linfáticos
- irritabilidade
- dor de cabeça
- sonolência
- tosse
- coriza, nariz entupido ou picado, espirros (rinite)
- náuseas
- vômitos
- erupção cutânea semelhante à varicela
- prurido
- dor nas articulações
- dor muscular
- febre superior a 39,5°C (medida no recto)
- fadiga
- mau-estar geral
- Raros (podem ocorrer em menos de 1 em cada 1000 doentes):
- conjuntivite
- dor abdominal
- diarreia
- erupção cutânea pruriginosa e elevada (urticária)
* Inchaço no local da injeção e febre podem ocorrer muito frequentemente em jovens e adultos. O inchaço pode ocorrer também muito frequentemente após a administração da segunda dose em crianças com menos de 13 anos.
Efeitos não desejados relatados raramente após a comercialização da vacina Varilrix:
- herpes zóster.
- pequenos sangramentos locais ou facilidade de formação de hematomas devido à redução do número de plaquetas.
- reações alérgicas (alergias). Este estado pode manifestar-se como erupção cutânea pruriginosa ou bolhosa, inchaço dos olhos e face, dificuldade em respirar ou engolir, queda súbita da pressão arterial e perda de consciência. Estas reações podem ocorrer ainda antes de o doente deixar o consultório médico. Se o doente apresentar algum destes sintomas, deve procurar imediatamente um médico.
infecção ou inflamação do cérebro, medula espinhal e nervos periféricos, resultando em dificuldades transitórias de marcha e/ou perda transitória de coordenação motora, acidente vascular cerebral (lesão cerebral devido à interrupção do fluxo sanguíneo).
- convulsões ou ataques epilépticos.
- inflamação, estreitamento ou obstrução dos vasos sanguíneos. Pode incluir sangramento anormal ou hematomas sob a pele (púrpura de Schönlein-Henoch) ou febre que dura mais de cinco dias com erupção cutânea no tronco, seguida por vezes de descamação da pele nas mãos e dedos, vermelhidão dos olhos, boca, garganta e língua (doença de Kawasaki).
- eritema multiforme (sintomas incluem placas vermelhas, frequentemente pruriginosas, semelhantes à erupção cutânea da sarampo, que aparecem nos membros e, por vezes, no rosto e outras partes do corpo).
Notificação de efeitos não desejados
Se o doente apresentar algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos da Agência Nacional de Medicamentos e Produtos de Saúde:
Av. República, 37
1050-187 Lisboa
Telefone: 213 012 400
Fax: 213 014 890
Sítio da internet: https://www.infarmed.pt
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos não desejados permite reunir mais informações sobre a segurança do medicamento.
5. Como conservar a vacina Varilrix
A vacina deve ser conservada em local não visível e inacessível às crianças.
Não deve ser utilizada após o prazo de validade impresso na embalagem. O prazo de validade (EXP) refere-se ao último dia do mês indicado.
Deve ser conservada e transportada a uma temperatura de 2°C a 8°C.
Deve ser conservada na embalagem original para proteger da luz.
A vacina deve ser administrada imediatamente após a reconstituição.
Se não for possível, a vacina reconstituída pode ser conservada durante 90 minutos a uma temperatura ambiente (25°C) ou durante 8 horas no frigorífico (a uma temperatura de 2°C a 8°C). Se a vacina reconstituída não for utilizada dentro do prazo recomendado ou não for conservada nas condições recomendadas, deve ser eliminada.
Os medicamentos não devem ser eliminados na canalização ou nos contentores de resíduos domésticos. Deve perguntar ao farmacêutico como eliminar os medicamentos que já não são utilizados. Este procedimento ajudará a proteger o ambiente.
6. Conteúdo do pacote e outras informações
O que contém a vacina Varilrix
- O princípio ativo da vacina é o vírus da varicela vivo e atenuado (cepa Oka, cultivado em células diploides humanas da linha MRC-5). Cada dose da vacina (0,5 ml) após reconstituição contém não menos de 10 UIF (unidade formadora de placas) do vírus da varicela.
- Os outros componentes da vacina são: Pó: aminoácidos (incluindo fenilalanina), lactose anidra, sorbitol (E 420), manitol (E 421). Diluente: água para injeção.
Como é a vacina Varilrix e o que contém o pacote
A Varilrix é apresentada como pó e diluente para solução injectável (pó em uma ampola de dose única e 0,5 ml de diluente em uma seringa pré-cheia).
Tamanho do pacote: 1x1, 10x1, 10x10.
A Varilrix tem a forma de um pó ligeiramente cremoso a amarelado ou rosado e um diluente claro e incolor (água para injeção), que devem ser utilizados para reconstituir a vacina.
Titular da autorização de comercialização e fabricante
GlaxoSmithKline Biologicals S.A.
rue de l’Institut 89
1330 Rixensart, Bélgica
Para obter informações mais detalhadas sobre esta vacina, deve contactar o representante local do titular da autorização de comercialização.
GSK Services, Unip. Lda.
Av. da República, 37
1050-187 Lisboa
Telefone: 213 012 400
Este medicamento está autorizado nos estados-membros do Espaço Económico Europeu sob as seguintes denominações:
| Estado-membro | Denominação |
| Alemanha, Áustria, Bélgica, Dinamarca, Eslováquia, Eslovénia, Espanha, Estónia, Finlândia, França, Grécia, Hungria, Irlanda, Itália, Letónia, Lituânia, Luxemburgo, Malta, Países Baixos, Polónia, Portugal, Reino Unido, República Checa, Suécia | VARILRIX |
Data da última revisão do folheto: maio 2025
-------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas a profissionais de saúde:
Assim como com todas as vacinas injectáveis, deve sempre estar disponível um tratamento adequado e supervisão médica para o caso de reacções anafilácticas raramente ocorridas após a vacinação.
O álcool e outros desinfetantes devem ter evaporado da pele antes da administração da vacina, pois podem inactivar os vírus atenuados presentes na vacina.
A vacina Varilrix não deve ser administrada por via intravenosa ou intradérmica.
Não misturar este medicamento com outros medicamentos, pois não foram realizados estudos de compatibilidade.
O diluente e a vacina reconstituída devem ser submetidos a uma inspecção visual. Devido às pequenas diferenças de pH, a vacina reconstituída pode apresentar uma cor que varia de ligeiramente alaranjada a rosa. Após a reconstituição, podem ser visíveis partículas translúcidas do produto. Este é um fenómeno normal e não afecta a eficácia da vacina.
Se a vacina apresentar uma cor diferente ou contiver outras partículas sólidas, não deve ser administrada.
A vacina deve ser reconstituída adicionando todo o diluente da seringa pré-cheia ao frasco de pó.
Para acoplar a agulha à seringa pré-cheia, deve seguir as instruções apresentadas nas figuras 1 e 2. A seringa pré-cheia fornecida com a vacina Varilrix pode diferir ligeiramente da apresentada na figura (pode não ter rosca para aparafusar a agulha). Nesse caso, a agulha deve ser fixada sem rosca.
Agulha
Seringa pré-cheia
Deve sempre segurar a seringa pré-cheia pelo seu corpo, não pelo pistão ou pelo adaptador Luer Lock, e a agulha deve ser mantida na direcção da seringa pré-cheia (como apresentado na figura 2). Não seguir estas instruções pode causar a torção do adaptador Luer Lock e, consequentemente, a fuga da seringa pré-cheia.
Se, ao acoplar a agulha à seringa pré-cheia, o adaptador Luer Lock se soltar, deve utilizar uma nova dose da vacina (nova seringa pré-cheia e frasco de pó).
- 1. Deve desrosquear a tampa da seringa pré-cheia, rodando-a no sentido contrário ao dos ponteiros do relógio (como apresentado na figura 1).
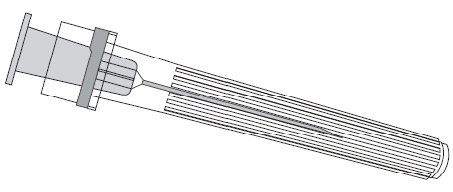
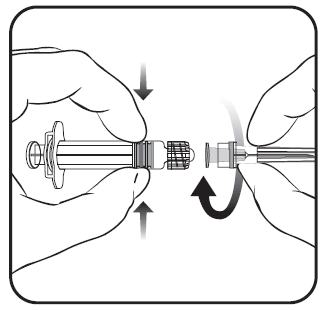
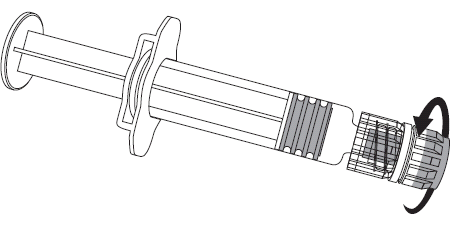
Figura 1. Figura 2.
independentemente de o adaptador Luer Lock rodar ou não, deve seguir as instruções abaixo:
- 2. Deve fixar a agulha à seringa pré-cheia, acoplando suavemente a tampa da agulha ao adaptador Luer Lock e rodando-a um quarto de volta no sentido dos ponteiros do relógio, até sentir o bloqueio da agulha (como apresentado na figura 2).
- 3. Deve remover a cobertura da agulha, que pode oferecer alguma resistência.
- 4. Deve adicionar o diluente ao pó. Em seguida, deve agitar energicamente até que o pó esteja completamente dissolvido.
- 5. Deve aspirar todo o conteúdo do frasco.
- 6. Para administrar a vacina, deve utilizar uma nova agulha. Para isso, deve desrosquear a agulha da seringa pré-cheia e acoplar uma agulha para injeção, seguindo as instruções apresentadas no ponto 2.
A vacina deve ser administrada imediatamente após a reconstituição.
No entanto, foi demonstrado que a vacina reconstituída pode ser conservada durante 90 minutos a uma temperatura ambiente (25°C) ou durante 8 horas no frigorífico (a uma temperatura de 2°C a 8°C). Se a vacina reconstituída não for utilizada dentro do prazo recomendado ou não for conservada nas condições recomendadas, deve ser eliminada.
Os resíduos de medicamentos ou os medicamentos não utilizados devem ser eliminados de acordo com as regulamentações locais.
Data da última actualização do folheto: maio 2025
-------------------------------------------------------------------------------------------------------------------------
Informações destinadas exclusivamente ao pessoal médico profissional:
Da mesma forma que no caso de todas as vacinas administradas por injeção, deve-se sempre
garantir a possibilidade de tratamento adequado e supervisão médica em caso de reacções anafilácticas raramente
ocorridas após a vacinação.
O álcool, bem como outros agentes desinfetantes, devem evaporar da pele antes da administração
da vacina, pois podem inactivar os vírus atenuados presentes na vacina.
As vacinas Varilrix nunca devem ser administradas por via intravascular ou intradérmica.
Não misturar este medicamento com outros medicamentos, pois não foram realizados estudos de compatibilidade.
O diluente e a vacina após a reconstituição devem ser submetidos a uma avaliação visual. Devido às
pequenas diferenças de pH, a vacina após a reconstituição pode apresentar uma cor que varia de
cor de branco-rosado a cor-de-rosa fuksia. Após a reconstituição, podem ser visíveis
partículas opacas do produto. Este é um fenómeno normal e não afecta a acção da
vacina.
Se a vacina apresentar uma coloração diferente ou contiver outras partículas sólidas, não deve ser administrada.
A vacina deve ser reconstituída adicionando todo o diluente do frasco ao frasco de pó. O frasco deve ser
agitado vigorosamente até que o pó seja completamente dissolvido.
Deve-se retirar todo o conteúdo do frasco.
Para a administração da vacina, deve-se usar uma agulha nova.
A vacina deve ser administrada imediatamente após a reconstituição.
No entanto, foi demonstrado que a vacina reconstituída pode ser armazenada durante 90 minutos a temperatura
ambiente (25°C) ou durante 8 horas no frigorífico (a uma temperatura de 2°C – 8°C). Se a vacina reconstituída não
for utilizada dentro do tempo recomendado ou não for armazenada nas condições recomendadas,
deve ser eliminada.
Qualquer resíduo não utilizado do medicamento ou resíduos deve ser eliminado de acordo com as regulamentações
locais.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorGlaxoSmithKline Biologicals S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a VarilrixForma farmacêutica: Pó, não menos de 1350 PFU/0,5 mlSubstância ativa: varicella, live attenuatedFabricante: Merck Sharp & Dohme B.V.Requer receita médicaForma farmacêutica: Suspensão, 160 unidades antigénicas ELISA do vírus da hepatite A, estirpe GBM/0,5 ml; 1 dose (0,5 ml)Substância ativa: hepatitis A, inactivated, whole virusRequer receita médicaForma farmacêutica: Suspensão, 60 mcg HA/cepa, 1 dose (0.7 ml)Substância ativa: influenza, inactivated, split virus or surface antigenRequer receita médica
Alternativas a Varilrix noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Varilrix em Ukraine
Alternativa a Varilrix em Espanha
Médicos online para Varilrix
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Varilrix – sujeita a avaliação médica e regras locais.














