
Prolastin
Pergunte a um médico sobre a prescrição de Prolastin

Como usar Prolastin
FOLHETO PARA O DOENTE
Folheto para o paciente: informação para o utilizador
Prolastin
1000 mg, pó e solvente para solução para infusão
inibidor de proteínase alfa-1, humano
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto, para que possa relê-lo se necessário.
- Em caso de alguma dúvida, deve consultar um médico, farmacêutico ou enfermeiro.
- Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o seu médico, farmacêutico ou enfermeiro. Ver ponto 4.
Índice do folheto:
- 1. O que é o medicamento Prolastin e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Prolastin
- 3. Como tomar o medicamento Prolastin
- 4. Efeitos não desejados
- 5. Como conservar o medicamento Prolastin
- 6. Conteúdo da embalagem e outras informações
1. O que é o medicamento Prolastin e para que é utilizado
Prolastin pertence a um grupo de inibidores de proteínase.
O inibidor de proteínase alfa-1 (alfa-PI) é produzido pelo organismo para inibir a ação de substâncias chamadas elastases, que danificam o tecido pulmonar. A deficiência hereditária de alfa-PI provoca um desequilíbrio entre alfa-PI e elastases. Isto pode levar a um dano progressivo do tecido pulmonar e ao desenvolvimento de enfisema pulmonar. O enfisema pulmonar é uma dilatação anormal dos pulmões, acompanhada da destruição do tecido pulmonar. O Prolastin é utilizado para restaurar o equilíbrio entre alfa-PI e elastases nos pulmões, e assim prevenir a deterioração adicional do enfisema pulmonar.
O Prolastin é utilizado no tratamento de longo prazo de suporte em doentes com deficiência de inibidor de proteínase alfa-1, em que o médico prescreveu este tipo de tratamento.
2. Informações importantes antes de tomar o medicamento Prolastin
Quando não tomar o medicamento Prolastin:
- se o doente for alérgico (hipersensível) ao princípio ativo inibidor de proteínase alfa-1 ou a qualquer um dos outros componentes do medicamento Prolastin (listados no ponto 6);
- se o doente tiver deficiência de uma classe específica de imunoglobulinas (IgA), pois existe o risco de reações alérgicas graves, até anafilácticas.
Precauções e advertências
- Antes de iniciar o tratamento com Prolastin, deve discutir com o seu médico, farmacêutico ou enfermeiro.
- Deve informar o seu médico se tiver insuficiência cardíaca grave. É necessário ter especial cuidado, pois o Prolastin pode causar um aumento transitório do volume de sangue.
Reações alérgicas (hipersensibilidade)
Em casos raros, podem ocorrer reações de hipersensibilidade ao medicamento Prolastin, mesmo que o doente tenha tolerado bem o inibidor de proteínase alfa-1 em administrações anteriores.
O médico informará o doente sobre os sintomas de reações alérgicas e o que fazer se ocorrerem (ver também ponto 4).
Se o doente apresentar algum sintoma de reação alérgica durante a infusão do medicamento, deve informar imediatamente o seu médico ou enfermeiro.
Informações sobre segurança relacionadas com o risco de infecções
Se o medicamento for produzido a partir de sangue ou plasma humano, são tomadas medidas de precaução para evitar a transmissão de infecções para o organismo do doente.
Estas medidas incluem:
- seleção apropriada de doadores de sangue e plasma, para excluir a possibilidade de transmissão de infecção,
- teste de doações individuais e de pool de plasma para vírus/infecções,
- inclusão no processo de produção de etapas de inativação ou remoção de vírus.
Apesar disto, não é possível eliminar completamente a possibilidade de transmissão de infecção ao utilizar medicamentos produzidos a partir de sangue ou plasma humano. Isto inclui também vírus desconhecidos ou novos e outros tipos de infecções.
As medidas de precaução atuais são consideradas eficazes na prevenção de infecções por vírus envelopados, como o vírus da imunodeficiência humana (HIV), vírus da hepatite B e C.
No entanto, podem ter uma eficácia limitada na prevenção de infecções por vírus não envelopados, como o vírus da hepatite A e parvovirus B19.
A infecção por parvovirus B19 pode ter consequências prejudiciais para as mulheres grávidas (infecção do feto) e para doentes com doenças imunológicas ou certos tipos de anemia (por exemplo, anemia falciforme, anemia hemolítica).
Se os inibidores de proteínase obtidos a partir de plasma humano forem utilizados regularmente ou em múltiplas doses, o médico pode recomendar vacinação contra a hepatite A e B.
É especialmente recomendado que, durante cada administração do medicamento Prolastin, sejam registrados o nome e o número de lote do medicamento, para que possa ser determinado qual doente recebeu o medicamento de qual lote.
Fumo
Devido ao fato de que o fumo limita a eficácia do medicamento Prolastin, os doentes devem ser aconselhados a parar de fumar.
Crianças e jovens
Até ao momento, não há experiência com o uso do medicamento Prolastin em crianças e jovens com menos de 18 anos.
Prolastin e outros medicamentos
Até ao momento, não são conhecidas interações entre o medicamento Prolastin e outros medicamentos.
No entanto, deve informar o seu médico ou farmacêutico sobre todos os medicamentos que está a tomar atualmente ou recentemente, incluindo os que são vendidos sem receita médica.
Gravidez e amamentação
Antes de tomar qualquer medicamento, deve consultar o seu médico ou farmacêutico.
Não há dados clínicos sobre o uso do medicamento Prolastin durante a gravidez. Deve informar o seu médico sobre a gravidez ou planeamento de gravidez. Não se sabe se o Prolastin passa para o leite materno. As mulheres que amamentam devem consultar o seu médico.
Condução de veículos e utilização de máquinas
Não há dados sobre o efeito do medicamento Prolastin na capacidade de conduzir veículos ou utilizar máquinas.
O medicamento Prolastin contém sódio
O Prolastin contém aproximadamente 110,4 mg de sódio (principal componente do sal de cozinha) em cada frasco.
No caso de um doente com 75 kg de peso corporal, isso corresponde a 24,84% da dose diária máxima recomendada de sódio na dieta para adultos.
Os doentes que controlam o teor de sódio na dieta devem contactar o seu médico ou farmacêutico.
3. Como tomar o medicamento Prolastin
Após a reconstituição com o solvente incluído na embalagem, o medicamento Prolastin é administrado por infusão intravenosa.
A primeira infusão do medicamento Prolastin deve ser supervisionada por um médico com experiência no tratamento de doenças pulmonares obstrutivas crónicas.
Tratamento em casa
Após a realização das primeiras infusões do medicamento Prolastin, o medicamento pode ser administrado por outra pessoa qualificada do pessoal médico, mas apenas após ter recebido treinamento adequado.
O médico decidirá se o doente é elegível para tratamento em casa e garantirá que a pessoa qualificada do pessoal médico receba instruções sobre os seguintes assuntos:
- como preparar e administrar a solução para infusão (ver instruções ilustradas no final deste folheto);
- como manter o medicamento em condições assépticas (regras para a realização de infusões em condições assépticas);
- como manter um registo do tratamento;
- como reconhecer efeitos não desejados, incluindo sintomas de reações alérgicas, e quais medidas tomar em caso de ocorrência desses efeitos (ver também ponto 4).
Dose
A dose do medicamento Prolastin que o doente recebe depende do seu peso corporal.
Normalmente, a administração semanal de uma dose de 60 mg de substância ativa por quilograma de peso corporal (o que corresponde a 180 ml de solução pronta com 25 mg/ml de inibidor de proteínase alfa-1 humano no caso de um doente com 75 kg de peso corporal) é suficiente para manter as concentrações de inibidor de proteínase alfa-1 na serosa que protegem contra a progressão adicional do enfisema pulmonar.
A duração do tratamento é decidida pelo médico.
Não há recomendações sobre a duração máxima do tratamento.
Se o doente sentir que o efeito do medicamento Prolastin é demasiado forte ou demasiado fraco, deve consultar o seu médico ou farmacêutico.
Uso de uma dose maior do que a recomendada do medicamento Prolastin
Não são conhecidos os efeitos de uma sobredose.
- Se o doente achar que tomou uma dose maior do que a recomendada do medicamento Prolastin, deve informar o seu médico ou outro profissional de saúde qualificado, que tomará as medidas necessárias.
Omissão da administração do medicamento Prolastin
- Deve falar com o seu médico para decidir se a dose omitida deve ser administrada.
- Não deve tomar uma dose dupla para compensar a infusão omitida.
Interrupção do tratamento com o medicamento Prolastin
Se o tratamento com o medicamento Prolastin for interrompido, a doença pode piorar.
Deve falar com o seu médico se desejar interromper o tratamento com o medicamento Prolastin.
Em caso de dúvidas adicionais sobre o uso deste medicamento, deve consultar o seu médico, farmacêutico ou enfermeiro.
4. Efeitos não desejados
Como qualquer medicamento, o Prolastin pode causar efeitos não desejados, embora não ocorram em todos.
Se ocorrerem efeitos não desejados durante a administração da infusão do medicamento Prolastin, dependendo do tipo e gravidade, a infusão deve ser interrompida ou terminada.
Efeitos não desejados graves
Raramente (em até 1 em 1000 doentes) podem ocorrer reações de hipersensibilidade, e em casos muito raros (em até 1 em 10 000 doentes) essas reações podem ter a forma de reações anafilácticas de qualquer tipo, mesmo que o doente não tenha apresentado sintomas de alergia em administrações anteriores.
Deve imediatamenteinformar o seu médico ou enfermeiro se o doente observar algum dos seguintes sintomas:
- erupções cutâneas, urticária, prurido;
- dificuldades em engolir;
- inchaço do rosto ou lábios;
- rubor súbito da pele;
- dificuldades em respirar (dispneia);
- queda da pressão arterial;
- mudança na frequência cardíaca;
- calafrios. O médico ou outro profissional de saúde qualificado pode decidir, consoante as necessidades, reduzir a velocidade ou interromper a infusão e administrar o tratamento adequado. Em caso de tratamento em casa, deve imediatamente interromper a infusãoe contactar o seu médico ou outro profissional de saúde qualificado
Durante o uso do medicamento Prolastin, ocorreram os seguintes efeitos não desejados:
Não muito frequentes (podem ocorrer em 1 em 100 doentes):
- calafrios, febre, sintomas semelhantes aos da gripe, dor no peito
- urticária
- tonturas, vertigens, dores de cabeça
- dificuldades em respirar (dispneia)
- erupções cutâneas
- náuseas
- dores nas articulações
Raro (podem ocorrer em 1 em 1000 doentes):
- reações de hipersensibilidade
- -taquicardia (batimento cardíaco acelerado)
- hipotensão (pressão arterial baixa)
- hipertensão (pressão arterial alta)
- dores nas costas
Muito raro (podem ocorrer em 1 em 10 000 doentes):
- choque anafilático
Notificação de efeitos não desejados
Se ocorrerem algum sintoma não desejado, incluindo quaisquer sintomas não desejados não mencionados neste folheto, deve informar o seu médico ou farmacêutico.
Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos da Agência Nacional de Medicamentos e Produtos de Saúde, IP, Rua Luís Pastor, 1200-244 Lisboa, tel.: +351 21 798 70 00, fax: +351 21 798 70 99,
Site da Internet: https://www.infarmed.pt/
Os efeitos não desejados podem ser notificados diretamente ao titular da autorização de introdução no mercado.
A notificação de efeitos não desejados permitirá reunir mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento Prolastin
Não conservar acima de 25°C.
Não congelar.
A solução reconstituída não deve ser conservada no frigorífico, deve ser utilizada dentro de 3 horas após a reconstituição.
Qualquer quantidade não utilizada do medicamento deve ser eliminada.
Os medicamentos não devem ser eliminados na canalização ou em contentores de resíduos domésticos.
Deve perguntar ao farmacêutico como eliminar os medicamentos de que já não precisa.
Este procedimento ajudará a proteger o ambiente.
O medicamento deve ser conservado fora do alcance e da vista das crianças.
Não utilizar o medicamento Prolastin após o prazo de validade impresso na etiqueta do frasco e na embalagem de cartão.
Não utilizar o medicamento Prolastin se a solução reconstituída não for transparente.
Os medicamentos não devem ser eliminados na canalização ou em contentores de resíduos domésticos.
Deve perguntar ao farmacêutico o que fazer com os medicamentos de que já não precisa.
Este procedimento ajudará a proteger o ambiente.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento Prolastin
- O princípio ativo é o inibidor de proteínase alfa-1 humano (obtido a partir de sangue ou plasma humano).
- Os outros componentes são: cloreto de sódio, di-hidrogenofosfato de sódio, água para injeção (solvente/diluente).
Como é o medicamento Prolastin e que conteúdo tem a embalagem
O inibidor de proteínase alfa-1 em pó de cor branca a bege.
A solução reconstituída é transparente.
1 ml de solução reconstituída contém 25 mg de inibidor de proteínase alfa-1
Na caixa de cartão do medicamento Prolastin, encontra-se:
- 1 frasco com pó contendo 1000 mg de inibidor de proteínase alfa-1 humano
- 1 frasco contendo 40 ml de solvente (água para injeção).
- 1 conector Mix2Vial para misturar e reconstituir a solução.
A embalagem em kit contém:
- 4 embalagens de Prolastin 1000 mg
Titular da autorização de introdução no mercado e fabricante
Titular da autorização de introdução no mercado:
Grifols Deutschland GmbH
Colmarer Straße 22
60528 Frankfurt
Alemanha
Tel.: +49 69/660 593 100
Fabricante:
Instituto Grifols, S.A.
Can Guasc, 2 – Parets del Vallès
08150 Barcelona
Espanha.
Para obter informações mais detalhadas, deve contactar
Grifols Portugal, Lda.
Avenida da República, 37, 3º andar
1050-187 Lisboa
Portugal
tel. (21) 319 69 90
| Alemanha | Prolastin |
| Austria | Prolastin |
| Bélgica | Pulmolast |
| Dinamarca | Prolastina |
| Espanha | Prolastina |
| Finlândia | Prolastina |
| França | Prolastin |
| Grécia | Prolastin |
| Irlanda | Prolastin |
| Itália | Prolastin |
| Países Baixos | Prolastin |
| Polónia | Prolastin |
| Portugal | Prolastin |
| Suécia | Prolastina |
Data da última revisão do folheto:setembro de 2021
---------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas a profissionais de saúde e doentes elegíveis para tratamento em casa:
Preparação da solução pronta para uso para infusão
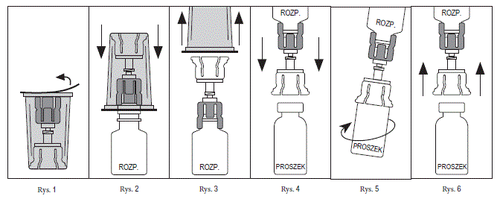
- 1. Deve seguir as regras de assepsia (limpeza e higiene) para manter a esterilidade. A preparação da solução pronta para uso deve ser feita em uma superfície plana.
- 2. Deve certificar-se de que os frascos do medicamento Prolastin e do solvente (água para injeção estéril) estão à temperatura ambiente (entre 20°C e 25°C).
- 3. Retire a tampa do frasco do Prolastin e desinfete o batoque de borracha com um cotonete estéril com álcool. Deixe o batoque de borracha secar.
- 4. Repita este procedimento com o frasco da água para injeção - solvente (Solvente).
- 5. Abra a embalagem do conector Mix2Vial (Fig. 1). Não retire o conector Mix2Vial da embalagem.
- 6. Coloque o conector Mix2Vial em uma superfície plana. Segurando com segurança o frasco do solvente, pressione a extremidade azul do conector Mix2Vial diretamente para baixo até que a ponta da agulha perfure a tampa ( Fig. 2)
- 7. Remova e descarte a parte transparente da embalagem do conector Mix2Vial ( Fig. 3)
- 8. Coloque o frasco do Prolastin em uma superfície plana e vire o frasco do solvente com o conector Mix2Vial anexado.
- 9. Segurando com segurança o frasco do Prolastin, pressione a extremidade transparente do conector Mix2Vial diretamente para baixo até que a ponta da agulha perfure a tampa ( Fig. 4). Sob ação do vácuo, o solvente passará automaticamente para o frasco do Prolastin. Nota: Se o conector Mix2Vial for conectado em um ângulo, pode remover o vácuo do frasco do Prolastin e o solvente não passará para o frasco. Se o frasco não tiver mais vácuo, deve-se usar uma seringa estéril e uma agulha para retirar a água para injeção do frasco do solvente e injetá-la na parede interna do frasco do Prolastin.
- 10. Deve girar suavemente o frasco do solvente e o frasco do Prolastin conectados com o conector Mix2Vial ( Fig. 5) até que o pó esteja completamente dissolvido. Não agite, para evitar a formação de espuma. A solução pronta para uso deve ser transparente. Não use a solução se tiver cor alterada ou contiver partículas sólidas.
- 11. Se for necessário usar mais de um frasco do medicamento para completar a dose necessária, deve usar um kit adicional do conector Mix2Vial e repetir os procedimentos acima. Não reutilize o conector Mix2Vial.
- 12. Desconecte o conector Mix2Vial ( Fig. 6), e em seguida, administre o medicamento de forma asséptica.
- País de registo
- Requer receita médicaSim
- Fabricante
- ImportadorInstituto Grifols, S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a ProlastinForma farmacêutica: Pó, 500 mgSubstância ativa: alfa1 antitrypsinFabricante: Takeda Manufacturing Austria AGRequer receita médicaForma farmacêutica: Pó, 1000 mgSubstância ativa: alfa1 antitrypsinFabricante: Takeda Manufacturing Austria AGRequer receita médicaForma farmacêutica: Solução, 277,8 unidades Ph. Eur. (500 000 KIU)Substância ativa: aprotininNão requer receita médica
Alternativas a Prolastin noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Prolastin em Ukraine
Alternativa a Prolastin em Espanha
Médicos online para Prolastin
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Prolastin – sujeita a avaliação médica e regras locais.














