
Infanrix - Ipv + Hib

Pergunte a um médico sobre a prescrição de Infanrix - Ipv + Hib

Como usar Infanrix - Ipv + Hib
Folheto informativo para o utilizador
INFANRIX-IPV+Hib, Pó e suspensão para suspensão injectável
Vacina contra a difteria (D), tétano (T), coqueluche (acelular, componente),
poliomielite (inactivada) (IPV) e Haemophilus influenzae tipo b (Hib) (conjugada), adsorvida
Deve ler atentamente o conteúdo do folheto antes de administrar a vacina, pois contém informações importantes para o paciente.
- Deve conservar este folheto para poder relê-lo se necessário.
- Em caso de dúvidas, deve consultar um médico ou farmacêutico.
- Se o paciente apresentar algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Ver secção 4.
Índice do folheto:
- 1. O que é a vacina INFANRIX-IPV+Hib e para que é utilizada
- 2. Informações importantes antes de administrar a vacina INFANRIX-IPV+Hib
- 3. Como administrar a vacina INFANRIX-IPV+Hib
- 4. Efeitos não desejados
- 5. Como conservar a vacina INFANRIX-IPV+Hib
- 6. Conteúdo do pacote e outras informações
1. O que é a vacina INFANRIX-IPV+Hib e para que é utilizada
A vacina INFANRIX-IPV+Hib é utilizada para prevenir a difteria, tétano, coqueluche (tosse convulsa),
poliomielite (polio, doença de Heine-Medina) e infecções causadas por Haemophilus influenzae tipo b em crianças.
A componente da vacina contra a difteria, tétano, coqueluche e polio (DTPa-IPV) é uma suspensão turva e branca em uma seringa pré-cheia (0,5 ml).
A componente da vacina contra o Hib é um pó branco contido em um frasco de vidro.
As duas componentes da vacina devem ser misturadas antes da administração à criança.
- Difteria:A difteria é uma doença infecciosa que afeta principalmente as vias respiratórias e, por vezes, a pele. Geralmente, as vias respiratórias inflamadas e inchadas causam dificuldades respiratórias graves e, por vezes, sufocamento. As bactérias da difteria também produzem toxinas que podem causar danos nos nervos, doenças cardíacas ou até a morte.
- Tétano:As bactérias do tétano entram no corpo humano através de cortes, arranhões ou feridas na pele. Os ferimentos que apresentam maior risco de infecção por tétano incluem: queimaduras, fraturas, feridas profundas ou feridas contaminadas com solo, poeira, esterco de cavalo ou lascas de madeira. Essas bactérias produzem toxinas que podem causar rigidez muscular, espasmos musculares dolorosos, convulsões ou até a morte. Os espasmos musculares podem ser tão fortes que causam fraturas na coluna vertebral.
- Coqueluche (tosse convulsa):A coqueluche é uma doença respiratória altamente contagiosa que causa acessos de tosse violentos que podem dificultar a respiração normal. A tosse característica dessa doença é conhecida como "tosse convulsa". A tosse pode durar de 1 a 2 meses ou mais. As bactérias da coqueluche também podem causar infecções no ouvido, pneumonia, convulsões, danos cerebrais ou até a morte.
Também podem causar infecções no ouvido, pneumonia, convulsões, danos cerebrais ou até a morte.
- Poliomielite(doença de Heine-Medina, polio): A poliomielite é uma infecção viral que pode causar vários sintomas. Frequentemente, é uma doença leve, mas em algumas pessoas pode causar danos permanentes ou até a morte. Na forma mais grave da doença, ocorre paralisia muscular (os músculos não conseguem realizar suas funções), que pode afetar os músculos respiratórios ou os músculos que permitem a locomoção. Os membros afetados podem ficar deformados e dolorosos.
- Haemophilus influenzaetipo b (Hib): A infecção por Hib geralmente causa meningite (inflamação e inchaço no cérebro). As consequências de uma infecção por Hib podem incluir deficiência mental, paralisia cerebral, surdez, epilepsia ou cegueira parcial. A infecção por Hib também pode causar inflamação e inchaço na garganta. Raramente, pode causar infecção no sangue, coração, pulmões, ossos, articulações e tecidos ao redor dos olhos e boca.
A vacina causa a formação de anticorpos no organismo contra as doenças mencionadas.
A vacinação é a melhor forma de prevenir essas doenças. Nenhum dos componentes da vacina é infeccioso.
2. Informações importantes antes de administrar a vacina INFANRIX-IPV+Hib
Quando não administrar a vacina INFANRIX-IPV+Hib:
- Se a criança tiver alergia à vacina INFANRIX-IPV+Hib ou a qualquer um dos outros componentes da vacina (listados na secção 6) ou à neomicina, polimixina ou formaldeído (substâncias presentes na vacina em quantidades residuais). Os sintomas de alergia incluem: erupção cutânea pruriginosa, dificuldade respiratória, inchaço no rosto ou língua;
- Se a criança tiver apresentado uma reação alérgica a qualquer vacina contra a difteria, tétano, coqueluche (tosse convulsa), polio ou infecções por Haemophilus influenzae tipo b;
- Se a criança tiver apresentado qualquer distúrbio do sistema nervoso nos 7 dias seguintes à administração de uma vacina contra a coqueluche (tosse convulsa);
- Se a criança tiver febre alta (acima de 38,0 °C). Uma infecção leve, como um resfriado, não deve ser um contraindicação para a vacinação, mas é importante informar o médico.
Precauções e advertências
Antes de iniciar a administração da vacina INFANRIX-IPV+Hib, deve discutir com o médico:
- Se a criança tiver apresentado problemas de saúde após a administração da vacina INFANRIX-IPV+Hib ou de outra vacina contra a coqueluche (tosse convulsa), especialmente:
- febre alta (≥ 40,0 °C) nos 48 horas seguintes à administração da vacina,
- choque ou colapso nos 48 horas seguintes à administração da vacina,
- choro contínuo por mais de 3 horas nos 48 horas seguintes à administração da vacina,
- convulsões ou espasmos com ou sem febre nos 3 dias seguintes à administração da vacina,
- Se a criança tiver uma doença cerebral não diagnosticada ou em progressão ou epilepsia não controlada. A vacina deve ser administrada após o controle da doença;
- Se a criança tiver tendência a convulsões febrís ou se houver histórico familiar de convulsões;
- Se a criança tiver tendência a sangramentos ou hematomas fáceis.
Nesses casos, o médico decidirá o momento e a forma adequados para a administração da vacina à criança.
Após ou antes da administração de cada vacina por injeção, pode ocorrer síncope. Portanto, é importante informar o médico ou enfermeiro se a criança tiver apresentado síncope durante a administração de uma injeção.
Uso da vacina INFANRIX-IPV+Hib em pacientes com distúrbios imunológicos
Em crianças com problemas de saúde decorrentes de distúrbios imunológicos, a resposta à vacinação pode ser reduzida. A infecção por HIV não é uma contraindicação para a vacinação.
Interacções com outros medicamentos
Deve informar o médico sobre todos os medicamentos que a criança está tomando ou tomou recentemente, bem como sobre as vacinações realizadas.
Em crianças que estão tomando medicamentos imunossupressores, a resposta à vacinação pode ser reduzida.
Diferentes vacinas pediátricas devem ser administradas em locais diferentes do corpo.
Gravidez e amamentação
Como a vacina é destinada a crianças, não há dados adequados sobre o uso durante a gravidez e amamentação em humanos.
Condução de veículos e operação de máquinas
Não se aplica.
A vacina INFANRIX-IPV+Hib contém para-aminobenzoato de sódio, fenilalanina, sódio e potássio
A vacina INFANRIX-IPV+Hib contém para-aminobenzoato de sódio. Pode causar reações alérgicas (possíveis reações tardias) e, raramente, broncoespasmo.
A vacina contém 0,036 microgramas de fenilalanina por dose. A fenilalanina pode ser prejudicial a pacientes com fenilcetonúria (PKU), uma doença genética rara, na qual a fenilalanina se acumula no organismo porque o organismo não a elimina adequadamente.
A vacina contém menos de 1 mmol (23 mg) de sódio por dose, ou seja, a vacina é considerada "livre de sódio".
A vacina contém potássio, menos de 1 mmol (39 mg) de potássio por dose, ou seja, a vacina é considerada "livre de potássio".
3. Como administrar a vacina INFANRIX-IPV+Hib
A criança deve receber um total de 3 doses da vacina, com intervalos de, no mínimo, 1 mês.
A primeira dose pode ser administrada no segundo mês de vida, e o ciclo completo de vacinação deve ser concluído nos primeiros 6 meses de vida.
É recomendada uma dose de reforço no segundo ano de vida.
Cada dose é administrada durante uma visita separada. O médico ou enfermeiro informará quando a criança deve retornar para a próxima dose.
Se a criança não receber a próxima dose da vacina no prazo estabelecido, é importante discutir com o médico e marcar outra consulta.
É importante garantir que a criança tenha recebido o esquema completo de vacinação, composto por 3 doses da vacina, pois, caso contrário, a criança pode não estar completamente protegida contra as doenças infecciosas cobertas pela vacinação.
A vacina INFANRIX-IPV+Hib será administrada por injeção intramuscular.
A vacina nunca deve ser administrada por via intravenosa.
4. Efeitos não desejados
Como qualquer vacina, a vacina INFANRIX-IPV+Hib pode causar efeitos não desejados, embora não em todas as crianças.
Abaixo estão listados os efeitos não desejados que podem ocorrer após a vacinação:
Muito frequentes(podem ocorrer em 1 caso em 10 doses da vacina ou mais frequentemente): perda de apetite, irritabilidade, choro anormal, agitação, sonolência, dor, vermelhidão e inchaço localizado (≤ 50 mm) no local da injeção, febre (≥ 38°C).
Frequentes(menos frequentes do que em 1 caso em 10 doses da vacina): vômitos, diarreia, nódulo duro ou inchaço localizado (> 50 mm) no local da injeção.
Pouco frequentes(menos frequentes do que em 1 caso em 100 doses da vacina): infecção das vias respiratórias superiores, inchaço dos gânglios linfáticos do pescoço, axilas e virilhas, tosse, pneumonia, coriza, erupção cutânea, urticária, febre (> 39,5°C), fadiga, inchaço difuso do membro no qual a vacina foi administrada, que pode incluir a articulação adjacentemente.
- Parada respiratória transitória (parada da respiração)
- Nos recém-nascidos muito prematuros (nascidos antes ou no 28º dia de gestação), nos 2-3 dias após a vacinação, podem ocorrer intervalos mais longos do que o normal entre as respirações.
- Sangramentos ou hematomas fáceis
- Reações alérgicas. Como em outras vacinas injetáveis, existe um risco muito pequeno de reações alérgicas (alérgicas). Essa condição pode ser reconhecida com base nos seguintes sintomas:
- erupção cutânea pruriginosa nas palmas das mãos e pés,
- inchaço ao redor dos olhos e face,
- dificuldade respiratória e deglutição. Esses sintomas geralmente ocorrem antes de a criança deixar o consultório médico. Em qualquer caso, deve-se iniciar o tratamento imediatamente.
- Convulsões (com ou sem febre), choque, alterações da consciência ou perda de consciência
- Inchaço limitado, geralmente localizado na cabeça e pescoço (inchaço angioneurótico)
- Inchaço de todo o membro no qual a vacina foi administrada
- Pequenas bolhas no local da injeção
Se esses sintomas persistirem ou piorarem, é importante informar o médico.
Não deve se preocupar com essa lista de possíveis efeitos não desejados. É possível que não ocorram efeitos não desejados após a vacinação.
Notificação de efeitos não desejados
Se ocorrerem qualquer efeito não desejado, incluindo qualquer efeito não desejado não mencionado no folheto, é importante informar o médico, farmacêutico ou enfermeiro. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Não Desejados de Produtos Farmacêuticos da Agência Reguladora de Produtos Farmacêuticos, Dispositivos Médicos e Produtos Biocidas: Al. Jerozolimskie 181C, 02-222 Varsóvia, telefone: 22 49-21-301, fax: 22 49-21-309
Sítio web: https://smz.ezdrowie.gov.pl
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos não desejados permitirá a coleta de mais informações sobre a segurança do medicamento.
5. Como conservar a vacina INFANRIX-IPV+Hib
Conservar na geladeira (2 °C – 8 °C). Não congelar.
Conservar no embalagem original para proteger da luz.
A vacina deve ser conservada em um local inacessível e fora do alcance das crianças.
Não usar a vacina após o prazo de validade impresso no embalagem. O prazo de validade (EXP) indica o último dia do mês indicado.
Número do lote.
6. Conteúdo do pacote e outras informações
O que a vacina INFANRIX-IPV+Hib contém:
1 dose da vacina (0,5 ml) após a reconstituição contém:
Toxóide diftérico
não menos de 30 UI
Toxóide tetânico
não menos de 40 UI
Antígenos da coqueluche Bordetella pertussis:
Toxóide da coqueluche
25 microgramas
Hemaglutinina filamentosa
25 microgramas
Pertactina
8 microgramas
Poliovírus (inativado):
tipo 1 (cepa Mahoney)
40 unidades antígeno D
tipo 2 (cepa MEF-1)
8 unidades antígeno D
tipo 3 (cepa Saukett)
32 unidades antígeno D
Polisacarídeo Haemophilus tipo b
(fosfato de polirribosil ribitol)
ligado ao toxóide tetânico como proteína transportadora
10 microgramas
aproximadamente 25 microgramas
adsorvido em hidróxido de alumínio, hidratado
0,5 miligrama Al
produzido em cultura de células VERO
Outros componentes são:
lactose, cloreto de sódio (ver também a secção 2, "A vacina INFANRIX-IPV+Hib contém sódio"),
meio 199 (contendo aminoácidos (incluindo fenilalanina), sais minerais (incluindo sódio e potássio),
vitaminas (incluindo ácido para-aminobenzoico) e outras substâncias), água para injeção.
Como a vacina INFANRIX-IPV+Hib é apresentada e o que o embalagem contém:
O componente liofilizado Haemophilus influenzaetipo b (Hib) é um pó branco.
A suspensão (DTPa-IPV) que contém toxóide diftérico, toxóide tetânico, antígenos da coqueluche e poliovírus inativado é uma suspensão branca e turva.
Antes da administração, o pó e a suspensão são misturados.
A vacina INFANRIX-IPV+Hib está disponível em embalagens de 1 dose, com ou sem agulha, em pacotes de 1 ou 10 unidades.
Titular da autorização de comercialização e fabricante:
GlaxoSmithKline Biologicals S.A.
rue de l’Institut 89
1330 Rixensart, Bélgica
Para obter informações mais detalhadas, por favor, contate o representante do titular da autorização de comercialização.
GSK Services, Lda.
Rua Rzymowskiego, 53
02-697 Varsóvia
Telefone: +48 (22) 576 90 00
Data da última atualização do folheto: abril de 2023
-------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas ao pessoal médico:
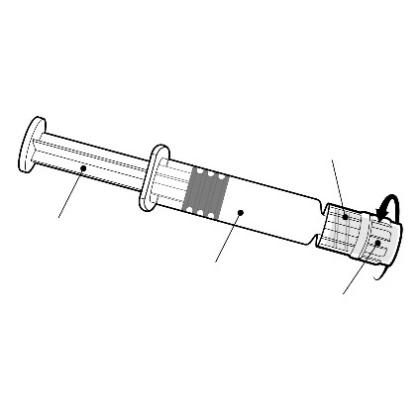
Adaptador do tipo Luer Lock
Deve segurar a seringa pré-cheia pelo corpo, não pelo êmbolo.
Deve remover a tampa da seringa pré-cheia girando-a no sentido contrário ao dos ponteiros do relógio.
Êmbolo
Corpo
Bico
Bico da agulha
Deve fixar a agulha à seringa pré-cheia conectando o bico da agulha ao adaptador Luer Lock e girando-o um quarto de volta no sentido dos ponteiros do relógio, até sentir o bloqueio da agulha.
Deve reconstituir a vacina de acordo com as instruções acima.
Não deve retirar o êmbolo do corpo da seringa pré-cheia. Se isso ocorrer, não deve administrar a vacina.
Eliminação
Todos os resíduos do produto não utilizado ou seus dejetos devem ser eliminados de acordo com as regulamentações locais.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorGlaxoSmithKline Biologicals S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Infanrix - Ipv + HibForma farmacêutica: Suspensão, 0.5 mlSubstância ativa: diphtheria-pertussis-poliomyelitis-tetanusFabricante: Sanofi-Aventis Zrt.Requer receita médicaForma farmacêutica: Suspensão, 0,5 ml (1 dose)Substância ativa: diphtheria-pertussis-poliomyelitis-tetanusFabricante: GlaxoSmithKline Biologicals S.A.Requer receita médicaForma farmacêutica: Suspensão, não menos de 2 UI + não menos de 20 UI + 40 unidades antigénicas D + 8 unidades antigénicas D + 32 unidades antigénicas D/0,5 ml, 1 dose (0,5 ml)Substância ativa: diphtheria-poliomyelitis-tetanusFabricante: Sanofi Pasteur Sanofi-Aventis Zrt.Requer receita médica
Alternativas a Infanrix - Ipv + Hib noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Infanrix - Ipv + Hib em Украина
Alternativa a Infanrix - Ipv + Hib em Испания
Médicos online para Infanrix - Ipv + Hib
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Infanrix - Ipv + Hib – sujeita a avaliação médica e regras locais.














