
Immunate 1000 Iu Fviii/750 Iu Vuf

Pergunte a um médico sobre a prescrição de Immunate 1000 Iu Fviii/750 Iu Vuf

Como usar Immunate 1000 Iu Fviii/750 Iu Vuf
Folheto informativo: informação para o utilizador
Immunate 1000 UI FVIII/ 750 UI VWF pó e solvente para solução injectável
para injeção
factor humano de coagulação VIII / factor humano de von Willebrand
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto para poder reler-lo se necessário.
- Se tiver alguma dúvida, deve consultar o seu médico ou farmacêutico.
- Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o seu médico ou farmacêutico. Ver ponto 4.
Índice do folheto
- 1. O que é Immunate 1000 UI FVIII/ 750 UI VWF e para que é utilizado
- 2. Informações importantes antes de tomar Immunate 1000 UI FVIII/ 750 UI VWF
- 3. Como tomar Immunate 1000 UI FVIII/ 750 UI VWF
- 4. Efeitos não desejados
- 5. Como conservar Immunate 1000 UI FVIII/ 750 UI VWF
- 6. Conteúdo da embalagem e outras informações
1. O que é Immunate 1000 UI FVIII/ 750 UI VWF e para que é utilizado
O que é Immunate 1000 UI FVIII/ 750 UI VWF
Immunate é um complexo de factor de coagulação VIII/factor de von Willebrand, produzido a partir de plasma humano. O factor de coagulação VIII contido no Immunate substitui o factor VIII ausente ou defeituoso na hemofilia A. A hemofilia A é uma doença hereditária ligada ao sexo, caracterizada por uma deficiência de factor VIII. Isso leva a sangramentos graves nas articulações, músculos e órgãos internos, que ocorrem espontaneamente ou após lesões acidentais ou cirurgias. A administração de Immunate fornece temporariamente o factor VIII ausente e reduz a tendência para sangramentos. Além do seu efeito como proteína de proteção do factor VIII, o factor de von Willebrand (VWF) media o processo de adesão das plaquetas no local da lesão vascular e desempenha um papel na agregação das plaquetas.
Para que é utilizado Immunate 1000 UI FVIII/ 750 UI VWF
Immunate é utilizado para o tratamento e prevenção de sangramentos na deficiência congénita (hemofilia A) ou adquirida de factor VIII. Immunate também é utilizado no tratamento de sangramentos em doentes com doença de von Willebrand com deficiência de factor VIII, se não estiver disponível um produto específico eficaz para a doença de von Willebrand e quando o tratamento com apenas desmopressina (DDAVP) for ineficaz ou contraindicado.
2. Informações importantes antes de tomar Immunate 1000 UI FVIII/ 750 UI VWF
Quando não tomar Immunate 1000 UI FVIII/ 750 UI VWF
- se o doente for alérgico ao factor humano de coagulação VIII ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6). Em caso de dúvida, deve consultar o seu médico.
Precauções e advertências
Em caso de reações alérgicas:
- Existe uma pequena probabilidade de ocorrência de reação anafilática (reação alérgica grave e súbita) ao medicamento Immunate. O doente deve ser informado sobre os primeiros sintomas de reações alérgicas, tais como rubor súbito, erupção, urticária, bolhas, prurido generalizado, inchaço dos lábios, pálpebras e língua, dificuldade respiratória, respiração sibilante, dor no peito, sensação de aperto no peito, mau-estar geral, tontura, taquicardia e hipotensão. Estes sintomas podem ser os primeiros sinais de choque anafilático, que pode incluir tontura extrema, perda de consciência e dificuldade respiratória extrema.
- Em caso de ocorrência de qualquer um destes sintomas, deve interromper imediatamente a injeção/infusão e contactar o seu médico. Sintomas graves, incluindo dificuldade respiratória e quase perda de consciência, requerem tratamento imediato como em caso de emergência.
Quando é necessário monitorizar o tratamento:
- O médico pode solicitar exames para garantir que a dose atualmente administrada é suficiente para atingir e manter níveis adequados de factor VIII e factor de von Willebrand.
Se o sangramento persistir:
- A formação de inibidores (anticorpos) é uma complicação conhecida que pode ocorrer durante o tratamento com todos os medicamentos que contenham factor VIII. Estes inibidores, especialmente em altas concentrações, interrompem o tratamento eficaz e o doente será monitorizado de perto para a formação desses inibidores. Se o sangramento no doente não for controlado adequadamente com o medicamento Immunate, deve informar imediatamente o seu médico. Doentes com doença de von Willebrand, especialmente doentes do tipo 3, podem desenvolver anticorpos neutralizantes (inibidores) contra o factor de von Willebrand. O médico pode solicitar exames para confirmar a presença desses inibidores. Inibidores contra o factor de von Willebrand são anticorpos no sangue que bloqueiam o factor de von Willebrand administrado. Por isso, o factor de von Willebrand é menos eficaz no controlo do sangramento. No caso de medicamentos produzidos a partir de sangue ou plasma humano, são tomadas medidas preventivas para evitar a transmissão de infecções aos doentes. Incluem a seleção cuidadosa de doadores de sangue e plasma para garantir que sejam excluídos indivíduos com risco de infecção, exame de cada lote de sangue doado e plasma para vírus/infecção e inclusão no processo de tratamento do sangue ou plasma de procedimentos que inativam ou removem vírus. Apesar da implementação dessas medidas, ao administrar medicamentos derivados de sangue ou plasma humano, não é possível excluir completamente a possibilidade de transmissão de infecção. Isso inclui vírus desconhecidos ou recentemente descobertos e outros tipos de infecção.
Medidas são consideradas eficazes contra vírus envelopados, como o vírus da imunodeficiência humana (HIV), vírus da hepatite B e C e vírus da hepatite A não envelopado. Medidas podem ter eficácia limitada contra vírus não envelopados, como o parvovirus B19. Infecção por parvovirus B19 pode ter consequências graves para mulheres grávidas (infecção fetal) e doentes com deficiências imunológicas ou certos tipos de anemia (por exemplo, esferocitose congénita ou anemia hemolítica). Em caso de administração regular ou repetida de produtos que contenham factor VIII derivados de plasma humano, o médico pode recomendar vacinação contra a hepatite A e B. É especialmente recomendado que, a cada administração de uma dose de Immunate ao doente, se registe o nome e o número de lote do medicamento para manter um registo do lote utilizado. Immunate contém isoaglutininas de grupos sanguíneos (anti-A e anti-B). Em doentes com grupo sanguíneo A, B ou AB, pode ocorrer hemólise devido à administração repetida em curto período de tempo ou administração de doses muito grandes.
Crianças
O produto deve ser utilizado com cautela em crianças abaixo de 6 anos que tenham sido expostas de forma limitada a produtos que contenham factor VIII, pois os dados clínicos sobre este grupo de doentes são limitados.
Immunate 1000 UI FVIII/ 750 UI VWF e outros medicamentos
Deve informar o seu médico ou farmacêutico sobre todos os medicamentos que está a tomar atualmente ou recentemente, bem como sobre os medicamentos que planeia tomar. Não foram relatadas interações medicamentosas entre o medicamento Immunate e outros medicamentos. O medicamento Immunate não deve ser misturado com outros medicamentos ou solventes antes da administração, excepto a água para injeção fornecida, pois podem afetar negativamente a eficácia e segurança do produto. Recomenda-se enxaguar o acesso venoso inserido com uma solução adequada, como solução salina, antes e após a injeção de Immunate.
Immunate 1000 UI FVIII/ 750 UI VWF com alimentos e bebidas
Não há recomendações especiais sobre a administração de Immunate em relação às refeições.
Gravidez, amamentação e fertilidade
Como a hemofilia A é rara em mulheres, não há experiência sobre a utilização de Immunate durante a gravidez, amamentação e fertilidade. Immunate deve ser utilizado durante a gravidez e amamentação apenas em indicações justificadas. Se a paciente estiver grávida ou a amamentar, suspeitar que possa estar grávida ou planeie ter um filho, deve consultar o seu médico ou farmacêutico antes de tomar este medicamento.
Condução de veículos e utilização de máquinas
Não há informações sobre o efeito de Immunate na capacidade de conduzir veículos ou utilizar máquinas.
Immunate 1000 UI FVIII/ 750 UI VWF contém sódio
O medicamento contém 19,6 mg de sódio (principal componente do sal de cozinha) em cada frasco. Isso corresponde a 1% da dose máxima recomendada de sódio na dieta para adultos.
3. Como tomar Immunate 1000 UI FVIII/ 750 UI VWF
O tratamento deve ser conduzido sob supervisão de um médico com experiência no tratamento de distúrbios da hemostase.
Este medicamento deve ser sempre administrado de acordo com as recomendações do médico. Em caso de dúvida, deve consultar o seu médico.
Dosagem para prevenção de sangramentos
Se o medicamento Immunate for utilizado para prevenir sangramentos, a dose será calculada pelo médico. Isso será feito com base nas necessidades individuais do doente. A dose usual é de 20 a 40 UI de factor VIII por quilograma de peso corporal, administrada em intervalos de 2 a 3 dias. No entanto, em alguns casos, especialmente em doentes mais jovens, podem ser necessários intervalos mais curtos entre as doses ou doses mais altas. Se o doente tiver a sensação de que o efeito do medicamento Immunate é muito fraco, deve consultar o seu médico.
Dosagem para tratamento de sangramentos
Se o medicamento Immunate for utilizado para tratar sangramentos, a dose será calculada pelo médico. Isso será feito com base nas necessidades individuais do doente. Se o doente tiver a sensação de que o efeito do medicamento Immunate é muito fraco, deve consultar o seu médico.
Monitorização do tratamento pelo médico
Para garantir que os níveis de factor VIII sejam adequados, o médico realizará exames laboratoriais apropriados. Isso é especialmente importante em cirurgias maiores.
Dosagem em doença de von Willebrand
O médico controlará os sangramentos de acordo com as diretrizes para a hemofilia A.
Via e/ou modo de administração
O medicamento Immunate é administrado por via intravenosa após a preparação da solução com o solvente fornecido. Deve seguir estritamente as recomendações do médico. Para dissolver o produto, deve utilizar apenas o conjunto de administração fornecido na embalagem, pois a adsorção do factor humano de coagulação VIII nas superfícies internas de alguns conjuntos de infusão pode levar a falha no tratamento. O medicamento Immunate deve ser dissolvido imediatamente antes da administração. A solução deve ser utilizada imediatamente, pois não contém conservantes.
Dissolução do pó para preparar a solução injectável Utilizar técnica asséptica!
- 1. Aquecer o frasco fechado que contém o solvente (água para injeção) à temperatura ambiente (máximo 37°C).
- 2. Remover as tampas de proteção dos frascos que contêm o pó e o solvente (fig. A) e limpar as rolhas de borracha dos dois frascos.
- 3. Colocar a extremidade ondulada do conjunto de transferência no frasco do solvente e pressionar (fig. B).
- 4. Remover a proteção da outra extremidade do conjunto de transferência, tendo cuidado para não tocar na extremidade exposta.
- 5. Inverter o conjunto de transferência com o frasco do solvente anexado sobre o frasco que contém o pó e introduzir a agulha livre através da rolha de borracha do frasco que contém o pó (fig. C). O solvente será aspirado pelo vácuo para o frasco que contém o pó.
- 6. Após cerca de um minuto, separar os frascos removendo o conjunto de transferência com o frasco do solvente anexado do frasco que contém o pó (fig. D). Como a dissolução ocorre facilmente, deve mover o frasco que contém o pó muito suavemente ou não mover. NÃO AGITAR O CONTEÚDO DO FRASCO. NÃO INVERTER O FRASCO QUE CONTÉM O PÓ ATÉ ESTAR PRONTO PARA TRANSFERIR O CONTEÚDO.
- 7. Após a dissolução, antes da administração, verificar a solução preparada para detectar a presença de partículas indissolúveis e alterações da cor. A solução deve ser transparente ou ligeiramente opalescente. No entanto, mesmo que se tenha seguido a procedura de dissolução, pode ocorrer uma pequena quantidade de partículas finas. O conjunto de filtro fornecido removerá as partículas e a potência do medicamento não será reduzida. A solução que é turva ou contém sedimento deve ser descartada. Não se deve voltar a colocar a solução pronta para uso no refrigerador.
Administração Utilizar técnica asséptica!
Utilizar o conjunto de filtro fornecido para evitar a administração de partículas de borracha, provenientes da rolha (risco de microembolia). Para retirar o produto dissolvido, colocar o conjunto de filtro na seringa de uso único e introduzir na rolha de borracha (fig. E). Desligar a seringa do conjunto de filtro por um momento. O ar entrará no frasco que contém o pó e qualquer espuma presente se dissipará. Através do conjunto de filtro (fig. F), retirar a solução para a seringa. Desligar a seringa do conjunto de filtro e injetar lentamente a solução por via intravenosa (velocidade máxima de injeção: 2 ml por minuto) utilizando o conjunto de infusão fornecido - agulha de borboleta (ou agulha de uso único fornecida).
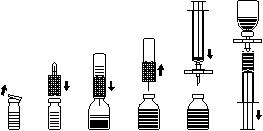
Fig. A
Fig. B
Fig. C
Fig. D
Fig. E
Fig. F
Qualquer resíduo não utilizado do medicamento ou resíduos deve ser eliminado de acordo com as regulamentações locais. A administração de Immunate deve ser documentada e o número de lote registado. Cada frasco vem com uma etiqueta adesiva que deve ser anexada à documentação.
Frequência de administração
O médico informará sobre a frequência e os intervalos de tempo para tomar o medicamento Immunate. Isso será determinado com base na eficácia do tratamento para cada doente individual.
Duração do tratamento
Normalmente, o tratamento de substituição com o medicamento Immunate é utilizado por toda a vida.
Uso de uma dose maior do que a recomendada de Immunate 1000 UI FVIII/ 750 UI VWF
- Não foram relatados sintomas de superdose de factor de coagulação VIII. Em caso de dúvida, deve consultar o seu médico.
- Pode ocorrer incidentes tromboembólicos.
- Pode ocorrer hemólise em doentes com grupo sanguíneo A, B ou AB.
Omissão da administração de Immunate 1000 UI FVIII/ 750 UI VWF:
- Não deve tomar uma dose dupla para compensar a dose omitida.
- Deve tomar a próxima dose regular e continuar o tratamento nos intervalos de tempo recomendados pelo médico.
Interrupção do tratamento com Immunate 1000 UI FVIII/ 750 UI VWF:
Não deve decidir interromper o tratamento com Immunate sem consultar o seu médico. Em caso de mais alguma dúvida sobre a utilização deste medicamento, deve consultar o seu médico.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não ocorram em todos.
Efeitos não desejados graves que podem ocorrer após a administração de produtos de factor VIII derivados de plasma humano
Factor VIII
Raramente, foram observadas reações alérgicas, que em alguns casos levaram a reações graves e potencialmente fatais (anafilaxia). Por isso, é importante estar ciente dos primeiros sintomas de reações alérgicas, tais como rubor súbito, erupção, urticária, bolhas, prurido generalizado, inchaço dos lábios e língua, dificuldade respiratória, respiração sibilante, dor no peito, sensação de aperto no peito, mau-estar geral, tontura, taquicardia e hipotensão. Estes sintomas podem ser os primeiros sinais de choque anafilático, que pode incluir tontura extrema, perda de consciência e dificuldade respiratória extrema. Em caso de ocorrência de qualquer reação alérgica ou anafilática, deve interromper imediatamente a injeção/infusão e informar o seu médico. Sintomas graves requerem tratamento imediato como em caso de emergência. Em crianças não tratadas anteriormente com medicamentos que contenham factor VIII, anticorpos inibidores (ver ponto 2) podem ocorrer muito frequentemente (mais de 1 em 10 doentes). No entanto, em doentes que foram tratados anteriormente com factor VIII (tratamento por mais de 150 dias), o risco é pouco frequente (menos de 1 em 100 doentes). Se isso ocorrer, os medicamentos do doente podem deixar de funcionar corretamente e o doente pode apresentar sangramento persistente. Se isso ocorrer, deve informar imediatamente o seu médico. A formação de anticorpos neutralizantes contra o factor de von Willebrand é uma complicação conhecida do tratamento de doentes com doença de von Willebrand. Se ocorrerem anticorpos neutralizantes (inibidores), pode manifestar-se como resultado clínico insuficiente do tratamento (sangramento não controlado com a dose adequada) ou como reação alérgica. Nesses casos, é recomendado contactar um centro especializado no tratamento da hemofilia. Após a administração de doses grandes, pode ocorrer hemólise em doentes com grupo sanguíneo A, B ou AB.
Efeitos não desejados relatados após a utilização de Immunate Muito frequentes (podem ocorrer em mais de 1 em 10 doentes)
- inibição do factor VIII (em crianças que não foram tratadas anteriormente com medicamentos que contenham factor VIII). Pouco frequentes (podem ocorrer em até 1 em 100 doentes)
- hipersensibilidade;
- inibição do factor VIII [em doentes que foram tratados anteriormente com factor VIII (tratamento por mais de 150 dias)]. Frequência desconhecida (frequência não pode ser estimada com base nos dados disponíveis)
- distúrbios da coagulação (incapacidade de formar coágulos);
- ansiedade;
- parestesia (sensação de formigamento ou picada);
- tontura;
- dor de cabeça;
- conjuntivite;
- taquicardia (batimento cardíaco acelerado);
- palpitações;
- hipotensão (pressão arterial baixa);
- rubor súbito;
- palidez (aparência pálida);
- dificuldade respiratória (problemas respiratórios);
- tosse;
- vômitos;
- náuseas;
- urticária (erupção urticariante em todo o corpo);
- erupção;
- prurido (sensação de coceira);
- rubor (vermelhidão da pele);
- suor excessivo;
- dermatite atópica (pele seca ou áspera);
- dor muscular;
- dor no peito;
- sensação de desconforto no peito;
- edema (retenção de líquidos);
- febre;
- calafrios;
- ardor e picada no local da injeção (reações no local da injeção);
- dor.
Notificação de efeitos não desejados
Se ocorrerem qualquer efeitos não desejados, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o seu médico ou farmacêutico. Efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos da Agência Nacional de Medicamentos e Produtos de Saúde. Rua ..., n.º ..., 1250- ... Lisboa. Telefone: ... Fax: ... Website: ... Efeitos não desejados também podem ser notificados ao titular da autorização de introdução no mercado. Ao notificar efeitos não desejados, pode ajudar a obter mais informações sobre a segurança do medicamento.
5. Como conservar Immunate 1000 UI FVIII/ 750 UI VWF
Conservar em local fresco e seco, protegido da luz. Não congelar. Conservar o medicamento na embalagem original para proteger do luz. Não utilizar este medicamento após o prazo de validade impresso na embalagem e na caixa, após EXP. O prazo de validade é o último dia do mês indicado. Durante o prazo de validade, o produto pode ser armazenado a temperatura ambiente (até 25°C) por um período não superior a 6 meses. Deve registrar na embalagem do produto o início da armazenagem a temperatura ambiente. Após armazenagem a temperatura ambiente, o medicamento Immunate não deve ser devolvido ao refrigerador, mas deve ser utilizado imediatamente ou descartado. Não utilize este medicamento se, após a reconstituição, a solução for turva ou contiver sedimento. Medicamentos não devem ser eliminados na canalização ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos de que já não precisa. Este procedimento ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém Immunate 1000 UI FVIII/ 750 UI VWF
Pó:
- Os princípios ativos do medicamento são o factor humano de coagulação VIII e o factor humano de von Willebrand. Cada frasco contém nominalmente 1000 UI de factor VIII e 750 UI de factor de von Willebrand obtidos a partir de plasma humano. Após a reconstituição com o solvente fornecido, o produto contém aproximadamente 100 UI/ml de factor VIII de plasma humano e 75 UI/ml de factor de von Willebrand de plasma humano.
- Os outros componentes são albumina humana, glicina, cloreto de sódio, citrato de sódio, cloreto de lisina e cloreto de cálcio.
Solvente:
- Água para injeção
Como é Immunate 1000 UI FVIII/ 750 UI VWF e que conteúdo tem a embalagem
Pó e solvente para solução injectável. Pó branco ou amarelo pálido ou massa cristalizada. O pó e o solvente estão disponíveis em frascos de vidro de uso único, Ph. Eur. (pó: vidro do tipo II; solvente: vidro do tipo I), fechados com rolhas de borracha de silicone, Ph. Eur. Cada embalagem contém: 1 frasco de Immunate 1000 UI FVIII/ 750 UI VWF, 1 frasco de água para injeção (10 ml), 1 conjunto de transferência ou filtro, 1 seringa de uso único (10 ml), 1 agulha de uso único e 1 conjunto de infusão (agulha de borboleta). Tamanho da embalagem: 1 x 1000 UI FVIII/ 750 UI VWF
Titular da autorização de introdução no mercado e fabricante
Titular da autorização de introdução no mercado
Takeda Pharma - Sociedade Unipessoal, Lda.
Rua ..., n.º ..., 1250- ... Lisboa
Fabricante
Takeda Manufacturing Austria AG
Industriestrasse 67
1221 Viena
Áustria
Este medicamento está autorizado nos Estados-Membros do Espaço Económico Europeu sob os seguintes nomes:
Immunate: Áustria, Bulgária, Chipre, Estónia, Finlândia, Alemanha, Letónia, Lituânia, Malta, Polónia, Portugal, Roménia, Eslováquia, Eslovénia, Suécia
Immunate Stim Plus: República Checa
Immunate S/D: Hungria
Talate: Itália
Data da última revisão do folheto: 12/2021
Outras fontes de informação
Informações destinadas apenas a profissionais de saúde:
Dosagem em hemofilia A
A dose e a duração do tratamento de substituição dependem do grau de deficiência de factor VIII, da localização e extensão do sangramento e do estado clínico do doente. A dose de factor VIII administrada é expressa em unidades internacionais (UI), referenciadas ao padrão atual da OMS para produtos que contenham factor VIII. A atividade de factor VIII no sangue é expressa em percentagem (em relação ao sangue normal humano) ou em UI (em relação ao Padrão Internacional para o factor VIII no sangue). Uma unidade internacional (UI) de atividade de factor VIII corresponde à quantidade de factor VIII contida em 1 mililitro de sangue normal humano. O cálculo da dose necessária de factor VIII baseia-se na observação empírica de que 1 UI de factor VIII por quilograma de peso corporal aumenta a atividade de factor VIII no sangue em cerca de 2% da atividade normal. A dose necessária é calculada com base na seguinte fórmula:
Dose necessária = peso corporal (kg) x aumento desejado de factor VIII (%) x 0,5
- País de registo
- Substância ativa
- Requer receita médicaNão
- Fabricante
- ImportadorTakeda Manufacturing Austria AG
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Immunate 1000 Iu Fviii/750 Iu VufForma farmacêutica: Pó, 1000 UISubstância ativa: coagulation factor VIIIFabricante: CSL Behring GmbHRequer receita médicaForma farmacêutica: Pó, 2000 UISubstância ativa: coagulation factor VIIIFabricante: CSL Behring GmbHRequer receita médicaForma farmacêutica: Pó, 250 UISubstância ativa: coagulation factor VIIIFabricante: CSL Behring GmbHRequer receita médica
Alternativas a Immunate 1000 Iu Fviii/750 Iu Vuf noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Immunate 1000 Iu Fviii/750 Iu Vuf em Espanha
Alternativa a Immunate 1000 Iu Fviii/750 Iu Vuf em Ukraine
Médicos online para Immunate 1000 Iu Fviii/750 Iu Vuf
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Immunate 1000 Iu Fviii/750 Iu Vuf – sujeita a avaliação médica e regras locais.














