
Haemoctin 250

Pergunte a um médico sobre a prescrição de Haemoctin 250

Como usar Haemoctin 250
Folheto informativo para o utilizador
Haemoctin 250
Haemoctin 500
Haemoctin 1000
Pó e solvente para solução injectável
Fator VIII de coagulação humana
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto para poder relê-lo se necessário.
- Em caso de dúvidas, deve consultar o médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode ser prejudicial ao outro, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Ver ponto 4.
Índice do folheto:
- 1. O que é o medicamento Haemoctin e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Haemoctin
- 3. Como tomar o medicamento Haemoctin
- 4. Efeitos não desejados
- 5. Como conservar o medicamento Haemoctin
- 6. Conteúdo do pacote e outras informações
1. O que é o medicamento Haemoctin e para que é utilizado
Haemoctin é um medicamento produzido a partir de plasma humano. Contém fator VIII de coagulação necessário
para o processo de coagulação do sangue. Após a dissolução do pó no solvente, a solução está pronta para administração intravenosa.
O medicamento Haemoctin é utilizado no tratamento e prevenção de hemorragias em doentes com hemofilia A
(deficiência congénita de fator VIII).
O medicamento Haemoctin não contém fator de von Willebrand em quantidades farmacologicamente eficazes, por
isso não é destinado ao tratamento da doença de von Willebrand.
2. Informações importantes antes de tomar o medicamento Haemoctin
Quando não tomar o medicamento Haemoctin
- se o doente tiver alergia à substância ativa ou a qualquer um dos outros componentes do medicamento (indicados no ponto 6). A reação alérgica pode incluir erupções cutâneas, prurido, dificuldades respiratórias ou inchaço do rosto, lábios, garganta ou língua.
Precauções e advertências
A formação de inibidores (anticorpos) é uma complicação conhecida que pode ocorrer durante o tratamento com todos os medicamentos que contenham fator VIII. Esses inibidores, especialmente em altas concentrações, interrompem o tratamento eficaz e o doente será monitorizado atentamente para a formação desses inibidores. Se a hemorragia no doente não for controlada adequadamente com o medicamento Haemoctin, deve informar imediatamente o médico.
Se o doente tiver fatores de risco para doenças cardiovasculares, o tratamento com o medicamento Haemoctin pode aumentar o risco cardiovascular. Em caso de dúvidas, deve discutir com o médico.
Complicações resultantes da introdução de um cateter venoso central: Se for necessário um dispositivo de acesso venoso central (em inglês, central venous access device, CVAD), deve considerar o risco de complicações relacionadas com o CVAD, incluindo infecções locais, bacteriemias e trombose no local de inserção do cateter.
Segurança virológica
Quando os produtos medicinais são produzidos a partir de sangue ou plasma humano, são tomadas medidas para prevenir a transmissão de infecções para os doentes. Incluem:
- seleção cuidadosa dos doadores de sangue e plasma para garantir a exclusão de doadores que possam ser portadores de infecções,
- testes de todas as amostras e pools de plasma para detectar a presença de vírus/infecções,
- implementação de etapas no processo de tratamento do sangue ou plasma para inativar ou remover vírus. Apesar dessas medidas, não é possível excluir completamente a possibilidade de transmissão de infecção quando se administram medicamentos preparados a partir de sangue ou plasma humano. Isso inclui vírus ou infecções desconhecidos ou recentemente descobertos.
As medidas tomadas são consideradas eficazes contra vírus envelopados, como o vírus da imunodeficiência humana (HIV), vírus da hepatite B e vírus da hepatite C, bem como contra o vírus da hepatite A não envelopado. As medidas tomadas podem ter eficácia limitada contra vírus não envelopados, como o parvovirus B19. A infecção por parvovirus B19 pode ser grave para mulheres grávidas (infecção do feto) e para pessoas com sistema imunológico debilitado ou com certos tipos de anemia (por exemplo, falciforme ou hemolítica).
O médico pode recomendar que o doente considere a vacinação contra a hepatite A e B, se o doente receber regularmente medicamentos que contenham fator VIII produzido a partir de plasma humano.
É altamente recomendável que, em cada caso de administração de uma dose do medicamento Haemoctin, seja registrada a nome e o número de lote do medicamento, para que se possa estabelecer as séries de medicamento utilizadas no futuro.
Crianças e adolescentes
As precauções e advertências para o uso mencionadas para adultos também devem ser consideradas para crianças e adolescentes.
Haemoctin e outros medicamentos
Deve informar o médico sobre todos os medicamentos que o doente está a tomar atualmente ou recentemente, bem como sobre os medicamentos que o doente planeia tomar.
Não foram relatadas interações entre o medicamento Haemoctin e outros produtos medicinais.
Gravidez, amamentação e fertilidade
Se a doente estiver grávida ou a amamentar, suspeitar que possa estar grávida ou planeiar ter um filho, deve consultar o médico antes de tomar este medicamento.
Devido à raridade da hemofilia A em mulheres, não há experiência disponível sobre o uso de fator VIII durante a gravidez ou amamentação. Não foram realizados estudos em animais durante a gravidez e amamentação.
Condução de veículos e utilização de máquinas
O medicamento Haemoctin não tem influência ou tem influência insignificante na capacidade de conduzir veículos e utilizar máquinas.
Haemoctin contém sódio
Haemoctin 250 contém, no máximo, 16,1 mg (0,70 mmol) de sódio (principal componente do sal de cozinha)
em cada frasco. Isso corresponde a 0,81% da dose diária máxima recomendada de sódio na dieta para adultos.
Haemoctin 500/1000 contém, no máximo, 32,2 mg (1,40 mmol) de sódio (principal componente do sal de cozinha)
em cada frasco. Isso corresponde a 1,61% da dose diária máxima recomendada de sódio na dieta para adultos.
3. Como tomar o medicamento Haemoctin
O medicamento Haemoctin é destinado a administração intravenosa. O tratamento deve ser supervisionado por um médico com experiência no tratamento da hemofilia A. O medicamento Haemoctin deve ser sempre administrado de acordo com as recomendações do médico. Em caso de dúvidas, deve contactar novamente o médico.
A dose e a duração do tratamento dependem do grau de deficiência de fator VIII, da localização e extensão da hemorragia e do estado clínico do doente. O médico determinará a dose adequada para o doente.
Deve garantir condições assépticas durante todos os estágios do procedimento.
Fig. 1a
Fig. 1b
Fig. 1c
Fig. 2
Fig. 3
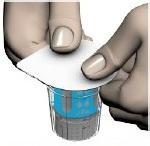

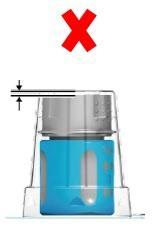


Fig. 4
Fig. 5
Fig. 6
Fig. 7
Fig. 8





Dissolução do concentrado:
- Levar o solvente (água para injeção) e o produto a temperatura ambiente em frascos não abertos. Se utilizar um banho de água para aquecer, deve ter muito cuidado para não entrar em contato com a água com as tampas ou rolhas dos frascos. Caso contrário, pode ocorrer contaminação do medicamento.
- Muito importantepara a aplicação correta do sistema de transferência: antes de abrir, deve garantir que a parte inferior branca do sistema de transferência esteja fixada diretamente na base do blister (fig. 1a: correto / fig. 1b: incorreto). Se estiver incorreto: pressione o sistema de transferência para baixo no blister até que a parte inferior branca do sistema de transferência esteja fixada diretamente na base do blister (fig. 1c).
- Remover as tampas dos frascos com solvente e produto, para expor as partes centrais das rolhas de borracha (fig. 2). Limpar as rolhas de borracha dos frascos com produto e solvente com um desinfetante.
- Remover a parte superior do invólucro do sistema de transferência (fig. 3).
- Colocar o frasco com solvente em uma superfície plana. Colocar a parte azul do sistema de transferência no blister diretamente sobre o frasco com solvente (fig. 4). Não girar o sistema de transferência!
- Remover o resto do blister do sistema de transferência. Não apertar o blister! Agora, a parte branca do sistema de transferência é exposta (fig. 5).
- Colocar o frasco com produto em uma superfície plana.
- Girar o sistema de transferência conectado e o frasco com solvente de cabeça para baixo. Empurrar a agulha da parte branca do adaptador para baixo através da rolha do frasco com produto (fig. 6). O vácuo no frasco com produto faz com que o solvente entre no frasco com produto.
- Um movimento suave do frasco com produto ajuda a dissolver o pó. Não agitar vigorosamente, para evitar a formação de espuma! A solução é transparente ou ligeiramente opalescente.
- Em seguida, desparafusar a parte azul do sistema de transferência junto com o frasco com solvente no sentido contrário ao dos ponteiros do relógio (fig. 7). Descartar o frasco com solvente com a parte azul do sistema de transferência conectada. Agora, a conexão luer-lock é visível.
A solução pronta para uso deve ser administrada imediatamente após a reconstituição. Não usar soluções que estejam turvas ou contenham partículas sólidas.
Administração:
- Após a reconstituição do pó, como descrito acima, conectar a seringa fornecida à conexão luer-lock do frasco com produto com a parte branca do sistema de transferência (fig. 8). Isso permitirá a fácil aspiração do medicamento reconstituído (Haemoctin 250: volume total de 2,5 ml, Haemoctin 500/1000: volume total de 5 ml) para a seringa. Um filtro separado não é necessário, pois o sistema de transferência está equipado com um filtro integrado.
- Desconectar cuidadosamente o frasco com a parte branca do sistema de transferência da seringa. Administrar lentamente por via intravenosa o produto usando a agulha de borboleta fornecida. Recomenda-se não administrar mais de 2-3 ml/minuto.
- Após o uso, a agulha de borboleta pode ser protegida com a tampa de proteção.
Uso de uma dose maior do que a recomendada do medicamento Haemoctin
Se o doente acreditar que recebeu uma dose maior do que a recomendada do medicamento Haemoctin, deve contactar o médico, que decidirá sobre o tratamento adicional.
Omissão da administração do medicamento Haemoctin
Nesse caso, o médico decidirá se é necessário continuar o tratamento.
Interrupção do tratamento com o medicamento Haemoctin
Não deve interromper o tratamento com o medicamento Haemoctin sem consultar o médico.
Em caso de dúvidas adicionais sobre o uso deste medicamento, deve contactar o médico ou farmacêutico.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não ocorram em todos.
Em caso de ocorrência de algum dos seguintes sintomas, deve informar imediatamente o médico:
- vermelhidão da pele,
- sensação de queimadura e picada no local da injeção,
- arrepios,
- vermelhidão súbita do rosto,
- dor de cabeça,
- urticária,
- hipotensão,
- sonolência,
- náuseas,
- inquietação motora,
- taquicardia,
- opressão no peito,
- formigamento,
- vômitos,
- respiração sibilante. Pode ser uma reação alérgica ou uma reação alérgica grave (choque anafilático) ou reação de hipersensibilidade.
Os seguintes efeitos não desejados foram observados com o uso do medicamento Haemoctin
Desconhecida: frequência não pode ser estimada com base nos dados disponíveis
- choque (anafilático), reação alérgica
- vermelhidão da pele, prurido, urticária
Em crianças não tratadas anteriormente com medicamentos que contenham fator VIII, anticorpos bloqueadores (ver ponto 2) podem ocorrer muito frequentemente (mais de 1 em 10 doentes). No entanto, em doentes que foram tratados anteriormente com fator VIII (mais de 150 dias de tratamento), o risco é incomum (menos de 1 em 100 doentes). Se isso ocorrer, os medicamentos do doente podem deixar de funcionar corretamente e o doente pode apresentar hemorragia persistente. Se isso ocorrer, deve contactar imediatamente o médico
Efeitos não desejados em crianças e adolescentes
Salvo a formação de inibidores (anticorpos), espera-se que os efeitos não desejados em crianças sejam os mesmos que em adultos.
Notificação de efeitos não desejados
Se ocorrerem algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados no folheto, deve informar o médico, farmacêutico ou enfermeiro. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Produtos Medicinais da Agência Reguladora de Produtos Medicinais, Dispositivos Médicos e Produtos Biocidas
Al. Jerozolimskie 181C
02 222 Varsóvia
Tel.: +48 22 49 21 301
Fax: +48 22 49 21 309
Sítio web: https://smz.ezdrowie.gov.pl
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos não desejados permitirá reunir mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento Haemoctin
O medicamento deve ser conservado em local não visível e inacessível a crianças.
Conservar os frascos no invólucro exterior para proteger da luz.
Não conservar a uma temperatura superior a 25°C. Não congelar.
Não usar este medicamento após o prazo de validade impresso na etiqueta do frasco e no invólucro exterior após: Prazo de validade.
Qualquer resíduo de produto não utilizado ou resíduos deve ser eliminado de acordo com as regulamentações locais. Os medicamentos não devem ser jogados na canalização ou em recipientes de lixo doméstico.
Deve perguntar ao farmacêutico como eliminar os medicamentos que já não são necessários. Essa ação ajudará a proteger o meio ambiente.
6. Conteúdo do pacote e outras informações
O que contém o medicamento Haemoctin
- A substância ativa do medicamento é: fator VIII de coagulação humana.
- Os outros componentes são: glicina, cloreto de sódio, citrato de sódio e cloreto de cálcio.
- O frasco com solvente contém água para injeção.
Como é o medicamento Haemoctin e que conteúdo tem o pacote
O medicamento Haemoctin é fornecido sob a forma de pó liofilizado (liofilizado). A água para injeção é usada como solvente. A solução reconstituída é transparente ou ligeiramente opalescente.
Haemoctin 250 contém 1 frasco com 250 UI e 1 frasco com 2,5 ml de água para injeção (100 UI/ml)
Haemoctin 500 contém 1 frasco com 500 UI e 1 frasco com 5 ml de água para injeção (100 UI/ml)
Haemoctin 1000 contém 1 frasco com 1000 UI e 1 frasco com 5 ml de água para injeção (200 UI/ml)
Cada pacote contém
- 1 seringa de uso único
- 1 sistema de transferência com filtro integrado
- 1 agulha de borboleta
Titular da autorização de comercialização e fabricante:
Biotest Pharma GmbH
Landsteinerstrasse 5
63303 Dreieich
Alemanha
Tel.: +49 6103 801-0
Fax: +49 6103 801-150
Email: [email protected]
Data da última atualização do folheto: 30.12.2024
Informações destinadas apenas ao pessoal médico especializado:
Monitorização do tratamento
Para determinar a dose a ser administrada e a frequência de infusões repetidas, é recomendável durante o tratamento a determinação adequada dos níveis de fator VIII. Os doentes individuais podem variar na resposta ao fator VIII, mostrando diferentes valores de meia-vida e diferentes níveis de recuperação. A dose baseada no peso corporal pode exigir ajuste em doentes com baixo peso ou excesso de peso. Especialmente em grandes procedimentos cirúrgicos, é necessário um controle preciso do tratamento de substituição por meio de testes de coagulação (atividade do fator VIII no soro).
No caso do uso de um teste de coagulação in vitrode uma etapa baseado no tempo de tromboplastina parcial ativada (aPTT) para determinar a atividade do fator VIII em amostras de sangue do doente, tanto o tipo de reagente aPTT quanto o padrão de referência usado no teste podem ter um impacto significativo nos resultados da determinação da atividade do fator VIII no soro. Também podem ocorrer diferenças significativas entre os resultados do teste de coagulação de uma etapa baseado no aPTT e os resultados do teste cromogênico de acordo com a Farmacopeia Europeia. Isso é particularmente importante no caso de mudanças de laboratório e (ou) reagentes usados no teste.
Posologia
A dose e a duração do tratamento de substituição dependem do grau de deficiência de fator VIII, da localização e extensão da hemorragia e do estado clínico do doente.
A quantidade de unidades de fator VIII administradas é expressa em unidades internacionais (UI), referindo-se ao padrão atual da OMS para produtos que contenham fator VIII. A atividade do fator VIII no soro é expressa como um percentual (em relação ao soro humano normal) ou melhor em unidades internacionais (em relação ao padrão internacional de fator VIII no soro).
Uma unidade internacional (UI) de atividade do fator VIII corresponde à quantidade de fator VIII em um mililitro de soro humano normal.
Tratamento sob demanda
O cálculo da dose necessária de fator VIII foi baseado na observação empírica de que 1 unidade internacional (UI) de fator VIII por 1 kg de peso corporal aumenta a atividade do fator VIII no soro de 1 a 2% da atividade normal. A dose necessária é calculada com base na seguinte fórmula:
Dose necessária = peso corporal (kg) × aumento desejado do fator VIII (%) × 0,5
A dose necessária e a frequência de administração devem ser sempre adaptadas à eficácia clínica em cada caso.
No caso de hemorragias do tipo a seguir, a atividade do fator VIII no soro não deve diminuir abaixo do nível de atividade indicado (% da norma). Para determinar a dose com base no tipo de hemorragia e no procedimento cirúrgico, pode-se usar a seguinte tabela:
Grau de hemorragia /
Tipo de procedimento cirúrgico
Nível necessário de
fator VIII de coagulação (%)
Frequência de doses (horas) /
Duração do tratamento (dias)
Hemorragia
Hemorragia inicial nas articulações,
músculos ou hemorragia na cavidade
oral
- 20 - 40 Repetir a cada 12-24 horas. Pelo menos 1 dia, até que a dor causada pela hemorragia desapareça ou até que a ferida cicatrize. Hemorragia mais grave nas articulações, músculos ou hemorragia que ameace a vida
- 30 - 60 Repetir a cada 12-24 horas durante 3-4 dias ou mais, até que a dor e a incapacidade motora aguda desapareçam. Hemorragias que ameacem a vida
- 60 - 100 Repetir a cada 8-24 horas até que o perigo desapareça.
Procedimentos cirúrgicos
Procedimento cirúrgico menor
incluindo extração de dentes
- 30 - 60 A cada 24 horas, pelo menos 1 dia, até que a ferida cicatrize. Procedimento cirúrgico maior
- 80 - 100 (pré e pós-operatório) Repetir a cada 8-24 horas até que a ferida cicatrize adequadamente e, em seguida, continuar por pelo menos 7 dias para manter a atividade do fator VIII em 30-60%.
Prevenção
Na prevenção de longo prazo de hemorragias em doentes com hemofilia A grave, as doses de fator VIII geralmente administradas são de 20-40 UI/kg de peso corporal a cada 2-3 dias. Em alguns casos, especialmente em doentes mais jovens, podem ser necessários intervalos mais curtos entre as doses ou doses mais altas.
Modo de administração:
Administração intravenosa. Recomenda-se não administrar mais de 2-3 ml/minuto.
Deve usar apenas o conjunto de infusão fornecido, pois a adsorção do fator VIII nas superfícies internas de alguns conjuntos de infusão pode levar a falha no tratamento.
Não misturar o medicamento Haemoctin com outros produtos medicinais.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorBiotest Pharma GmbH
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Haemoctin 250Forma farmacêutica: Pó, 1000 UISubstância ativa: coagulation factor VIIIFabricante: CSL Behring GmbHRequer receita médicaForma farmacêutica: Pó, 2000 UISubstância ativa: coagulation factor VIIIFabricante: CSL Behring GmbHRequer receita médicaForma farmacêutica: Pó, 250 UISubstância ativa: coagulation factor VIIIFabricante: CSL Behring GmbHRequer receita médica
Alternativas a Haemoctin 250 noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Haemoctin 250 em Espanha
Alternativa a Haemoctin 250 em Ukraine
Médicos online para Haemoctin 250
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Haemoctin 250 – sujeita a avaliação médica e regras locais.














