
Gartior
Pergunte a um médico sobre a prescrição de Gartior

Como usar Gartior
Folheto informativo: informação para o doente
Gartior, 18 microgramas/dose medida, pó de inhalação em cápsula dura
Tiotrópio
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto, para que possa relê-lo se necessário.
- Em caso de dúvidas, deve consultar o médico ou farmacêutico.
- Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico ou farmacêutico. Ver ponto 4.
Índice do folheto
- 1. O que é o medicamento Gartior e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Gartior
- 3. Como tomar o medicamento Gartior
- 4. Efeitos não desejados
- 5. Como conservar o medicamento Gartior
- 6. Conteúdo da embalagem e outras informações
1. O que é o medicamento Gartior e para que é utilizado
O medicamento Gartior, 18 microgramas/dose medida, pó de inhalação em cápsula dura, contém a substância ativa tiotrópio e pertence a um grupo de medicamentos utilizados no tratamento de doenças obstrutivas das vias respiratórias, medicamentos inhalados, medicamentos anticolinérgicos.
O medicamento Gartior facilita a respiração das pessoas com doença pulmonar obstrutiva crónica (DPOC).
A DPOC é uma doença pulmonar crónica que causa falta de ar e tosse. O nome DPOC está relacionado com a bronquite crónica e a enfisema pulmonar. A DPOC é uma doença crónica, por isso o medicamento Gartior deve ser tomado diariamente, e não apenas quando ocorrem problemas respiratórios ou outros sintomas da DPOC.
O Gartior é um medicamento broncodilatador de ação prolongada que ajuda a dilatar as vias respiratórias e a facilitar a entrada de ar nos pulmões. A administração regular do medicamento Gartior também pode ajudar a reduzir a falta de ar persistente associada à doença e a melhorar a qualidade de vida diária. A administração diária do medicamento Gartior também pode ajudar a prevenir o agravamento súbito e temporário dos sintomas da DPOC, que pode durar vários dias. O efeito do medicamento dura 24 horas, por isso deve ser tomado apenas uma vez por dia.
As informações sobre a dosagem correta do medicamento Gartior podem ser encontradas mais adiante neste folheto, no ponto 3. Como tomar o medicamento Gartior e nas Instruções de uso.
2. Informações importantes antes de tomar o medicamento Gartior
Quando não tomar o medicamento Gartior
- se o doente for alérgico ao tiotrópio ou a qualquer outro componente deste medicamento (listados no ponto 6).
- se o doente for alérgico à atropina ou aos seus derivados, como por exemplo, ipratrópio ou oxitrópio.
Precauções e advertências
Antes de iniciar o tratamento com o medicamento Gartior, deve consultar o médico ou farmacêutico.
- Deve consultar o médico se o doente tiver glaucoma de ângulo estreito, problemas com a próstata ou dificuldades em urinar.
- Se o doente tiver problemas renais, deve consultar o médico.
- O medicamento Gartior é indicado para tratamento de manutenção em doentes com doença pulmonar obstrutiva crónica. Não deve ser utilizado para tratar episódios agudos de falta de ar ou sibilância.
- Após a administração do medicamento Gartior, podem ocorrer reações alérgicas imediatas, como erupções cutâneas, edema, prurido, sibilância ou falta de ar. Nesse caso, deve contactar imediatamente o médico.
- Imediatamente após a administração de medicamentos inhalados, como o Gartior, pode ocorrer sensação de compressão no peito, tosse, sibilância ou falta de ar. Nesse caso, deve contactar imediatamente o médico.
- Deve ter cuidado para que o pó não entre nos olhos durante a inhalação, pois pode causar a ocorrência ou agravamento de sintomas de glaucoma de ângulo estreito, que é uma doença ocular. Dor nos olhos ou desconforto, visão turva, visão de um halo colorido em torno de uma fonte de luz ou alterações na visão das cores, juntamente com vermelhidão nos olhos, podem ser sinais de ocorrência de glaucoma de ângulo estreito agudo. Os distúrbios oculares podem ser acompanhados de dor de cabeça, náuseas e vômitos. Se ocorrerem sintomas de glaucoma de ângulo estreito, deve interromper a administração do tiotrópio e contactar imediatamente o médico, preferencialmente um oftalmologista.
- A secura da mucosa oral que ocorre durante a administração do medicamento, relacionada com a sua ação anticolinérgica, pode causar cáries dentárias após um período prolongado, por isso é importante manter a higiene oral.
- Se o doente teve um ataque cardíaco nos últimos 6 meses ou teve arritmia cardíaca instável ou grave nos últimos 12 meses, deve informar o médico. É importante tomar a decisão certa sobre se o medicamento Gartior pode ser utilizado pelo doente.
- O medicamento Gartior não deve ser tomado mais de uma vez por dia.
Crianças e adolescentes
O medicamento Gartior não é recomendado para crianças e adolescentes com menos de 18 anos.
Medicamento Gartior e outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que está a tomar atualmente ou recentemente, bem como sobre os medicamentos que planeia tomar.
Deve informar o médico ou farmacêutico sobre outros medicamentos que está a tomar para a doença pulmonar, como ipratrópio ou oxitrópio.
Não foram relatados efeitos não desejados durante a administração do medicamento Gartior com outros medicamentos utilizados no tratamento da DPOC, como medicamentos inhalados de ação rápida, por exemplo, salbutamol, metilxantinas, por exemplo, teofilina, e (ou) esteroides orais e inhalados, por exemplo, prednisolona.
Gravidez e amamentação
Se a paciente estiver grávida ou a amamentar, suspeitar que possa estar grávida ou planeiar ter um filho, deve consultar o médico ou farmacêutico antes de tomar este medicamento. Não deve tomar este medicamento, a menos que tenha sido prescrito pelo médico.
Condução de veículos e utilização de máquinas
Se ocorrerem tonturas, visão turva ou dor de cabeça, esses estados podem afetar a capacidade de conduzir veículos e utilizar máquinas.
Medicamento Gartior contém lactose
Se o doente tiver sido diagnosticado previamente com intolerância a certains açúcares ou alergia a proteínas do leite (que podem estar presentes em pequenas quantidades no componente lactose), o doente deve contactar o médico antes de tomar o medicamento.
3. Como tomar o medicamento Gartior
Este medicamento deve ser sempre tomado de acordo com as recomendações do médico ou farmacêutico. Em caso de dúvidas, deve consultar o médico ou farmacêutico.
A dose recomendada é a inhalação do conteúdo de uma cápsula (18 microgramas de tiotrópio) uma vez por dia.
Deve realizar 2 inhalações da mesma cápsula (ver ponto "Instruções de uso" no final deste folheto).
Não deve tomar uma dose maior do que a recomendada.
O medicamento Gartior não é recomendado para crianças e adolescentes com menos de 18 anos.
Deve tomar a cápsula no mesmo horário todos os dias. Isso é importante, pois o medicamento Gartior tem efeito durante 24 horas.
As cápsulas só devem ser utilizadas para inhalação e não devem ser ingeridas. As cápsulas não devem ser engolidas.
O inhalador Vertical-Haler, no qual se insere a cápsula do medicamento Gartior, perfura a cápsula, permitindo a inhalação do pó contido.
O doente deve certificar-se de que tem o inhalador e de que o utiliza corretamente. As Instruções de uso do inhalador encontram-se mais adiante neste folheto.
Deve certificar-se de que o ar não é expirado para o inhalador Vertical-Haler.
Em caso de dificuldades com o uso do inhalador Vertical-Haler, deve contactar o médico, enfermeira ou farmacêutico para que indiquem a forma correta de utilização.
O inhalador Vertical-Haler deve ser limpo uma vez por semana. As Instruções de limpeza do inhalador encontram-se mais adiante neste folheto.
Ao tomar o medicamento Gartior, deve ter cuidado para que o pó não entre nos olhos. Isso pode causar visão turva, dor nos olhos e (ou) vermelhidão nos olhos. Deve lavar imediatamente os olhos com água morna e contactar o médico sem demora.
Administração de uma dose maior do que a recomendada do medicamento Gartior
Em caso de administração de mais de 1 cápsula do medicamento Gartior por dia, deve contactar imediatamente o médico. O doente pode ter um risco aumentado de efeitos não desejados, como secura da mucosa oral, constipação, dificuldades em urinar, aceleração do ritmo cardíaco ou visão turva.
Omissão da administração do medicamento Gartior
Se o doente esquecer de tomar uma dose, deve tomá-la assim que se lembrar.
Nunca deve tomar duas doses ao mesmo tempo ou no mesmo dia. A próxima dose deve ser tomada no horário habitual.
Interrupção da administração do medicamento Gartior
Antes de interromper a administração do medicamento Gartior, deve consultar o médico ou farmacêutico.
Após a interrupção da administração do medicamento Gartior, os sintomas da DPOC podem piorar.
Em caso de dúvidas adicionais sobre a administração deste medicamento, deve consultar o médico ou farmacêutico.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não ocorram em todos.
Os efeitos não desejados descritos abaixo foram relatados por doentes durante a administração deste medicamento. Os efeitos não desejados são listados de acordo com a frequência de ocorrência: frequente, menos frequente, raro ou frequência desconhecida.
Frequente (pode ocorrer em até 1 em cada 10 doentes):
- secura da mucosa oral: geralmente de intensidade leve
Menos frequente (pode ocorrer em até 1 em cada 100 doentes):
- tonturas
- dor de cabeça
- distúrbios do paladar
- visão turva
- batimento cardíaco irregular (fibrilação atrial)
- faríngite
- rouquidão (disfonia)
- tosse
- azia (doença de refluxo gastroesofágico)
- constipação
- infecções fúngicas na boca e garganta (candidíase oral e faríngea)
- erupções cutâneas
- dificuldades em urinar (retenção urinária)
- dor ao urinar
Raro (pode ocorrer em até 1 em cada 1000 doentes):
- dificuldades em adormecer (insónia)
- visão de um halo colorido em torno de uma fonte de luz ou alterações na visão das cores, juntamente com vermelhidão nos olhos (glaucoma)
- aumento da pressão ocular
- batimento cardíaco irregular (taquicardia supraventricular)
- aceleração do ritmo cardíaco (taquicardia)
- sensação de batimento cardíaco rápido (palpitações)
- compressão no peito relacionada com tosse, sibilância ou falta de ar ocorrendo imediatamente após a inhalação do medicamento (broncoespasmo)
- sangramento nasal
- larigite
- sinusite
- obstrução intestinal ou falta de movimentos intestinais (obstrução intestinal, incluindo obstrução intestinal paralítica)
- gengivite
- glossite
- dificuldades em engolir (disfagia)
- estomatite
- náuseas
- reações de hipersensibilidade, incluindo reações imediatas
- reação alérgica grave que pode causar edema na face ou garganta (angioedema)
- urticária
- prurido
- infecções urinárias
Frequência desconhecida (frequência não pode ser estimada com base nos dados disponíveis):
- desidratação
- cáries dentárias
- reações alérgicas graves (reações anafiláticas)
- infecções ou ulcerações da pele
- secura da pele
- edema articular
Efeitos não desejados graves, como reações alérgicas que podem causar edema na face ou garganta (angioedema), ou outras reações de hipersensibilidade (como hipotensão súbita ou tonturas) podem ocorrer sozinhos ou como parte de uma reação alérgica grave (reação anafilática) após a administração do medicamento Gartior. Além disso, como no caso de outros medicamentos inhalados, alguns doentes podem apresentar compressão no peito, tosse, sibilância ou falta de ar imediatamente após a inhalação do medicamento (broncoespasmo). Em caso de ocorrência de qualquer um desses sintomas, deve contactar imediatamente o médico.
Notificação de efeitos não desejados
Se ocorrerem efeitos não desejados, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico, farmacêutico ou enfermeira.
Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos da Agência Nacional de Vigilância Sanitária:
Rua Alexandre Herculano, 58, 1250-008 Lisboa
Telefone: +351 21 798 73 00, fax: +351 21 798 73 99
Site: https://www.infarmed.pt/
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos não desejados permite reunir mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento Gartior
O medicamento deve ser conservado em local seguro e fora do alcance das crianças.
Não deve tomar este medicamento após o prazo de validade impresso na caixa de cartão ou na embalagem de blister: data de validade. O prazo de validade é o último dia do mês indicado.
O inhalador Vertical-Haler deve ser eliminado após 90 dias da primeira utilização.
A cápsula deve ser utilizada imediatamente após a abertura da embalagem de blister.
Não deve conservar o medicamento a temperaturas superiores a 30°C.
Os medicamentos não devem ser eliminados na canalização ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos que já não são utilizados. Este procedimento ajudará a proteger o ambiente.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento Gartior
A substância ativa é tiotrópio. Cada cápsula contém 22,5 microgramas de brometo de tiotrópio monohidratado, o que corresponde a 18 microgramas de tiotrópio.
A dose deliverada durante a inhalação, a partir do bocal do inhalador Vertical-Haler, contém 10 microgramas de tiotrópio.
Os outros componentes são lactose monohidratada (que pode conter pequenas quantidades de proteínas do leite).
A cápsula contém gelatina, água purificada, macrogol 4000, dióxido de titânio (E 171), óxido de ferro amarelo (E 172) e azul brilhante FCF (E 133).
Como é o medicamento Gartior e que conteúdo tem a embalagem
O medicamento Gartior, 18 microgramas/dose medida, pó de inhalação em cápsula dura, são cápsulas de gelatina duras e opacas de cor verde, contendo um pó branco.
Blister de folha de alumínio/PVC/Alumínio contendo 10 cápsulas.
O Vertical-Haler é um inhalador de dose única com bocal laranja e corpo branco. É fabricado em polímero de acrilonitrila-butadieno-estireno (ABS) e aço inoxidável.
Os materiais que têm contacto direto com o medicamento no momento da inhalação são: aço inoxidável 304 (agulhas que perfuram a cápsula), ABS (entra na composição do bocal e da câmara da cápsula).
Os seguintes tamanhos de embalagem estão disponíveis:
- Caixa de cartão contendo 30 cápsulas (3 blisters) e inhalador de pó seco
- Caixa de cartão contendo 60 cápsulas (6 blisters) e inhalador de pó seco
- Caixa de cartão contendo 90 cápsulas (9 blisters) e inhalador de pó seco
- Caixa de cartão contendo 30 cápsulas (3 blisters)
- Caixa de cartão contendo 60 cápsulas (6 blisters)
Nem todos os tamanhos de embalagem podem estar disponíveis.
Titular da autorização de comercialização
Glenmark Pharmaceuticals s.r.o.
Hvězdova 1716/2b
140 78 Praga 4
República Checa
Fabricante/Importador
Pharmadox Healthcare Limited
Kw20a Kordin Industrial Park
Paola, PLA 3000
Malta
Glenmark Pharmaceuticals s.r.o.
Fibichova 143
566 17 Vysoké Mýto
República Checa
Este medicamento está autorizado para comercialização nos países membros do Espaço Económico Europeu sob as seguintes denominações:
Para obter informações mais detalhadas sobre o medicamento, deve contactar o representante local do titular da autorização de comercialização:
| País | Nome do medicamento |
| República Checa | Gartior |
| Polónia | Gartior |
| Eslováquia | Tiotrópio Glenmark |
Glenmark Pharmaceuticals, S.A.
Rua Alexandre Herculano, 58, 1250-008 Lisboa
Telefone: +351 21 798 73 00
Email: [[email protected]](mailto:[email protected])
Data da última revisão do folheto:
Dispositivo médico: Inhalador de pó seco
- (em inglês: DPI - Dry Powder Inhaler) Nome comercial: Vertical-Haler
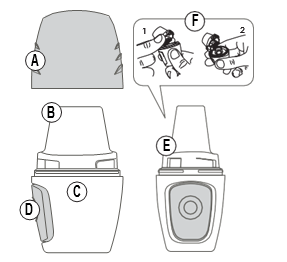
Partes do inhalador:
A) Bocal D) Botão lateral
B) Ustnik E) Espaço aberto
C) Câmara F) Câmara da cápsula
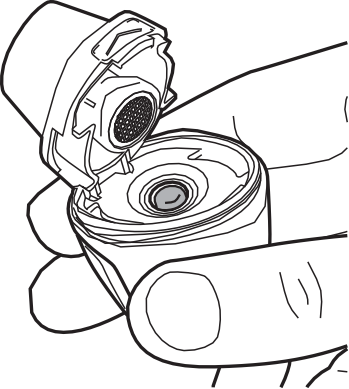
- 1) Remoção da tampaAo utilizar o inhalador, as mãos devem estar limpas e secas. Deve segurar firmemente a base do inhalador e remover a tampa do lado, como mostrado abaixo. (fig. 1).


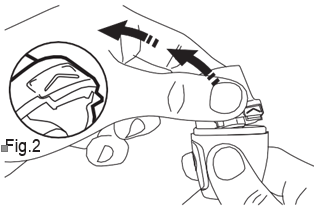
- 2) Abertura do inhalador Vertical-HalerPara abrir o inhalador, deve segurá-lo firmemente pela base. Com a ponta do dedo, deve pressionar para cima a área marcada com "" (fig. 2).




Antes de usar:
O inhalador foi projetado para
auxiliar a inhalação de medicamentos
inhalados em pó seco contidos em
cápsulas; tal dispositivo é
ativado pela inhalação (inhalador de
pó seco ativado pela inhalação -
DPI). As cápsulas que contêm o
medicamento são armazenadas
separadamente do inhalador.
Cada cápsula que contém uma dose única deve ser colocada na câmara do inhalador apenas no momento de uso.
Após a colocação na câmara do inhalador e
perfuração pelo botão, logo antes da
inhalação, o doente pode iniciar a
inhalação do medicamento.
O inhalador deve ser vendido apenas com
o medicamento.
Contraindicações:
Pacientes que não são capazes de controlar
suas próprias respirações.
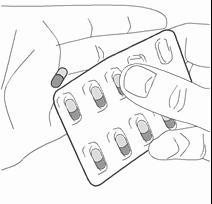
- 3) Remoção da cápsulaDeve remover a folha de proteção para retirar a cápsula do blister (fig. 3).
- 4) Colocação da cápsulaDeve segurar o inhalador aberto na vertical. Deve colocar a cápsula na câmara (fig. 4).
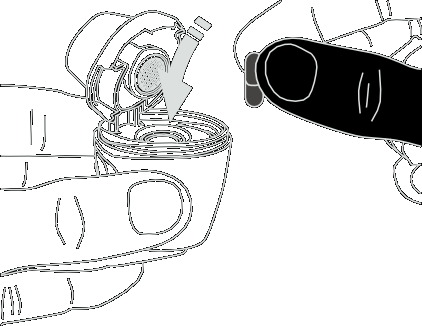
- 5) Verificação da posição correta da cápsulaA cápsula deve estar no encaixe da câmara (fig. 5).
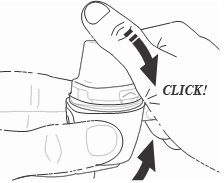
- 6) Fechamento do inhalador Vertical-HalerDeve segurar o inhalador Vertical-Haler na vertical e fechar o bocal. O som de "clic" confirma que o inhalador Vertical-Haler foi fechado corretamente (fig. 6).
- 8) Realização de uma expiração profundaDeve segurar o inhalador longe da boca e realizar uma expiração tranquila e profunda (fig. 9). Deve segurar a respiração.
NÃO deve soprar ar para o interior do inhalador. O ar umedecido soprado para o interior do inhalador
pode reduzir a dose inalada.
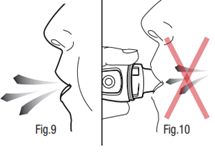
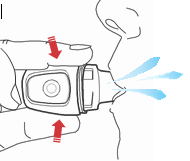
- 9) Realização da inhalaçãoDeve colocar o bocal entre os dentes e fechar firmemente os lábios em torno dele. Deve inspirar o ar lentamente e tão profundamente quanto possível (fig. 11). O som vibratório confirma a realização correta da ação.
NÃO deve bloquear as entradas de ar localizadas diretamente abaixo do bocal. Caso contrário, não será
garantida a liberação ótima do medicamento.
O som vibratório confirma a inhalação realizada corretamente.
NÃO deve pressionar o botão lateral durante a inhalação, pois isso bloqueará a liberação do medicamento. O som
vibratório confirma a inhalação realizada
corretamente.
- 7) Perfuração da cápsulaDeve segurar o inhalador na vertical (fig. 7) e pressionar firmemente o botão lateral, até sentir a resistência. A resistência leve confirma a perfuração correta da cápsula (fig. 8)
Se necessário, deve repetir a ação do ponto 5. Deve abrir a câmara da cápsula (fig. 2), para garantir que
a cápsula esteja corretamente colocada no
encaixe (fig. 5).

- 10) Seguração da respiraçãoDeve segurar a respiração por pelo menos 10 segundos. Deve remover o inhalador da boca e respirar normalmente (fig. 9). Isso garante que o medicamento se deposita nos pulmões. Deve repetir as etapas de 8 a 10, para garantir que todo o medicamento foi administrado.

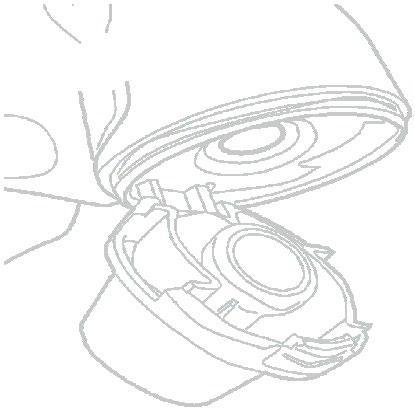
- 11) Verificação da cápsula vaziaDeve abrir o inhalador Vertical-Inhaler e verificar se o pó do medicamento ainda está na cápsula. Se o pó ainda estiver na cápsula, deve repetir as etapas de 8 a 11.
- 12) Esvaziamento do inhalador Vertical-HalerDeve remover a cápsula vazia (fig. 13). A cápsula pode ter se partido em pequenos fragmentos, que podem ter entrado na boca ou garganta. Não deve se preocupar, pois o componente da cápsula é comestível e inofensivo.
- 13) Limpeza do inhalador Vertical-HalerO inhalador Vertical-Haler deve ser limpo uma vez por semana. O bocal do inhalador e a câmara da cápsula devem ser limpos com um pano limpo e seco. Alternativamente, pode usar uma escova macia e limpa para remover os resíduos que possam ter ficado dentro do inhalador. Deve fechar o inhalador Vertical-Haler.
Deve colocar a tampa de volta no bocal, para proteger o dispositivo contra contaminações.
NÃO deve usar água ou detergentes agressivos para limpar o dispositivo.
- 14) Enxágue da bocaDeve enxaguar a boca com água, não engolir a água.
- 15) Eliminação do dispositivoO inhalador Vertical-Inhaler é projetado para uso apenas com o medicamento fornecido e não com qualquer outro. Se o doente receber um novo pacote com um novo inhalador Vertical-Haler, deve lembrar de eliminar o inhalador antigo.
Precauções adicionais:
NÃO DEVEtrocar o inhalador
Vertical-Haler com outras pessoas. Existe
um risco grave de contaminação cruzada.
Pode ser eliminado com os resíduos
domésticos.
O inhalador deve ser usado apenas com
o medicamento fornecido, de acordo com
as instruções.
NÃO DEVE abrir a cápsula e tocar no
pó.
NÃO DEVE colocar mais de uma cápsula
na câmara do inhalador ou colocar dois
medicamentos diferentes.
O barulho no ambiente pode dificultar
a audição, se o dispositivo está funcionando
corretamente. Recomenda-se usar o
dispositivo em um ambiente silencioso.
Para obter informações adicionais sobre
o uso do inhalador, deve contactar o
médico ou farmacêutico.
NÃO DEVEdesmontar o inhalador.
Se ocorrerem problemas com o uso do
dispositivo médico, o doente deve devolvê-lo
ao titular da autorização de comercialização
ou ao seu representante, em embalagem que
garanta a integridade física.
Todos os incidentes graves que ocorreram
após o uso do dispositivo médico devem
ser notificados ao titular da autorização de
comercialização que tem a autorização de
comercialização e à autoridade nacional
competente de vigilância.

- País de registo
- Substância ativa
- Requer receita médicaSim
- ImportadorGlenmark Pharmaceuticals s.r.o. Pharmadox Healthcare Limited
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a GartiorForma farmacêutica: Pó, 18 mcgSubstância ativa: tiotropium bromideFabricante: Ferrer Internacional, S.A.Requer receita médicaForma farmacêutica: Pó, 10 mcgSubstância ativa: tiotropium bromideFabricante: Actavis Ltd. Laboratorios Liconsa S.A. Teva Operations Poland Sp. z o.o. Teva Pharma B.V.Requer receita médicaForma farmacêutica: Pó, 18 mcg/dose medidaSubstância ativa: tiotropium bromideNão requer receita médica
Alternativas a Gartior noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Gartior em Ukraina
Alternativa a Gartior em Hiszpania
Médicos online para Gartior
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Gartior – sujeita a avaliação médica e regras locais.














