
Gadovist 1,0

Pergunte a um médico sobre a prescrição de Gadovist 1,0

Como usar Gadovist 1,0
ULOTKA PARA O DOENTE: INFORMAÇÃO PARA O UTILIZADOR
Gadovist 1,0, 1,0 mmol/ml, solução para injeção
Gadobutrol
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto para poder reler se necessário.
- Se tiver alguma dúvida, deve consultar o médico (radiologista) ou o pessoal do serviço de ressonância magnética.
- Se o doente apresentar algum efeito secundário, incluindo qualquer efeito secundário não mencionado neste folheto, deve informar o médico ou o pessoal do serviço de ressonância magnética. Ver ponto 4.
Índice do folheto:
- 1. O que é Gadovist 1,0 e para que é utilizado
- 2. Informações importantes antes de tomar Gadovist 1,0
- 3. Como é que o medicamento Gadovist 1,0 é administrado
- 4. Efeitos secundários possíveis
- 5. Como conservar o medicamento Gadovist 1,0
- 6. Conteúdo da embalagem e outras informações
1. O que é Gadovist 1,0 e para que é utilizado
Medicamento destinado apenas a diagnóstico.
O medicamento Gadovist 1,0 é um produto (agente de contraste) para utilização em imagiologia por ressonância magnética, utilizado para examinar várias partes do corpo, como: cérebro, coluna vertebral, cabeça, pescoço, tórax, seios, abdómen (incluindo pâncreas, fígado e baço), pelve (incluindo próstata, bexiga urinária, útero), espaço retroperitoneal (na parte de trás da cavidade abdominal) (incluindo rins), membros (superiores e inferiores) e sistema musculoesquelético (músculos, ossos e articulações), vasos sanguíneos e coração. Pode ser avaliada a perfusão do músculo cardíaco em condições de estresse (por exemplo, induzida por medicamentos). Pode ser diagnosticada a viabilidade do músculo cardíaco (por exemplo, pode ser detectada a presença de cicatriz na parede do coração). O exame de ressonância magnética é um tipo de diagnóstico por imagem na medicina que utiliza o comportamento diferente das moléculas de água nos tecidos saudáveis e alterados por doença. O exame é realizado com o auxílio de sistemas magnéticos e ondas de rádio complexos. A atividade é registrada por computadores que a traduzem em imagens.
O medicamento Gadovist 1,0 é utilizado em adultos e crianças e jovens de todas as idades (incluindo recém-nascidos).
O medicamento Gadovist 1,0 é administrado por injeção intravenosa. O medicamento deve ser administrado por profissionais de saúde qualificados com experiência em realização de exames de ressonância magnética.
2. Informações importantes antes de tomar Gadovist 1,0
Quando não tomar Gadovist 1,0
se o doente for alérgico à substância ativa ou a qualquer um dos outros componentes do medicamento (listados no ponto 6). Não há outras contraindicações absolutas para a administração de Gadovist 1,0.
Advertências e precauções
Antes de iniciar o tratamento com Gadovist 1,0, o doente deve consultar o médico se:
- for diagnosticada hipersensibilidade (alergia) ao gadobutrol ou a qualquer um dos outros componentes do medicamento Gadovist 1,0 (ver "O que contém o medicamento Gadovist 1,0"),
- apresentar alergia (por exemplo, febre dos fenos, urticária) ou asma,
- tiver apresentado reação a um agente de contraste anteriormente,
- apresentar doenças do cérebro com convulsões ou outras doenças do sistema nervoso. O médico decidirá se o exame solicitado pode ser realizado. Após a administração de Gadovist 1,0, podem ocorrer reações de tipo alérgico ou outras reações, levando a distúrbios cardíacos, dificuldades respiratórias ou reações cutâneas. São possíveis reações graves. A maioria das reações ocorre dentro de meia hora após a administração. Por isso, é recomendável monitorizar o doente. Foram observadas reações tardias (após várias horas ou dias) (ver ponto 4 "Efeitos secundários possíveis").
- Deve informar o médico se o doente tem um marca-passo cardíaco implantado ou qualquer implante que contenha ferro. Distúrbios da função renal e (ou) hepática Deve informar o médico se:
- os rins do doente não funcionam corretamente,
- o doente teve recentemente ou está prestes a ter um transplante de fígado.
Recém-nascidos e lactentes
Devido à função renal imatura nos recém-nascidos (crianças até 4 semanas de vida) e nos lactentes (crianças até 1 ano de vida), o medicamento Gadovist 1,0 deve ser utilizado nestes doentes apenas após uma avaliação cuidadosa pelo médico.
O médico pode decidir realizar um exame de sangue para verificar a função renal antes de decidir sobre a administração de Gadovist 1,0, especialmente em doentes com mais de 65 anos.
Se os rins não funcionam corretamente, o médico garantirá que o medicamento Gadovist 1,0 tenha sido eliminado do organismo antes de o doente receber uma segunda injeção de Gadovist 1,0.
O medicamento Gadovist 1,0 pode ser eliminado do organismo através de diálise. Se os rins não funcionam corretamente, o médico pode decidir realizar diálise após a administração de Gadovist 1,0.
Foram relatados casos de reação grave, principalmente relacionados à fibrose da pele e tecido conjuntivo (fibrose sistémica nefrogênica, em inglês: nephrogenic systemic fibrosis– NSF). A NSF pode causar grande debilidade na mobilidade das articulações, fraqueza muscular ou pode afetar o funcionamento correto dos órgãos internos, o que pode ser uma ameaça à vida. A NSF está relacionada à administração de alguns produtos que contenham gadolínio (incluindo Gadovist 1,0) em doentes com distúrbios graves da função renal. Também está relacionada à administração de alguns produtos que contenham gadolínio (incluindo Gadovist 1,0) em doentes com insuficiência renal aguda, devido à síndrome hepatorrenal (insuficiência renal em doentes com doença hepática crônica avançada) ou em doentes com insuficiência renal aguda que recentemente tiveram ou estão prestes a ter um transplante de fígado (ver ponto "Efeitos secundários possíveis").
Se o doente apresentar qualquer uma das condições acima, o médico decidirá sobre a administração de Gadovist 1,0 após uma avaliação cuidadosa do risco-benefício.
Gadovist 1,0 e outros medicamentos
Deve informar o médico sobre todos os medicamentos que o doente está tomando atualmente ou recentemente, bem como sobre os medicamentos que o doente planeia tomar.
Gravidez e amamentação
Antes de tomar qualquer medicamento, deve consultar o médico.
Gravidez
O gadobutrol pode atravessar a placenta. Não se sabe se isso afeta o feto. As mulheres que acreditam que estão grávidas ou podem estar grávidas devem informar o médico, pois o medicamento Gadovist 1,0 não deve ser utilizado durante a gravidez, a menos que seja absolutamente necessário.
Amamentação
As mulheres que amamentam ou planeiam amamentar devem informar o médico. O médico discutirá com a paciente se ela deve continuar a amamentar ou se deve interromper a amamentação por um período de 24 horas após a administração de Gadovist 1,0.
Gadovist 1,0 contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por dose (calculada com base na dose média administrada a um adulto com 70 kg de peso corporal), ou seja, é considerado "livre de sódio".
3. Como é que o medicamento Gadovist 1,0 é administrado
O medicamento Gadovist 1,0 é injetado por uma agulha fina na veia por pessoal médico. O medicamento Gadovist 1,0 será administrado imediatamente antes do exame de ressonância magnética.
Após a injeção, o doente será monitorizado por pelo menos 30 minutos.
A dose real de Gadovist 1,0 adequada para o doente dependerá do peso corporal e da área do corpo a ser examinada.
Em adultos, é recomendada uma injeção única de 0,1 ml de Gadovist 1,0 por quilo de peso corporal (o que significa que um adulto com 70 kg de peso corporal receberá 7 ml). Nos exames de imagem do sistema nervoso central (SNC) e na angiografia por ressonância magnética com contraste (CE-MRA), pode ser administrada uma dose máxima de 0,3 ml de Gadovist 1,0 por quilo de peso corporal (o que significa que um adulto com 70 kg de peso corporal receberá 21 ml). Nos exames de imagem do SNC, a dose mínima que pode ser administrada é de 0,075 ml de Gadovist 1,0 por quilo de peso corporal (o que significa que um adulto com 70 kg de peso corporal receberá 5,25 ml).
Para a imagem por ressonância magnética do cérebro, coluna vertebral, fígado e rins, geralmente é suficiente uma injeção única de 0,1 ml de Gadovist 1,0 por quilo de peso corporal.
Para a imagem por ressonância magnética dos vasos, dependendo do tipo de exame, é recomendada uma injeção única de 7,5 a 15 ml (em doentes com peso corporal inferior a 75 kg) ou 10 a 20 ml (em doentes com peso corporal de 75 kg ou mais).
Dosagem em grupos especiais de doentes
Não é recomendada a administração de Gadovist 1,0 em doentes com doenças renais graves, bem como em doentes que recentemente tiveram ou estão prestes a ter um transplante de fígado.
Se a administração do medicamento for necessária, o doente deve receber apenas uma dose de Gadovist 1,0 durante o exame e não deve receber uma segunda injeção por pelo menos 7 dias.
Administração em crianças e jovens
Em crianças de todas as idades (incluindo recém-nascidos), é recomendada uma injeção única de 0,1 ml de Gadovist 1,0 por quilo de peso corporal (ver ponto 1: "O que é Gadovist 1,0 e para que é utilizado"). Devido à função renal imatura nos recém-nascidos (crianças até 4 semanas de vida) e nos lactentes (crianças até 1 ano de vida), o medicamento Gadovist 1,0 deve ser utilizado nestes doentes apenas após uma avaliação cuidadosa pelo médico. Recém-nascidos e lactentes devem receber uma dose única durante o exame e não devem receber uma segunda injeção por pelo menos 7 dias.
Doentes idosos
Não é necessário ajustar a dose em doentes com mais de 65 anos, mas é recomendável realizar um exame de sangue para verificar a função renal.
Para mais informações sobre a administração e preparação de Gadovist 1,0, ver o final do folheto.
Se ocorrer uma superdose, o médico tratará todos os sintomas que ocorrerem e monitorizará se o coração e os rins do doente estão funcionando corretamente.
Se tiver alguma dúvida adicional sobre a administração do medicamento, deve consultar o médico ou o pessoal do serviço de ressonância magnética.
4. Efeitos secundários possíveis
Como qualquer medicamento, Gadovist 1,0 pode causar efeitos secundários, embora não todos os doentes os apresentem. A maioria dessas reações ocorre dentro de meia hora após a administração de Gadovist 1,0.
Em casos raros, foram observadas reações alérgicas tardias ou outros tipos de reações adversas, ocorrendo dentro de várias horas a vários dias após a administração de Gadovist 1,0. Se isso ocorrer, informe imediatamente o médico ou o radiologista.
A maioria dos efeitos secundários é leve a moderada. Os efeitos secundários mais frequentemente observados em doentes que receberam Gadovist 1,0 (que podem ocorrer em 5 ou mais casos em 1000 doentes) são: dor de cabeça, náuseas (sensação de enjoo) e tontura.
Os efeitos secundários mais graves(em alguns casos, ameaçadores da vida ou fatais) são: parada cardíaca (coração para de bater), doença pulmonar grave (síndrome de dificuldade respiratória aguda) / líquido nos pulmões (edema pulmonar) e reações alérgicas graves (incluindo anafilaxia). Além disso, foram observados efeitos secundários(em alguns casos, ameaçadores da vida ou fatais): dificuldade respiratória (respiração superficial) e perda de consciência (desmaio).
Raramente, podem ocorrer casos de reações alérgicas, incluindo reações graves que podem exigir intervenção médica.
O doente deve informar imediatamente o pessoal do serviço de ressonância magnéticase ocorrerem:
- inchaço no rosto, lábios, língua ou garganta,
- tosse e espirros,
- dificuldade respiratória,
- coceira,
- coriza,
- urticária (um tipo específico de erupção cutânea).
Esses sintomas podem ser os primeiros sinais de uma reação grave, o que significa que pode ser necessário interromper o exame e administrar um tratamento apropriado.
Os efeitos secundários mais frequentemente observados(que podem ocorrer em 5 ou mais casos em 1000 doentes) são: dor de cabeça, náuseas, tontura.
A maioria dos efeitos secundários é leve a moderada.
Abaixo, são listados os efeitos secundários possíveis observados durante os estudos clínicos, antes da autorização do medicamento, de acordo com a frequência de ocorrência.
Frequente(pode ocorrer em até 1 em 10 doentes):
- dor de cabeça
- náuseas (sensação de enjoo) Pouco frequente(pode ocorrer em até 1 em 100 doentes):
- reações alérgicas (hipersensibilidade, reação pseudoalérgica), por exemplo:
- hipotensão (pressão arterial baixa)
- urticária
- inchaço no rosto (inchaço facial)
- inchaço nas pálpebras (inchaço palpebral)
- vermelhidão A frequência de ocorrência das seguintes reações alérgicas é desconhecida:
- choque anafilático (reação alérgica grave)
- colapso circulatório (choque)
- parada respiratória (falta de ar)
- espasmo brônquico (dificuldade respiratória)
- cinose (coloração azulada dos lábios)
- inchaço na boca e garganta (inchaço bucofaríngeo)
- inchaço na laringe (inchaço laríngeo)
- hipertensão (pressão arterial alta)
- dor no peito
- inchaço angioneurótico (por exemplo, inchaço no rosto, garganta, lábios e/ou língua)
- conjuntivite
- suor excessivo (hiperidrose)
- tosse
- espirros
- sensação de queimadura
- palidez (pele pálida)
- tontura, alterações do paladar (distúrbios do sentido do paladar), parestesias (formigamento e dormência)
- dificuldade respiratória (respiração superficial)
- vômitos
- rubor (vermelhidão da pele)
- coceira (incluindo coceira generalizada) (prurido)
- erupção cutânea (incluindo erupção cutânea generalizada, erupção cutânea maculopapular, erupção cutânea papular, rubor com coceira)
- diversos tipos de reações no local da injeção (por exemplo, extravasamento, sensação de queimadura, sensação de frio, sensação de calor, vermelhidão, coceira, dor ou hematoma)
- sensação de calor Raro(pode ocorrer em até 1 em 1000 doentes):
- perda de consciência (desmaio)
- convulsões
- alucinações olfativas (distúrbios do sentido do olfato)
- taquicardia (batimento cardíaco rápido)
- palpitações (batimento cardíaco irregular)
- secura na boca
- mal-estar
- sensação de frio
Efeitos secundários relatados após a autorização do medicamento Gadovist 1,0
Frequência desconhecida(não pode ser estimada com base nos dados disponíveis):
- parada cardíaca (coração para de bater)
- doença pulmonar grave (síndrome de dificuldade respiratória aguda)
- líquido nos pulmões (edema pulmonar)
- foram relatados casos de fibrose sistémica nefrogênica (uma doença relacionada à fibrose da pele, que também pode afetar os tecidos moles e órgãos internos), a maioria dos quais ocorreu em doentes que receberam Gadovist 1,0 em combinação com outros medicamentos que contenham gadolínio. Após a administração de Gadovist 1,0, foram observadas alterações nos exames de sangue da função renal (por exemplo, aumento da creatinina sérica).
Notificação de efeitos secundários
Se ocorrerem qualquer efeito secundário, incluindo qualquer efeito secundário não mencionado neste folheto, deve informar o médico ou a enfermeira. Os efeitos secundários podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Secundários de Medicamentos da Agência Reguladora de Medicamentos, Al. Jerozolimskie 181C, 02-222 Varsóvia, telefone: + 48 22 49 21 301, fax: + 48 22 49 21 309, site: https://smz.ezdrowie.gov.pl
Os efeitos secundários também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos secundários ajudará a obter mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento Gadovist 1,0
Conservar em local não visível e inacessível a crianças.
Conservar a uma temperatura não superior a 30°C.
A estabilidade química, física e microbiológica foi demonstrada por 24 horas a uma temperatura entre 20 e 25°C. Do ponto de vista microbiológico, o medicamento deve ser utilizado imediatamente após a abertura.
Não utilizar o medicamento Gadovist 1,0 após o prazo de validade impresso na embalagem após "Validade" (EXP). O prazo de validade é o último dia do mês indicado.
O número do lote na embalagem é indicado após "Lote".
Os medicamentos não devem ser jogados na canalização ou nos lixos domésticos. Deve perguntar ao farmacêutico como eliminar os medicamentos que não são mais utilizados. Essa ação ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento Gadovist 1,0
- A substância ativa do medicamento é o gadobutrol. 1 ml de solução para injeção contém 604,72 mg de gadobutrol (equivalente a 1,0 mmol de gadobutrol contendo 157,25 mg de gadolínio).
- Os outros componentes são: calcobutrol sódico, trometamol, ácido clorídrico 3,6% e água para injeção. 1 frasco contém 2 ml de solução, o que corresponde a 1209,44 mg de gadobutrol. 1 frasco contém 7,5 ml de solução, o que corresponde a 4535 mg de gadobutrol. 1 frasco contém 10 ml de solução, o que corresponde a 6047,20 mg de gadobutrol. 1 frasco contém 15 ml de solução, o que corresponde a 9070 mg de gadobutrol. 1 frasco contém 30 ml de solução, o que corresponde a 18141 mg de gadobutrol. 1 seringa pré-cheia contém 5,0 ml de solução, o que corresponde a 3023 mg de gadobutrol. 1 seringa pré-cheia contém 7,5 ml de solução, o que corresponde a 4535 mg de gadobutrol. 1 seringa pré-cheia contém 10 ml de solução, o que corresponde a 6047 mg de gadobutrol. 1 seringa pré-cheia contém 15 ml de solução, o que corresponde a 9070 mg de gadobutrol. 1 seringa pré-cheia contém 20 ml de solução, o que corresponde a 12094 mg de gadobutrol. 1 cartucho para seringa automática contém 15 ml de solução, o que corresponde a 9070 mg de gadobutrol. 1 cartucho para seringa automática contém 20 ml de solução, o que corresponde a 12094 mg de gadobutrol. 1 cartucho para seringa automática contém 30 ml de solução, o que corresponde a 18140 mg de gadobutrol. 1 frasco para infusão contém 65 ml de solução, o que corresponde a 39307 mg de gadobutrol.
Como é o medicamento Gadovist 1,0 e o que o conteúdo da embalagem
Antes de usar, o medicamento deve ser inspecionado. O medicamento Gadovist 1,0 é uma solução transparente, incolor ou amarelo-clara. Não deve ser utilizado se houver descoloração significativa, presença de partículas sólidas ou dano ao recipiente.
A embalagem contém:
1 ou 3 frascos, cada um contendo 2 ml de solução para injeção intravenosa.
1 ou 10 frascos, cada um contendo 7,5; 15 ou 30 ml de solução para injeção intravenosa.
10 frascos, cada um contendo 10 ml de solução para injeção intravenosa.
1 ou 5 seringas pré-cheias, cada uma contendo 5, 7,5 ou 10 ml de solução para injeção intravenosa (em seringa de vidro ou plástico com capacidade de 10 ml).
1 ou 5 seringas pré-cheias contendo 15 ml de solução para injeção intravenosa (em seringa de vidro com capacidade de 17 ml ou seringa de plástico com capacidade de 20 ml).
1 ou 5 seringas pré-cheias contendo 20 ml de solução para injeção intravenosa (em seringa de vidro ou plástico com capacidade de 20 ml).
1 ou 5 cartuchos para seringa automática contendo 15, 20 ou 30 ml de solução para injeção intravenosa (cartucho com capacidade de 65 ml).
1 ou 10 frascos contendo 65 ml de solução para injeção (em frasco para infusão com capacidade de 100 ml).
Nem todos os tamanhos de embalagem podem estar disponíveis.
Título do titular da autorização de comercialização e fabricante
Título do titular da autorização de comercialização:
Bayer AG
Kaiser-Wilhelm-Allee 1
51373 Leverkusen,
Alemanha
Fabricante:
Bayer AG
Müllerstrasse 178
13353 Berlim
Alemanha
Para obter informações mais detalhadas, deve contatar o representante do titular da autorização de comercialização:
Bayer Sp. z o.o.
Al. Jerozolimskie 158
02-326 Varsóvia
Polônia
telefone: (0-22) 572 35 00
Data da última atualização do folheto: Julho 2025
---------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas ao pessoal médico especializado (ver também os pontos de 1 a 6):
Método de administração
O medicamento é destinado apenas a injeções intravenosas. Após a administração do medicamento, o doente deve ser monitorizado por pelo menos meia hora, pois a experiência indica que a maioria dos efeitos secundários ocorre nesse período.
A dose necessária deve ser administrada em uma injeção única intravenosa. O exame de ressonância magnética com contraste pode ser iniciado imediatamente após a injeção (ou logo após a injeção, dependendo das sequências de pulsos e do protocolo de exame) devido ao rápido início do efeito de contraste.
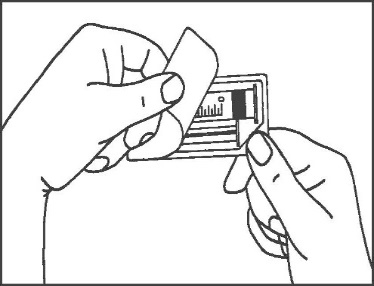
- 1. Abrir as embalagens
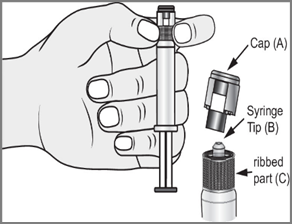
- 2.
- 3. Com a outra mão, segurar a ponta (A) do sistema de fechamento e inclinar suavemente para a frente e para trás, até que a ponta se separe e possa ser removida (todas as selas serão quebradas)
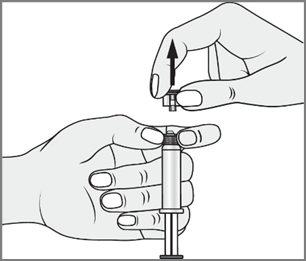
- 4. Remover a ponta (A) na direção oposta. Não tocar na ponta da seringa (B) para manter a esterilidade.
- 5.
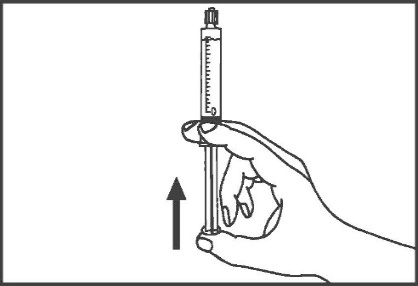
Seringas pré-cheias de plástico:
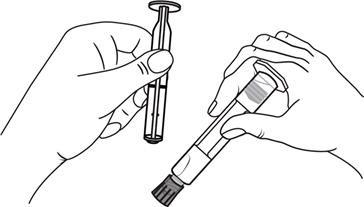
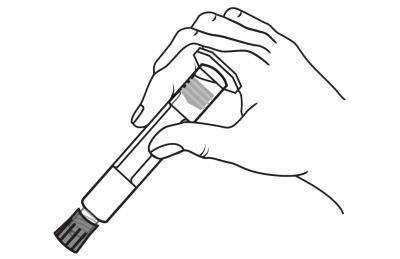
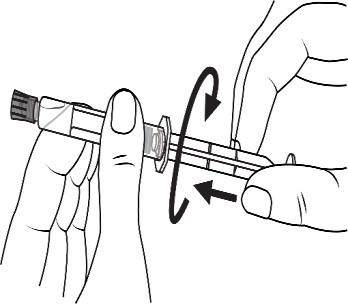
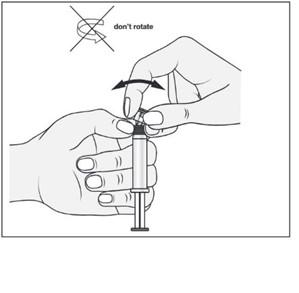
Remover a tampa da ponta da seringa, girando-a
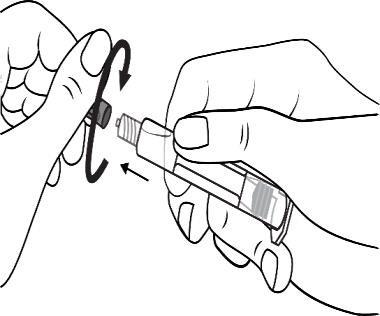
Girar o êmbolo na seringa no sentido horário
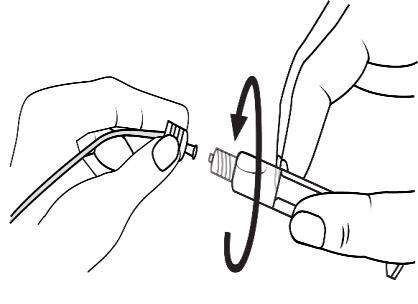
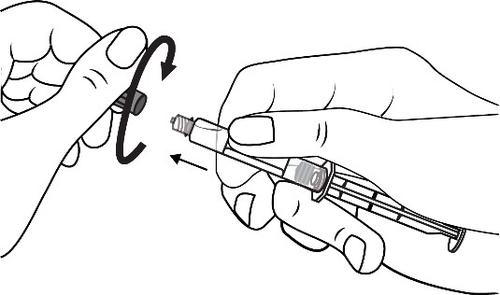
Conectar a ponta da seringa ao dreno, girando no sentido horário. Em seguida, proceder de acordo com as instruções de operação.
Remover a tampa da ponta da seringa, girando-a
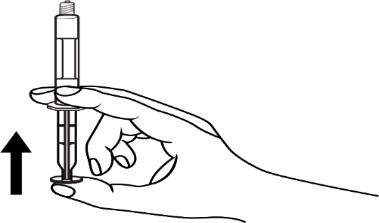
- 4. Remover o ar da seringa
Cartuchos para seringas automáticas
O medicamento deve ser administrado por pessoal médico especializado, utilizando procedimentos e equipamentos apropriados.
Deve ser mantida a esterilidade durante todas as injeções do medicamento.
As instruções de operação do equipamento devem ser fornecidas pelo fabricante.
O medicamento que não for utilizado durante um exame deve ser descartado.
Frasco para infusão
O frasco contém 65 ml de solução.
O medicamento pode ser administrado utilizando um dispositivo de infusão automática.
As instruções de operação do equipamento devem ser fornecidas pelo fabricante.
Para outras informações, ver o ponto "Como conservar o medicamento Gadovist 1,0".
Qualquer resíduo de medicamento não utilizado ou seus dejetos deve ser eliminado de acordo com as regulamentações locais.
A etiqueta do frasco ou seringa pré-cheia ou cartucho ou frasco para infusão deve ser colada na ficha do doente para permitir o registro correto do medicamento que contém gadolínio utilizado. Também deve ser anotada a dose. Se os prontuários do doente forem eletrônicos, deve ser registrado o nome do medicamento, o número do lote e a dose.
Incompatibilidades
Como não foram realizados estudos de compatibilidade, o medicamento não deve ser misturado com outros medicamentos.
Dosagem
Deve ser utilizada a menor dose que forneça contraste suficiente para os fins diagnósticos. A dose deve ser calculada com base no peso corporal do doente. Não deve exceder a dose recomendada por quilo de peso corporal indicada neste ponto.
Doentes adultos
A dose depende da indicação. Uma injeção única de 0,1 mmol de Gadovist 1,0 por quilo de peso corporal (o que corresponde a 0,1 ml/kg de peso corporal) é geralmente suficiente. A dose total máxima é de 0,3 mmol de Gadovist 1,0 por quilo de peso corporal (o que corresponde a 0,3 ml/kg de peso corporal).
Exame do sistema nervoso central (SNC):
Geralmente, a dose recomendada para estabelecer o diagnóstico é de 0,1 mmol por quilo de peso corporal.
Se, apesar do resultado negativo do exame de ressonância magnética, ainda houver suspeita clínica significativa de doença ou se a obtenção de informações mais precisas puder afetar o tratamento do doente, pode ser realizada uma segunda injeção do medicamento, ajustando a dose para a dose máxima de 0,2 mmol/kg de peso corporal dentro de 30 minutos após a primeira administração. Nos exames de imagem do SNC, a dose mínima que pode ser administrada é de 0,075 mmol de gadobutrol por quilo de peso corporal (o que corresponde a 0,075 ml de Gadovist 1,0 por quilo de peso corporal).
Exame de imagem do corpo inteiro (exceto CE-MRA):
Geralmente, é suficiente uma dose de 0,1 ml/kg de peso corporal de Gadovist 1,0.
Angiografia:
Imagem de um campo de visão (em inglês: field of view– FOV):
- 7,5 ml em doentes com peso corporal inferior a 75 kg; 10 ml em doentes com peso corporal de 75 kg ou mais (o que corresponde a 0,1-0,15 mmol/kg de peso corporal)
- Imagem de mais de um campo de visão (FOV):
- 15 ml em doentes com peso corporal inferior a 75 kg; 20 ml em doentes com peso corporal de 75 kg ou mais (o que corresponde a 0,2-0,3 mmol/kg de peso corporal).
Grupos especiais de doentes
Crianças e jovens
Em crianças de todas as idades (incluindo recém-nascidos), a dose recomendada é de 0,1 mmol de gadobutrol por quilo de peso corporal (ver ponto 1: "O que é Gadovist 1,0 e para que é utilizado"). Devido à função renal imatura nos recém-nascidos (crianças até 4 semanas de vida) e nos lactentes (crianças até 1 ano de vida), o medicamento Gadovist 1,0 deve ser utilizado nestes doentes apenas após uma avaliação cuidadosa pelo médico. Recém-nascidos e lactentes devem receber uma dose única durante o exame e não devem receber uma segunda injeção por pelo menos 7 dias.
Doentes com distúrbios da função renal
Gadovist 1,0 pode ser utilizado em doentes com distúrbios graves da função renal (taxa de filtração glomerular, em inglês: glomerular filtration rate– GFR <30 ml min 1,73 m) e em doentes que recentemente tiveram ou estão prestes a ter um transplante de fígado apenas após uma avaliação cuidadosa do risco-benefício se informação diagnóstica for necessária não estiver disponível para o exame ressonância magnética sem contraste. administração medicamento necessária, dose deve ser maior 0,1 mmol kg peso corporal. administrada mais durante exame. devido à falta dados sobre múltipla, as injeções gadovist 1,0 devem repetidas, menos intervalo entre seja pelo 7 dias.< p>
Precauções especiais para a administração
Hipersensibilidade
Como ocorre com outros agentes de contraste, a administração de Gadovist 1,0 pode estar associada ao risco de reações pseudoalérgicas, hipersensibilidade ou idiossincrasia, caracterizadas por sintomas cardiovasculares, respiratórios ou cutâneos, até reações graves, incluindo choque. Geralmente, os doentes com doenças cardiovasculares são mais propensos a apresentar sintomas graves, incluindo morte, devido a reações graves de hipersensibilidade.
O risco de reação de hipersensibilidade pode aumentar em:
- reações anteriores a agentes de contraste,
- asma brônquica na história clínica,
- doenças alérgicas na história clínica. Em doentes com tendência a alergias, a decisão de administrar Gadovist 1,0 deve ser tomada após uma avaliação cuidadosa do risco-benefício. A maioria das reações ocorre dentro de meia hora após a administração do medicamento. Por isso, é recomendável monitorizar o doente. Deve ser garantido o acesso a medicamentos utilizados em reações de hipersensibilidade e equipamentos apropriados. Raramente, foram observadas reações tardias (após várias horas a vários dias). Distúrbios da função renal
Antes da administração de Gadovist 1,0, é recomendável que todos os doentes sejam submetidos a um exame para distúrbios da função renal, incluindo testes laboratoriais.
Foram relatados casos de fibrose sistémica nefrogênica (em inglês: nephrogenic systemic fibrosis– NSF) associados à administração de alguns medicamentos que contenham gadolínio em doentes com distúrbios graves da função renal (taxa de filtração glomerular, em inglês: glomerular filtration rate– GFR <30 ml min 1,73 m). os doentes submetidos a transplante de fígado estão particularmente expostos, pois o risco insuficiência renal aguda nesse grupo é alto. devido ao nsf associado à administração gadovist 1,0, esse medicamento pode ser utilizado em com distúrbios graves da função e que recentemente tiveram ou prestes ter um apenas após uma avaliação cuidadosa do risco-benefício se informação diagnóstica for necessária não estiver disponível para exame ressonância magnética sem contraste. necessária, dose deve maior 0,1 mmol kg peso corporal. administrada mais durante exame. falta dados sobre múltipla, as injeções 1,0 devem repetidas, menos intervalo entre seja pelo 7 dias.
Como a depuração renal do gadobutrol pode ser reduzida em doentes idosos, especialmente é importante monitorizar os doentes com 65 anos ou mais para distúrbios da função renal.
A diálise logo após a administração de Gadovist 1,0 pode facilitar a remoção do medicamento do organismo. Não há evidências que justifiquem o início da diálise para prevenir ou tratar a NSF em doentes que não estão em diálise.
Portanto, Gadovist 1,0 deve ser utilizado nesses doentes após uma avaliação cuidadosa do risco-benefício (ver ponto 4.8).
Gravidez e amamentação
O medicamento Gadovist 1,0 não deve ser utilizado durante a gravidez, a menos que o estado clínico da mulher exija a administração de gadobutrol.
O médico e a mãe que amamenta devem decidir se a amamentação deve ser continuada ou interrompida por um período de 24 horas após a administração de Gadovist 1,0.
Efeitos secundários
O resumo do perfil de segurança é baseado em dados de estudos clínicos realizados com mais de 6300 doentes e em estudos pós-comercialização.
Sobredosagem
Doses únicas de gadobutrol de até 1,5 mmol/kg de peso corporal foram bem toleradas.
Em caso de sobredosagem, como medida de precaução, é recomendável monitorizar a função cardiovascular (incluindo ECG) e a função renal.
Em caso de sobredosagem, o medicamento Gadovist 1,0 pode ser removido do organismo por diálise.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorBayer AG Bayer Schering Pharma AG
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Gadovist 1,0Forma farmacêutica: Solução, 279,3 mg/mlSubstância ativa: gadobutrolFabricante: BIPSO GmbH Bracco Imaging S.p.A.Não requer receita médicaForma farmacêutica: Solução, 0.5 mmol/mlSubstância ativa: gadoteric acidFabricante: GE Healthcare AS GE Healthcare IrelandRequer receita médicaForma farmacêutica: Solução, 0.5 mmol/mlSubstância ativa: gadoteric acidFabricante: GE Healthcare ASRequer receita médica
Alternativas a Gadovist 1,0 noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Gadovist 1,0 em Ukraine
Alternativa a Gadovist 1,0 em Espanha
Médicos online para Gadovist 1,0
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Gadovist 1,0 – sujeita a avaliação médica e regras locais.














