
Emoclot

Pergunte a um médico sobre a prescrição de Emoclot

Como usar Emoclot
Folheto informativo: informação para o utilizador
EMOCLOT, 500 UI, pó e solvente para solução para injeção e infusão
EMOCLOT, 1000 UI, pó e solvente para solução para injeção e infusão
Fator VIII humano
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém
informações importantes para o doente.
- Deve conservar este folheto, para que possa relê-lo se necessário.
- Em caso de dúvidas, deve consultar o seu médico.
- O medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode prejudicar outras pessoas, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o doente apresentar algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, deve informar o seu médico. Ver ponto 4.
Índice do folheto:
- 1. O que é o EMOCLOT e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento EMOCLOT
- 3. Como tomar EMOCLOT
- 4. Efeitos não desejados
- 5. Como conservar EMOCLOT
- 6. Conteúdo do pacote e outras informações
1. O que é o EMOCLOT e para que é utilizado
O EMOCLOT é um concentrado de fator VIII de coagulação altamente purificado, obtido a partir de plasma humano. O fator VIII é uma proteína com atividade antihemorrágica.
O EMOCLOT é utilizado:
- no tratamento e prevenção de hemorragias em doentes com deficiência congénita de fator VIII (hemofilia A);
- no tratamento de hemorragias em doentes com deficiência adquirida de fator VIII;
- no tratamento de doentes com hemofilia com anticorpos contra o fator VIII (inibidores).
Este medicamento não contém uma quantidade farmacologicamente eficaz de fator de von Willebrand, pelo que não é indicado para o tratamento da doença de von Willebrand.
2. Informações importantes antes de tomar o medicamento EMOCLOT
Quando não tomar o medicamento EMOCLOT
se o doente tiver alergia ao fator VIII humano ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6).
Precauções e advertências
Antes de iniciar o tratamento com o medicamento EMOCLOT, deve discutir com o seu médico.
Hipersensibilidade
É possível ocorrer reações de hipersensibilidade do tipo alérgico relacionadas com o medicamento EMOCLOT.
O EMOCLOT contém quantidades residuais de proteínas humanas outras que não o fator VIII. Os doentes devem ser informados sobre os sintomas precoces de reação de hipersensibilidade. A administração do medicamento deve ser interrompida imediatamente se o doente apresentar algum dos seguintes sintomas que possam indicar reação alérgica: erupção cutânea, urticária generalizada, compressão no peito, respiração sibilante, hipotensão e reação alérgica aguda.
Em caso de choque, a administração deve ser interrompida imediatamente e proceder de acordo com as diretrizes de tratamento de choque.
Anticorpos
A formação de inibidores (anticorpos) é uma complicação conhecida que pode ocorrer durante o tratamento com todos os medicamentos que contenham fator VIII. Estes inibidores, especialmente em concentrações elevadas, interrompem o tratamento eficaz e o doente será monitorizado atentamente para a formação desses inibidores. Se a hemorragia no doente não for controlada adequadamente após a administração do medicamento Emoclot, deve informar imediatamente o seu médico.
Eventos cardiovasculares
Em doentes com fatores de risco de doenças cardiovasculares, o tratamento de substituição com fator VIII pode aumentar o risco de distúrbios cardiovasculares.
Complicações relacionadas com a administração por cateter
Se for necessário usar um dispositivo de administração por veia central, deve considerar o risco de complicações relacionadas com a sua utilização, incluindo infecção local, bacteriemia e trombose no local de inserção do cateter.
Segurança viral
No caso de medicamentos produzidos a partir de sangue ou plasma humano, são tomadas medidas preventivas adequadas para evitar a transmissão de infecções para os doentes. Incluem:
- seleção cuidadosa dos doadores de sangue e plasma para garantir que sejam excluídos os indivíduos com risco de transmissão de infecções;
- testes de cada doação e pool de plasma (coleta de doações) para vírus e infecções.
- inclusão no processo de tratamento do sangue ou plasma de procedimentos que inativam ou removem vírus. Apesar das medidas preventivas acima, não é possível excluir completamente a possibilidade de transmissão de agentes infecciosos por medicamentos preparados a partir de sangue ou plasma humano. Isso se aplica também a vírus desconhecidos ou recentemente descobertos e outros patógenos. Considera-se que as medidas preventivas são eficazes contra vírus envelopados, como o vírus da imunodeficiência adquirida (HIV), o vírus da hepatite B (HBV) e o vírus da hepatite C (HCV) e vírus não envelopados, como o vírus da hepatite A (HAV). Essas medidas podem ter eficácia limitada contra vírus não envelopados, como o parvovirus B19. A infecção por parvovirus B19 pode ser prejudicial para as mulheres grávidas (infecção fetal) e para doentes com deficiência imunológica ou certos tipos de anemia (por exemplo, anemia falciforme ou anemia hemolítica).
Recomenda-se fortemente que, sempre que o medicamento EMOCLOT for administrado ao doente, o nome e o número de lote do produto sejam registrados para determinar, no futuro, qual lote do produto o doente recebeu.
Em doentes que recebem regularmente ou de forma repetida fator VIII de origem plasmática, deve considerar a vacinação adequada (contra a hepatite A e B).
Crianças e adolescentes
As advertências e precauções mencionadas se aplicam tanto a adultos como a crianças.
Mais informações no final do folheto, na seção destinada ao pessoal médico especializado.
Interacções com outros medicamentos
Deve informar o seu médico ou farmacêutico sobre todos os medicamentos que está a tomar atualmente ou recentemente, bem como sobre os medicamentos que planeia tomar.
Não foram relatadas interacções do fator VIII com outros medicamentos.
Não há dados especiais sobre a utilização em crianças.
Gravidez e amamentação
- Se a paciente estiver grávida ou a amamentar, suspeitar que possa estar grávida ou planejar ter um filho, deve consultar o seu médico antes de tomar este medicamento.
- Não foram realizados estudos sobre o efeito do fator VIII na reprodução animal. Devido à raridade da hemofilia A em mulheres, não há experiência com a utilização do fator VIII em mulheres grávidas e a amamentar. Portanto, o fator VIII pode ser utilizado durante a gravidez e a amamentação apenas em casos de necessidade absoluta.
Condução de veículos e utilização de máquinas
O EMOCLOT não afeta a capacidade de conduzir veículos ou utilizar máquinas.
EMOCLOT contém sódio
O medicamento contém até 41 mg de sódio (principal componente do sal de cozinha) por frasco de 10 ml. Isso corresponde a 2,05% da dose diária máxima recomendada de sódio na dieta para adultos.
3. Como tomar EMOCLOT
Este medicamento deve ser sempre utilizado de acordo com as recomendações do seu médico. O tratamento deve ser iniciado sob controlo de um médico experiente no tratamento da hemofilia.
Dose recomendada
A dose e a duração do tratamento de substituição dependem do grau de deficiência de fator VIII, do local e da extensão da hemorragia e do estado clínico do doente.
Tratamento por necessidade
Ao determinar a dose necessária e a frequência de administração, deve ser guiado pela eficácia clínica no caso individual.
Profilaxia
Na profilaxia a longo prazo de hemorragias em doentes com hemofilia A grave, são geralmente utilizadas doses de 20 a 40 UI de fator VIII por kg de peso corporal, administradas a intervalos de 2 a 3 dias.
Em alguns casos, especialmente em doentes mais jovens, pode ser necessário administrar o medicamento a intervalos mais curtos ou em doses maiores.
Os doentes tratados com fator VIII devem ser monitorizados atentamente e submetidos a exames para detectar a formação de anticorpos.
Durante o tratamento, deve ser avaliado o nível adequado de fator VIII para ajustar a dose e a frequência de administração. Especialmente em casos de cirurgia grave, é necessário um monitorização precisa do tratamento de substituição através de exames de coagulação (atividade de fator VIII no plasma).
Crianças e adolescentes
O EMOCLOT não é recomendado para utilização em crianças com menos de 12 anos devido à falta de dados sobre a segurança e eficácia.
Mais informações sobre a dose e duração do tratamento encontram-se no final deste folheto, na seção destinada aos médicos e pessoal médico especializado.
Método de administração
O medicamento deve ser administrado por via intravenosa em injeção ou infusão lenta.
Em caso de injeção intravenosa, recomenda-se respeitar o tempo de administração de 3 a 5 minutos, verificando a frequência cardíaca do doente e interrompendo a administração ou reduzindo a velocidade de infusão se a frequência cardíaca aumentar.
A velocidade de infusão deve ser determinada individualmente para cada doente.
Deve utilizar apenas os conjuntos de injeção ou infusão fornecidos, pois a adsorção do fator VIII humano nas superfícies internas de alguns conjuntos de injeção ou infusão pode ser a causa de falha terapêutica.
Incompatibilidades: devido à falta de estudos de compatibilidade deste medicamento, não deve ser misturado com outros medicamentos.
Reconstituição do pó com solvente:
- 1. levar o frasco de pó e o frasco de solvente à temperatura ambiente;
- 2. manter a temperatura ambiente durante todo o processo de reconstituição (máximo 10 minutos);
- 3. remover as tampas de proteção dos frascos de pó e solvente;
- 4. limpar com álcool a superfície do batoque dos dois frascos;
- 5. abrir o pacote do material médico para reconstituição, removendo a tampa com cuidado para não tocar no dispositivo dentro do pacote (fig. A);
- 6. não remover o dispositivo do pacote;
- 7. invertar o pacote com o dispositivo para cima e inserir a ponta de plástico através da tampa do frasco de solvente para conectar a parte azul do dispositivo ao frasco de solvente (fig. B);
- 8. segurando a borda do pacote, retirar o pacote do dispositivo sem tocá-lo (fig. C);
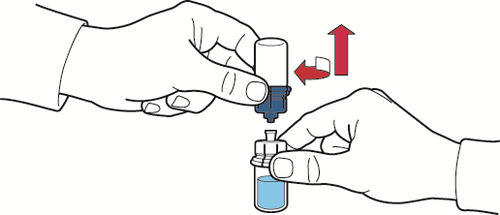
- 9. certificar-se de que o frasco de pó está colocado em uma superfície segura, invertar o dispositivo conectado e o frasco de solvente para que o frasco fique em cima; pressionar o adaptador transparente na tampa do frasco de pó para que a ponta de plástico do dispositivo passe através da tampa do frasco; o solvente fluirá automaticamente para o frasco de pó (fig. D);
- 10. após o fluxo do solvente, remover a parte azul do dispositivo de reconstituição com o frasco de solvente conectado e descartá-lo (fig. E);
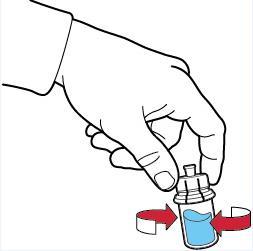
- 11. agitar suavemente até que o pó esteja completamente dissolvido (fig. F);
- 12. não agitar vigorosamente, deve evitar a formação de espuma na solução.
fig. A
fig. B
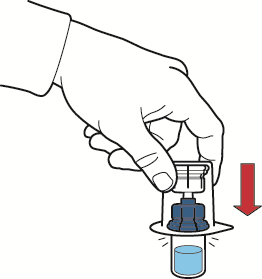
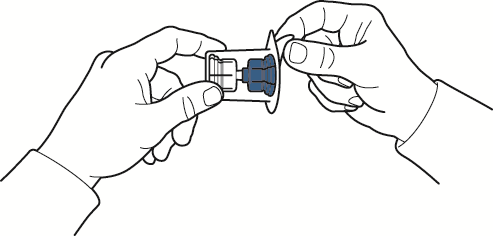
fig. C
fig. D
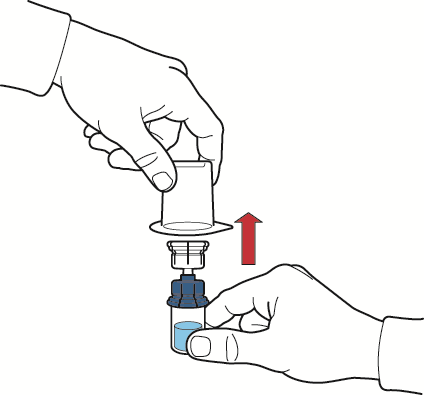
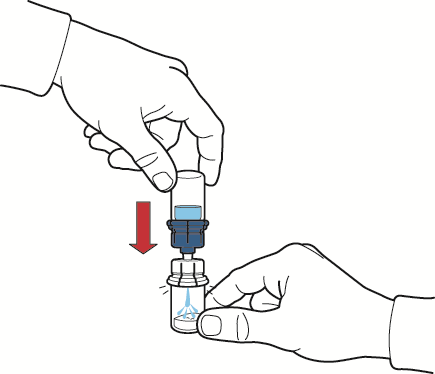
fig. E
fig. F
Administração da solução
Após a reconstituição, a solução pode conter alguns pequenos fragmentos ou partículas.
Deve verificar visualmente a solução antes da administração para detectar a presença de partículas sólidas ou descoloração.
A solução deve ser transparente ou ligeiramente opalescente. Não deve ser utilizado se a solução estiver turva ou contiver sedimentos.
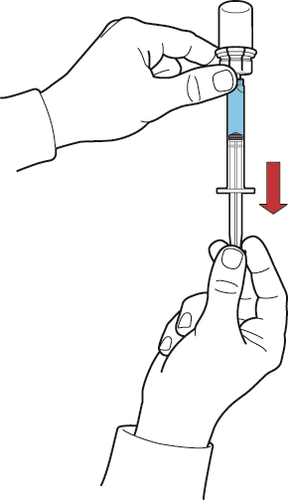
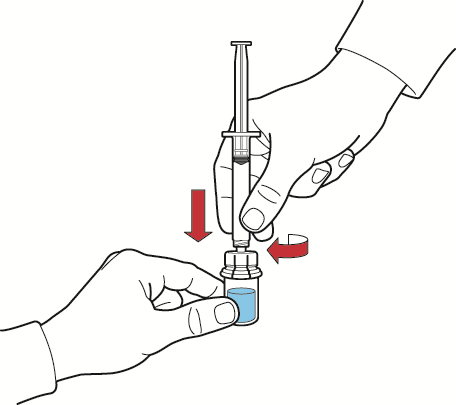
- 1. Encher a seringa com ar, puxando o êmbolo da seringa, conectar a seringa ao dispositivo e, pressionando o êmbolo da seringa, introduzir ar no frasco com a solução reconstituída (fig. G);
- 2. segurando o êmbolo da seringa imóvel, invertar o frasco e a seringa para que o frasco com a solução reconstituída fique em cima, e, puxando lentamente o êmbolo da seringa, aspirar a solução para a seringa (fig. H);
- 3. desconectar a seringa, girando-a no sentido contrário ao dos ponteiros do relógio;
- 4. verificar a solução na seringa, que deve ser transparente ou ligeiramente opalescente, sem partículas;
- 5. conectar a agulha de borboleta à seringa e administrar por infusão ou injeção intravenosa lenta.
fig. G
fig. H
Uso de mais do que a dose recomendada de EMOCLOT
Não são conhecidos os sintomas de superdose de fator VIII humano.
Em caso de ingestão acidental ou superdose do medicamento EMOCLOT, deve procurar imediatamente um hospital.
Em caso de dúvidas adicionais sobre a utilização deste medicamento, deve consultar o seu médico.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não ocorram em todos.
Se ocorrer algum dos efeitos não desejados mencionados, deve informar imediatamente o seu médico ou o hospital mais próximo:
- Reações alérgicas graves (hipersensibilidade): edema rápido de pele e mucosas ao redor da boca e face (edema angioneurótico). Esta reação é rara, mas em alguns casos pode agravar-se para uma reação alérgica aguda, incluindo choque.
- Em doentes com hemofilia A, podem ocorrer anticorpos neutralizantes (inibidores) contra o fator VIII, o que se manifesta por uma resposta clínica fraca ao tratamento. Nesses casos, é recomendada a consulta a um centro especializado no tratamento da hemofilia.
Outros efeitos não desejados possíveis:
- Outras reações alérgicas (hipersensibilidade) podem incluir:
- ardor e dor no local da injeção;
- calafrios, rubor facial súbito, urticária generalizada (que ocorre na pele de todo o corpo), erupção cutânea;
- dor de cabeça
- hipotensão (pressão baixa), ansiedade, taquicardia (batimento cardíaco rápido), compressão no peito, respiração sibilante;
- sonolência (letargia);
- náuseas, vômitos;
- sensação de formigamento. Estas reações não desejadas são raras, mas em alguns casos podem agravar-se para reações alérgicas agudas, incluindo choque.
A frequência de ocorrência de efeitos não desejados após a comercialização do medicamento EMOCLOT é desconhecida, o que significa que não pode ser determinada com base nos dados disponíveis.
Também foi observada a ocorrência de febre.
Em crianças não tratadas previamente com medicamentos que contenham fator VIII, os anticorpos bloqueadores (ver ponto 2) podem ocorrer muito frequentemente (mais de 1 em 10 doentes). No entanto, em doentes que foram tratados previamente com fator VIII (mais de 150 dias de tratamento), o risco é pouco frequente (menos de 1 em 100 doentes). Se isso ocorrer, os medicamentos podem deixar de funcionar corretamente no doente e pode ocorrer hemorragia persistente. Se isso ocorrer, deve contactar imediatamente o seu médico.
Efeitos não desejados adicionais em crianças
Embora não haja dados especiais sobre a população pediátrica, alguns dados publicados sobre estudos de eficácia e segurança não mostraram grandes diferenças entre adultos e crianças com a mesma doença.
Notificação de efeitos não desejados
Se ocorrerem algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado no folheto, deve informar o seu médico ou enfermeiro. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos do Infarmed:
Av. da República, 37, 4º,
1050-187 Lisboa,
tel: 21 792 53 00,
fax: 21 792 53 99,
Site da Internet: https://www.infarmed.pt/
Ao notificar os efeitos não desejados, pode ajudar a obter mais informações sobre a segurança do medicamento.
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
5. Como conservar EMOCLOT
Manter o medicamento fora do alcance e da vista das crianças. Não utilizar o medicamento após o prazo de validade impresso na embalagem após EXP. O prazo de validade é o último dia do mês indicado.
Conservar no frigorífico (2°C - 8°C). Não congelar. Conservar na embalagem exterior para proteger da luz.
Antes da utilização e durante o prazo de validade do medicamento, o frasco de pó pode ser conservado à temperatura ambiente, não excedendo 25°C, por um máximo de 6 meses consecutivos. Após este período, o medicamento deve ser destruído. Em caso algum, o medicamento não pode ser devolvido ao frigorífico se foi conservado à temperatura ambiente.
No rótulo da embalagem exterior (caixa), deve registrar a data inicial de conservação à temperatura ambiente.
Após a abertura dos frascos, o conteúdo deve ser utilizado imediatamente. O conteúdo de um frasco deve ser utilizado para uma única administração do medicamento.
Os medicamentos não devem ser eliminados na canalização ou nos contentores de resíduos domésticos. Deve perguntar ao farmacêutico como eliminar os medicamentos de que já não necessita. Este procedimento ajudará a proteger o ambiente.
6. Conteúdo do pacote e outras informações
O que contém o EMOCLOT
A substância ativa do medicamento é o fator VIII humano de coagulação.
| EMOCLOT 500 UI | EMOCLOT 1000 UI | |
| Fator VIII humano de coagulação | 500 UI/frasco | 1000 UI/frasco |
| Fator VIII humano de coagulação após reconstituição em água para injeção | 50 UI/ml (500 UI/10 ml) | 100 UI/ml (1000 UI/10 ml) |
| Solvente (água para injeção) | 10 ml | 10 ml |
A potência do produto (UI) foi determinada pelo método cromogênico de acordo com a Farmacopeia Europeia.
A atividade específica do medicamento é de aproximadamente 80 UI/mg de proteína.
O medicamento é produzido a partir de plasma humano proveniente de doadores.
O medicamento contém: fator de von Willebrand: atividade de cofator de ristocetina (RCO) não inferior a 10 UI/ml para o tamanho de 500 UI/10 ml e não inferior a 20 UI/ml para o tamanho de 1000 UI/10 ml.
Os outros componentes do medicamento são citrato de sódio, cloreto de sódio, glicina, cloreto de cálcio.
Solvente: água para injeção.
Como é o EMOCLOT e que conteúdo tem o pacote
Pó e solvente para solução para injeção e infusão.
Após a reconstituição, a solução pode conter alguns pequenos fragmentos ou partículas.
A solução reconstituída deve ser verificada visualmente para detectar a presença de partículas sólidas ou descoloração.
A solução deve ser transparente ou ligeiramente opalescente. Não deve ser utilizado se a solução estiver turva ou contiver sedimentos.
O pacote do medicamento EMOCLOT contém um frasco de pó, um frasco de solvente para preparar a solução para administração e um conjunto estéril para preparar a solução e administração, composto por um dispositivo de reconstituição, uma seringa de uso único e uma agulha de borboleta com tubo de PVC.
Emoclot, 500 UI/10 ml
1 frasco de pó + 1 frasco de solvente + conjunto para preparar a solução e administração.
Emoclot, 1000 UI/10 ml,
1 frasco de pó + 1 frasco de solvente + conjunto para preparar a solução e administração.
Titular da autorização de comercialização e fabricante Titular da autorização de comercialização
Kedrion S.p.A. - Loc. Ai Conti, 55051 Castelvecchio Pascoli, Barga (Lucca), Itália
Fabricante
Kedrion S.p.A. - 55027 Bolognana, Gallicano (Lucca), Itália
Para obter informações mais detalhadas, deve contactar o representante do titular da autorização de comercialização
MB&S, Rua de Campolide, 237, 1070-030 Lisboa
Tel/fax: 21 790 47 00
Data da última revisão do folheto:
Informações destinadas apenas ao pessoal médico especializado:
Monitorização do tratamento
Durante o tratamento, deve ser avaliado o nível adequado de fator VIII para ajustar a dose e a frequência de administração. A resposta ao fator VIII, em doentes individuais, pode variar em termos de meia-vida e níveis de recuperação. A dose baseada no peso corporal pode necessitar de ajuste em doentes com baixo peso ou excesso de peso.
Especially em casos de cirurgia grave, é necessário um monitorização precisa do tratamento de substituição através de exames de coagulação (atividade de fator VIII no plasma).
Quando se utiliza um teste de coagulação in vitrode um estágio baseado no tempo de tromboplastina parcial ativada (aPTT) para determinar a atividade de fator VIII no sangue do doente, tanto o tipo de reagente aPTT como o padrão de referência utilizado no teste podem ter um impacto significativo nos resultados da determinação da atividade de fator VIII no plasma.
Também podem ocorrer diferenças significativas entre os resultados do teste de coagulação de um estágio baseado no aPTT e os resultados do teste cromogênico realizado de acordo com a Farmacopeia Europeia. Isso é especialmente importante em caso de mudança de laboratório e (ou) reagentes utilizados no teste.
Dosagem
A dose e a duração do tratamento de substituição dependem do grau de deficiência de fator VIII, do local e da extensão da hemorragia e do estado clínico do doente.
A quantidade de unidades de fator VIII administradas é expressa em unidades internacionais (UI) correspondentes aos padrões atuais da OMS para produtos de fator VIII. A atividade de fator VIII no plasma é expressa em percentagem (em relação ao plasma humano normal) ou em unidades internacionais (em relação aos padrões internacionais de fator VIII no plasma).
Uma unidade internacional (UI) de atividade de fator VIII é equivalente à quantidade de fator VIII presente em 1 ml de plasma de uma pessoa saudável.
Tratamento por necessidade
O cálculo da dose necessária de fator VIII é baseado em dados empíricos que demonstram que 1 UI de fator VIII por kg de peso corporal aumenta a atividade de fator VIII no plasma em 1,5% a 2%.
A dose necessária é determinada de acordo com a seguinte fórmula:
Quantidade de unidades necessárias = peso corporal [kg] x aumento desejado da atividade de fator VIII [%] [UI/dl] x 0,4
Ao determinar a dose necessária e a frequência de administração, deve ser guiado pela eficácia clínica no caso individual.
Na seguinte tabela de hemorragias, a atividade de fator VIII no plasma não deve diminuir abaixo do valor indicado (% da norma ou UI/dl).
A tabela abaixo pode ser usada como base para a dosagem em episódios de hemorragia e cirurgia:
Gravidade da hemorragia / Tipo de cirurgia
Frequência de dosagem (horas)/
Duração do tratamento (dias)
Hemorragias:
Hemorragia precoce na articulação,
hemorragia muscular ou na cavidade oral
Nível de fator VIII necessário (%) (UI/dl)
- 20 - 40 Repetir as infusões a cada 12 a 24 horas durante pelo menos 1 dia, até que a hemorragia seja controlada, avaliada pela diminuição da dor ou cicatrização da ferida. Hemorragia mais grave na articulação, hemorragia muscular ou hematoma
- 30 - 60 Repetir a cada 12-24 horas durante 3-4 dias ou mais, até que a dor ou a incapacidade aguda diminua. Hemorragias que colocam a vida em risco
- 60 - 100 Repetir a cada 8 a 24 horas até que o risco seja controlado Cirurgias: Cirurgias menores, incluindo extração de dentes
- 30 – 60 Repetir as infusões a cada 24 horas durante pelo menos 1 dia, até que a ferida seja cicatrizada. Cirurgias maiores
- 80 – 100 (antes e após a cirurgia) Repetir a cada 8 a 24 horas até que a ferida seja cicatrizada, e então por pelo menos 7 dias para manter a atividade de fator VIII em 30% a 60% (30 UI/dl - 60 UI/dl).
Profilaxia
Na profilaxia a longo prazo de hemorragias em doentes com hemofilia A grave, são geralmente utilizadas doses de 20 a 40 UI de fator VIII por kg de peso corporal, administradas a intervalos de 2 a 3 dias.
Em alguns casos, especialmente em doentes mais jovens, pode ser necessário administrar o medicamento a intervalos mais curtos ou em doses maiores.
Crianças e adolescentes
O EMOCLOT não é recomendado para utilização em crianças com menos de 12 anos devido à falta de dados sobre a segurança e eficácia. A dosagem em adolescentes (12-18 anos) em cada indicação é calculada com base no peso corporal.
Método de administração
Administrar por via intravenosa em injeção ou infusão lenta.
Em caso de injeção intravenosa, recomenda-se respeitar o tempo de administração de 3 a 5 minutos, verificando a frequência cardíaca do doente e interrompendo a administração ou reduzindo a velocidade de infusão se a frequência cardíaca aumentar.
A velocidade de infusão deve ser determinada individualmente para cada doente.
Instruções para a reconstituição do produto antes da administração, ver ponto 3. Como tomar EMOCLOT.
Inibidores
A importância clínica do inibidor formado dependerá do título do inibidor, sendo que inibidores com títulos baixos apresentam menor risco de resposta clínica inadequada do que inibidores com títulos altos.
Em geral, todos os doentes tratados com produtos de fator VIII devem ser monitorizados atentamente para a formação de inibidores, através da observação do estado clínico e da avaliação de exames laboratoriais. Se, apesar da administração de uma dose adequada, não for possível atingir o nível esperado de atividade de fator VIII no plasma ou controlar a hemorragia, deve ser realizado um exame para detectar a presença de inibidores do fator VIII. Em doentes com atividade significativa de inibidor, o tratamento com fator VIII pode ser ineficaz e deve ser considerada outra opção terapêutica. O tratamento desses doentes deve ser realizado sob a supervisão de médicos experientes no tratamento da hemofilia e inibidores do fator VIII.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorKedrion S.p.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a EmoclotForma farmacêutica: Pó, 1000 UISubstância ativa: coagulation factor VIIIFabricante: CSL Behring GmbHRequer receita médicaForma farmacêutica: Pó, 2000 UISubstância ativa: coagulation factor VIIIFabricante: CSL Behring GmbHRequer receita médicaForma farmacêutica: Pó, 250 UISubstância ativa: coagulation factor VIIIFabricante: CSL Behring GmbHRequer receita médica
Alternativas a Emoclot noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Emoclot em Espanha
Alternativa a Emoclot em Ukraine
Médicos online para Emoclot
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Emoclot – sujeita a avaliação médica e regras locais.














