
Biotum
Pergunte a um médico sobre a prescrição de Biotum

Como usar Biotum
Folheto informativo para o utilizador
Biotum, 1 g, pó de ceftazidima para solução injectável ou infusão
Biotum, 2 g, pó de ceftazidima para solução injectável ou infusão
Ceftazidima
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve conservar este folheto para poder relê-lo se necessário.
- Em caso de dúvidas, deve consultar o médico ou a enfermeira.
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode ser prejudicial a outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o doente apresentar algum efeito secundário, incluindo quaisquer efeitos secundários não mencionados neste folheto, deve informar o médico ou a enfermeira. Ver ponto 4.
Índice do folheto
- 1. O que é o medicamento Biotum e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Biotum
- 3. Como tomar o medicamento Biotum
- 4. Efeitos secundários possíveis
- 5. Como conservar o medicamento Biotum
- 6. Conteúdo do pacote e outras informações
1. O que é o medicamento Biotum e para que é utilizado
O Biotum é um antibiótico utilizado em adultos e crianças (incluindo recém-nascidos). Actua como bactericida sobre as bactérias que causam infecções. Pertence a um grupo de medicamentos chamados cefalosporinas .
O Biotum é utilizado no tratamento de infecções bacterianas graves:
- das vias respiratórias inferiores, incluindo os pulmões
- dos pulmões e brônquios em doentes com fibrose cística
- do cérebro (meningite)
- do ouvido
- do trato urinário
- da pele e tecidos moles
- da cavidade abdominal e revestimento abdominal (peritonite)
- dos ossos e articulações.
O Biotum também pode ser utilizado:
- na prevenção de infecções durante a ressecção transuretral da próstata em homens
- no tratamento de doentes com uma baixa contagem de glóbulos brancos (neutropenia), com febre devido a uma infecção bacteriana.
2. Informações importantes antes de tomar o medicamento Biotum
Quando não tomar o medicamento Biotum
- Se o doente for alérgico à ceftazidima ou a qualquer outro componente deste medicamento (listados no ponto 6).
- Se o doente já teve uma reação alérgica gravea qualquer outro antibiótico(penicilinas, monobactamas e carbapenémicos), pois o doente pode também ser alérgico ao Biotum.
➢
Se o doente suspeitar que se aplicam as circunstâncias acima descritas, deve informar o seu médico antesde iniciar o tratamento com o medicamento Biotum.
Não administrar o medicamento Biotum ao doente.
Precauções e advertências
Antes de iniciar o tratamento com o medicamento Biotum, deve discutir com o médico ou a enfermeira.
Deve estar atento a quaisquer sintomas especiais, tais como reações alérgicas, distúrbios do sistema nervoso e distúrbios gastrointestinais, incluindo diarreia. Isso reduzirá o risco de possíveis problemas. Ver "Sintomas a que deve prestar atenção" no ponto 4. Se o doente já teve uma reação alérgica a outros antibióticos, pode ser alérgico ao Biotum.
Foram relatados casos de reações cutâneas graves com ceftazidima, incluindo síndrome de Stevens-Johnson, necrólise epidérmica tóxica, síndrome de hipersensibilidade a medicamentos (DRESS) e pustulose exantemática aguda generalizada (AGEP). Se o doente apresentar algum dos sintomas associados a essas reações cutâneas graves descritas no ponto 4, deve contactar imediatamente o médico.
Exames de sangue e urina
O Biotum pode alterar os resultados dos exames de urina para detecção de glicose e dos exames de sangue conhecidos como teste de Coombs.
Se o doente tiver de realizar esses exames:
- Deve informar a pessoa que recolhe as amostrasde que está a tomar o medicamento Biotum.
Biotum e outros medicamentos
Deve informar o médico sobre todos os medicamentos que está a tomar atualmente ou recentemente,
e também sobre os medicamentos que planeia tomar.
O doente não deve tomar o medicamento Biotum sem consultar o médico, se também estiver a tomar:
- um antibiótico chamado clorafenicol
- um antibiótico do grupo chamado aminoglicosídeos, como a gentamicina ou a tobramicina
- comprimidos diuréticos que contenham furosemida.
➢
Se as circunstâncias acima descritas se aplicam ao doente, deve informar o seu médico.
Gravidez e amamentação
Se a doente estiver grávida ou a amamentar, suspeitar que possa estar grávida ou planeia ter um filho, deve consultar o médico antes de tomar este medicamento.
O médico avaliará se os benefícios do tratamento com o medicamento Biotum durante a gravidez e a amamentação para a doente superam os riscos para o bebê.
Condução de veículos e utilização de máquinas
O Biotum pode causar efeitos secundários que afetam a capacidade de conduzir veículos ou operar máquinas, como tonturas (ver ponto 4). O doente não deve conduzir veículos ou operar máquinas, a menos que tenha certeza de que não apresenta esses efeitos secundários.
Biotum contém sódio
Cada frasco de 1 g contém 60 mg de sódio. Isso corresponde a 3% da dose diária máxima recomendada de sódio na dieta para adultos.
Cada frasco de 2 g contém 120 mg de sódio. Isso corresponde a 6% da dose diária máxima recomendada de sódio na dieta para adultos.
O medicamento contém 60 mg de sódio (principal componente do sal de cozinha) por grama de pó. Isso corresponde a 3% da dose diária máxima recomendada de sódio na dieta para adultos.
Isso deve ser considerado em doentes com função renal reduzida e em doentes que controlam a ingestão de sódio na dieta.
Preparação do medicamento para administração - ver ponto: "Informações destinadas apenas ao pessoal médico" no final do folheto. Ao calcular o teor total de sódio na solução diluída preparada, deve-se considerar o sódio proveniente do diluente. Para obter informações precisas sobre o teor de sódio na solução utilizada para diluir o medicamento, deve-se consultar o folheto do paciente do diluente utilizado.
3. Como tomar o medicamento Biotum
Este medicamento deve ser sempre tomado de acordo com as recomendações do médico. Em caso de dúvida, deve consultar o médico.
O Biotum é geralmente administrado por um médico ou enfermeira.
O Biotum de 1 g pode ser administrado por gotejamento(infusão intravenosa) ou como injeção directa na veia ou injeção intramuscular.
O Biotum de 2 g pode ser administrado por gotejamento(infusão intravenosa) ou como injeção directa na veia.
O Biotum é preparado pelo médico ou enfermeira utilizando água para injeção ou outro líquido de infusão adequado.
Dose usualmente recomendada
O médico decidirá a dose adequada de Biotum para o doente, considerando a gravidade e o tipo de infecção, a ingestão de outros antibióticos, o peso corporal, a idade e a função renal do doente.
Recém-nascidos e lactentes (com 0-2 meses)
Para cada 1 kg de peso corporal do lactente, administra-se durante 24 horas de 25 mg a 60 mg de Biotum em duas doses divididas.
Lactentes (com mais de 2 meses) e criançascom peso corporal inferior a 40 kg Para cada kg de peso corporal do lactente ou criançaadministra-se durante 24 horas de 100 mg a 150 mg de Biotum em três doses divididas. Máximo 6 g por dia.
Adultos e adolescentescom peso corporal de 40 kg ou mais
De 1g a 2 g de Biotum três vezes por dia. Máximo 9 g por dia.
Doentes com mais de 65 anos
A dose diária não deve ser superior a 3 g por dia, especialmente em doentes com mais de 80 anos.
Doentes com doença renal
O doente pode receber uma dose diferente da usualmente recomendada. O médico ou enfermeira decidirá qual dose de Biotum deve ser administrada ao doente, com base na gravidade da doença renal. O médico supervisionará atentamente o doente e pode ordenar a realização de exames de função renal mais frequentes.
Uso de dose maior do que a recomendada de Biotum
Em caso de administração acidental de uma dose maior do que a prescrita de Biotum, deve contactar imediatamente o médico ou dirigir-se ao hospital mais próximo.
Omissão da dose de Biotum
Se o doente não tomou a injeção, deve administrá-la o mais breve possível.
Não deve tomar uma dose dupla (duas injeções ao mesmo tempo) para compensar a dose omitida, mas sim a próxima dose no horário usual.
Interrupção do tratamento com Biotum
Não deve interromper o tratamento com Biotum sem o conselho do médico.
Em caso de dúvidas adicionais sobre o uso deste medicamento, deve consultar o médico ou a enfermeira.
4. Efeitos secundários possíveis
Como qualquer medicamento, este medicamento pode causar efeitos secundários, embora não em todos os doentes.
Sintomas a que deve prestar atenção
➢
Os sintomas graves abaixo descritos ocorreram em um pequeno número de doentes, mas a frequência exata é desconhecida (a frequência não pode ser determinada com base nos dados disponíveis).
Se o doente apresentar algum dos seguintes sintomas, deve contactar imediatamente o médico:
- Reação alérgica grave. Os sintomas são: erupção cutânea elevada e pruriginosa, inchaço, sometimes da face ou lábios, que pode causar dificuldade respiratória.
- Manchas vermelhas no tronco, manchas semelhantes a um alvo ou redondas, frequentemente com bolhas centrais, descamação da pele, úlceras na boca, garganta, nariz, genitais e olhos. Essas erupções cutâneas graves podem ser precedidas por febre e sintomas semelhantes aos da gripe (síndrome de Stevens-Johnson, necrólise epidérmica tóxica).
- Erupção cutânea generalizada, febre alta e linfonodos aumentados (síndrome de hipersensibilidade a medicamentos ou síndrome DRESS).
- Erupção cutânea vermelha, descamativa, generalizada com nódulos sob a pele e bolhas e febre associada. Os sintomas ocorrem geralmente no início do tratamento (pustulose exantemática aguda generalizada ou AGEP).
- Distúrbios do sistema nervoso: tremores, convulsões e, por vezes, coma. Esses distúrbios ocorreram em doentes que receberam doses excessivas, especialmente em doentes com doença renal.
Efeitos secundários frequentes
Podem ocorrer em até 1 em cada 10doentes:
- diarreia
- inchaço e vermelhidão ao longo da veia
- erupção cutânea vermelha e elevada, que pode ser pruriginosa
- dor, ardor, inchaço ou inflamação no local da injeção.
➢
Se algum dos sintomas acima preocupar o doente, deve informar o seu médico.
Efeitos secundários frequentes que podem ser detectados em exames de sangue:
- aumento do número de um tipo de glóbulos brancos (eosinofilia)
- aumento do número de plaquetas, que participam na coagulação do sangue
- aumento da atividade de enzimas hepáticas.
Efeitos secundários menos frequentes
Podem ocorrer em até 1 em cada 100doentes:
- colite, que pode causar dor ou diarreia, que pode conter sangue
- infecções fúngicas da boca ou vagina
- dor de cabeça
- tonturas
- dor abdominal
- náuseas ou vómitos
- febre e calafrios.
➢
Deve informar o seu médico se apresentar algum dos sintomas acima.
Efeitos secundários menos frequentes que podem ser detectados em exames de sangue:
- diminuição do número de glóbulos brancos
- diminuição do número de plaquetas (células que participam na coagulação do sangue)
- aumento da concentração de ureia, azoto ureico ou creatinina no sangue.
Efeitos secundários muito raros
Podem ocorrer em até 1 em cada 10 000doentes:
- inflamação ou insuficiência renal.
Outros efeitos secundários
Outros efeitos secundários que ocorreram em um pequeno número de doentes, mas a frequência exata é desconhecida:
- formigamento
- sabor desagradável na boca
- amarelamento da esclera e pele.
Outros efeitos secundários que podem ser detectados em exames de sangue:
- destruição de glóbulos vermelhos
- aumento do número de um tipo de glóbulos brancos no sangue
- diminuição acentuada do número de glóbulos brancos.
Notificação de efeitos secundários
Se ocorrerem efeitos secundários, incluindo quaisquer efeitos secundários não mencionados neste folheto, deve informar o médico, farmacêutico ou enfermeira. Os efeitos secundários podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Secundários de Medicamentos da Autoridade de Regulação de Medicamentos
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Sítio web: https://smz.ezdrowie.gov.pl
Os efeitos secundários também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos secundários permitirá reunir mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento Biotum
O medicamento deve ser conservado a uma temperatura não superior a 25°C. Proteger da luz.
A solução preparada pode ser conservada durante 24 horas no frigorífico, a uma temperatura entre 2°C e 8°C.
O medicamento deve ser conservado fora do alcance e da vista das crianças.
Não deve tomar este medicamento após o prazo de validade impresso no pacote. O prazo de validade é o último dia do mês indicado.
A menção no pacote após a abreviatura EXP indica o prazo de validade, e após a abreviatura Lot, o número da série.
Os medicamentos não devem ser eliminados na canalização ou nos contentores de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos que já não são utilizados. Essa ação ajudará a proteger o ambiente.
6. Conteúdo do pacote e outras informações
O que contém o medicamento Biotum
- O princípio ativo do medicamento é a ceftazidima. Cada frasco contém 1 g ou 2 g de ceftazidima na forma de pentaidrato de ceftazidima, tamponado com carbonato de sódio.
- O outro componente é: carbonato de sódio.
Como é o medicamento Biotum e que conteúdo tem o pacote
Pó branco ou amarelo claro contido em frascos de vidro, fechados com um rolha de borracha e protegidos por uma cápsula de alumínio ou uma cápsula de alumínio com uma tampa, em caixas de cartão.
O pacote contém 1 ou 10 frascos.
Nem todos os tamanhos de pacotes podem estar disponíveis.
Titular da autorização de comercialização e fabricante
Titular da autorização de comercialização
Zakłady Farmaceutyczne POLPHARMA S.A.
ul. Pelplińska 19, 83-200 Starogard Gdański
tel. + 48 22 364 61 01
Fabricante
Zakłady Farmaceutyczne POLPHARMA S.A.
ul. Pelplińska 19, 83-200 Starogard Gdański
Zakłady Farmaceutyczne POLPHARMA S.A.
Divisão de Produção em Duchnice
ul. Ożarowska 28/30, 05-850 Ożarów Mazowiecki
Data da última actualização do folheto:
---------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas ao pessoal médico
Biotum, 1 g, pó de ceftazidima para solução injectável ou infusão
Biotum, 2 g, pó de ceftazidima para solução injectável ou infusão
Ceftazidima
A pressão nos frascos de Biotum de qualquer tamanho é inferior à pressão atmosférica. Durante a dissolução do pó, a pressão aumenta devido à libertação de dióxido de carbono. Podem ser ignorados pequenos bolhas de dióxido de carbono presentes na solução preparada.
Instruções para a preparação do medicamento para administração
Deve consultar a tabela de volumes adicionados e concentrações obtidas, o que pode ser útil quando são necessárias doses parciais.
| Conteúdo do frasco | Via de administração | Volume do diluente a adicionar [ml] | Concentração aproximada de ceftazidima [mg/ml] |
| 1 g | injeção intramuscular | 3 ml | 260 |
| injeção intravenosa | 10 ml | 90 |
| infusão intravenosa | 50 ml* | 20 | |
| 2 g | injeção intravenosa | 10 ml | 170 |
| infusão intravenosa | 50 ml* | 40 |
* Nota. Adicionar em duas etapas
A coloração da solução varia de amarelo claro a âmbar, dependendo da concentração, do tipo de diluente e das condições de armazenamento. Se as condições recomendadas forem cumpridas, a variabilidade da coloração da solução não afeta adversamente a eficácia do medicamento.
Para a preparação de soluções de infusão intravenosa com concentrações de ceftazidima entre 1 mg/ml e 40 mg/ml, utilizam-se:
- 9 mg/ml (0,9%) solução de cloreto de sódio para injeção
- M/6 solução de lactato de sódio para injeção
- solução de lactato de sódio multicomponente para injeção (solução de Hartmann)
- 5% solução de glicose para injeção
- 0,225% solução de cloreto de sódio com 5% solução de glicose para injeção
- 0,45% solução de cloreto de sódio com 5% solução de glicose para injeção
- 0,9% solução de cloreto de sódio com 5% solução de glicose para injeção
- 0,18% solução de cloreto de sódio com 4% solução de glicose para injeção
- 10% solução de glicose para injeção
- 10% solução de dextrana 40 em 0,9% solução de cloreto de sódio para injeção
- 10% solução de dextrana 40 em 5% solução de glicose para injeção
- 6% solução de dextrana 70 em 0,9% solução de cloreto de sódio
- 6% solução de dextrana 70 em 5% solução de glicose para injeção.
A ceftazidima em concentrações entre 0,05 mg/ml e 0,25 mg/ml é compatível com o líquido de diálise peritoneal (com lactato).
A ceftazidima para injeção intramuscular pode ser dissolvida em uma solução contendo 0,5% ou 1% de cloridrato de lidocaína para injeção.
Preparação da solução para injeção rápida
- 1. Perfurar o rolha com a agulha e injetar no frasco o volume recomendado de diluente. Para perfurar o rolha, deve utilizar uma agulha com diâmetro não superior a 0,8 mm (21 G na escala Gauge [G]). A agulha deve ser inserida no centro do rolha a um ângulo de 90°, de acordo com o esquema abaixo:
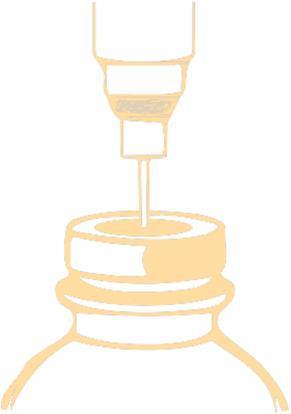
A pressão negativa dentro do frasco pode facilitar a entrada do diluente. Retirar a agulha com a seringa.
- 2. Agitar até dissolver: liberta-se dióxido de carbono e, dentro de 1 a 2 minutos, obtém-se uma solução clara.
- 3. Inverter o frasco. Mantendo o êmbolo da seringa na posição totalmente pressionada, perfurar o rolha do frasco com a agulha e aspirar todo o volume da solução para a seringa (a pressão aumentada no frasco facilitará esta operação). A agulha deve ser mantida dentro da solução para evitar a aspiração de ar. A solução aspirada para a seringa pode conter pequenas bolhas de dióxido de carbono.
- País de registo
- Substância ativa
- Requer receita médicaNão
- Fabricante
- ImportadorZakłady Farmaceutyczne POLPHARMA S.A. Zakłady Farmaceutyczne POLPHARMA S.A. Oddział Produkcyjny w Duchnicach
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a BiotumForma farmacêutica: Pó, 500 mgSubstância ativa: ceftazidimeFabricante: Zakłady Farmaceutyczne POLPHARMA S.A. Zakłady Farmaceutyczne POLPHARMA S.A. Oddział Produkcyjny w DuchnicachNão requer receita médicaForma farmacêutica: Pó, 1 gSubstância ativa: ceftazidimeFabricante: Zakłady Farmaceutyczne POLPHARMA S.A. Zakłady Farmaceutyczne POLPHARMA S.A. Oddział Produkcyjny w DuchnicachNão requer receita médicaForma farmacêutica: Pó, 1 gSubstância ativa: ceftazidimeNão requer receita médica
Alternativas a Biotum noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Biotum em Espanha
Alternativa a Biotum em Ukraine
Médicos online para Biotum
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Biotum – sujeita a avaliação médica e regras locais.














