
TEVAGRASTIM 30 MU/0.5 ml SOLUTION FOR INJECTION OR INFUSION

How to use TEVAGRASTIM 30 MU/0.5 ml SOLUTION FOR INJECTION OR INFUSION
Translated with AI
This page provides general information and does not replace a doctor’s consultation. Always consult a doctor before taking any medication. Seek urgent medical care if symptoms are severe.
Show originalContents of the leaflet
Introduction
Package Leaflet: Information for the User
Tevagrastim 30 MUI/0.5 ml Solution for Injection and Infusion
Tevagrastim 48 MUI/0.8 ml Solution for Injection and Infusion
filgrastim
Read all of this leaflet carefully before you start using this medicine because it contains important information for you.
- Keep this leaflet, you may need to read it again.
- If you have any further questions, ask your doctor, pharmacist, or nurse.
- This medicine has been prescribed for you only. Do not pass it on to others. It may harm them, even if their signs of illness are the same as yours.
- If you get any side effects, talk to your doctor, pharmacist, or nurse. This includes any possible side effects not listed in this leaflet. See section 4.
Contents of the pack
- What is Tevagrastim and what is it used for
- What you need to know before you use Tevagrastim
- How to use Tevagrastim
- Possible side effects
- Storage of Tevagrastim
- Contents of the pack and other information
- Information for self-injection
- This information is intended only for healthcare professionals
1. What is Tevagrastim and what is it used for
What is Tevagrastim
Tevagrastim is a white blood cell growth factor (granulocyte-colony stimulating factor) and belongs to a group of medicines called cytokines. Growth factors are proteins that are produced naturally in the body, but they can also be produced using genetic engineering for use as a medicine. Tevagrastim works by making the bone marrow produce more white blood cells.
What is Tevagrastim used for
A reduction in the number of white blood cells (neutropenia) can occur for several reasons and makes your body less able to fight infections. Tevagrastim stimulates the bone marrow to produce new white blood cells quickly.
Tevagrastim can be used:
- to increase the number of white blood cells after chemotherapy to help prevent infections;
- to increase the number of white blood cells after a bone marrow transplant to help prevent infections;
- before high-dose chemotherapy to make the bone marrow produce more stem cells, which can be collected and returned to your body after treatment. These cells can be collected from you or a donor. The stem cells will then return to the bone marrow and produce blood cells;
- to increase the number of white blood cells if you have severe chronic neutropenia to help prevent infections;
- to help reduce the risk of infections in patients with advanced HIV infection.
2. What you need to know before you use Tevagrastim
Do not use Tevagrastim
- if you are allergic to filgrastim or any of the other ingredients of this medicine (listed in section 6).
Warnings and precautions
Talk to your doctor, pharmacist, or nurse before starting Tevagrastim.
Tell your doctor before starting treatment if you have:
- sickle cell anaemia, as this medicine may cause sickle cell crisis;
- osteoporosis (bone disease).
Tell your doctor immediately during treatment with Tevagrastim if:
- you have sudden signs of allergy, such as rash, itching or hives on the skin, swelling of the face, lips, tongue or other parts of the body, shortness of breath, wheezing or difficulty breathing, as these may be signs of a severe allergic reaction (hypersensitivity);
- you have swelling of the face or ankles, blood in the urine or brown-coloured urine or if you notice that you urinate less often than usual (glomerulonephritis);
- you have pain in the upper left side of the abdomen (abdominal pain), pain below the left side of the rib cage or pain at the tip of the left shoulder (these may be symptoms of an enlarged spleen [splenomegaly] or a possible rupture of the spleen);
- you notice bleeding or bruising (these may be symptoms of a reduction in platelets in the blood [thrombocytopenia], with a reduced ability of the blood to clot);
- you have symptoms of inflammation of the aorta (the large blood vessel that carries blood from the heart to the rest of the body), this has been rarely reported in patients with cancer and in healthy donors. Symptoms may include fever, abdominal pain, general malaise, back pain, and increased inflammatory markers. Tell your doctor if you experience these symptoms.
Loss of response to filgrastim
If you experience a loss of response or if it is not possible to maintain a response to treatment with filgrastim, your doctor will investigate the causes, including whether you have developed antibodies that may neutralize the activity of filgrastim.
Your doctor may want to closely monitor you, see section 4 of the leaflet.
If you are a patient with severe chronic neutropenia, you may be at risk of developing blood cancer (leukaemia, myelodysplastic syndrome [MDS]). Talk to your doctor about the risks of developing blood cancer and the tests that should be performed. If you develop or are likely to develop blood cancer, you should not use Tevagrastim unless your doctor says so.
If you are a stem cell donor, you must be between 16 and 60 years old.
Be careful with other products that stimulate white blood cells
Tevagrastim belongs to a group of medicines that stimulate the production of white blood cells. Your doctor should always record the exact product you are using.
Other medicines and Tevagrastim
Tell your doctor or pharmacist if you are using, have recently used, or might use any other medicines.
Pregnancy and breastfeeding
Tevagrastim has not been studied in pregnant or breastfeeding women.
Tevagrastim is not recommended during pregnancy.
It is important that you tell your doctor:
- if you are pregnant or breastfeeding;
- if you think you may be pregnant; or
- if you plan to become pregnant
If you become pregnant during treatment with Tevagrastim, tell your doctor. Unless your doctor tells you otherwise, you must stop breastfeeding if you use Tevagrastim.
Driving and using machines
Tevagrastim has a minor influence on your ability to drive and use machines. This medicine may cause dizziness. It is recommended that you wait and see how you feel after administration of the medicine before driving or operating machinery.
Tevagrastim contains sorbitol
This medicine contains 50 mg of sorbitol in each ml.
For intravenous administration
Sorbitol is a source of fructose. If you (or your child) have hereditary fructose intolerance (HFI), a rare genetic disorder, you (or your child) should not receive this medicine. Patients with HFI cannot break down fructose, which can cause serious side effects. Consult your doctor before receiving this medicine if you (or your child) have HFI or if your child cannot take sweet foods or drinks because they cause nausea, vomiting, or unpleasant effects such as bloating, stomach cramps, or diarrhoea.
Tevagrastim contains sodium
This medicine contains less than 1 mmol of sodium (23 mg) per pre-filled syringe; this is essentially “sodium-free”.
3. How to use Tevagrastim
Follow the instructions for administration of this medicine exactly as told by your doctor or pharmacist. If you are unsure, consult your doctor or pharmacist again.
How is Tevagrastim administered and how much should you take?
Tevagrastim is usually administered once a day as an injection into the tissue just under the skin (known as a subcutaneous injection). It can also be administered once a day as a slow injection into a vein (known as an intravenous infusion). The usual dose varies depending on your condition and weight. Your doctor will tell you how much Tevagrastim to take.
Patient with bone marrow transplant after chemotherapy:
You will usually receive your first dose of Tevagrastim at least 24 hours after chemotherapy and at least 24 hours after receiving your bone marrow transplant.
You or the people caring for you may be taught how to administer subcutaneous injections so that you can continue treatment at home. However, you should not attempt to do this unless your healthcare professional has trained you adequately.
How long will you need to take Tevagrastim?
You will need to take Tevagrastim until your white blood cell count is normal. You will have regular blood tests to monitor the number of white blood cells in your body. Your doctor will tell you how long you need to take Tevagrastim.
Use in children
Tevagrastim is used to treat children who are receiving chemotherapy or who have a low white blood cell count (neutropenia). The dose given to children receiving chemotherapy is the same as for adults.
If you use more Tevagrastim than you should
Do not increase the dose that your doctor has prescribed. If you have used more Tevagrastim than you should, contact your doctor or pharmacist as soon as possible.
If you forget to use Tevagrastim
If you have missed an injection, or if you have injected less dose, contact your doctor as soon as possible. Do not take a double dose to make up for forgotten doses.
If you have any other questions on the use of this medicine, ask your doctor, pharmacist, or nurse.
4. Possible side effects
Like all medicines, this medicine can cause side effects, although not everybody gets them.
Important side effects
It is important that you contact your doctor immediately:
- if you experience an allergic reaction, including weakness, low blood pressure, difficulty breathing, swelling of the face (anaphylaxis), skin rash, itchy skin rash (urticaria), swelling of the face, lips, mouth, tongue or throat (angioedema), and shortness of breath (dyspnoea);
- if you experience cough, fever, and difficulty breathing (dyspnoea), as this may be a sign of acute respiratory distress syndrome (ARDS);
- if you experience kidney damage (glomerulonephritis). Kidney damage has been observed in patients receiving filgrastim. Contact your doctor immediately if you notice swelling of the face or ankles, blood in the urine or brown-coloured urine, or if you notice that you urinate less often than usual;
- if you experience any or a combination of the following side effects:
- swelling that may be associated with urinating less often, difficulty breathing, swelling, and a feeling of fullness in the abdomen, and a general feeling of tiredness. These symptoms usually develop quickly.
These may be symptoms of a condition called “capillary leak syndrome” and can cause blood to leak from small blood vessels into other parts of your body and require urgent medical attention.
- if you experience a combination of the following symptoms:
- fever, chills or feeling very cold, high heart rate, confusion or disorientation, difficulty breathing, severe pain or discomfort, and sweaty skin.
These could be symptoms of a condition called “sepsis” (also called “blood poisoning”), a serious infection with a whole-body inflammatory response that can be life-threatening and requires urgent medical attention;
- if you experience pain in the upper left side of the abdomen (abdominal pain), pain below the left side of the rib cage or pain at the tip of the left shoulder, as this may be a problem with your spleen (enlarged spleen [splenomegaly] or rupture of the spleen);
- if you are being treated for severe chronic neutropenia and have blood in the urine (haematuria). Your doctor will perform regular urine tests if you experience this side effect or if protein is found in your urine (proteinuria).
A common side effect of using Tevagrastim is pain in the muscles or bones (musculoskeletal pain), which can be relieved by taking ordinary pain-relieving medicines (analgesics). In patients undergoing stem cell or bone marrow transplantation, graft-versus-host disease (GVHD) may occur. This is a reaction of the donor cells against the patient receiving the transplant; signs and symptoms include rashes on the palms of the hands or soles of the feet, and ulcers and sores in the mouth, gut, liver, skin, eyes, lungs, vagina, and joints.
In healthy donors of stem cells, an increase in white blood cells (leucocytosis) and a decrease in platelets that can reduce the ability of the blood to clot (thrombocytopenia) may be observed. These effects will be monitored by your doctor.
You may experience the following side effects:
Very common(may affect more than 1 in 10 people):
- reduction in platelets, which reduces the ability of the blood to clot (thrombocytopenia)
- low red blood cell count (anaemia)
- headache
- diarrhoea
- vomiting
- nausea
- unusual hair loss or thinning (alopecia)
- fatigue (fatigue)
- irritation and swelling of the lining of the digestive tract (mucosal inflammation)
- fever (pyrexia)
Common(may affect up to 1 in 10 people):
- inflammation of the lungs (bronchitis)
- infection of the upper respiratory tract
- infection of the urinary tract
- decreased appetite
- sleeping problems (insomnia)
- dizziness
- reduced sensitivity, especially in the skin (hypoesthesia)
- tingling or numbness of the hands or feet (paraesthesia)
- low blood pressure (hypotension)
- high blood pressure (hypertension)
- cough
- coughing up blood (haemoptysis)
- mouth and throat pain (oropharyngeal pain)
- nosebleeds (epistaxis)
- constipation
- mouth pain
- enlargement of the liver (hepatomegaly)
- rash
- redness of the skin (erythema)
- muscle cramp
- pain when urinating (dysuria)
- chest pain
- pain
- general weakness (asthenia)
- feeling unwell (malaise)
- swelling of the hands and feet (peripheral oedema)
- increase in certain enzymes in the blood
- changes in blood biochemistry tests
- transfusion reaction
Uncommon(may affect up to 1 in 100 people):
- increase in white blood cells in the blood (leucocytosis)
- allergic reaction (hypersensitivity)
- rejection of the bone marrow transplant (graft-versus-host disease)
- high levels of uric acid in the blood, which can cause gout (hyperuricaemia) (elevated uric acid in blood)
- liver damage caused by blockage of the small veins of the liver (veno-occlusive disease)
- the lungs not working as they should, causing shortness of breath (respiratory failure)
- swelling or fluid in the lungs (pulmonary oedema)
- inflammation of the lungs (interstitial lung disease)
- abnormal chest X-rays (pulmonary infiltration)
- bleeding in the lungs (pulmonary haemorrhage)
- lack of oxygen absorption in the lungs (hypoxia)
- irregular skin rash (maculopapular rash)
- disease that causes bones to lose density, making them weaker, more fragile, and prone to breaking (osteoporosis)
- reaction at the injection site
Rare(may affect up to 1 in 1,000 people):
- severe pain in the bones, chest, intestines, or joints (sickle cell crisis)
- sudden, life-threatening allergic reactions (anaphylactic reaction)
- swelling and pain in the joints, similar to gout (pseudogout)
- a change in the way your body regulates body fluids that can result in swelling (fluid volume alterations)
- inflammation of the blood vessels in the skin (cutaneous vasculitis)
- painful, inflamed, and dark red ulcers on the limbs and sometimes on the face and neck, accompanied by fever (Sweet's syndrome)
- worsening of rheumatoid arthritis
- unusual changes in urine
- reduction in bone density
- inflammation of the aorta (the large blood vessel that carries blood from the heart to the rest of the body), see section 2
Reporting of side effects
If you experience any side effects, talk to your doctor, pharmacist, or nurse. This includes any possible side effects not listed in this leaflet. You can also report side effects directly via the national reporting system listed in Appendix V. By reporting side effects, you can help provide more information on the safety of this medicine.
5. Storage of Tevagrastim
Keep this medicine out of the sight and reach of children.
Do not use this medicine after the expiry date which is stated on the carton and on the pre-filled syringe after EXP. The expiry date is the last day of the month stated.
Store in a refrigerator (2°C - 8°C).
Within its validity period and for ambulatory use, the medicine can be taken out of the refrigerator (2°C - 8°C) and stored at a temperature of up to 25°C for a single period of up to 4 days. If the medicine is not used within these 4 days, it should be returned to the refrigerator (2°C - 8°C) until the expiry date. Pre-filled syringes stored at more than 8°C for more than 4 days should be discarded.
Do not use this medicine if you notice turbidity or particles in the solution.
Medicines should not be disposed of via wastewater or household waste. Ask your pharmacist how to dispose of medicines no longer required. This will help protect the environment.
6. Container Content and Additional Information
Composition of Tevagrastim
- The active substance is filgrastim. Each ml of injectable solution and infusion contains 60 million international units (MIU) (600 micrograms) of filgrastim.
Tevagrastim 30 MIU/0.5 ml: each pre-filled syringe contains 30 million international units [MIU] (300 micrograms) of filgrastim in 0.5 ml of solution.
Tevagrastim 48 MIU/0.8 ml: each pre-filled syringe contains 48 million international units [MIU] (480 micrograms) of filgrastim in 0.8 ml of solution.
- The other components are: sodium hydroxide, glacial acetic acid, sorbitol, polysorbate 80, water for injectable preparations.
Appearance of the Product and Container Content
Tevagrastim is an injectable solution and infusion in a pre-filled syringe with or without a safety device. Tevagrastim is a clear and colorless solution. Each pre-filled syringe contains 0.5 ml or 0.8 ml of solution.
Tevagrastim is supplied in packs of 1, 5 or 10 pre-filled syringes or in multiple packs containing 10 pre-filled syringes (2 packs of 5) with injection needle and with or without needle safety protector. Not all pack sizes may be marketed.
Marketing Authorization Holder
TEVA GmbH
Graf-Arco-Strasse 3
89079 Ulm
Germany
Manufacturer
Teva Pharma B.V.
Swensweg 5
2031 GA Haarlem
Netherlands
Merckle GmbH
Graf-Arco-Straße 3
89079 Ulm
Germany
You can request more information about this medicine by contacting the local representative of the marketing authorization holder:
Belgium/Belgique/Belgien Teva Pharma Belgium N.V./S.A./AG Tel: +32 38207373 | Lithuania UAB Teva Baltics Tel: +370 52660203 |
| Luxembourg/Luxemburg Teva Pharma Belgium N.V./S.A./AG Belgique/Belgien Tel: +32 38207373 |
Czech Republic Teva Pharmaceuticals CR, s.r.o. Tel: +420 251007111 | Hungary Teva Gyógyszergyár Zrt. Tel: +36 12886400 |
Denmark Teva Denmark A/S Tlf: +45 44985511 | Malta Teva Pharmaceuticals Ireland Ireland Tel: +44 2075407117 |
Germany TEVA GmbH Tel: +49 73140208 | Netherlands Teva Nederland B.V. Tel: +31 8000228400 |
Estonia UAB Teva Baltics Eesti filiaal Tel: +372 6610801 | Norway Teva Norway AS Tlf: +47 66775590 |
Greece TEVA HELLAS Α.Ε. Τηλ: +30 2118805000 | Austria ratiopharm Arzneimittel Vertriebs-GmbH Tel: +43 1970070 |
Spain Teva Pharma, S.L.U. Tel: +34 913873280 | Poland Teva Pharmaceuticals Polska Sp. z o.o. Tel: +48 223459300 |
France Teva Santé Tél: +33 155917800 | Portugal Teva Pharma - Produtos Farmacêuticos, Lda. Tel: +351 214767550 |
Croatia Pliva Hrvatska d.o.o. Tel: +385 13720000 | Romania Teva Pharmaceuticals S.R.L. Tel: +40 212306524 |
Ireland Teva Pharmaceuticals Ireland Tel: +44 2075407117 | Slovenia Pliva Ljubljana d.o.o. Tel: +386 15890390 |
Iceland Teva Pharma Iceland ehf. Sími: +354 5503300 | Slovakia TEVA Pharmaceuticals Slovakia s.r.o. Tel: +421 257267911 |
Italy Teva Italia S.r.l. Tel: +39 028917981 | Finland Teva Finland Oy Puh/Tel: +358 201805900 |
Cyprus TEVA HELLAS Α.Ε. Ελλáδα Τηλ: +30 2118805000 | Sweden Teva Sweden AB Tel: +46 42121100 |
Latvia UAB Teva Baltics filiale Latvija Tel: +371 67323666 | United Kingdom (Northern Ireland) Teva Pharmaceuticals Ireland Ireland Tel: +44 2075407117 |
Date of Last Revision of this Leaflet:
Detailed information on this medicine is available on the European Medicines Agency website: http://www.ema.europa.eu.
- Information for Self-Administration
This section contains information on how to administer a Tevagrastim injection to yourself. It is essential that you do not attempt to administer an injection without having received the necessary training from your doctor or nurse. If you are unsure about administering an injection or have any doubts, consult your doctor or nurse.
How to Self-Administer Tevagrastim
You must inject it into the tissue just under the skin. This is known as a subcutaneous injection. The injection should be administered every day at approximately the same time.
Equipment Needed for Administration
For subcutaneous injection administration, you will need:
- a pre-filled syringe of Tevagrastim,
- cotton or similar with alcohol.
What to Do Before Administering a Subcutaneous Injection of Tevagrastim
- Try to administer the injection at approximately the same time every day.
- Remove the pre-filled syringe of Tevagrastim from the refrigerator.
- Check the expiration date indicated on the pre-filled syringe (EXP). Do not use it if the date is later than the last day of the month shown.
- Check the appearance of Tevagrastim. It should be a clear and colorless liquid. If there are particles inside, do not use it.
- For a more comfortable injection, let the pre-filled syringe stand at room temperature for 30 minutes or gently hold the pre-filled syringe in your hands for a few minutes. Do not heat Tevagrastim in any other way (e.g., do not heat it in a microwave or in hot water)
- Do notremove the cap from the syringe until you are ready for injection
- Wash your hands carefully.
- Find a comfortable and well-lit place and place everything you need within reach (the pre-filled syringe of Tevagrastim and the cotton).
How to Prepare Your Tevagrastim Injection
Before injecting Tevagrastim, you must:
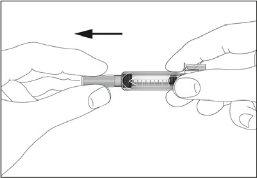
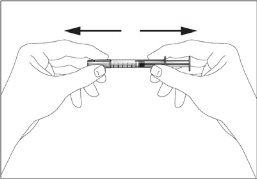
- Take the syringe and remove the protective cap from the needle gently without tilting it. Separate as indicated in images 1 and 2. Do not touch the needle or push the plunger.
|
|
- A small air bubble may appear in the pre-filled syringe. If there are bubbles, tap the syringe gently with your fingers until the bubbles go to the end of the syringe. With the syringe pointing upwards, remove the air from the syringe by pushing the plunger.
- The syringe has a scale. Push the plunger until the number (ml) on the syringe corresponds to the dose of Tevagrastim prescribed by your doctor.
- Check again that the dose of Tevagrastim is correct.
- Now you can use the pre-filled syringe.
Where to Inject
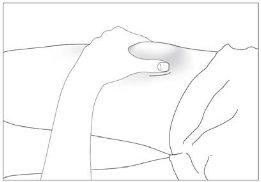
The most suitable injection sites are:
- the top of the thighs; and
- the abdomen, except the area around the navel (see image 3).
|
|
If someone else administers the injection, they can also use the back of your upper arms (see image 4)
To avoid the risk of pain at a given point, it is best to change the injection site every day.
How to Inject
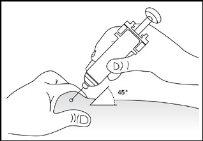
- Disinfect the injection site using cotton with alcohol and pinch the skin between your thumb and index finger, without squeezing (see image 5).
- Insert the needle completely into the skin as your nurse or doctor indicated (see image 6).
- Gently pull the plunger to ensure that you have not punctured a vein. If you see blood in the syringe, remove the needle and insert it into another site.
- While keeping the skin pinched, push the plunger slowly and evenly until the entire dose has been administered and the plunger can no longer move. Do not release the pressure on the plunger!
- Inject only the dose prescribed by your doctor.
- After injecting the liquid, remove the needle while maintaining pressure on the plunger and then release the skin.
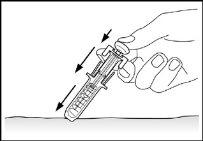
- Release the plunger. The needle safety protector will move quickly to cover the needle (see image 7).
 5
5
 6
6
 7
7
Remember
If you have any doubts, ask for help or advice from your doctor or nurse.
How to Dispose of Used Syringes
- The needle safety protector prevents needlestick injuries after use, so no special disposal precautions are necessary. Dispose of the syringe according to the doctor's, nurse's, or pharmacist's instructions.
- This information is intended only for healthcare professionals
Tevagrastim does not contain preservatives. In view of a possible risk of microbial contamination, Tevagrastim pre-filled syringes are for single use only.
Accidental exposure to freezing temperatures does not negatively affect the stability of Tevagrastim.
Tevagrastim should not be diluted with sodium chloride. This medicine should not be mixed with other medicines except those mentioned below. The dilution of filgrastim may be adsorbed by glass and plastic materials unless diluted as mentioned below.
Tevagrastim can be diluted, if necessary, in a 50 mg/ml (5%) glucose solution for infusion. It is not recommended to dilute to final concentrations below 0.2 MIU (2 μg) per ml. The solution should be inspected visually before use. Only clear solutions without particles should be used. In patients treated with filgrastim diluted to concentrations below 1.5 MIU (15 μg) per ml, human serum albumin (HSA) should be added to a final concentration of 2 mg/ml. Example: if the final injection volume is 20 ml and the total dose of filgrastim is below 30 MIU (300 μg), 0.2 ml of a 200 mg/ml (20%) human albumin solution should be administered. When Tevagrastim is diluted in a 50 mg/ml (5%) glucose solution for infusion, it is compatible with glass and various plastics such as PVC, polyolefin (copolymer of polypropylene and polyethylene), and polypropylene.
After dilution: the chemical and physical stability of the diluted infusion solution has been demonstrated for 24 hours stored between 2 and 8 °C. From a microbiological point of view, the product should be used immediately. If not used immediately, the storage time and conditions of the diluted solution are the responsibility of the user and should not normally exceed 24 hours between 2 and 8 °C, unless the dilution has been made under validated and controlled aseptic conditions.
Use of the Pre-Filled Syringe with Needle Safety Protector
The needle safety protector covers the needle after injection to prevent accidental needlestick injuries. This does not affect the way the syringe is used. Push the plunger slowly and evenly until the entire dose has been administered and the plunger can no longer move. Remove the syringe while maintaining pressure on the plunger. The needle safety protector will cover the needle once the plunger is released.
Disposal
Disposal of unused medicine and all materials that have come into contact with it will be carried out in accordance with local regulations.
Leaflet: Information for the User
Tevagrastim 30 MIU/0.5 ml Solution for Injection and Infusion
Tevagrastim 48 MIU/0.8 ml Solution for Injection and Infusion
filgrastim
Read this leaflet carefully before you start using this medicine because it contains important information for you.
- Keep this leaflet, as you may need to read it again.
- If you have any further questions, ask your doctor, pharmacist, or nurse.
- This medicine has been prescribed for you only. Do not pass it on to others. It may harm them, even if their signs of illness are the same as yours.
- If you get any side effects, talk to your doctor, pharmacist, or nurse. This includes any possible side effects not listed in this leaflet. See section 4.
Contents of the Leaflet
- What is Tevagrastim and what is it used for
- What you need to know before you use Tevagrastim
- How to use Tevagrastim
- Possible side effects
- Storage of Tevagrastim
- Container content and additional information
- Information for self-administration
- This information is intended only for healthcare professionals
- What is Tevagrastim and what is it used for
What is Tevagrastim
Tevagrastim is a white blood cell growth factor (granulocyte colony-stimulating factor) and belongs to a group of medicines called cytokines. Growth factors are proteins that are produced naturally in the body, but they can also be produced using genetic engineering for use as a medicine. Tevagrastim works by stimulating the bone marrow to produce more white blood cells.
What is Tevagrastim used for
A decrease in the number of white blood cells (neutropenia) can occur for several reasons and makes your body less effective at fighting infections. Tevagrastim stimulates the bone marrow to produce new white blood cells quickly.
Tevagrastim can be used:
- to increase the number of white blood cells after chemotherapy to help prevent infections;
- to increase the number of white blood cells after a bone marrow transplant to help prevent infections;
- before high-dose chemotherapy to stimulate the bone marrow to produce more stem cells, which can be collected and returned to your body after treatment. These cells can be collected from you or a donor. The stem cells will then return to the bone marrow and produce blood cells;
- to increase the number of white blood cells if you have severe chronic neutropenia to help prevent infections;
- to help reduce the risk of infections in patients with advanced HIV infection.
- What you need to know before you use Tevagrastim
Do not use Tevagrastim
- if you are allergic to filgrastim or any of the other ingredients of this medicine (listed in section 6).
Warnings and Precautions
Consult your doctor, pharmacist, or nurse before starting treatment with Tevagrastim.
Tell your doctor before starting treatment if you have:
- sickle cell anemia, as this medicine may cause sickle cell crisis;
- osteoporosis (bone disease).
Tell your doctor immediately during treatment with Tevagrastim if:
- you have sudden signs of an allergic reaction, such as a rash, itching, or hives on the skin, swelling of the face, lips, tongue, or other parts of the body, shortness of breath, wheezing, or difficulty breathing, as these may be signs of a severe allergic reaction (hypersensitivity);
- you have swelling in the face or ankles, blood in the urine, or urine that is brown in color, or if you notice that you urinate less often than usual (glomerulonephritis);
- you have pain in the upper left part of the abdomen (abdominal pain), pain under the left side of the rib cage or in the left shoulder tip (these may be symptoms of an enlarged spleen [splenomegaly] or possible spleen rupture);
- you notice unusual bleeding or bruising (these may be symptoms of a decrease in platelets in the blood [thrombocytopenia], with a reduced ability of the blood to clot);
- you have symptoms of inflammation of the aorta (the large blood vessel that carries blood from the heart to the rest of the body), this has rarely been reported in patients with cancer and in healthy donors. Symptoms may include fever, abdominal pain, general malaise, back pain, and increased inflammatory markers. Tell your doctor if you have these symptoms.
Loss of Response to Filgrastim
If you experience a loss of response or if you cannot maintain a response to treatment with filgrastim, your doctor will investigate the causes, including whether you have developed antibodies that may neutralize the activity of filgrastim.
Your doctor may want to closely monitor you, see section 4 of the leaflet. If you are a patient with severe chronic neutropenia, you may be at risk of developing antibodies that neutralize the activity of filgrastim.
Develop blood cancer (leukemia, myelodysplastic syndrome [MDS]). Talk to your doctor about the risks of developing blood cancer and the tests that should be performed. If you develop or are likely to develop blood cancer, you should not use Tevagrastim unless your doctor indicates it.
If you are a stem cell donor, you must be between 16 and 60 years old.
Be careful with other products that stimulate white blood cells
Tevagrastim belongs to a group of medications that stimulate the production of white blood cells. Your doctor should always record the exact product you are using.
Other medications and Tevagrastim
Tell your doctor or pharmacist if you are using, have recently used, or may need to use any other medication.
Pregnancy and breastfeeding
Tevagrastim has not been studied in pregnant or breastfeeding women.
Tevagrastim is not recommended during pregnancy.
It is essential that you inform your doctor if you:
- are pregnant or breastfeeding;
- think you may be pregnant; or
- plan to become pregnant.
If you become pregnant during treatment with Tevagrastim, inform your doctor. Unless your doctor tells you otherwise, you should stop breastfeeding if you use Tevagrastim.
Driving and using machines
The influence of Tevagrastim on your ability to drive and use machines is small. This medication may cause dizziness. It is advisable to wait and see how you feel after taking the medication before driving or operating machinery.
Tevagrastim contains sorbitol
This medication contains 50 mg of sorbitol per ml.
For intravenous administration
Sorbitol is a source of fructose. If you (or your child) have hereditary fructose intolerance (HFI), a rare genetic disease, you (or your child) should not receive this medication. Patients with HFI cannot break down fructose, which can cause severe adverse effects. Consult your doctor before receiving this medication if you (or your child) have HFI or if your child cannot consume sweet foods or drinks because they cause dizziness, vomiting, or unpleasant effects such as bloating, stomach cramps, or diarrhea.
Tevagrastim contains sodium
This medication contains less than 1 mmol of sodium (23 mg) per pre-filled syringe; that is, it is essentially "sodium-free).
- How to use Tevagrastim
Follow your doctor's or pharmacist's instructions for administering this medication exactly. If in doubt, consult your doctor or pharmacist again.
How is Tevagrastim administered and how much should I take?
Tevagrastim is usually administered once a day as an injection into the tissue just under the skin (known as a subcutaneous injection). It can also be administered once a day as a slow injection into a vein (known as intravenous infusion). The usual dose varies depending on your disease and weight. Your doctor will indicate the amount of Tevagrastim you should take.
Patients with bone marrow transplant after chemotherapy:
Normally, you will receive your first dose of Tevagrastim at least 24 hours after chemotherapy and at least 24 hours after receiving your bone marrow transplant.
You or the people caring for you may be taught to administer subcutaneous injections so that you can continue treatment at home. However, you should not attempt to do so unless your healthcare professional has properly trained you.
How long do I need to take Tevagrastim?
You will need to take Tevagrastim until your white blood cell count is normal. You will have regular blood tests to monitor the number of white blood cells in your body. Your doctor will indicate how long you need to take Tevagrastim.
Use in children
Tevagrastim is used to treat children who are receiving chemotherapy or who have a low white blood cell count (neutropenia) severe. The dose administered to children receiving chemotherapy is the same as for adults.
If you use more Tevagrastim than you should
Do not increase the dose that your doctor has prescribed. If you have used more Tevagrastim than you should, contact your doctor or pharmacist as soon as possible.
If you forget to use Tevagrastim
If you have forgotten an injection, or if you injected less dose, contact your doctor as soon as possible. Do not take a double dose to make up for forgotten doses.
If you have any other questions about using this medication, ask your doctor, pharmacist, or nurse.
- Possible side effects
Like all medications, this medication can cause side effects, although not everyone gets them.
Important side effects
It is essential that you contact your doctor immediately:
- if you experience an allergic reaction, including weakness, low blood pressure, difficulty breathing, swelling of the face (anaphylaxis), skin rash, itchy skin rash (urticaria), swelling of the face, lips, mouth, tongue, or throat (angioedema), and shortness of breath (dyspnea);
- if you experience cough, fever, and difficulty breathing (dyspnea), as it may be a sign of acute respiratory distress syndrome (ARDS);
- if you experience kidney damage (glomerulonephritis). Kidney damage has been observed in patients receiving filgrastim. Contact your doctor immediately if you notice swelling in the face or ankles, blood in the urine, or brown-colored urine, or if you urinate less frequently than usual;
- if you experience any or a combination of the following side effects:
- swelling that may be associated with urinating less frequently, difficulty breathing, swelling, and a feeling of fullness in the abdomen, and a general feeling of tiredness. These symptoms usually develop rapidly.
These may be symptoms of a disease called "capillary leak syndrome" and can cause blood to leak from a small blood vessel into other parts of your body and require urgent medical attention.
- if you experience a combination of the following symptoms:
- fever, chills, or feeling very cold, high heart rate, confusion or disorientation, difficulty breathing, extreme pain or discomfort, and sweaty or clammy skin.
These could be symptoms of a condition called "sepsis" (also called "blood poisoning"), a severe infection with a systemic inflammatory response that can be potentially fatal and requires urgent medical attention;
- if you experience pain in the upper left side of the abdomen (abdominal pain), pain in the lower left side of the chest, or pain in the tip of the shoulder, as it could be a problem with your spleen (splenomegaly or spleen rupture);
- if you are being treated for chronic severe neutropenia and have blood in the urine (hematuria). Your doctor will perform regular urine tests if you experience this side effect or if proteins are found in your urine (proteinuria).
A common side effect of using Tevagrastim is pain in the muscles or bones (musculoskeletal pain), which can be relieved by taking ordinary pain-relieving medications (analgesics). In patients undergoing stem cell or bone marrow transplantation, graft-versus-host disease (GVHD) may occur. This is a reaction of the donor cells against the patient receiving the transplant; signs and symptoms include rashes on the palms of the hands or soles of the feet, and ulcers and sores in the mouth, intestine, liver, skin, eyes, lungs, vagina, and joints.
In healthy stem cell donors, an increase in white blood cells (leukocytosis) and a decrease in platelets that can reduce the ability of the blood to clot (thrombocytopenia) may be observed. These effects will be monitored by your doctor.
You may experience the following side effects:
Very common(may affect more than 1 in 10 people):
- Decrease in platelets, which reduces the ability of the blood to clot (thrombocytopenia)
- Low red blood cell count (anemia)
- Headache
- Diarrhea
- Vomiting
- Nausea
- Unusual hair loss or weakening (alopecia)
- Fatigue
- Irritation and swelling of the lining of the digestive tract (mucosal inflammation)
- Fever (pyrexia)
Common(may affect up to 1 in 10 people):
- Inflammation of the lungs (bronchitis)
- Upper respiratory tract infection
- Urinary tract infection
- Decreased appetite
- Sleeping problems (insomnia)
- Dizziness
- Decreased sensitivity, especially in the skin (hypoesthesia)
- Numbness or tingling in the hands or feet (paresthesia)
- Low blood pressure (hypotension)
- High blood pressure (hypertension)
- Cough
- Coughing up blood (hemoptysis)
- Pain in the mouth and throat (oropharyngeal pain)
- Nosebleeds (epistaxis)
- Constipation
- Oral pain
- Enlargement of the liver (hepatomegaly)
- Rash
- Redness of the skin (erythema)
- Muscle cramp
- Pain when urinating (dysuria)
- Chest pain
- Pain
- General weakness (asthenia)
- Feeling unwell (general malaise)
- Swelling in hands and feet (peripheral edema)
- Increased levels of certain enzymes in the blood
- Changes in blood biochemical analysis
- Transfusion reaction
Uncommon(may affect up to 1 in 100 people):
- Increased white blood cells in the blood (leukocytosis)
- Allergic reaction (hypersensitivity)
- Rejection of bone marrow transplant (graft-versus-host disease)
- High levels of uric acid in the blood, which can cause gout (hyperuricemia) (elevated uric acid in blood)
- Liver damage caused by blockage of small blood vessels in the liver (veno-occlusive disease)
- Lungs not working as they should, causing shortness of breath (respiratory failure)
- Swelling or fluid in the lungs (pulmonary edema)
- Inflammation of the lungs (interstitial lung disease)
- Abnormal lung X-rays (pulmonary infiltration)
- Bleeding in the lungs (pulmonary hemorrhage)
- Lack of oxygen absorption in the lungs (hypoxia)
- Irregular skin rash (maculopapular rash)
- Disease that causes bones to lose density, making them weaker, more fragile, and prone to breaking (osteoporosis)
- Reaction at the injection site
Rare(may affect up to 1 in 1,000 people):
- Severe pain in the bones, chest, intestines, or joints (sickle cell anemia with crisis)
- Sudden and life-threatening allergic reactions (anaphylactic reaction)
- Swelling and pain in the joints, similar to gout (pseudogout)
- A change in the way your body regulates body fluids that can result in swelling (fluid volume disturbances)
- Inflammation of the blood vessels in the skin (cutaneous vasculitis)
- Painful, inflamed, and dark red ulcers on the extremities and sometimes on the face and neck, accompanied by fever (Sweet's syndrome)
- Worsening of rheumatoid arthritis
- Unusual changes in urine
- Decreased bone density
- Inflammation of the aorta (the large blood vessel that carries blood from the heart to the rest of the body), see section 2
Reporting side effects
If you experience any side effects, consult your doctor, pharmacist, or nurse, even if it is a possible side effect not listed in this leaflet. You can also report them directly through the national reporting system included in Appendix V. By reporting side effects, you can help provide more information on the safety of this medication.
- Storage of Tevagrastim
Keep this medication out of the sight and reach of children.
Do not use this medication after the expiration date that appears on the box and on the pre-filled syringe after EXP. The expiration date is the last day of the month indicated.
Store in a refrigerator (between 2°C and 8°C).
Within its validity period and for ambulatory use, the medication can be taken out of the refrigerator (2°C - 8°C) and stored at a temperature of up to 25°C for a single period of up to 4 days. If the medication has not been used within those 4 days, it should be refrigerated again (2°C - 8°C) until the expiration date. Pre-filled syringes stored at more than 8°C for more than 4 days should be discarded.
Do not use this medication if you notice turbidity or particles inside.
Medications should not be disposed of through wastewater. Ask your pharmacist how to dispose of the packaging and medications you no longer need. This will help protect the environment.
- Package contents and additional information
Composition of Tevagrastim
- The active ingredient is filgrastim. Each ml of solution for injection and infusion contains 60 million international units (MIU) (600 micrograms) of filgrastim.
Tevagrastim 30 MIU/0.5 ml: each pre-filled syringe contains 30 million international units [MIU] (300 micrograms) of filgrastim in 0.5 ml of solution.
Tevagrastim 48 MIU/0.8 ml: each pre-filled syringe contains 48 million international units [MIU] (480 micrograms) of filgrastim in 0.8 ml of solution.
- The other components are: sodium hydroxide, glacial acetic acid, sorbitol, polysorbate 80, water for injectable preparations.
Appearance of the product and package contents
Tevagrastim is a solution for injection and infusion in a pre-filled syringe. Tevagrastim is a clear and colorless solution. Each pre-filled syringe contains 0.5 ml or 0.8 ml of solution.
Tevagrastim is supplied in packs of 1, 5, or 10 pre-filled syringes or in multiple packs containing 10 pre-filled syringes (2 packs of 5) with injection needle and with or without needle safety protector. Not all formats may be marketed.
Marketing authorization holder
TEVA GmbH
Graf-Arco-Straße 3
89079 Ulm
Germany
Manufacturer
Teva Pharma B.V.
Swensweg 5
2031 GA Haarlem
Netherlands
Merckle GmbH
Graf-Arco-Straße 3
89079 Ulm
Germany
You can request more information about this medication by contacting the local representative of the marketing authorization holder:
België/Belgique/Belgien Teva Pharma Belgium N.V./S.A./AG Tél/Tel: +32 38207373 | Lietuva UAB Teva Baltics Tel: +370 52660203 |
| Luxembourg/Luxemburg Teva Pharma Belgium N.V./S.A./AG Belgique/Belgien Tél/Tel: +32 38207373 |
Ceská republika Teva Pharmaceuticals CR, s.r.o. Tel: +420 251007111 | Magyarország Teva Gyógyszergyár Zrt. Tel: +36 12886400 |
Danmark Teva Denmark A/S Tlf: +45 44985511 | Malta Teva Pharmaceuticals Ireland L-Irlanda Tel: +44 2075407117 |
Deutschland TEVA GmbH Tel: +49 73140208 | Nederland Teva Nederland B.V. Tel: +31 8000228400 |
Eesti UAB Teva Baltics Eesti filiaal Tel: +372 6610801 | Norge Teva Norway AS Tlf: +47 66775590 |
Ελλάδα TEVA HELLAS Α.Ε. Τηλ: +30 2118805000 | Österreich ratiopharm Arzneimittel Vertriebs-GmbH Tel: +43 1970070 |
España Teva Pharma, S.L.U. Tel: +34 913873280 | Polska Teva Pharmaceuticals Polska Sp. z o.o. Tel: +48 223459300 |
France Teva Santé Tél: +33 155917800 | Portugal Teva Pharma - Produtos Farmacêuticos, Lda. Tel: +351 214767550 |
Hrvatska Pliva Hrvatska d.o.o. Tel: +385 13720000 | România Teva Pharmaceuticals S.R.L. Tel: +40 212306524 |
Ireland Teva Pharmaceuticals Ireland Tel: +44 2075407117 | Slovenija Pliva Ljubljana d.o.o. Tel: +386 15890390 |
Ísland Teva Pharma Iceland ehf. Sími: +354 5503300 | Slovenská republika TEVA Pharmaceuticals Slovakia s.r.o. Tel: +421 257267911 |
Italia Teva Italia S.r.l. Tel: +39 028917981 | Suomi/Finland Teva Finland Oy Puh/Tel: +358 201805900 |
Κύπρος TEVA HELLAS Α.Ε. Ελλάδα Τηλ: +30 2118805000 | Sverige Teva Sweden AB Tel: +46 42121100 |
Latvija UAB Teva Baltics filiale Latvija Tel: +371 67323666 | United Kingdom (Northern Ireland) Teva Pharmaceuticals Ireland Ireland Tel: +44 2075407117 |
Date of last revision of this leaflet:
Detailed information on this medication is available on the European Medicines Agency website: http://www.ema.europa.eu.
- Information for self-injection
This section contains information on how to self-administer a Tevagrastim injection. It is essential that you do not attempt to self-administer an injection without having been trained by your healthcare professional.
Follow the necessary course as prescribed by your doctor or nurse. It is also important that you have a syringe in a puncture-proof container. If you are not sure if you can inject yourself or if you have any doubts, consult your doctor or nurse.
It is important to discard used syringes in a puncture-proof container.
How to self-inject Tevagrastim
You should inject into the tissue just under the skin. This is known as a subcutaneous injection. The injection should be administered every day at approximately the same time.
Equipment needed for administration
For the administration of the subcutaneous injection, the following is needed:
- a pre-filled Tevagrastim syringe,
- cotton or similar with alcohol,
- a container, puncture-proof (plastic container supplied by a hospital or pharmacy) to safely discard used syringes.
What should I do before administering a subcutaneous injection of Tevagrastim
- Try to administer the injection at approximately the same time every day.
- Remove the pre-filled Tevagrastim syringe from the refrigerator.
- Check the expiration date indicated on the pre-filled syringe (EXP). Do not use it if the date is later than the last day of the month that appears.
- Check the appearance of Tevagrastim. It should be a clear and colorless liquid. If there are particles inside, do not use it.
- For a more comfortable injection, let the pre-filled syringe rest for 30 minutes at room temperature or gently hold the pre-filled syringe in your hands for a few minutes. Do not heat Tevagrastim in any other way (e.g., do not heat it in a microwave or in hot water)
- Do notremove the syringe cap until you are ready for the injection
- Wash your hands carefully.
- Find a comfortable and well-lit place and place everything you need within reach (the pre-filled Tevagrastim syringe, cotton, and the container for waste).
How should I prepare my Tevagrastim injection
Before injecting Tevagrastim, you should:
- Take the syringe and gently remove the protective cover from the needle without tilting it. Push the plunger. Separate as indicated in figures 1 and 2. Do not touch the needle or push the plunger.
|
|
- A small air bubble may appear in the pre-filled syringe. If there are bubbles, tap the syringe gently with your fingers until the bubbles go to the end of the syringe. With the syringe pointing upwards, extract the air from the syringe by pushing the plunger.
- The syringe has a scale. Push the plunger until the number (ml) on the syringe corresponds to the dose of Tevagrastim prescribed by your doctor.
- Check again that the dose of Tevagrastim is correct.
- Now you can use the pre-filled syringe.
Where should I put the injection
The most suitable sites for injection are:
- the top of the thighs; and
- the abdomen, except the area around the navel (see image 3).
|
|
If someone else administers the injection, they can also use the back of your forearms (see image 4)
To avoid the risk of pain at a given point, it is best to change the injection site every day.
How should I inject myself
- Disinfect the injection site using cotton with alcohol and pinch the skin between your thumb and index finger, without squeezing (see image 5).
- Insert the needle completely into the skin as indicated by your nurse or doctor (see image 6).
- Gently pull the plunger to make sure you have not punctured a vein. If you see blood in the syringe, remove the needle and insert it into another site.
- Inject the liquid slowly and regularly, always keeping the skin pinched.
- Inject only the dose prescribed by your doctor.
- After injecting the liquid, remove the needle and release the skin.
- Use only one syringe for one injection. Do not use any remaining Tevagrastim from the syringe.
|
|
Remember
If you have any doubts, ask for help or advice from your doctor or nurse.
How to dispose of used syringes
- Do not put the protective cover back on used syringes.
- Put used syringes in a puncture-proof container and keep this container out of reach and sight of children.
- Deposit the full container according to the instructions of the doctor, nurse, or pharmacist.
- Never throw used syringes in the usual trash can.
- This information is intended only for healthcare professionals
Tevagrastim does not contain preservatives. In view of the possible risk of microbial contamination, Tevagrastim pre-filled syringes are for single use only.
Accidental exposure to freezing temperatures does not negatively affect the stability of Tevagrastim.
Tevagrastim should not be diluted with sodium chloride. This medication should not be mixed with other medications except as mentioned below. The dilution of filgrastim may be adsorbed by glass and plastic materials except if diluted as mentioned below.
Tevagrastim can be diluted, if necessary, in a glucose solution for infusion 50 mg/ml (at 5%). It is not recommended to dilute to final concentrations below 0.2 MIU (2 μg) per ml. The solution should be visually inspected before use. Only clear solutions without particles should be used. In patients treated with filgrastim diluted to concentrations below 1.5 MIU (15 μg) per ml, human serum albumin (HSA) should be added to a final concentration of 2 mg/ml. Example: if the final injection volume is 20 ml and the total dose of filgrastim is less than 30 MIU (300 μg), 0.2 ml of a 200 mg/ml (20%) human albumin solution should be administered. When Tevagrastim is diluted in a glucose solution for infusion 50 mg/ml (at 5%), it is compatible with glass and various plastics such as PVC, polyolefin (copolymer of polypropylene and polyethylene), and polypropylene.
After dilution: the chemical and physical stability of the diluted infusion solution has been demonstrated for 24 hours stored between 2 and 8 ºC. From a microbiological point of view, the product should be used immediately. If not used immediately, the time and storage conditions of the diluted solution are the responsibility of the user and should not normally exceed 24 hours between 2 and 8 ºC, unless the dilution has been performed under validated and controlled aseptic conditions.
Use of the pre-filled syringe without a safety needle protector
Administer the dose according to the standard protocol.
Elimination
The elimination of unused medication and all materials that have come into contact with it will be carried out in accordance with local regulations.
- Country of registration
- Active substance
- Prescription requiredYes
- Manufacturer
- This information is for reference only and does not constitute medical advice. Always consult a doctor before taking any medication. Oladoctor is not responsible for medical decisions based on this content.
- Alternatives to TEVAGRASTIM 30 MU/0.5 ml SOLUTION FOR INJECTION OR INFUSIONDosage form: INJECTABLE, 12 IU/0.2 mlActive substance: filgrastimManufacturer: Accord Healthcare S.L.U.Prescription requiredDosage form: INJECTABLE, 0.3 mg / prefilled syringeActive substance: filgrastimManufacturer: Accord Healthcare S.L.U.Prescription requiredDosage form: INJECTABLE, 0.3 mg / prefilled syringeActive substance: filgrastimManufacturer: Accord Healthcare S.L.U.Prescription required
Online doctors for TEVAGRASTIM 30 MU/0.5 ml SOLUTION FOR INJECTION OR INFUSION
Discuss questions about TEVAGRASTIM 30 MU/0.5 ml SOLUTION FOR INJECTION OR INFUSION, including use, safety considerations and prescription review, subject to medical assessment and local regulations.
Frequently Asked Questions






 1
1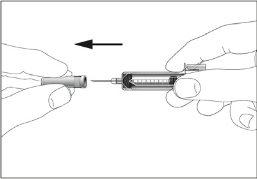 2
2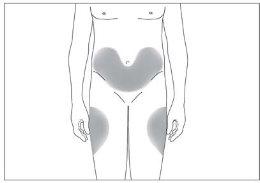 3
3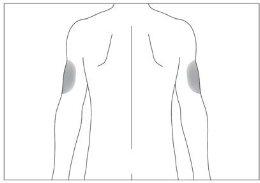 4
4
 1
1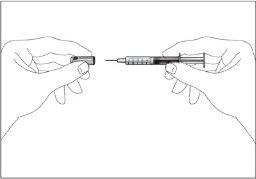 2
2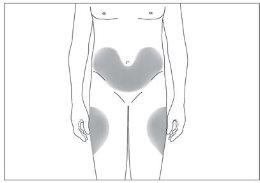 3
3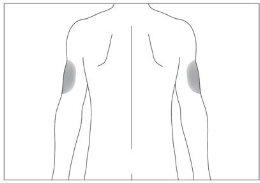 4
4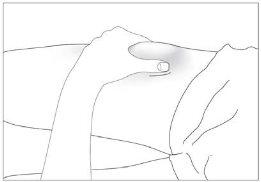 5
5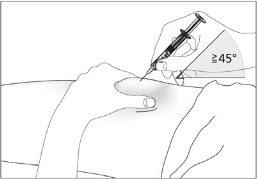 6
6
