RANIVISIO 10 mg/ml INJECTABLE SOLUTION

How to use RANIVISIO 10 mg/ml INJECTABLE SOLUTION
Translated with AI
This page provides general information and does not replace a doctor’s consultation. Always consult a doctor before taking any medication. Seek urgent medical care if symptoms are severe.
Show originalContents of the leaflet
Introduction
Package Leaflet: Information for the Adult Patient
Ranivisio 10 mg/ml Solution for Injection
ranibizumab
This medicinal product is subject to additional monitoring, which will allow for the quick identification of new safety information. You can help by reporting any side effects you may get. The last section of the leaflet includes information on how to report side effects.
ADULTS
Read all of this leaflet carefully before you are given this medicine because it contains important information for you.
- Keep this leaflet, you may need to read it again.
- If you have any further questions, ask your doctor.
- If you get any side effects, talk to your doctor, even if they are not listed in this leaflet. See section 4.
Contents of the Pack
- What is Ranivisio and what is it used for
- What you need to know before you are given Ranivisio
- How Ranivisio is given
- Possible side effects
- Storing Ranivisio
- Package Contents and Further Information
1. What is Ranivisio and what is it used for
What is Ranivisio
Ranivisio is a solution that is injected into the eye. Ranivisio belongs to a group of medicines called anti-angiogenic agents. It contains the active substance called ranibizumab.
What Ranivisio is used for
Ranivisio is used in adults to treat several eye diseases that cause vision problems.
These diseases are the result of an injury to the retina (the light-sensitive layer at the back of the eye) caused by:
- The growth of abnormal blood vessels that leak fluid. This is seen in diseases such as age-related macular degeneration (AMD) and proliferative diabetic retinopathy (PDR, a disease caused by diabetes). It may also be associated with choroidal neovascularization (CNV) due to pathological myopia (PM), angioid streaks, central serous chorioretinopathy, or inflammatory CNV.
- Macular edema (swelling of the center of the retina). The cause of this swelling may be diabetes (a disease known as diabetic macular edema, DME) or a blockage of the retinal veins in the retina (a disease known as retinal vein occlusion, RVO).
How Ranivisio works
Ranivisio recognizes and binds specifically to a protein called vascular endothelial growth factor A (VEGF-A) present in the eyes. In excess, VEGF-A causes the growth of abnormal blood vessels and swelling in the eye that can lead to vision problems in diseases such as AMD, DME, PDR, RVO, PM, and CNV.
By binding to VEGF-A, Ranivisio can prevent it from working and prevent such abnormal growth and swelling.
In these diseases, Ranivisio can help stabilize and, in many cases, improve your vision.
2. What you need to know before you are given Ranivisio
Ranivisio must not be given to you
- If you are allergic to ranibizumab or any of the other ingredients of this medicine (listed in section 6).
- If you have an eye infection or inflammation.
- If you have severe eye pain or redness.
Warnings and precautions
Tell your doctor before you are given Ranivisio.
- Ranivisio is given by injection into the eye. Occasionally, after treatment with Ranivisio, an infection in the inner eye, pain, or redness (inflammation), retinal detachment, or cataract may occur. It is essential to identify and treat such an infection or retinal detachment as soon as possible. Tell your doctor immediately if you notice signs such as eye pain or increased discomfort in the eye, worsening redness in the eye, blurred vision, or decreased vision, an increase in the number of small spots in your vision, or increased sensitivity to light.
- In some patients, after the injection, the pressure in the eye may increase for a short period. You may not be aware of this, so your doctor may monitor your eye pressure after each injection.
- Tell your doctor if you have had eye diseases or have received any previous eye treatment, or if you have had a stroke or have had symptoms of a stroke (weakness or paralysis of a limb or face, difficulty speaking or understanding). This information will be taken into account to assess whether Ranivisio is the right treatment for you.
For more detailed information on the side effects that may occur during treatment with Ranivisio, see section 4 ("Possible side effects").
Children and adolescents (under 18 years)
Ranivisio is not recommended for use in children and adolescents, as it has not been established in these age groups.
Other medicines and Ranivisio
Tell your doctor if you are using, have recently used, or might use any other medicines.
Pregnancy and breastfeeding
- Women who could become pregnant should use effective contraception during treatment and for at least 3 months after the last injection of Ranivisio.
- There is no experience with the use of Ranivisio in pregnant women. Ranivisio should not be used during pregnancy unless the potential benefit outweighs the potential risk to the fetus. If you are pregnant, think you may be pregnant, or plan to become pregnant, consult your doctor before treatment with Ranivisio.
- Small amounts of Ranivisio may pass into breast milk, so the use of Ranivisio is not recommended during breastfeeding. Consult your doctor or pharmacist before treatment with Ranivisio.
Driving and using machines
After treatment with Ranivisio, you may experience temporary blurred vision. If this happens, do not drive or use machines until this symptom disappears.
3. How Ranivisio is given
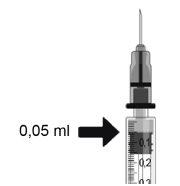
Ranivisio is given by an ophthalmologist as a single injection into the eye under local anesthesia. The usual dose of an injection is 0.05 ml (which contains 0.5 mg of the active substance). The interval between two doses given in the same eye should be at least 4 weeks. All injections will be given by an ophthalmologist.
To prevent infection, before the injection, your doctor will carefully clean your eye. Your doctor will also give you a local anesthetic to reduce or prevent any pain you may feel with the injection.
Treatment starts with an injection of Ranivisio every month. Your doctor will monitor the disease in your eye and, depending on how you respond to treatment, decide whether you need further treatment and when you need to be treated.
At the end of the leaflet, in the section "How to prepare and administer Ranivisio," detailed instructions for use are provided.
Elderly patients (65 years and older)
Ranivisio can be used in people 65 years of age or older, and no dose adjustment is necessary.
Before stopping treatment with Ranivisio
If you are considering stopping treatment with Ranivisio, attend your next appointment and discuss it with your doctor beforehand. Your doctor will advise and decide how long you should be treated with Ranivisio.
If you have any further questions on the use of this medicine, ask your doctor.
4. Possible side effects
Like all medicines, this medicine can cause side effects, although not everybody gets them.
The side effects associated with the use of Ranivisio are either due to the medicine itself or the injection procedure, and most affect the eye.
The following are the most serious side effects:
Common serious side effects(may affect up to 1 in 10 patients)
Detachment or tear of a layer in the inner eye (retinal detachment), resulting in flashes of light with floating particles that progress to temporary vision loss or cataract.
Uncommon serious side effects(may affect up to 1 in 100 patients)
Blindness, infection of the eyeball (endophthalmitis) with inflammation of the inner eye.
The symptoms you may experience are eye pain or increased discomfort in the eye, worsening redness in the eye, blurred vision, or decreased vision, an increase in the number of small spots in your vision, or increased sensitivity to light. Tell your doctor immediately if you experience any of these side effects.
The following are the most commonly reported side effects:
Very common side effects(may affect more than 1 in 10 patients)
Ocular side effects include: Eye inflammation, bleeding in the back of the eye (retinal hemorrhage), visual disturbances, eye pain, small particles or spots in the vision (floaters), blood in the eye, eye irritation, feeling of having something in the eye, increased tear production, inflammation or infection of the eyelid margin, dry eye, redness or itching of the eye, and increased eye pressure.
Non-ocular side effects include: Sore throat, nasal congestion, runny nose, headache, and joint pain.
The following are other side effects that may occur after treatment with Ranivisio:
Common side effects
Ocular side effects include: Decreased sharpness of vision, swelling of a section of the eye (uvea, cornea), inflammation of the cornea (front part of the eye), small marks on the surface of the eye, blurred vision, bleeding at the injection site, bleeding in the eye, eye discharge with itching, redness, and swelling (conjunctivitis), sensitivity to light, eye discomfort, eyelid swelling, eyelid pain.
Non-ocular side effects include: Urinary tract infection, low red blood cell count (with symptoms such as fatigue, difficulty breathing, dizziness, paleness), anxiety, cough, nausea, allergic reactions such as rash, hives, itching, and redness of the skin.
Uncommon side effects
Ocular side effects include: Inflammation and bleeding in the front part of the eye, accumulation of pus in the eye, changes in the central part of the eye surface, pain or irritation at the injection site, abnormal sensation in the eye, eyelid irritation.
Reporting of side effects
If you experience any side effects, talk to your doctor, even if they are not listed in this leaflet. You can also report side effects directly through the national reporting system listed in Appendix V. By reporting side effects, you can help provide more information on the safety of this medicine.
5. Storing Ranivisio
- Keep this medicine out of the sight and reach of children.
- Do not use this medicine after the expiry date which is stated on the carton after CAD and on the label after EXP. The expiry date is the last day of the month shown.
- Store in a refrigerator (between 2°C and 8°C). Do not freeze.
- Before use, the unopened vial can be stored at room temperature (25°C) for a maximum of 24 hours.
- Keep the vial in the outer packaging to protect it from light.
- Do not use any packaging that is damaged.
6. Container Contents and Additional Information
Ranivisio Composition
- The active ingredient is ranibizumab. Each ml contains 10 mg of ranibizumab. Each vial contains 2.3 mg of ranibizumab in 0.23 ml of solution. This provides an adequate amount to deliver a single dose of 0.05 ml, which contains 0.5 mg of ranibizumab.
- The other components are α,α-trehalose dihydrate; histidine hydrochloride monohydrate; histidine; polysorbate 20; water for injectable preparations.
Product Appearance and Container Contents
Ranivisio is an injectable solution contained in a vial (0.23 ml). The solution is clear, colorless to pale yellow, and aqueous.
One type of container is available:
A container containing a glass vial with ranibizumab, with a chlorobutyl rubber stopper. The vial is for single use.
Marketing Authorization Holder and Manufacturer
Midas Pharma GmbH
Rheinstraße 49
D-55218 Ingelheim
Germany
For further information on this medicinal product, please contact the local representative of the marketing authorization holder:
Belgium/Belgique/Belgien Teva Pharma Belgium N.V./S.A./A.G. Tel/Tél: +32 3 820 73 73 | Lithuania UAB Teva Baltics Tel: +370 5 266 02 03 |
Bulgaria Teva Pharmaceuticals Bulgaria EOOD Tel: +359 2 489 95 85 | Luxembourg/Luxemburg Teva Pharma Belgium N.V./S.A./A.G. Tél: +32 3 820 73 73 |
Czech Republic Teva Pharmaceuticals CR, s.r.o. Tel: +420 251 007 111 | Hungary Teva Gyógyszergyár Zrt. Tel.: +36 1 288 6400 |
Denmark Teva Denmark A/S Tlf: +45 44 98 55 11 | Malta Teva Pharmaceuticals Ireland, Ireland Tel: +353 (0)1912 7700 |
Germany ratiopharm GmbH Tel: +49 731 402 02 | Netherlands Teva Nederland B.V. Tel: +31 (0) 800 0228400 |
Estonia UAB Teva Baltics Eesti filiaal Tel: +372 661 0801 | Norway Teva Norway AS Tlf: +47 66 77 55 90 |
Greece Specifar ΑΒΕΕ Τηλ: +30 211 880 5000 | Austria ratiopharm Arzneimittel Vertriebs-GmbH Tel: +43 1 970070 |
Spain Teva Pharma, S.L.U. Tel: +34 91 387 32 80 | Poland Teva Pharmaceuticals Polska Sp. z o.o. Tel.: +48 22 345 93 00 |
France Teva Santé Tél: +33 1 55 91 78 00 | Portugal Teva Pharma - Produtos Farmacêuticos Lda Tel: +351 214 767 550 |
Croatia Pliva Hrvatska d.o.o Tel: + 385 1 37 20 000 | Romania Teva Pharmaceuticals S.R.L Tel: +40 21 230 65 24 |
Ireland Teva Pharmaceuticals Ireland Tel: +353 (0)1912 7700 | Slovenia Pliva Ljubljana d.o.o. Tel: +386 1 58 90 390 |
Iceland Teva Pharma Iceland ehf. Sími: + 354 550 3300 | Slovak Republic Teva Pharmaceuticals Slovakia s.r.o. Tel: +421 2 5726 7911 |
Italy Teva Italia S.r.l. Tel: +39 0289 17981 | Finland ratiopharm Oy Puh/Tel: +358 20 180 5900 |
Cyprus Specifar ΑΒΕΕ, Greece Τηλ: +30 211 880 5000 | Sweden Teva Sweden AB Tel: +46 42 12 11 00 |
Latvia UAB Teva Baltics filiale Latvija Tel: +371 67 323 666 | United Kingdom (Northern Ireland) Teva Pharmaceuticals Ireland Tel: +44 (0) 207 540 7117 |
Date of Last Revision of this Leaflet:
Other Sources of Information
Detailed information on this medicinal product is available on the European Medicines Agency website: http://www.ema.europa.eu
---------------------------------------------------------------------------------------------------------------------------
THIS INFORMATION IS INTENDED ONLY FOR HEALTHCARE PROFESSIONALS:
See also section 3 “How to administer Ranivisio”.
How to Prepare and Administer Ranivisio in Adults
Single-use vial. For intravitreal use only.
Ranivisio should be administered by an ophthalmologist experienced in administering intravitreal injections.
In exudative age-related macular degeneration (AMD), choroidal neovascularization (CNV), retinal pigment epithelial detachment (RPED), and visual impairment due to macular edema (ME) secondary to retinal vein occlusion (RVO), the recommended dose of Ranivisio is 0.5 mg administered as a single intravitreal injection. This corresponds to an injection volume of 0.05 ml. The interval between two doses injected into the same eye should be at least four weeks.
Treatment is initiated with one injection per month until maximum visual acuity is achieved and/or there are no signs of disease activity, i.e., no change in visual acuity or other signs and symptoms of the disease under continued treatment. In patients with exudative AMD, ME, RPED, and RVO, three or more consecutive monthly injections may initially be necessary.
From that point on, monitoring and treatment intervals should be determined based on medical judgment and the activity of the disease, as assessed by visual acuity and/or anatomical parameters.
Treatment with Ranivisio should be discontinued if, in the physician's judgment, visual and anatomical parameters indicate that the patient is not benefiting from continued treatment.
Monitoring to determine disease activity may include clinical examination, functional testing, or imaging techniques (e.g., optical coherence tomography or fluorescein angiography).
If patients are being treated according to a treat-and-extend regimen, once maximum visual acuity is achieved and/or there are no signs of disease activity, treatment intervals may be gradually extended until signs of disease activity or visual impairment recur. In the case of exudative AMD, the treatment interval should not be extended by more than two weeks at a time, and in the case of ME, it may be extended up to one month at a time. For RPED and RVO, treatment intervals may also be gradually extended; however, the available data are insufficient to determine the duration of these intervals. If disease activity recurs, the treatment interval should be shortened accordingly.
Treatment of visual impairment due to CNV should be determined on an individual basis for each patient based on disease activity. Some patients may require only one injection during the first 12 months; others may require more frequent treatment, including monthly injections. In the case of CNV secondary to pathologic myopia (PM), many patients may require only one or two injections during the first year.
Ranivisio and Laser Photocoagulation in ME and Macular Edema Secondary to Branch Retinal Vein Occlusion (BRVO)
There is some experience with ranibizumab administered concomitantly with laser photocoagulation. When administered on the same day, Ranivisio should be administered at least 30 minutes after laser photocoagulation. Ranivisio may be administered in patients who have previously received laser photocoagulation.
Ranivisio and Photodynamic Therapy with Verteporfin in CNV Secondary to Pathologic Myopia
There is no experience with the concomitant administration of ranibizumab and verteporfin.
Before administering Ranivisio, the absence of particles and discoloration should be checked visually.
The injection procedure should be carried out under aseptic conditions, including surgical hand washing, use of sterile gloves, a sterile field, a sterile blepharostat (or equivalent), and the availability of a sterile paracentesis (if necessary). Before performing the intravitreal injection procedure, the patient's medical history should be thoroughly evaluated for hypersensitivity reactions. Before injection, adequate anesthesia and a broad-spectrum topical microbicide should be administered to disinfect the periocular skin, eyelid, and ocular surface, according to local practice.
The vial is for single use. After injection, any unused product should be discarded. No vial showing signs of damage or tampering should be used. Sterility can only be guaranteed if the container closure is maintained intact.
The following medical devices (for single use) are required for preparation and intravitreal injection:
- a 5 µm filter needle (18G)
- a sterile 1 ml syringe (with a 0.05 ml mark)
- an injection needle (30G x ½″).
These medical devices are not included in the Ranivisio packaging. They can be obtained separately or in independent intravitreal injection kits (e.g., the Vortex Surgical I2 injection kit).
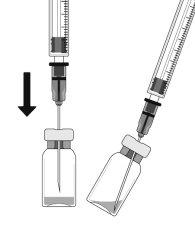
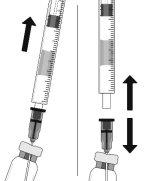
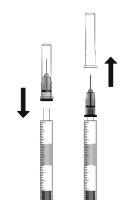
To prepare Ranivisio for intravitreal administration in adult patients, follow these instructions:
|
|
|
|
|
Note: Hold the injection needle by the cone while removing the cap. |
|
Note: Do not dry the injection needle. Do not pull the plunger back. |
The injection needle should be inserted 3.5-4.0 mm behind the limbus into the vitreous cavity, avoiding the horizontal meridian and in the direction of the center of the globe. The injection volume of 0.05 ml should then be delivered; subsequent injections should be applied to a different scleral location each time.
After injection, do not cover the needle with the needle cap or separate it from the syringe. Discard the used syringe along with the needle in a puncture-resistant container or dispose of according to local regulations.
- Country of registration
- Active substance
- Prescription requiredYes
- Manufacturer
- This information is for reference only and does not constitute medical advice. Always consult a doctor before taking any medication. Oladoctor is not responsible for medical decisions based on this content.
- Alternatives to RANIVISIO 10 mg/ml INJECTABLE SOLUTIONDosage form: INJECTABLE, 10 mg/mLActive substance: ranibizumabManufacturer: Samsung Bioepis Nl B.V.Prescription requiredDosage form: INJECTABLE, 10 mg/mLActive substance: ranibizumabManufacturer: Novartis Europharm LimitedPrescription requiredDosage form: INJECTABLE, 10 mg/mLActive substance: ranibizumabManufacturer: Novartis Europharm LimitedPrescription required
Online doctors for RANIVISIO 10 mg/ml INJECTABLE SOLUTION
Discuss questions about RANIVISIO 10 mg/ml INJECTABLE SOLUTION, including use, safety considerations and prescription review, subject to medical assessment and local regulations.
Frequently Asked Questions