
ONNIMIA 250 mg Injectable Solution in Pre-filled Syringe

How to use ONNIMIA 250 mg Injectable Solution in Pre-filled Syringe
Translated with AI
This page provides general information and does not replace a doctor’s consultation. Always consult a doctor before taking any medication. Seek urgent medical care if symptoms are severe.
Show originalContents of the leaflet
Introduction
Package Leaflet: Information for the Patient
Onnimia 250 mg Solution for Injection in Pre-filled Syringe EFG
fulvestrant
Read all of this leaflet carefully before you start using this medicine because it contains important information for you.
- Keep this leaflet, you may need to read it again.
- If you have any further questions, ask your doctor, pharmacist, or nurse.
- This medicine has been prescribed for you only. Do not pass it on to others. It may harm them, even if their signs of illness are the same as yours.
- If you get any side effects, talk to your doctor, pharmacist, or nurse. This includes any possible side effects not listed in this leaflet. See section 4.
Contents of the Package Leaflet
- What is Onnimia and what is it used for
- What you need to know before you use Onnimia
- How to use Onnimia
- Possible side effects
- Storage of Onnimia
- Contents of the pack and other information
1. What is Onnimia and what is it used for
Onnimia contains the active substance fulvestrant, which belongs to the group of estrogen blockers. Estrogens, a type of female sex hormone, may be involved in the development of breast cancer in some cases.
Fulvestrant is used:
? as monotherapy, to treat postmenopausal women with a type of breast cancer called hormone receptor-positive breast cancer, which is locally advanced or has spread to other parts of the body (metastatic), or
? in combination with palbociclib to treat women with a type of breast cancer called hormone receptor-positive, human epidermal growth factor receptor 2 (HER2)-negative breast cancer, which is locally advanced or has spread to other parts of the body (metastatic). Women who have not reached menopause will also be treated with a medicine called a luteinizing hormone-releasing hormone (LHRH) agonist.
Fulvestrant may be administered in combination with palbociclib. It is important that you also read the package leaflet for palbociclib. If you have any questions about palbociclib, ask your doctor.
2. What you need to know before you use Onnimia
Do not use Onnimia:
- if you are allergic to fulvestrant or any of the other ingredients of this medicine (listed in section 6)
- if you are pregnant or breast-feeding
- if you have severe liver problems
Warnings and precautions
Tell your doctor, pharmacist, or nurse before starting Onnimia if any of the following apply to you:
- kidney or liver problems
- low platelet count (which helps blood to clot) or bleeding disorders
- previous blood clot problems
- osteoporosis (loss of bone density)
- alcoholism
Children and adolescents
Onnimia is not indicated for children and adolescents under 18 years of age.
Using Onnimia with other medicines
Tell your doctor or pharmacist if you are taking, have recently taken, or might take any other medicines.
In particular, you should tell your doctor if you are using anticoagulants (medicines to prevent blood clots).
Pregnancy and breast-feeding
You should not use fulvestrant if you are pregnant. If you can become pregnant, you must use an effective contraceptive method while being treated with Onnimia and for 2 years after the last dose.
You should not breast-feed while being treated with fulvestrant.
Driving and using machines
Fulvestrant is not expected to affect your ability to drive or use machines. However, if you feel tired after treatment, do not drive or use machines.
Use in athletes
This medicine contains fulvestrant, which may produce a positive result in doping tests.
Onnimia contains ethanol (alcohol), benzyl alcohol, benzyl benzoate, and refined castor oil.
This medicine contains 10% v/v ethanol (alcohol), which is equivalent to 500 mg per dose, equivalent to 10 ml of beer or 4 ml of wine. This medicine is harmful to individuals with alcoholism.
The alcohol content should be taken into account in the case of pregnant or breast-feeding women, children, and high-risk groups, such as patients with liver disease or epilepsy.
This medicine contains 500 mg of benzyl alcohol per injection, which is equivalent to 100 mg/ml.
Benzyl alcohol may cause allergic reactions.
Ask your doctor or pharmacist if you are pregnant or breast-feeding or if you have liver or kidney disease. This is because large amounts of benzyl alcohol can accumulate in your body and cause side effects (so-called "metabolic acidosis").
This medicine contains 750 mg of benzyl benzoate per injection, which is equivalent to 150 mg/ml.
This medicine may cause severe allergic reactions because it contains refined castor oil.
3. How to use Onnimia
Follow exactly the instructions for administration of this medicine given by your doctor or pharmacist. If you are unsure, consult your doctor or pharmacist again.
The recommended dose is 500 mg of fulvestrant (two 250 mg/5 ml injections) administered once a month with an additional dose of 500 mg administered 2 weeks after the initial dose.
Your doctor or nurse will administer fulvestrant by slow intramuscular injection into each of your buttocks.
In case of overdose or accidental ingestion, consult your doctor or pharmacist immediately or call the Toxicological Information Service, telephone: 91 562 04 20, indicating the medicine and the amount ingested.
If you have any other questions about the use of this medicine, ask your doctor, pharmacist, or nurse.
4. Possible side effects
Like all medicines, this medicine can cause side effects, although not everybody gets them.
You may need urgent medical treatment if you experience any of the following side effects:
? Allergic reactions (hypersensitivity), including swelling of the face, lips, tongue, and/or throat, which may be symptoms of anaphylactic reactions
? Thromboembolism (increased risk of blood clots)*
? Hepatitis (inflammation of the liver)
? Liver failure
Tell your doctor, pharmacist, or nurse immediately if you notice any of the following side effects:
Very common side effects(may affect more than 1 in 10 people)
? Injection site reactions, such as pain and/or inflammation
? Abnormal levels of liver enzymes (in blood tests)*
? Nausea (feeling sick)
? Weakness, fatigue*
? Joint and musculoskeletal pain
? Hot flushes
? Skin rash
? Allergic reactions (hypersensitivity), including swelling of the face, lips, tongue, and/or throat.
All other side effects:
Common side effects(may affect up to 1 in 10 people)
? Headache
? Vomiting, diarrhea, or loss of appetite*
? Urinary tract infections
? Back pain*
? Increased bilirubin (a bile pigment produced by the liver)
? Thromboembolism (increased risk of blood clots)*
? Decreased platelet count (thrombocytopenia)
? Vaginal bleeding
? Lumbar pain radiating to one leg (sciatica)
? Sudden weakness, numbness, tingling, or loss of movement in your leg, especially on one side of the body, sudden problems with walking or balance (peripheral neuropathy).
Uncommon side effects(may affect up to 1 in 100 people)
? Thick, white vaginal discharge and candidiasis (infection)
? Hematoma and bleeding at the injection site
? Increased gamma-GT, a liver enzyme identified in a blood test
? Hepatitis (inflammation of the liver)
? Liver failure
? Numbness, tingling, and pain
? Anaphylactic reactions.
- Includes side effects for which the exact role of fulvestrant cannot be evaluated due to the underlying disease.
Reporting of side effects
If you experience any side effects, talk to your doctor, pharmacist, or nurse, even if they are not listed in this leaflet. You can also report side effects directly to the Spanish Medicines and Healthcare Products Agency (AEMPS) through the website: https://www.notificaram.es/. By reporting side effects, you can help provide more information on the safety of this medicine.
5. Storage of Onnimia
Keep this medicine out of the sight and reach of children.
Do not use this medicine after the expiry date which is stated on the carton or on the label of the syringe after the abbreviation EXP. The expiry date refers to the last day of the month stated.
Store and transport refrigerated (between 2°C and 8°C).
Temperature deviations outside the range of 2°C to 8°C should be controlled. This includes avoiding storage at temperatures above 30°C, and not exceeding a period of 28 days, during which the average storage temperature of the medicine is below 25°C (but above 2°C to 8°C). After temperature deviations, the medicine should be returned immediately to the recommended storage conditions (store and transport refrigerated between 2°C and 8°C). Temperature deviations have a cumulative effect on the quality of the medicine, and the 28-day period should not be exceeded beyond the 2-year shelf life of Onnimia. Exposure to temperatures below 2°C will not damage the medicine, provided it is not stored below -20°C.
Store the pre-filled syringe in the original packaging to protect it from light.
Your healthcare professional will be responsible for the proper storage, use, and disposal of Onnimia.
This medicine may pose a risk to the aquatic environment. Medicines should not be disposed of via wastewater or household waste. Dispose of the packaging and any unused medicine in the pharmacy's SIGRE collection point. If you have any doubts, ask your pharmacist how to dispose of the packaging and any unused medicine. This will help protect the environment.
6. Contents of Onnimia
Composition of Onnimia
- The active substance is fulvestrant. Each pre-filled syringe (5 ml) contains 250 mg of fulvestrant. Each ml contains 50 mg of fulvestrant.
- The other ingredients (excipients) are ethanol (96%), benzyl alcohol, benzyl benzoate, and refined castor oil.
Appearance and packaging
Onnimia is a viscous, clear, colorless to yellow solution in a pre-filled syringe equipped with a tamper-evident closure, which contains 5 ml of injectable solution. Two syringes should be administered to receive the recommended monthly dose of 500 mg.
Onnimia is available in 2 formats, either a pack containing 1 glass pre-filled syringe or a pack containing 2 glass pre-filled syringes. Safety needles ("BD SafetyGlide") are also provided for connection to the syringe body.
Only some pack sizes may be marketed.
Marketing authorization holder and manufacturer
Marketing authorization holder
Adamed Laboratorios, S.L.U.
c/ de las Rosas de Aravaca, 31 - 2ª planta
28023 Aravaca - Madrid
Spain
Manufacturer
Laboratori FUNDACIO DAU
C/De la letra C, 12-14, Polígono Industrial de la Zona Franca
Barcelona 08040
Spain
This medicine is authorized in the Member States of the European Economic Area under the following names:
France | Fulvestrant Intas 250 mg, solution injectable en seringue préremplie |
Germany | Fulvestrant Intas 250 mg Injektionslösung in einer Fertigspritze. |
Spain | Onnimia 250 mg solución inyectable en jeringa precargada EFG |
Date of last revision of this leaflet:August 2020
Detailed and up-to-date information on this medicine is available on the website of the Spanish Agency for Medicines and Healthcare Products (AEMPS) http://www.aemps.gob.es/.
--------------------------------------------------------------------------------------------------------------------------------
This information is intended only for healthcare professionals:
Onnimia 500 mg (2 x 250 mg/5 ml solution for injection) should be administered using two pre-filled syringes, see section 3.
Administration instructions
Warning – Do not autoclave the safety needle (Protected Hypodermic Needle "BD SafetyGlide") before use. Hands should remain behind the needle at all times during use and disposal.
For each of the two syringes:
? Remove the glass body of the syringe from the tray and check that it is not damaged. ? Open the outer packaging of the safety needle ("SafetyGlide"). ? Before administration, visually inspect the parenteral solutions for particulate matter and discoloration. ? Hold the syringe in a vertical position, holding it by the striated part (C). With the other hand, hold the cap (A) and carefully tilt it back and forth until it comes off and can be removed, do not twist it (see Figure 1). | Figure 1
|
? Remove the cap (A) by pulling upwards. To maintain sterility, avoid touching the tip of the syringe (B) (see Figure 2) | Figure 2
|
? Attach the safety needle to the "Luer-Lok" and screw it on until it is firmly attached (see Figure 3). ? Check that the needle is attached to the Luer connector before releasing it from the vertical position. ? Pull the needle protector cap straight off to avoid damaging the needle tip. ? Take the loaded syringe to the administration site. ? Remove the needle protector cap. ? Eliminate excess gas from the syringe. | Figure 3
|
? Administer slowly by intramuscular injection into the buttock (gluteal area) (1-2 minutes/injection). For greater comfort, the position of the needle with the bevel up has the same orientation as the lever raised (see Figure 4). | Figure 4
|
? After injection, immediately touch the lever once to activate the protective mechanism (see Figure 5). NOTE: Activate away from your body and others. Listen for the click and visually confirm that the needle tip is fully protected. |
|
Disposal
The pre-filled syringes are for singleuse only.
This medicine may pose a risk to the aquatic environment. Disposal of unused medicine and all materials that have come into contact with it will be carried out in accordance with local regulations.
- Country of registration
- Average pharmacy price408.86 EUR
- Active substance
- Prescription requiredYes
- Manufacturer
- This information is for reference only and does not constitute medical advice. Always consult a doctor before taking any medication. Oladoctor is not responsible for medical decisions based on this content.
- Alternatives to ONNIMIA 250 mg Injectable Solution in Pre-filled SyringeDosage form: INJECTABLE, 250 mg/5 mlActive substance: fulvestrantManufacturer: Bexal Farmaceutica S.A.Prescription requiredDosage form: INJECTABLE, 250 mgActive substance: fulvestrantManufacturer: Ever Valinject GmbhPrescription requiredDosage form: INJECTABLE, 250 mgActive substance: fulvestrantManufacturer: Astrazeneca AbPrescription required
Online doctors for ONNIMIA 250 mg Injectable Solution in Pre-filled Syringe
Discuss questions about ONNIMIA 250 mg Injectable Solution in Pre-filled Syringe, including use, safety considerations and prescription review, subject to medical assessment and local regulations.
Frequently Asked Questions





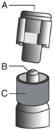
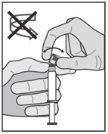
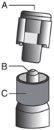
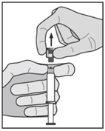
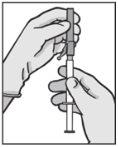
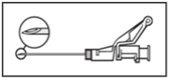
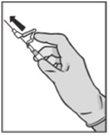 Figure 5
Figure 5







