FEIBA 50 U/mL POWDER AND SOLVENT FOR SOLUTION FOR INFUSION

How to use FEIBA 50 U/mL POWDER AND SOLVENT FOR SOLUTION FOR INFUSION
Translated with AI
This page provides general information and does not replace a doctor’s consultation. Always consult a doctor before taking any medication. Seek urgent medical care if symptoms are severe.
Show originalContents of the leaflet
Introduction
Package Leaflet: Information for the User
FEIBA 50 U/ml powder and solvent for solution for infusion
Anti-inhibitor Coagulant Complex
Read all of this leaflet carefully before you start using this medicine because it contains important information for you.
- Keep this leaflet, you may need to read it again.
- If you have any further questions, ask your doctor or pharmacist.
- This medicine has been prescribed for you only. Do not pass it on to others. It may harm them, even if their signs of illness are the same as yours.
- If you get any side effects, talk to your doctor or pharmacist. This includes any possible side effects not listed in this leaflet. See section 4.
Contents of the package leaflet
- What is FEIBA and what is it used for
- What you need to know before you use FEIBA
- How to use FEIBA
- Possible side effects
- Storage of FEIBA
- Contents of the pack and other information
1. What is FEIBA and what is it used for
FEIBA is a preparation made from human plasma, which allows for hemostasis, even when the amount of specific coagulation factors is reduced or absent.
FEIBA is used for the treatment and prophylaxis of bleeding in patients with hemophilia A and inhibitors.
FEIBA is used for the treatment of bleeding in patients with hemophilia B and inhibitors.
FEIBA is used for the treatment and prophylaxis of bleeding in non-hemophilic patients with acquired factor VIII inhibitors.
In addition, FEIBA is used for prophylaxis in surgical interventions in patients with hemophilia A and inhibitors.
FEIBA can be used in all age groups.
2. What you need to know before you use FEIBA
Tell your doctor if you have any known allergies.
Tell your doctor if you are on a low-sodium diet.
Do not use FEIBA
FEIBA should only be used in the following circumstances if, for example, due to a very high titre of inhibitors, no response to treatment with the appropriate coagulation factor concentrate is expected:
- if you are allergic (hypersensitive) to the anti-inhibitor coagulant complex or to any of the other components of this medicine (listed in section 6).
- if there is disseminated intravascular coagulation (DIC). (DIC = consumption coagulopathy, a potentially life-threatening condition in which there is excessive blood clotting, with pronounced formation of blood clots in the blood vessels. This consumes the coagulation factors throughout the body)
- in case of myocardial infarction, thrombosis and/or acute embolism: FEIBA should only be used in life-threatening bleeding episodes.
Warnings and precautions
Consult your doctor before starting to use FEIBA because hypersensitivity reactions can occur, as with all plasma-derived products administered intravenously. To recognize an allergic reaction as early as possible, you should know that the first potential symptoms of a hypersensitivity reaction may be:
- erythema (redness of the skin)
- rash
- appearance of hives on the skin (urticaria)
- itching all over the body
- swelling of the lips and tongue
- difficulty breathing/dyspnea
- chest tightness
- general malaise
- dizziness
- drop in blood pressure
Other symptoms of hypersensitivity reactions to plasma-derived products include lethargy and fatigue.
If you notice any of these symptoms, you should stop the administration immediately and contact your doctor immediately. The symptoms described may indicate anaphylactic shock. Severe symptoms require early emergency treatment.
Your doctor will only reuse FEIBA in patients with suspected hypersensitivity to the product or to any of its components after carefully weighing the expected benefit and the risk of re-exposure and/or not expecting any response with other preventive treatment or alternative therapy.
- If you experience significant changes in blood pressure or pulse rate, difficulty breathing, coughing or chest pain, you should stop the administration immediately and contact your doctor. Your doctor will initiate the appropriate diagnostic and therapeutic measures.
- In patients with hemophilia with inhibitors or with acquired inhibitors to coagulation factors. During treatment with FEIBA, these patients may have an increased tendency to develop bleeding and an increased risk of thrombosis at the same time.
During treatment with FEIBA, thrombotic and thromboembolic events, including disseminated intravascular coagulation (DIC), venous thrombosis, pulmonary embolism, myocardial infarction, and stroke, have occurred. It is likely that concomitant use with recombinant factor VIIa increases the risk of developing a thromboembolic event. Some of the thromboembolic events have occurred with high-dose treatment with FEIBA.
In a trial conducted by another company to evaluate emicizumab (a medicine to prevent bleeding in patients with hemophilia A), some patients who experienced intercurrent bleeding were treated with FEIBA to control the bleeding, and some of these patients developed thrombotic microangiopathy (TMA). TMA is a serious and potentially life-threatening condition. When this condition occurs, the vascular wall can be damaged and clots can develop in the small blood vessels. In some cases, this can cause kidney damage and damage to other organs. In case of intercurrent bleeding while on prophylaxis with emicizumab, contact your hematologist or Hemophilia Treatment Center immediately.
When administering medicines derived from human plasma or blood, certain measures must be taken to prevent the transmission of infections to patients. Such measures include careful selection of donors to exclude those at risk of being carriers of infectious diseases, testing for specific infection markers in individual donations and plasma pools, as well as inclusion of stages in the manufacturing process to eliminate/inactivate viruses. Despite this, when administering medicines derived from human blood or plasma, the possibility of transmitting infectious agents cannot be completely excluded. This also applies to emerging or unknown viruses or other types of infections.
These measures are considered effective for enveloped viruses such as human immunodeficiency virus (HIV), hepatitis B virus, and hepatitis C virus, and for non-enveloped viruses such as hepatitis A virus. The measures taken may have limited value for non-enveloped viruses such as parvovirus B19.
Parvovirus B19 infection can be severe for a pregnant woman (fetal infection) and for individuals whose immune system is depressed or for patients with certain types of anemia (e.g., sickle cell disease or hemolytic anemia).
It is possible that your doctor may recommend that you be vaccinated against hepatitis A and hepatitis B if you are regularly or repeatedly administered plasma-derived products for factor VIII inhibitors.
After administration of high doses of FEIBA, the transient increase in passively transferred hepatitis B surface antibodies may lead to misinterpretation of positive serological test results.
FEIBA is a plasma derivative and may contain substances that react when infused into patients, causing the presence of isohemagglutinins (antibodies that cause the agglutination of red blood cells from another person). This process can lead to misinterpretation of blood test results.
It is strongly recommended that each time a dose of FEIBA is administered, a record be kept of the name of the medicine and batch number administered in order to maintain a record of the batches used.
Children
Experience in children under 6 years is limited; the same dosing regimen as in adults should be adapted for the child's clinical condition.
Use of FEIBA with other medicines
Tell your doctor or pharmacist if you are using, have recently used, or might use any other medicines.
No adequate and well-controlled studies have been conducted on the combined or sequential use of FEIBA and recombinant factor VIIa, antifibrinolytics, or emicizumab. When using systemic antifibrinolytics such as tranexamic acid and aminocaproic acid during treatment with FEIBA, the possibility of thromboembolic events should be considered. Therefore, antifibrinolytics should not be used until approximately 6 to 12 hours after administration of FEIBA.
Based on available in vitro data and clinical observations, a potential drug interaction cannot be excluded with concomitant use with recombinant factor VIIa, which may potentially produce a thromboembolic event.
Tell your doctor if you are to be treated with FEIBA after having received emicizumab (a medicine to prevent bleeding in patients with hemophilia A), as specific warnings and precautions need to be considered. Your doctor will need to closely monitor you.
As with all products used for blood coagulation, FEIBA should not be mixed with other medicines before administration, as this may affect the efficacy and tolerance of the product. It is advisable to flush the venous line with isotonic saline solution before and after administration of FEIBA.
Pregnancy, breast-feeding, and fertility
If you are pregnant or breast-feeding, think you may be pregnant, or are planning to have a baby, ask your doctor or pharmacist for advice before using this medicine.
Your doctor will decide whether FEIBA can be used during pregnancy and breast-feeding. Due to the increased risk of thrombosis during pregnancy, FEIBA should only be administered under close medical supervision and only if clearly indicated. For information on the risk of parvovirus B19 infection, see section warnings and precautions.
Driving and using machines
There is no indication that FEIBA may affect the ability to drive and use machines.
FEIBA contains sodium
500 U
This medicine contains approximately 40 mg of sodium (main component of cooking/table salt) per vial. This is equivalent to 2% of the maximum recommended daily intake of sodium for an adult.
1000 U
This medicine contains approximately 80 mg of sodium (main component of cooking/table salt) per vial. This is equivalent to 4% of the maximum recommended daily intake of sodium for an adult.
2500 U
This medicine contains approximately 200 mg of sodium (main component of cooking/table salt) per vial. This is equivalent to 10% of the maximum recommended daily intake of sodium for an adult.
3. How to use FEIBA
Reconstitute the FEIBA lyophilized powder with the included solvent and administer the solution intravenously.
Follow exactly the administration instructions of this medication as indicated by your doctor. In case of doubt, consult your doctor or pharmacist again.
Your doctor will determine the frequency and dose required for you personally, taking into account the severity of the blood coagulation disorder, the location and magnitude of the hemorrhage, and the clinical condition and response to the preparation. Do not change the dosage established by your doctor and do not suspend the administration of the preparation.
If you feel that the effect of FEIBA is too strong or too weak, consult your doctor or pharmacist.
Warm the product to room temperature or body temperature before administration, if necessary.
FEIBA must be reconstituted immediately before administration. The solution must be used immediately (since the preparation does not contain preservatives).
Gently shake until the entire product is dissolved. Ensure that FEIBA is completely dissolved, as otherwise, fewer FEIBA units will pass through the filter of the equipment.
Solutions with a turbid appearance or containing deposits must be properly eliminated.
Do not reuse opened containers.
Use only the water for injectable preparations and the equipment for reconstitution included in the package.
If other equipment is used, different from the ones included, ensure to use a filter with a pore size of at least 149 µm.
Do not use the product if its sterility barrier system or container is damaged or shows any signs of deterioration.
Do not refrigerate after reconstitution.
After complete reconstitution of FEIBA, the injection or infusion must begin immediately and must be completed within 3 hours from reconstitution.
The disposal of unused medication and all materials that have come into contact with it will be carried out in accordance with local regulations.
[For the prospectus for administration with needles]
Reconstitution of powder for preparation of a solution for infusion with needles:
Use an aseptic technique throughout the procedure.
- Warm the unopened vial of solvent (water for injectable preparations) to room temperature or a maximum of +37 °C, if necessary.
- Remove the protectors from the vial containing the powder and the vial containing the solvent (Figure A), and disinfect the rubber stoppers of both vials.
- Turn to open the protective cap from one end of the included transfer needle, remove it, and insert the needle through the rubber stopper of the vial of solvent (Figures B and C).
- Remove the protective cap from the other end of the transfer needle, being careful not to touch it.
- Invert the vial of solvent and insert the free end of the transfer needle through the rubber stopper of the vial of powder (Figure D). The vacuum existing in this vial will aspirate the solvent.
- Separate the two vials by removing the transfer needle from the vial of powder (Figure E). Gently shake the vial of powder to accelerate dissolution.
7. Once the powder is completely dissolved, insert the air needle (Figure F) and any foam that may have formed will disappear. Remove the air needle.
Infusion:
Use an aseptic technique throughout the procedure.
- Turn to open one end of the protective cap of the included filter needle; remove and connect the needle to the disposable and sterile syringe. Aspirate the solution into the syringe (Figure G).
- Separate the filter needle from the syringe and administer the solution slowly intravenously, with the included infusion equipment (or the included disposable needle).
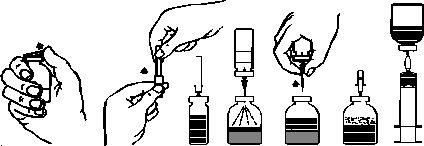
Figure A Figure B Figure C Figure D Figure E Figure F Figure G
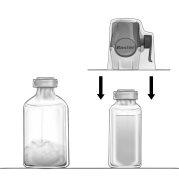
[For the prospectus for administration with BAXJECT II-Hi-Flow]
Reconstitution of powder for preparation of a solution for infusion with the BAXJECT II Hi-Flow equipment:
- Warm the unopened vial of solvent (water for injectable preparations) to room temperature or a maximum of 37°C, if necessary, for example, using a water bath for several minutes.
- Remove the protective caps from the vial of powder and the vial of solvent, and disinfect the rubber stoppers of both vials. Place the vials on a smooth surface.
- Open the packaging of the BAXJECT II Hi-Flow equipment by removing the protective foil without touching the contents of the package (Figure a). Do not remove the equipment from the packaging.
- Turn the packaging over and insert the transparent plastic tip through the rubber stopper of the vial of solvent (Figure b). Now remove the BAXJECT II Hi-Flow equipment from its packaging (Figure c). Do not remove the blue protective cap from the BAXJECT II Hi-Flow equipment.
- With the BAXJECT II Hi-Flow equipment attached to the vial of solvent, invert the system so that the vial of solvent is at the top of the equipment. Insert the purple plastic tip of the BAXJECT II Hi-Flow equipment through the stopper of the vial of FEIBA. The vacuum will cause the solvent to penetrate the vial of FEIBA (Figure d).
- Gently shake, without shaking, the entire system until the powder is completely dissolved. Ensure that FEIBA is completely dissolved, otherwise, the active material may be retained in the filter of the equipment.
Figure a | Figure b | Figure c |
|
|
|
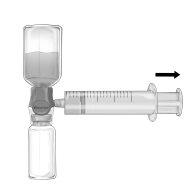
Infusion
Use an aseptic technique throughout the procedure!
- Remove the blue protective cap from the BAXJECT II Hi-Flow equipment. Firmly connect the syringe to the BAXJECT II Hi-Flow equipment. DO NOT INTRODUCE AIR INTO THE SYRINGE. (Figure e). It is strongly recommended to use a Luer Lock syringe to ensure a firm connection between the syringe and the BAXJECT II Hi-Flow equipment (turn the syringe clockwise until it stops when it reaches the top).
- Invert the system so that the dissolved product is at the top. Introduce the dissolved product into the syringe, slowly pulling the plunger back and ensuring that the firm connection between the BAXJECT II Hi-Flow equipment and the syringe is maintained throughout the process while pulling the syringe plunger (Figure f).
- Disconnect the syringe.
- If foam forms inside the syringe, wait for the foam to compact. Administer the solution slowly intravenously with the supplied infusion equipment (or a disposable needle).
Figure d | Figure e | Figure f |
|
|
|
Do not exceed an infusion rate of 2 U of FEIBA/kg per minute.
If you use more FEIBA than you should
Inform your doctor immediately. Overdose of FEIBA may increase the risk of adverse effects, such as thromboembolism (formation of a blood clot with redness in the blood vessels), disseminated intravascular coagulation (DIC), or myocardial infarction. Some of the reported thromboembolic events occurred with doses higher than 200 U/kg/day or with patients with other risk factors for thromboembolic events.
If signs or symptoms of a thromboembolic event are observed, the infusion should be interrupted immediately and the necessary diagnostic and therapeutic measures should be taken.
4. Possible side effects
Like all medications, this medication can cause side effects, although not all people experience them.
Common side effects(may affect up to 1 in 10 patients)
Hypersensitivity, headache, dizziness, hypotension, skin rash, positive hepatitis B surface antibodies.
Side effects with unknown frequency(cannot be estimated from the available data)
Blood and lymphatic system disorders:disseminated intravascular coagulation (DIC), increased inhibitor titre
Immune system disorders:anaphylactic reactions, urticaria (hives)
Nervous system disorders:numbness of the extremities (hypoesthesia), abnormal or reduced sensitivity (paresthesia), stroke (thrombotic or embolic accident), somnolence, altered taste (dysgeusia).
Cardiac disorders:heart attack (myocardial infarction), heart palpitations (tachycardia)
Vascular disorders:formation of blood clots with redness of the blood vessels (thromboembolic events, venous and arterial thrombosis), increased blood pressure (hypertension), flushing.
Respiratory, thoracic, and mediastinal disorders:pulmonary embolism, airway obstruction (bronchospasm), wheezing, cough, difficulty breathing (dyspnea).
Gastrointestinal disorders:vomiting, diarrhea, abdominal discomfort, feeling of illness (nausea)
Skin and subcutaneous tissue disorders:numbness in the face, facial swelling, tongue, and lip swelling (angioedema), urticaria (hives), itching (pruritus).
General disorders and administration site conditions:pain at the injection site, general discomfort, feeling of heat, chills, fever, chest pain, chest discomfort.
Investigations:decrease in blood pressure, increase in D-dimer fibrin level in blood.
Rapid intravenous infusion may cause a stabbing pain and a feeling of numbness in the face and extremities, as well as a decrease in blood pressure.
There have been reports of myocardial infarction after administration of doses higher than the maximum daily dose and/or with prolonged administration and/or presence of thromboembolic risk factors.
Reporting of side effects
If you experience any side effects, consult your doctor, even if they are possible side effects not listed in this prospectus. You can also report them directly through the Spanish Pharmacovigilance System for Human Use Medicines: www.notificaram.es
By reporting side effects, you can contribute to providing more information on the safety of this medication.
5. Storage of FEIBA
Keep this medication out of the sight and reach of children.
Do not store above 25 °C. Do not freeze.
Store in the original packaging to protect it from light.
Do not use this medication after the expiration date shown on the label and packaging. The expiration date is the last day of the month indicated.
Medications should not be disposed of through wastewater or household waste. Ask your pharmacist how to dispose of the packaging and medications you no longer need. This will help protect the environment.
6. Contents of the container and additional information
Composition of FEIBA
Powder
- The active principle per vial is anti-inhibitor coagulant complex.
- 1 ml contains 50 U of anti-inhibitor coagulant complex.
- FEIBA 50 U/ml is available in three presentations:
- The 500 U FEIBA presentation contains 500 U (units) of anti-inhibitor coagulant complex in 200 – 600 mg of human plasma protein.
- The 1000 U FEIBA presentation contains 1000 U (units) of anti-inhibitor coagulant complex in 400 – 1200 mg of human plasma protein.
- The 2500 U FEIBA presentation contains 2500 U (units) of anti-inhibitor coagulant complex in 1000 – 3000 mg of human plasma protein.
- FEIBA also contains factors II, IX, and X, mainly non-activated, as well as activated factor VII. The antigen of coagulant factor VIII (F VIII C:Ag) as well as the factors of the kallikrein-kinin system are present only in trace amounts.
- The other components are sodium chloride and sodium citrate.
Solvent
- Water for injectable preparations
Appearance of the product and contents of the container
The product is presented as a lyophilized or friable solid powder, white to off-white or pale green in color. The reconstituted solution has a pH between 6.8 and 7.6.
The powder and solvent are supplied in glass vials closed with rubber stoppers.
Presentation:1 x 500 U
1 x 1000 U
1 x 2500 U
Only some package sizes may be marketed.
[For the prospectus for administration with needles]
Contents of the container:
- 1 vial with 500 U / 1000 U of FEIBA - powder for solution for infusion
- 1 vial with 10 ml / 20 ml of water for injectable preparations
- 1 disposable syringe
- 1 disposable needle
- 1 butterfly needle
- 1 filter needle
- 1 transfer needle
- 1 vent needle
[For the prospectus for administration with BAXJECT II-Hi-Flow]
Contents of the container:
- 1 vial with 500U/1000 U/2500 U of FEIBA - powder for solution for infusion
- 1 vial with 10 ml/20 ml/50 ml of water for injectable preparations
- 1 BAXJECT II Hi-Flow reconstitution device
- 1 disposable syringe
- 1 disposable needle
- 1 butterfly needle
Marketing authorization holder and manufacturer
Marketing authorization holder
Baxalta Innovations GmbH
Industriestrasse, 67
1221 Vienna, Austria
Manufacturer
Takeda Manufacturing Austria AG Industriestrasse, 67
1221 Vienna, Austria
Local representative of the marketing authorization holder
Takeda Farmacéutica España S.A.
Calle Albacete, 5, 9th floor,
Edificio Los Cubos
28027 Madrid
Spain
Tel: +34 91 790 42 22
This medicinal product is authorized in the Member States of the European Economic Area under the following names:
Austria:
FEIBA 50 E./ml Powder and solvent for solution for infusion
Croatia:
FEIBA 50 U/ml powder and solvent for solution for infusion
Cyprus:
FEIBA 50 U/ml κ?νις και διαλ?της για δι?λυμα προς ?γχυση
Czech Republic: FEIBA NF
Denmark:
Feiba
Estonia:
FEIBA
Finland:
Feiba
Germany: FEIBA 500 E, FEIBA 1000 E, FEIBA 2500 E
Greece:
FEIBA 50 U/ml κ?νις και διαλ?της για δι?λυμα προς ?γχυση
Ireland:
FEIBA 50 U/ml powder and solvent for solution for infusion
Latvia: Feiba 50 V/ml pulveris un škidinatajs infuziju škiduma pagatavošanai
Lithuania: Feiba 50 V/ml milteliai ir tirpiklis infuziniam tirpalui
Malta: FEIBA 50 U/ml powder and solvent for solution for infusion
Netherlands: FEIBA 50 E/ML, poeder en oplosmidel voor oplossing voor injectie
Norway:
Feiba
Romania:
FEIBA 50 U/ml pulbere si solvent pentru solutie injectabila
Slovakia: FEIBA 50 U/ml prášok a rozpúštadlo na infúzny roztok
Slovenia:
FEIBA 50 e./ml prašek in vehikel za raztopino za infundiranje
Spain:
FEIBA 50 U/ml powder and solvent for solution for infusion
Sweden:
Feiba 50 enheter/ml pulver och vätska till infusionsvätska, lösning
Date of the last revision of this prospectus:August 2024
Detailed and updated information on this medicinal product is available on the website of the Spanish Agency for Medicines and Health Products (AEMPS) http://www.aemps.gob.es/
---------------------------------------------------------------------------------------------------------------------
This information is intended only for healthcare professionals:
Treatment should be initiated and monitored under the supervision of a physician experienced in the treatment of coagulation disorders.
Posology
The dose and duration of therapy depend on the severity of the hemostatic function disorder, the location and severity of the hemorrhage, and the patient's clinical condition.
The dose and frequency of administration will always be determined based on clinical efficacy in each case.
As a general guideline, doses of 50 –100 U/kg of FEIBA are recommended; a single dose of 100 U/kg should not be exceeded, nor a maximum daily dose of 200 U/kg, unless the severity of the hemorrhage requires and justifies the use of higher doses.
Due to specific patient factors, the response to a bypass agent may vary, and in a given hemorrhage situation, patients with an insufficient response to one agent may respond to another agent. In case of insufficient response to a bypass agent, the use of another agent should be considered.
Pediatric population
Experience in children under 6 years is limited; the same dosage regimen as in adults should be adapted for the child's clinical condition.
- Spontaneous hemorrhage
Hemorrhages in joints, muscles, and soft tissue
For mild to moderate hemorrhages, a dose of 50 to 75 U/kg is recommended every 12 hours. Treatment should continue until clear signs of clinical improvement appear, such as decreased pain, reduced swelling, or increased joint mobility.
For severe hemorrhages in muscles and soft tissue, e.g., retroperitoneal hemorrhage, a dose of 100 U/kg every 12 hours is recommended.
Hemorrhages in mucous membranes
A dose of 50 U/kg every 6 hours is recommended, under strict patient surveillance (visual control of bleeding, repetition of hematocrit). If bleeding does not stop, the dose can be increased to 100 U/kg; however, a dose of 200 U/kg should not be exceeded.
Other severe hemorrhages
In severe hemorrhage, such as CNS hemorrhage, a dose of 100 U/kg every 12 hours is recommended. In particular cases, FEIBA can be administered every 6 hours, until clear signs of clinical improvement appear (the maximum daily dose of 200 U/kg should not be exceeded).
- Surgery
In surgical interventions, an initial dose of 100 U/kg can be administered before the operation, and between 6 to 12 hours later, another dose of 50 – 100 U/kg can be administered. As postoperative maintenance doses, 50 – 100 U/kg can be administered every 6 – 12 hours; the dose, dosing intervals, and duration of peri- and postoperative treatment depend on the surgical intervention, the patient's general condition, and clinical efficacy in each particular case (the maximum daily dose of 200 U/kg should not be exceeded).
- Prophylaxis in patients with hemophilia A and inhibitor
- Prophylaxis of hemorrhages in patients with a high inhibitor titre and frequent hemorrhages, after a failed response to immune tolerance induction (ITI) or when such induction is not considered:
A dose of 70 to 100 U/kg is recommended on alternate days. If necessary, the dose can be increased to 100 U/kg per day or gradually reduced.
- Prophylaxis of hemorrhages in patients with a high inhibitor titre during immune tolerance induction (ITI):
FEIBA can be administered in combination with factor VIII, at a dosing interval of 50 – 100 U/kg, twice a day, until the factor VIII inhibitor titre has decreased to <2 u.b.*< p>
*1 Bethesda Unit is defined as the amount of antibodies that inhibits 50% of factor VIII activity in plasma incubated (2 hours at 37 °C).
- Use of FEIBA in special patient groups
FEIBA has also been used in combination with a factor VIII concentrate as long-term treatment for the complete and permanent elimination of factor VIII inhibitors.
Monitoring
In case of an inadequate response to treatment with the product, a platelet count is recommended, as a sufficient number of functionally intact platelets is considered necessary for the treatment with the product to be effective.
Due to the complex mechanism of action, there is no direct monitoring of the active principles. Coagulation tests such as total blood coagulation time (TCT), thromboelastogram (TEG, r value), and activated partial thromboplastin time (TTPa) generally show only small shortenings, which do not necessarily correlate with clinical improvement. For these reasons, the usefulness of these tests for monitoring treatment with FEIBA is very limited.
Method of administration
FEIBA should be administered slowly, intravenously. The infusion rate should not exceed 2 U/kg per minute.
FEIBA should be reconstituted immediately before administration. The solution should be used immediately (since the preparation does not contain preservatives). Do not use cloudy solutions or those containing deposits. The disposal of unused medicinal products and all materials that have come into contact with them should be carried out in accordance with local regulations.
Monitoring of therapy
Individual doses of 100 U/kg and daily doses of 200 U/kg should not be exceeded. Patients receiving more than 100 U/kg should be monitored for the development of CID and/or acute coronary ischemia and for symptoms of thrombotic or thromboembolic events. High doses of FEIBA should only be administered for the time strictly necessary to stop a hemorrhage.
If clinically significant changes in blood pressure or pulse rate, respiratory distress, cough, or chest pain occur, the infusion should be interrupted immediately, and the necessary diagnostic and therapeutic measures should be taken. The characteristic laboratory parameters of CID are a decrease in fibrinogen, a decrease in platelet count, and/or the presence of fibrin or fibrinogen degradation products (PDF). Other parameters for the development of CID are a clear prolongation of thrombin time, prothrombin time, or activated partial thromboplastin time TTPa. In patients with hemophilia and inhibitors or with acquired inhibitors of factors VIII, IX, and/or XI, the TTPa is prolonged due to the underlying disease.
The administration of FEIBA in patients with inhibitors may produce an initial "anamnestic" increase in inhibitor levels. During continued administration of FEIBA, inhibitor levels may decrease over time. Both clinical data and published data suggest that the efficacy of FEIBA is not reduced.
Patients with hemophilia and inhibitors or with acquired inhibitors of coagulation factors who receive treatment with FEIBA may be more prone to hemorrhage, while the risk of thrombosis may increase.
Laboratory tests and clinical efficacy
In vitro tests to control efficacy, such as TTPa, total coagulation time (TCT), and thromboelastogram (TEG), do not necessarily correlate with clinical improvement. For this reason, it is not recommended to seek the normalization of these values by increasing the dose of FEIBA, and it is even strongly discouraged due to the possible risk of CID due to overdose.
Importance of platelet count
In case of an inadequate response to treatment with FEIBA, a platelet count is recommended, as a sufficient number of functionally intact platelets is considered necessary for the treatment with FEIBA to be effective.
Treatment of patients with hemophilia B and inhibitor
Experience in patients with hemophilia B and inhibitor of factor IX is limited due to the rarity of the disease. Five patients with hemophilia B and inhibitor were treated with FEIBA during clinical trials, either with on-demand treatment or prophylactic treatment or for surgical interventions:
In a prospective, open, randomized, and parallel clinical study in patients with hemophilia A or B with a constantly elevated inhibitor titre (090701, PROOF), 36 patients were randomized to receive prophylactic treatment or on-demand treatment for 12 months ± 14 days. The 17 patients in the prophylactic treatment group received 85 ± 15 U/kg of FEIBA, administered on alternate days, and the 19 patients in the on-demand treatment group received individual treatment, determined by the physician. Two patients with hemophilia B and inhibitor received on-demand treatment, and one patient with hemophilia B received prophylactic treatment.
The median Annual Bleeding Rate (ABR) for all types of bleeding episodes in patients in the prophylactic treatment group (median ABR = 7.9) was lower than that in patients in the on-demand treatment group (median ABR = 28.7), which represents a 72.5% decrease in the median ABR between treatment groups.
In another completed prospective, non-interventional study of the perioperative use of FEIBA (PASS-INT-003, SURF), a total of 34 surgical interventions were performed in 23 patients. Most patients (18) had congenital hemophilia A with inhibitor, two were patients with hemophilia B and inhibitor, and three were patients with acquired hemophilia A and inhibitor. The exposure time to FEIBA ranged from 1 to 28 days, with a mean of 9 days and a median of 8 days. The mean cumulative dose was 88,347 U, and the median dose was 59,000 U. In patients with hemophilia B and inhibitor, the longest exposure to FEIBA was 21 days, and the maximum dose administered was 7,324 U.
Additionally, 48 patients have been described in the literature in whom FEIBA was used for the treatment and prevention of bleeding episodes in patients with hemophilia B and inhibitor of factor IX (34 patients with hemophilia B and inhibitor received on-demand treatment, six patients with hemophilia B and inhibitor received prophylactic treatment, and eight patients with hemophilia B and inhibitor received treatment for surgical interventions).
There are also isolated reports on the use of FEIBA in the treatment of patients with acquired inhibitors against factors IX, X, XI, and XIII.
In rare cases, FEIBA has also been used in patients with inhibitors against von Willebrand factor.
- Country of registration
- Active substance
- Prescription requiredYes
- Manufacturer
- This information is for reference only and does not constitute medical advice. Always consult a doctor before taking any medication. Oladoctor is not responsible for medical decisions based on this content.
- Alternatives to FEIBA 50 U/mL POWDER AND SOLVENT FOR SOLUTION FOR INFUSIONDosage form: INJECTABLE PERFUSION, 100 U/mlActive substance: factor VIII inhibitor bypassing activityManufacturer: Baxalta Innovations GmbhPrescription requiredDosage form: INJECTABLE, 1,000 IUActive substance: coagulation factor VIIIManufacturer: Takeda Manufacturing Austria AgPrescription requiredDosage form: INJECTABLE, 1500 IUActive substance: coagulation factor VIIIManufacturer: Takeda Manufacturing Austria AgPrescription required
Online doctors for FEIBA 50 U/mL POWDER AND SOLVENT FOR SOLUTION FOR INFUSION
Discuss questions about FEIBA 50 U/mL POWDER AND SOLVENT FOR SOLUTION FOR INFUSION, including use, safety considerations and prescription review, subject to medical assessment and local regulations.
Frequently Asked Questions