ENTYVIO 108 mg SOLUTION FOR INJECTION IN PRE-FILLED SYRINGE

How to use ENTYVIO 108 mg SOLUTION FOR INJECTION IN PRE-FILLED SYRINGE
Translated with AI
This page provides general information and does not replace a doctor’s consultation. Always consult a doctor before taking any medication. Seek urgent medical care if symptoms are severe.
Show originalContents of the leaflet
Introduction
Package Leaflet: Information for the Patient
Entyvio 108mg solution for injection in pre-filled syringe
vedolizumab
Read all of this leaflet carefully before you start using this medicine because it contains important information for you.
- Keep this leaflet, you may need to read it again.
- If you have any further questions, ask your doctor, pharmacist, or nurse.
- This medicine has been prescribed for you only. Do not pass it on to others. It may harm them, even if their signs of illness are the same as yours.
- If you get any side effects, talk to your doctor, pharmacist, or nurse. This includes any possible side effects not listed in this leaflet. See section 4.
Contents of the pack
- What is Entyvio and what is it used for
- What you need to know before you use Entyvio
- How to use Entyvio
- Possible side effects
- Storage of Entyvio
- Contents of the pack and other information
1. What is Entyvio and what is it used for
What is Entyvio
Entyvio contains the active substance “vedolizumab”. Vedolizumab belongs to a group of biological medicines called monoclonal antibodies (MAb).
How Entyvio works
Entyvio blocks a protein on the surface of white blood cells (leucocytes) that causes inflammation in ulcerative colitis and Crohn's disease, thereby reducing inflammation.
What Entyvio is used for
Entyvio is used to treat signs and symptoms in adults with:
- moderate to severe active ulcerative colitis
- moderate to severe active Crohn's disease.
Ulcerative Colitis
Ulcerative colitis is a disease that causes inflammation of the large intestine. If you have ulcerative colitis, you will first be given other medicines. If you do not respond satisfactorily or cannot tolerate these medicines, your doctor may prescribe Entyvio to reduce the signs and symptoms of the disease.
Crohn's Disease
Crohn's disease is a disease that causes inflammation of the digestive tract. If you have Crohn's disease, you will first be given other medicines. If you do not respond satisfactorily or cannot tolerate these medicines, your doctor may prescribe Entyvio to reduce the signs and symptoms of the disease.
2. What you need to know before you use Entyvio
Do not use Entyvio
- if you are allergic to vedolizumab or any of the other ingredients of this medicine (listed in section 6).
- if you have a severe active infection, such as tuberculosis, sepsis, severe vomiting or diarrhea (gastroenteritis) or infection of the nervous system.
Warnings and precautions
Talk to your doctor, pharmacist, or nurse before using Entyvio.
Tell your doctor, pharmacist, or nurse immediatelywhen you start using this medicine for the first time, during treatment, and between doses:
- if you experience double vision, blurred vision, or loss of vision, difficulty speaking, weakness in an arm or leg, a change in your walking or balance problems, persistent numbness, decreased or lost sensation, confusion, or memory loss. All these symptoms could be signs of a serious and potentially life-threatening brain complicationknown as progressive multifocal leukoencephalopathy (PML).
- if you have an infection, or think you have an infection - signs may include shivering, persistent cough, or high fever. Some infections can be serious and even life-threatening if not treated.
- if you experience signs of an allergic reactionsuch as wheezing, difficulty breathing, hives, itching, swelling, or dizziness. For more detailed information, see the section on allergic reactions in section 4.
- if you are going to receive any vaccineor have recently received one. Entyvio may affect how you respond to a vaccine.
- if you have cancer, tell your doctor. Your doctor will have to decide whether it is possible to administer Entyvio.
- if you do not feel any better, as vedolizumab may take up to 14 weeks to work in some patients with very active Crohn's disease.
Children and adolescents
Entyvio is not recommended for use in children and adolescents (under 18 years of age) due to a lack of information on the use of this medicine in this age group.
Other medicines and Entyvio
Tell your doctor, pharmacist, or nurse if you are taking, have recently taken, or might take any other medicines.
- Entyvio must not be administered with other biological medicines that suppress the immune system, as the effects that may occur are unknown.
Tell your doctor if you have previously been given:
- natalizumab (a medicine used for multiple sclerosis) or
- rituximab (a medicine used for certain types of cancer and rheumatoid arthritis).
Your doctor will have to decide whether it is possible to administer Entyvio.
Pregnancy and breast-feeding
If you are pregnant or breast-feeding, think you may be pregnant, or are planning to have a baby, ask your doctor for advice before using this medicine.
Pregnancy
The effects of Entyvio in pregnant women are not known. Therefore, this medicine is not recommended during pregnancy. You and your doctor must decide whether the benefit to you is clearly greater than the potential risk to you and your baby.
If you are a woman of childbearing potential, you are advised to avoid becoming pregnant during use of Entyvio. You should use adequate contraceptive methods during treatment and for at least 4.5 months after receiving the last dose.
Breast-feeding
Tell your doctor if you are breast-feeding or plan to breast-feed. Entyvio passes into breast milk. There is not enough information on the effects this may have on your baby and on milk production. A decision must be made whether to discontinue breast-feeding or to discontinue/abstain from Entyvio therapy, taking into account the benefit of breast-feeding for the child and the benefit of therapy for you.
Driving and using machines
The effects of this medicine on the ability to drive and use machines or tools are small. A small number of patients have felt dizzy after receiving Entyvio. If you feel dizzy, do not drive or use tools or machines.
Entyvio 108mg solution for injection contains sodium
This medicine contains less than 1 mmol of sodium (23 mg) per dose; this is essentially “sodium-free”.
3. How to use Entyvio
Follow exactly the instructions for administration of this medicine given by your doctor or pharmacist. If you are unsure, ask them again.
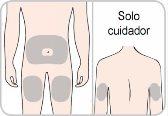
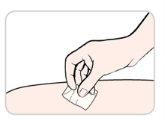
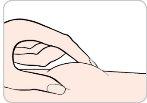
You or your caregiver will receive training on the use of subcutaneous injections (injections under the skin) of Entyvio.
How much Entyvio will you be given
Treatment with Entyvio is the same for ulcerative colitis and Crohn's disease.
The recommended dose is 108 mg of Entyvio administered by subcutaneous injection once every 2 weeks.
- At the start of treatment, your doctor will give you the initial doses of Entyvio through a drip into one of the veins in your arm (intravenous infusion) over about 30 minutes.
- After at least 2 intravenous infusions, you may start treatment with Entyvio by subcutaneous injection (by injection under the skin). The first subcutaneous injection will be given at the time of the next scheduled intravenous infusion, and every 2 weeks thereafter.
How to inject Entyvio
You can give yourself the subcutaneous injections or a caregiver can give them to you after receiving training. At the end of this leaflet, you will find instructions on how to proceed with the subcutaneous injection.
If you miss or omit an Entyvio injection
If you miss or omit a dose, inject the next dose as soon as possible and then every 2 weeks.
If you stop treatment with Entyvio
Do not stop using Entyvio without talking to your doctor first.
If you have any further questions on the use of this medicine, ask your doctor, pharmacist, or nurse.
4. Possible side effects
Like all medicines, this medicine can cause side effects, although not everybody gets them.
Serious side effects
Tell your doctor immediatelyif you notice any of the following symptoms:
- allergic reactions (may affect up to 1 in 100 people), with signs such as wheezing or difficulty breathing, hives, itching, swelling, or feeling unwell, pain at the infusion site, redness of the skin
- infections (may affect up to 1 in 10 people), with signs such as chills or shivering, high fever or rash
Other side effects
Tell your doctor as soon as possibleif you notice any of the following symptoms:
Very common side effects(may affect more than 1 in 10 people)
- common cold
- joint pain
- headache
Common side effects(may affect up to 1 in 10 people)
- pneumonia
- bacterial infection of the colon by Clostridium difficile
- fever
- respiratory infection
- changes in liver function, increased liver enzymes (shown in blood tests)
- fatigue
- cough
- flu
- back pain
- sore throat
- sinusitis
- itching/pruritus
- rash and redness
- limb pain
- muscle cramps
- muscle weakness
- throat infection
- stomach flu
- anal infection
- anal pain
- hard stools
- bloating
- gas
- high blood pressure
- numbness or tingling
- heartburn
- hemorrhoids
- stuffy nose
- eczema
- night sweats
- acne (pimples)
- reactions at the injection site (pain, swelling, redness, or itching)
- shingles
Uncommon side effects(may affect up to 1 in 100 people)
- redness and sensitivity of the hair follicles
- infection of the mouth and throat by yeast
- vaginal infection
- blurred vision (loss of visual acuity)
Rare side effects(may affect up to 1 in 10,000 people)
- sudden and severe allergic reaction that can cause difficulty breathing, swelling, rapid heartbeat, sweating, low blood pressure, dizziness, loss of consciousness, and fainting (anaphylactic reaction and anaphylactic shock)
- inflammation of the liver (hepatitis). The signs and symptoms of hepatitis may include abnormal liver function tests, yellowing of the eyes or skin (jaundice), pain in the right upper area of the stomach or bruising
Frequency not known(frequency cannot be estimated from the available data)
- lung disease that causes difficulty breathing (interstitial lung disease)
Reporting of side effects
If you experience any side effects, talk to your doctor, pharmacist, or nurse, including any possible side effects not listed in this leaflet. You can also report side effects directly through the national reporting system listed in Appendix V. By reporting side effects, you can help provide more information on the safety of this medicine.
5. Storage of Entyvio
- Keep this medicine out of the sight and reach of children.
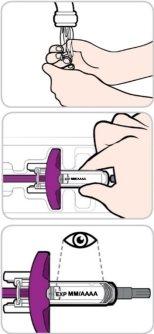
- Do not use this medicine after the expiry date which is stated on the carton and on the label after “EXP”. The expiry date is the last day of the month stated.
- Entyvio is for single use only.
Store in a refrigerator (between 2°C and 8°C). Store the pre-filled syringe(s) in the original carton to protect from light. If necessary, a single pre-filled syringe can be stored out of the refrigerator, protected from light, at room temperature (up to 25°C) for a maximum of 7 days. Do not use the syringe if it has been out of the refrigerator for more than 7 days.
- Do not freeze. Do not expose directly to sunlight.
- Do not use this medicine if you notice particles in the liquid or discoloration (should be colorless or slightly yellowish) before administration.
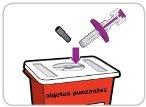
- Medicines should not be disposed of via wastewater or household waste. Ask your pharmacist how to dispose of medicines no longer required. These measures will help protect the environment.
6. Container Contents and Additional Information
Composition of Entyvio
- The active substanceis vedolizumab. Each prefilled syringe contains 108 mg of vedolizumab.
- The other componentsare citric acid monohydrate, sodium citrate dihydrate, L-histidine, L-histidine monohydrochloride, L-arginine hydrochloride, polysorbate 80, and water for injectable preparations.
Appearance of the Product and Container Contents
- Entyvio is a colorless or slightly yellowish injectable solution provided in a glass prefilled syringe with an automatic safety device that protects the needle after injection. The syringe has a rubber needle shield, covered by a plastic sleeve and a rubber stopper.
- Entyvio is available in packs containing 1 or 2 prefilled syringes and in multipacks containing 6 (6 x 1) prefilled syringes. Not all pack sizes may be marketed.
Marketing Authorization Holder
Takeda Pharma A/S
Delta Park 45
2665 Vallensbaek Strand
Denmark
Manufacturer
Takeda Austria GmbH
St. Peter-Straße 25
A-4020 Linz
Austria
You can request more information about this medicinal product from the local representative of the marketing authorization holder:
België/Belgique/Belgien Takeda Belgium NV Tel.: +32 2 464 06 11 | Lietuva Takeda, UAB Tel.: +370 521 09 070 |
| Luxembourg/Luxemburg Takeda Belgium NV Tel.: +32 2 464 06 11 |
Česká republika Takeda Pharmaceuticals Czech Republic s.r.o. Tel: +420 234 722 722 | Magyarország Takeda Pharma Kft. Tel.: +361 2707030 |
Danmark Takeda Pharma A/S Tlf: +45 46 77 10 10 | Malta Drugsales Ltd Tel.: +356 2141 9070 |
Deutschland Takeda GmbH Tel.: +49 (0) 800 825 3325 | Nederland Takeda Nederland B.V. Tel.: +31 20 203 5492 |
Eesti Takeda Pharma OÜ Tel.: +372 6177 669 | Norge Takeda AS Tlf.: +47 800 800 30 |
Ελλάδα ΤΑΚΕДА ΕΛΛΑΣ Α.Ε. Τηλ.: +30 210 6387800 | Österreich Takeda Pharma Ges.m.b.H. Tel.: +43 (0) 800 20 80 50 |
España Takeda Farmacéutica España, S.A. Tel.: +34 917 90 42 22 | Polska Takeda Pharma Sp. z o.o. Tel.: +48223062447 |
France Takeda France SAS Tel.: +33 1 40 67 33 00 | Portugal Takeda Farmacêuticos Portugal, Lda. Tel.: +351 21 120 1457 |
Hrvatska Takeda Pharmaceuticals Croatia d.o.o. Tel: +385 1 377 88 96 | România Takeda Pharmaceuticals SRL Tel.: +40 21 335 03 91 |
Ireland Takeda Products Ireland Ltd. Tel.: 1800 937 970 | Slovenija Takeda Pharmaceuticals farmacevtska družba d.o.o. Tel.: +386 (0) 59 082 480 |
Ísland Vistor hf. Sími: +354 535 7000 | Slovenská republika Takeda Pharmaceuticals Slovakia s.r.o. Tel.: +421 (2) 20 602 600 |
Italia Takeda Italia S.p.A Tel.: +39 06 502601 | Suomi/Finland Takeda Oy Puh./Tel.: 0800 774 051 |
Κύπρος A.POTAMITIS MEDICARE LTD Τηλ: +357 22583333 | Sverige Takeda Pharma AB Tel: 020 795 079 |
Latvija Takeda Latvia SIA Tel.: +371 67840082 | United Kingdom (Northern Ireland) Takeda UK Ltd Tel.: +44 (0) 3333 000 181 |
Date of Last Revision of this Leaflet: 03/2025
Other Sources of Information
This leaflet is available in a format suitable for blind or partially sighted patients and can be requested from the local representative of the marketing authorization holder.
Detailed information on this medicinal product is available on the European Medicines Agency website: http://www.ema.europa.eu.
-----------------------------------------------------------------------------------------------------------------------
This information is intended only for healthcare professionals:
Traceability
In order to improve the traceability of biological medicinal products, the name and batch number of the administered product should be clearly recorded.
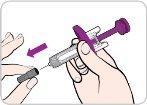
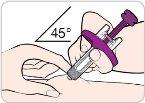
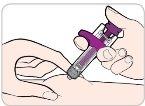
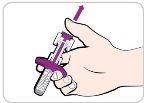
Instructions for Use:
Read and follow these instructions before proceeding with the injection. Your doctor, nurse, or pharmacist should show you how to use the Entyvio prefilled syringe before you use it for the first time.
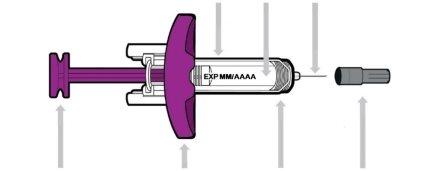
Your Entyvio Single-Use Prefilled Syringe
Before Use | |||
Needle Shield | Medicine | Needle | |
| |||
Purple Plunger | Wings | Spring | Needle Cap |
After Use | |||
Needle Shield | |||
| |||
Covered Needle | |||
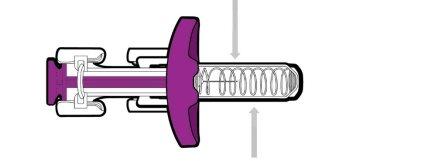
Each prefilled syringe has a needle shield that automatically covers the needle after you press the plunger all the way down and release it. |
| |
| Wait 30minutes
|
| |
|
|
| |
|
|
| |
|
|
| |
|
|
- Country of registration
- Active substance
- Prescription requiredYes
- Manufacturer
- This information is for reference only and does not constitute medical advice. Always consult a doctor before taking any medication. Oladoctor is not responsible for medical decisions based on this content.
- Alternatives to ENTYVIO 108 mg SOLUTION FOR INJECTION IN PRE-FILLED SYRINGEDosage form: INJECTABLE, 0.68 ml (158.8 mg/ml)Active substance: vedolizumabManufacturer: Takeda Pharma A/SPrescription requiredDosage form: INJECTABLE INFUSION, 300 mgActive substance: vedolizumabManufacturer: Takeda Pharma A/SPrescription requiredDosage form: INJECTABLE PERFUSION, 120 mg (80 mg/kg) belimumabActive substance: belimumabManufacturer: Glaxosmithkline (Ireland) LimitedPrescription required
Online doctors for ENTYVIO 108 mg SOLUTION FOR INJECTION IN PRE-FILLED SYRINGE
Discuss questions about ENTYVIO 108 mg SOLUTION FOR INJECTION IN PRE-FILLED SYRINGE, including use, safety considerations and prescription review, subject to medical assessment and local regulations.
Frequently Asked Questions