
DOTIMIR 20 mg/mL + 5 mg/mL EYE DROPS SOLUTION

How to use DOTIMIR 20 mg/mL + 5 mg/mL EYE DROPS SOLUTION
Translated with AI
This page provides general information and does not replace a doctor’s consultation. Always consult a doctor before taking any medication. Seek urgent medical care if symptoms are severe.
Show originalContents of the leaflet
Introduction
Package Leaflet: Information for the Patient
Dotimir 20 mg/ml + 5 mg/ml Eye Drops Solution
dorzolamide/timolol
Read the entire package leaflet carefully before starting to use this medication, as it contains important information for you.
- Keep this package leaflet, as you may need to read it again.
- If you have any questions, ask your doctor or pharmacist.
- This medication has been prescribed to you only, and you should not give it to others, even if they have the same symptoms as you, as it may harm them.
- If you experience side effects, consult your doctor or pharmacist, even if they are side effects not listed in this package leaflet. See section 4.
Contents of the Package Leaflet
- What is Dotimir and what is it used for
- What you need to know before using Dotimir
- How to use Dotimir
- Possible side effects
- Storage of Dotimir
- Contents of the pack and further information
1. What is Dotimir and what is it used for
Dotimir contains two medications: dorzolamide and timolol.
- Dorzolamide belongs to a group of medications called "carbonic anhydrase inhibitors".
- Timolol belongs to a group of medications called "beta-blockers".
These medications decrease eye pressure in different ways.
Dotimir is prescribed to reduce elevated eye pressure in the treatment of glaucoma when the use of a single beta-blocker eye drop is not suitable.
Dotimir eye drops solution is a sterile solution that does not contain preservatives.
2. What you need to know before using Dotimir
Do not use Dotimir
- if you are allergic to dorzolamide hydrochloride, timolol maleate, or any of the other components of this medication (listed in section 6).
- if you currently have or have had in the past severe respiratory problems, such as asthma or chronic obstructive pulmonary disease (severe lung disease that can cause wheezing, difficulty breathing, and/or persistent cough over a long period).
- if you have a slow heart rate, heart failure, or heart rhythm disturbances (irregular heartbeats).
- if you have severe kidney disease or a history of kidney stones.
- if you have excess acidity in the blood caused by an accumulation of chloride in the blood (hyperchloremic acidosis).
If you are not sure whether you should use this medication, consult your doctor or pharmacist.
Warnings and precautions
Consult your doctor before starting to use Dotimir. Inform your doctor if you have or have had in the past:
- coronary heart disease (symptoms may include chest pain or tightness, difficulty breathing, or shortness of breath), heart failure, low blood pressure.
- heart rhythm disturbances such as decreased heart rate.
- respiratory problems, asthma, or chronic obstructive pulmonary disease.
- circulatory problems (such as Raynaud's disease or Raynaud's syndrome).
- diabetes, as timolol may mask signs and symptoms of low blood sugar levels.
- hyperthyroidism, as timolol may mask signs and symptoms.
- any allergy or anaphylactic reaction.
- muscle weakness or if you have been diagnosed with myasthenia gravis.
- if you use soft contact lenses, Dotimir has not been studied in patients using contact lenses.
If you have a history of contact hypersensitivity to silver, you should not use this medication, as the dispensed drops may contain traces of silver from the container.
Inform your doctor before having surgery that you are using Dotimir, as timolol may change the effects of some medications used during anesthesia.
When Dotimir is instilled in the eye, it can affect the entire body.
Consult your doctor if, during treatment with Dotimir, you:
- develop eye irritation or any new eye problems, such as redness of the eyes or swelling of the eyelids.
- suspect that Dotimir is causing an allergic reaction or hypersensitivity (e.g., skin rash, severe skin reaction, or redness and itching in the eyes). Stop using this medication and contact your doctor immediately.
- develop an eye infection, suffer an eye injury, undergo eye surgery, or develop a reaction that includes new or worsening symptoms.
Use in Children
There is limited experience with the use of dorzolamide/timolol (preservative-containing formulation) in infants and children.
Use in Elderly Patients
In studies with dorzolamide/timolol (preservative-containing formulation), the effects were similar in both elderly and younger patients.
Use in Patients with Hepatic Impairment
Inform your doctor if you have or have had liver problems in the past.
Other Medications and Dotimir
Dotimir may affect or be affected by other medications you are using, including other eye drops for the treatment of glaucoma.
Inform your doctor if you are using or plan to use medications to lower blood pressure, heart medications, or medications to treat diabetes.
Inform your doctor or pharmacist if you are using, have recently used, or may need to use any other medication.
This is particularly important if you are:
- taking medications to lower blood pressure or to treat heart diseases (such as calcium channel blockers, beta-blockers, or digoxin).
- taking medications to treat a heart rhythm disturbance, such as calcium channel blockers, beta-blockers, or digoxin.
- using another eye drop that contains beta-blockers.
- taking another carbonic anhydrase inhibitor such as acetazolamide.
- taking monoamine oxidase inhibitors (MAOIs).
- taking a parasymphathomimetic medication that may have been prescribed to help eliminate urine. Parasymphathomimetics are also a type of medication that is sometimes used to help restore normal bowel movements.
- taking narcotics such as morphine used to treat moderate to severe pain.
- taking medications to treat diabetes.
- taking antidepressants known as fluoxetine and paroxetine.
- taking a sulfonamide medication
- taking quinidine (used to treat heart disorders and some types of malaria).
Pregnancy and Breastfeeding
If you are pregnant or breastfeeding, think you may be pregnant, or plan to become pregnant, consult your doctor or pharmacist before using this medication.
Use During Pregnancy
Do not use Dotimir if you are pregnant unless your doctor considers it necessary.
Use During Breastfeeding
Do not use Dotimir if you are breastfeeding. Timolol may pass into breast milk. Consult your doctor before taking any medication during breastfeeding.
Driving and Using Machines
No studies have been conducted on the effects on the ability to drive or use machines. There are side effects associated with Dotimir, such as blurred vision, that may affect your ability to drive and/or operate machines. Do not drive or operate machines until you feel well or your vision is clear.
3. How to Use Dotimir
Follow your doctor's instructions for administering this medication exactly. If you are unsure, consult your doctor again. The appropriate dose and duration of treatment will be determined by your doctor.
Recommended Dose
The recommended dose is one drop in the affected eye(s) in the morning and at night.
If you are using Dotimir with another eye drop, the drops should be instilled at least 10 minutes apart.
Do not change the dose of the medication without consulting your doctor.
If you have difficulty administering the drops, seek help from a family member or caregiver.
Instructions for Use
Do not let the tip of the multidose container touch the eyes or the surrounding areas. This can cause damage to your eyes. The eye drop solution may be contaminated with bacteria that can cause eye infections leading to serious damage to the eyes, including loss of vision. To avoid possible contamination of the multidose container, wash your hands before using this medication and avoid letting the tip of the multidose container come into contact with any surface.
- Before the first application, write the date of opening on the space provided on the label of the bottle. Remove the protective cap before each application. Do not touch anything with the tip of the bottle.
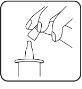
- Before the first application of the Dotimir bottle, press the pump mechanism several times (up to 10 times) to activate it until the first drop appears. Then, discard the first two drops as well. While doing this, hold the bottle upside down as shown in the figure. This only applies to the first application and is not necessary for all subsequent applications. Avoid any contact between the dropper tip, fingers, and eyes.
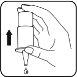
- Hold the bottle as shown in the image. Make sure your thumb rests on the circular, wide, and non-slip thumb rest.
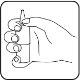
- Tilt your head slightly backwards (neck position) and use your free hand to gently pull the lower eyelid down. Apply one drop of Dotimir to the conjunctival sac of the affected eye by actuating the pump mechanism once. Make sure the bottle is kept vertical.
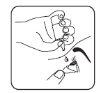
- Close your eye and press the inner corner of your eye with your finger for about two minutes. This helps prevent the medication from reaching the rest of the body.
- Repeat steps 3 and 4 to apply a drop to the other eye, if your doctor has instructed you to do so. Sometimes, only one eye needs to be treated, and your doctor will tell you if this applies to you and which eye needs treatment.
After using the multidose container, replace the protective cap. Clean any excess liquid from the skin around the eyes.
The bottle can be used for 2 months after opening. After this time, the bottle must be discarded, even if there is still solution left.
If You Use More Dotimir Than You Should
If you apply too many drops in the eye or swallow part of the contents of the bottle, among other effects, you may feel dizziness, have difficulty breathing, or notice that your heart beats more slowly. Contact your doctor immediately.
In case of overdose or accidental ingestion, consult your doctor or pharmacist immediately or call the Toxicology Information Service, phone: 91 562 04 20, indicating the medication and the amount ingested.
If You Forget to Use Dotimir
It is important to use Dotimir as your doctor has prescribed.
If you forget to apply a dose, you should administer it as soon as possible. However, if it is almost time for the next dose, do not administer the missed dose and continue with the scheduled dosing program as normal.
Do not use a double dose to make up for missed doses.
If You Stop Using Dotimir
If you want to stop using this medication, consult your doctor first.
If you have any other questions about the use of this medication, ask your doctor or pharmacist.
4. Possible Side Effects
Like all medications, this medication can cause side effects, although not everyone will experience them.
Severe side effects:
If you experience any of the following side effects, stop using this medication and seek immediate medical help, as these can be signs of a reaction to the medication.
Rare(may affect up to 1 in 1,000 people):
- Chest pain, edema (fluid accumulation), changes in heart rate or rhythm, congestive heart failure (heart disease with difficulty breathing and swelling of feet and legs due to fluid accumulation), cardiac arrest, heart block, low blood pressure, cerebral ischemia (reduced blood supply to the brain), stroke.
- Difficulty breathing, respiratory failure, constriction of airways in the lungs.
- Signs and symptoms of systemic allergic reactions, including angioedema, urticaria, pruritus, skin rash, and anaphylaxis.
- Severe skin reactions, including swelling under the skin.
Other side effects:
You can usually continue using the drops, unless the effects are severe. If you are concerned, consult your doctor or pharmacist. Do not stop using Dotimir without talking to your doctor.
The following side effects have been reported with dorzolamide/timolol eye drops or one of its components during clinical trials or post-marketing experience:
Very Common(may affect more than 1 in 10 people):
- Burning and stinging in the eyes, altered taste.
Common(may affect up to 1 in 10 people):
- Eye effects: redness in and around the eyes, tearing or itching in the eyes, corneal erosion (damage to the front layer of the eyeball), swelling and/or irritation in and around the eyes, sensation of having something in the eye, decreased corneal sensitivity (not noticing something entering the eye and not feeling pain), eye pain, dry eyes, blurred vision.
- General side effects: headache, sinusitis (feeling of tension or congestion in the nose), nausea, weakness/fatigue, fatigue.
Uncommon(may affect up to 1 in 100 people):
- Eye effects: inflammation of the iris, visual disturbances including refractive changes (due to the suspension of miotic therapy in some cases).
- General side effects: dizziness, depression, slow heart rate, fainting, difficulty breathing (dyspnea), indigestion, kidney stones.
Rare(may affect up to 1 in 1,000 people):
- Eye effects: temporary myopia that may resolve when treatment is discontinued, retinal detachment after filtration surgery that can cause visual disturbances, drooping eyelids (making the eye stay half-closed), double vision, crust formation on the eyelids, corneal swelling (with symptoms of visual disturbances), low eye pressure.
- General side effects: strong and/or irregular heartbeats, Raynaud's phenomenon, swelling or coldness of hands and feet and reduced circulation in arms and legs, leg cramps and/or leg pain when walking (claudication), cough, sore throat, dry mouth, insomnia, nightmares, memory loss, tingling or numbness of hands or feet, increased signs and symptoms of myasthenia gravis (muscle disorder), decreased sexual desire, systemic lupus erythematosus (an immune system disease that can cause inflammation of internal organs), ringing in the ears, rhinitis, nosebleeds, diarrhea, contact dermatitis, hair loss, skin rash with a white, silvery appearance (psoriasiform rash), Peyronie's disease (which can cause curvature of the penis), allergic reactions such as skin rash, urticaria, itching, and in rare cases, possible swelling of lips, eyes, and mouth, wheezing, or severe skin reactions (Stevens-Johnson syndrome, toxic epidermal necrolysis).
As with other eye medications, timolol is absorbed into the bloodstream. This can cause side effects similar to those observed with oral beta-blockers. The incidence of side effects after topical ophthalmic administration is lower than when medications, for example, are taken orally or injected. The additional side effects listed include reactions observed within the class of beta-blockers when used to treat eye conditions.
Frequency Not Known(frequency cannot be estimated from available data):
Low blood sugar levels, abdominal pain, vomiting, muscle pain not caused by exercise, sexual dysfunction, hallucinations, feeling of a foreign body in the eye (feeling that something is in the eye), increased heart rate, and increased blood pressure.
Reporting Side Effects
If you experience any side effects, consult your doctor, pharmacist, or report them directly through the Spanish Medication Surveillance System for Human Use: www.notificaRAM.es. By reporting side effects, you can help provide more information on the safety of this medication.
5. Storage of Dotimir
Keep this medication out of the sight and reach of children.
Do not use this medication after the expiration date stated on the carton and on the label of the bottle after EXP. The expiration date is the last day of the month indicated.
This medication does not require special storage conditions.
After the first opening of the bottle, the solution can be used for 2 months.
Medications should not be disposed of via wastewater or household waste. Deposit the containers and medications you no longer need at the SIGRE collection point in your pharmacy. If in doubt, ask your pharmacist how to dispose of containers and medications you no longer need. This will help protect the environment.
6. Container Content and Additional Information
Composition of Dotimir
- The active ingredients are dorzolamida and timolol.
Each ml contains 20 mg of dorzolamida (as 22.26 mg of dorzolamida hydrochloride) and 5 mg of timolol (as 6.83 mg of timolol maleate). Each drop (approximately 0.028 ml) contains approximately 0.56 mg of dorzolamida and 0.14 mg of timolol.
- The other components are hydroxyethylcellulose, mannitol, sodium citrate, sodium hydroxide, and water for injectable preparations.
Appearance of the Product and Container Content
Dotimir is a clear, colorless to almost colorless, and slightly viscous solution, presented in a white HDPE multidose container, with a dropper applicator (PP, HDPE, LDPE) and an HDPE cap, as well as an ergonomic PP applicator.
Container sizes:
1 bottle of 5 ml
1 bottle of 9 ml
2 bottles of 9 ml
Only some container sizes may be marketed.
Marketing Authorization Holder and Manufacturer
Marketing Authorization Holder
OmniVision GmbH
Lindberghstrasse 9
82178 Puchheim
Germany
Manufacturer
Tubilux Pharma S.p.A.
Via Costarica 20/22
00071 Pomezia
Italy
This medicinal product is authorized in the Member States of the European Economic Area under the following names:
Austria: DorzoComp-Vision sine 20 mg/ml + 5 mg/ml Augentropfen, Lösung
France: Dotimir 20 mg/5 mg par ml, collyre en solution
Germany: DorzoComp-Vision sine 20 mg/ml + 5 mg/ml Augentropfen, Lösung
Italy: Dotimir 20 mg/ml + 5 mg/ml collirio, soluzione
Spain: Dotimir 20 mg/ml + 5 mg/ml colirio en solución
Date of the Last Revision of this Leaflet: June 2025
Detailed information on this medicinal product is available on the website of the Spanish Agency for Medicines and Health Products (AEMPS) (http://www.aemps.gob.es/)
- Country of registration
- Active substance
- Prescription requiredYes
- Manufacturer
- This information is for reference only and does not constitute medical advice. Always consult a doctor before taking any medication. Oladoctor is not responsible for medical decisions based on this content.
- Alternatives to DOTIMIR 20 mg/mL + 5 mg/mL EYE DROPS SOLUTIONDosage form: EYEDROP, 10 mg/ml + 5 mg/mlActive substance: timolol, combinationsManufacturer: Novartis Europharm LimitedPrescription requiredDosage form: EYEDROP, 0.3 mg/ml + 5 mg/mlActive substance: timolol, combinationsManufacturer: Brill Pharma S.L.Prescription requiredDosage form: EYE DROP, 0.3 mg/ml + 5 mg/mlActive substance: timolol, combinationsManufacturer: Laboratorio Stada S.L.Prescription required
Online doctors for DOTIMIR 20 mg/mL + 5 mg/mL EYE DROPS SOLUTION
Discuss questions about DOTIMIR 20 mg/mL + 5 mg/mL EYE DROPS SOLUTION, including use, safety considerations and prescription review, subject to medical assessment and local regulations.
Frequently Asked Questions















