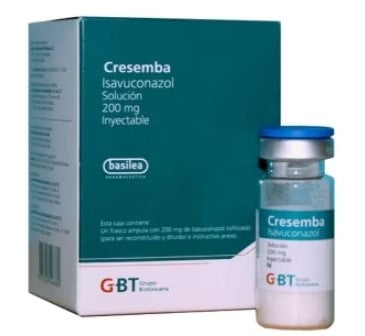
CRESEMBA 200 mg POWDER FOR CONCENTRATE FOR SOLUTION FOR INFUSION

How to use CRESEMBA 200 mg POWDER FOR CONCENTRATE FOR SOLUTION FOR INFUSION
Translated with AI
This page provides general information and does not replace a doctor’s consultation. Always consult a doctor before taking any medication. Seek urgent medical care if symptoms are severe.
Show originalContents of the leaflet
Introduction
Package Leaflet: Information for the Patient
Cresemba 200mg powder for concentrate for solution for infusion
isavuconazonium
Read all of this leaflet carefully before you start using this medicine because it contains important information for you.
- Keep this leaflet, you may need to read it again.
- If you have any further questions, ask your doctor, pharmacist, or nurse.
- If you experience any side effects, talk to your doctor, pharmacist, or nurse, even if they are not listed in this leaflet. See section 4.
Contents of the pack
- What is Cresemba and what is it used for
- What you need to know before you use Cresemba
- How to use Cresemba
- Possible side effects
- Storage of Cresemba
- Contents of the pack and other information
1. What is Cresemba and what is it used for
What is Cresemba
Cresemba is an antifungal medicine that contains the active substance isavuconazonium.
How Cresemba works
Isavuconazonium works by killing or stopping the growth of the fungus that causes the infection.
What Cresemba is used for
Cresemba is used in patients from 1 year of age to treat the following fungal infections:
- invasive aspergillosis, caused by a fungus of the 'Aspergillus' group,
- mucormycosis, caused by a fungus belonging to the 'Mucorales' group, in patients for whom treatment with amphotericin B is not appropriate.
2. What you need to know before you use Cresemba
Do not use Cresemba
- if you are allergic to isavuconazonium or any of the other ingredients of this medicine (listed in section 6),
- if you have a heart rhythm problem called 'short QT syndrome',
- if you are using any of the following medicines:
- ketoconazole, used for fungal infections,
- high doses of ritonavir (more than 200 mg every 12 hours), used for HIV,
- rifampicin, rifabutin, used for tuberculosis,
- carbamazepine, used for epilepsy,
- barbiturates such as phenobarbital, used for epilepsy and sleep disorders,
- phenytoin, used for epilepsy,
- St. John's Wort, a herbal medicine used for depression,
- efavirenz, etravirine, used for HIV,
- nafcillin, used for bacterial infections.
Warnings and precautions
Talk to your doctor, pharmacist, or nurse before you start using Cresemba:
- if you have had an allergic reaction to another antifungal treatment with 'azole', such as ketoconazole, fluconazole, itraconazole, voriconazole, or posaconazole in the past,
- if you have severe liver disease. Your doctor will monitor you for possible side effects.
Monitoring of side effects
Stop using Cresemba and call your doctor immediately if you notice any of the following side effects:
- sudden wheezing, difficulty breathing, swelling of the face, lips, mouth, or tongue, intense itching, sweating, dizziness, or fainting, rapid heartbeat or palpitations in the chest: these may be signs of a severe allergic reaction (anaphylaxis).
Problems with Cresemba and its administration by intravenous infusion (drip)
Call your doctor immediately if you notice any of the following side effects:
- low blood pressure, difficulty breathing, nausea, dizziness, headache, tingling, your doctor will decide whether to stop the infusion.
Changes in liver function
Cresemba may sometimes affect liver function. Your doctor may perform blood tests while you are taking this medicine.
Skin problems
Call your doctor immediately if you experience severe skin peeling, mouth, eyes, or genital areas.
Children and adolescents
Do not give Cresemba to children under 1 year of age, as there is no information on its use in this age group.
Other medicines and Cresemba
Tell your doctor or pharmacist if you are using, have recently used, or might use any other medicines. Some medicines may change the way Cresemba works or Cresemba may change the way other medicines work if taken at the same time.
In particular, do not take this medicine and tell your doctor or pharmacist if you are taking any of the following medicines:
- ketoconazole, used for fungal infections,
- high doses of ritonavir (more than 200 mg every 12 hours), used for HIV,
- rifampicin, rifabutin, used for tuberculosis,
- carbamazepine, used for epilepsy,
- barbiturates such as phenobarbital, used for epilepsy and sleep disorders,
- phenytoin, used for epilepsy,
- St. John's Wort, a herbal medicine used for depression,
- efavirenz, etravirine, used for HIV,
- nafcillin, used for bacterial infections.
Unless your doctor tells you otherwise, do not take this medicine and tell your doctor or pharmacist if you are taking any of the following medicines:
- rufinamide or any other medicine that reduces the QT interval on the electrocardiogram (ECG),
- aprepitant, used to prevent nausea and vomiting in cancer treatment,
- prednisone, used for rheumatoid arthritis,
- pioglitazone, used for diabetes.
Tell your doctor or pharmacist if you are taking any of the following medicines, as it may be necessary to adjust or monitor the dose to ensure that the medicines continue to have the desired effect:
- ciclosporin, tacrolimus, and sirolimus, used to prevent transplant rejection,
- cyclophosphamide, used for cancer,
- digoxin, used to treat heart failure or irregular heartbeat,
- colchicine, used to treat gout attacks,
- dabigatran etexilate, used to prevent blood clots after hip or knee replacement surgery,
- clarithromycin, used for bacterial infections,
- saquinavir, fosamprenavir, indinavir, nevirapine, lopinavir/ritonavir combination, used for HIV,
- alfentanil, fentanyl, used for severe pain,
- vincristine, vinblastine, used for cancer,
- mycophenolate mofetil (MMF), used in transplant patients,
- midazolam, used for severe insomnia and stress,
- bupropion, used for depression,
- metformin, used for diabetes,
- daunorubicin, doxorubicin, imatinib, irinotecan, lapatinib, mitoxantrone, topotecan, used for various types of cancer.
Pregnancy and breastfeeding
If you are pregnant or breastfeeding, think you may be pregnant, or plan to become pregnant, consult your doctor before using this medicine.
Do not take Cresemba if you are pregnant, unless your doctor tells you to. As it is not known whether it may affect or harm the fetus.
Cresemba should not be used during breastfeeding.
Driving and using machines
Cresemba may make you feel confused, tired, or sleepy. It may also cause fainting. Therefore, be very careful when driving or operating machinery.
3. How to use Cresemba
Cresemba will be administered under the direction of a doctor or nurse.
The recommended dose is as follows:
Initial dose during the first two days (every 8hours for the first 48hours)1 | Maintenance dose after the first two days (once a day)2 | |
Adults | 200 mg of isavuconazonium (1 vial) | 200 mg of isavuconazonium (1 vial) |
Adolescents and children between 1 and 18years of age | ||
Body weight <37 kg | 5.4 mg/kg of isavuconazonium | 5.4 mg/kg of isavuconazonium |
Body weight ≥37 kg | 200 mg of isavuconazonium (1 vial) | 200 mg of isavuconazonium (1 vial) |
1 Six administrations in total. 2 Starts between 12 and 24 hours after the last initial dose. |
This dose should be administered until your doctor tells you otherwise. The duration of treatment with Cresemba may be more than 6 months if your doctor considers it necessary.
Your doctor or nurse will administer the vial as an infusion into a vein.
If you use more Cresemba than you should
If you think you have been given too much Cresemba, talk to your doctor or nurse immediately. It may cause more side effects such as:
- headache, feeling dizzy, agitation, or sleepiness,
- tingling, decreased sensitivity, or tactile sensation,
- problems perceiving things, hot flashes, anxiety, joint pain,
- altered taste, dry mouth, diarrhea, stomach pain,
- palpitations, increased heart rate, increased sensitivity to light.
If you miss a dose of Cresemba
Since this medicine is administered under close medical supervision, it is unlikely that you will miss a dose. However, tell your doctor or nurse if you think you have missed a dose.
If you stop treatment with Cresemba
Treatment with Cresemba will continue for the time that your doctor indicates. This is to ensure that the fungal infection has disappeared.
If you have any other questions about the use of this medicine, ask your doctor, pharmacist, or nurse.
4. Possible side effects
Like all medicines, this medicine can cause side effects, although not everybody gets them.
Stop using Cresemba and call your doctor immediately if you notice any of the following side effects:
- a severe allergic reaction (anaphylaxis) such as sudden wheezing, difficulty breathing, swelling of the face, lips, mouth, or tongue, intense itching, sweating, dizziness, or fainting, rapid heartbeat or palpitations in the chest.
Call your doctor immediately if you notice any of the following side effects:
- severe skin peeling, mouth, eyes, or genital areas.
Other side effects
Tell your doctor, pharmacist, or nurse if you notice any of the following side effects:
Common:may affect up to 1 in 10 people
- reduced potassium levels in the blood,
- decreased appetite,
- confusion (delirium),
- headache,
- sleepiness,
- inflamed veins that can cause blood clots,
- sudden shortness of breath or severe respiratory problems,
- nausea, vomiting, diarrhea, and stomach pain,
- changes in liver function blood tests,
- skin rash, itching,
- kidney failure (symptoms may include swelling of the legs),
- chest pain, feeling tired or sleepy,
- problems at the injection site.
Uncommon:may affect up to 1 in 100 people
- reduced white blood cell count, may increase the risk of infection and fever,
- reduced platelet count, may increase the risk of bleeding or bruising,
- reduced red blood cell count, may make you feel weak or short of breath or pale,
- severe reduction in the number of blood cells, may make you feel weak, cause bruising, or increase the likelihood of infections,
- skin rash, swelling of the lips, mouth, tongue, or throat with difficulty breathing (hypersensitivity),
- low blood sugar levels,
- low magnesium levels in the blood,
- low levels of a protein called 'albumin' in the blood,
- malnutrition,
- low sodium levels in the blood (hyponatremia),
- depression, difficulty sleeping,
- stroke, fainting, or feeling faint, dizziness,
- tingling, numbness, or prickling sensation on the skin (paresthesia),
- mental changes (encephalopathy),
- altered taste (dysgeusia),
- 'spinning' sensation or dizziness (vertigo),
- heart rhythm problems, may be too fast or irregular, or extra heartbeat, this may appear on your electrocardiogram or ECG,
- circulatory problems,
- low blood pressure,
- wheezing, rapid breathing, coughing up blood or bloody sputum, nosebleeds,
- indigestion,
- constipation,
- abdominal swelling (abdominal distension),
- enlargement of the liver,
- liver inflammation,
- skin problems, red or purple spots on the skin (petechiae), skin inflammation, hair loss,
- back pain,
- swelling of the limbs,
- feeling weak, very tired, sleepy, feeling unwell (malaise).
Side effects with unknown frequency:
- anaphylaxis (severe allergic reaction).
Reporting of side effects
If you experience any side effects, talk to your doctor, pharmacist, or nurse, even if they are not listed in this leaflet. You can also report side effects directly through the national reporting system included in Appendix V. By reporting side effects, you can help provide more information on the safety of this medicine.
5. Storage of Cresemba
Keep this medicine out of the sight and reach of children.
Do not use this medicine after the expiry date which is stated on the label after EXP. The expiry date is the last day of the month stated.
Store in a refrigerator (between 2 °C and 8 °C).
Medicines should not be disposed of via wastewater or household waste. Ask your pharmacist how to dispose of medicines no longer required. This will help protect the environment.
6. Container contents and additional information
Composition of Cresemba
- The active substance is isavuconazole. Each vial contains 372.6 mg of isavuconazonium sulfate, equivalent to 200 mg of isavuconazole.
- The other ingredients (excipients) are: mannitol (E421) and sulfuric acid.
Appearance of Cresemba and container contents
Cresemba 200 mg is presented in a single-use glass vial as a powder for concentrate for solution for infusion.
Marketing authorization holder:
Basilea Pharmaceutica Deutschland GmbH
Marie-Curie-Strasse 8
79539 Lörrach
Germany
Manufacturer:
Almac Pharma Services (Ireland) Limited
Finnabair Industrial Estate
Dundalk, Co. Louth
A91 P9KD
Ireland
Almac Pharma Services Limited
Seagoe Industrial Estate
Craigavon, Co. Armagh
BT63 5UA
United Kingdom (Northern Ireland)
For further information about this medicinal product, please contact the local representative of the marketing authorization holder:
België/Belgique/Belgien Pfizer SA/NV Tel/Tél: +32 (0)2 554 62 11 | Lietuva Pfizer Luxembourg SARL filialas Lietuvoje Tel: +3705 2514000 |
| Luxembourg/Luxemburg Pfizer SA/NV Tél/Tel: +32 (0)2 554 62 11 |
Ceská republika Pfizer s.r.o. Tel: +420-283-004-111 | Magyarország Pfizer Kft. Tel.: + 36 1 488 37 00 |
Danmark Unimedic Pharma AB Tlf.: +46 (0) 10-130 99 50 | Malta Vivian Corporation Ltd. Tel: +35621 344610 |
Deutschland PFIZER PHARMA GmbH Tel: +49 (0)30 550055-51000 | Nederland Pfizer bv Tel: +31 (0)800 63 34 636 |
Eesti Pfizer Luxembourg SARL Eesti filiaal Tel: +372 666 7500 | Norge Unimedic Pharma AB Tlf: +46 (0) 10-130 99 50 |
Ελλάδα Pfizer ΕΛΛΑΣ A.E. Τηλ: +30 210 67 85 800 | Österreich Pfizer Corporation Austria Ges.m.b.H. Tel: +43 (0)1 521 15-0 |
España Pfizer S.L. Tel: +34 91 490 99 00 | Polska Pfizer Polska Sp. z o.o. Tel.: +48 22 335 61 00 |
France Pfizer Tél: +33 (0)1 58 07 34 40 | Portugal Laboratórios Pfizer, Lda. Tel: +351 21 423 5500 |
Hrvatska Pfizer Croatia d.o.o. Tel: +385 1 3908 777 | România Pfizer România S.R.L. Tel: +40 (0) 21 20 728 00 |
Ireland Pfizer Healthcare Ireland Unlimited Company Tel: +1800 633 363 (toll free) +44 (0)1304 616161 | Slovenija Pfizer Luxembourg SARL Pfizer, podružnica za svetovanje s podrocja farmacevtske dejavnosti, Ljubljana Tel: + 386 (0) 1 52 11 400 |
Ísland Unimedic Pharma AB Sími: +46 (0) 10-130 99 50 | Slovenská republika Pfizer Luxembourg SARL, organizacná zložka Tel: +421-2-3355 5500 |
Italia Pfizer S.r.l. Tel: +39 06 33 18 21 | Suomi/Finland Unimedic Pharma AB Puh/Tel: +46 (0) 10-130 99 50 |
Κύπρος Pfizer ΕΛΛΑΣ Α.Ε. (CYPRUS BRANCH) Τηλ: +357 22 817690 | Sverige Unimedic Pharma AB Tel: +46 (0) 10-130 99 50 |
Latvija Pfizer Luxembourg SARL filiale Latvija Tel: +371 670 35 775 |
Date of last revision of this leaflet:
Other sources of information
Detailed information on this medicinal product is available on the European Medicines Agency website: https://www.ema.europa.eu. There are also links to other websites on rare diseases and orphan medicines.
--------------------------------------------------------------------------------------------------------------------
This information is intended for healthcare professionals only:
Cresemba 200 mg powder for concentrate for solution for infusion should be reconstituted and diluted before infusion.
Reconstitution
To reconstitute a vial of powder for concentrate for solution for infusion, 5 ml of water for injections should be added to the vial. The reconstituted concentrate contains 40 mg of isavuconazole per ml. The vial should be shaken until the powder is completely dissolved. The reconstituted solution should be inspected visually for particulate matter and discoloration. The reconstituted concentrate should be clear and free of visible particles. It should be diluted before administration.
Dilution
Adults and pediatric patients weighing more than 37 kg:
After reconstitution, the entire contents of the reconstituted concentrate should be withdrawn from the vial and added to an infusion bag containing 250 ml of sodium chloride 9 mg/ml (0.9%) injection solution or dextrose 50 mg/ml (5%) solution. The infusion solution contains approximately 0.8 mg of isavuconazole per ml.
Pediatric patients weighing less than 37 kg:
The final concentration of the infusion solution should be within the range of 0.4 to 0.8 mg/ml of isavuconazole. Higher concentrations should be avoided, as they may cause irritation at the infusion site.
To achieve the final concentration, the appropriate volume of the reconstituted concentrate should be withdrawn from the vial according to the dosing recommendations for pediatric patients (see section 3) and added to an infusion bag containing the appropriate amount of diluent. The appropriate volume of the infusion bag is calculated as follows:
[Dose required (mg)/final concentration (mg/ml)] – Volume of concentrate (ml)
The concentrate can be diluted with sodium chloride 9 mg/ml (0.9%) injection solution or dextrose 50 mg/ml (5%) solution.
Administration
After dilution of the reconstituted concentrate, the diluted solution may exhibit fine white to translucent particles of isavuconazole that do not settle (but will be removed by in-line filtration). The diluted solution should be gently mixed, or the bag can be rolled to minimize particle formation. Avoid excessive shaking and agitation of the solution. The infusion solution should be administered through an infusion set with an in-line filter (pore size 0.2 μm to 1.2 μm) made of polyethersulfone (PES). Infusion pumps can be used and should be placed before the infusion set. Regardless of the size of the infusion solution container used, the entire volume of the container should be administered to ensure that the full dose is delivered.
Isavuconazole should not be administered by infusion in the same line or cannula with other intravenous products.
Chemical and physical stability has been demonstrated for 24 hours at 2°C to 8°C, or 6 hours at room temperature, after reconstitution and dilution.
From a microbiological point of view, the product should be used immediately. If not used immediately, the in-use storage times and conditions are the responsibility of the user and normally should not be longer than 24 hours at 2 to 8°C, unless reconstitution and dilution are performed in validated and controlled aseptic conditions.
If possible, intravenous administration of isavuconazole should be completed within 6 hours after reconstitution and dilution at room temperature. If this is not possible, after dilution, the infusion solution should be refrigerated immediately, and infusion should be completed within 24 hours.
An existing intravenous line should be flushed with sodium chloride 9 mg/ml (0.9%) injection solution or dextrose 50 mg/ml (5%) solution before administration.
This medicinal product is for single use only. Partially used vials should be discarded.
- Country of registration
- Active substance
- Prescription requiredYes
- Manufacturer
- This information is for reference only and does not constitute medical advice. Always consult a doctor before taking any medication. Oladoctor is not responsible for medical decisions based on this content.
- Alternatives to CRESEMBA 200 mg POWDER FOR CONCENTRATE FOR SOLUTION FOR INFUSIONDosage form: CAPSULE, 100 mg (equivalent to 186.3 mg isavuconazole sulfate)Active substance: isavuconazoleManufacturer: Basilea Pharmaceutica Deutschland GmbhPrescription requiredDosage form: CAPSULE, 40 mgActive substance: isavuconazoleManufacturer: Basilea Pharmaceutica Deutschland GmbhPrescription requiredDosage form: CAPSULE, 100 mgActive substance: itraconazoleManufacturer: Esteve Pharmaceuticals S.A.Prescription required
Online doctors for CRESEMBA 200 mg POWDER FOR CONCENTRATE FOR SOLUTION FOR INFUSION
Discuss questions about CRESEMBA 200 mg POWDER FOR CONCENTRATE FOR SOLUTION FOR INFUSION, including use, safety considerations and prescription review, subject to medical assessment and local regulations.
Frequently Asked Questions