CLINIMIX N12G20 SOLUTION FOR INFUSION

How to use CLINIMIX N12G20 SOLUTION FOR INFUSION
Translated with AI
This page provides general information and does not replace a doctor’s consultation. Always consult a doctor before taking any medication. Seek urgent medical care if symptoms are severe.
Show originalContents of the leaflet
Introduction
Package Leaflet: Information for the Patient
Clinimix N12G20 Solution for Infusion
Read all of this leaflet carefully before starting treatment with this medicine, because it contains important information for you.
- Keep this leaflet, you may need to read it again.
- If you have any further questions, ask your doctor or nurse.
- If you experience any side effects, talk to your doctor or nurse, even if they are not listed in this leaflet. See section 4.
Contents of the Package Leaflet:
- What is CLINIMIX and what is it used for
- What you need to know before taking CLINIMIX
- How to take CLINIMIX
- Possible side effects
- Storage of CLINIMIX
- Contents of the pack and further information
1. What is Clinimix and what is it used for
CLINIMIX is a solution for infusion. It is supplied in a bag with 2 compartments. One compartment contains an amino acid solution and the second contains a glucose solution. The compartments are separated by a non-permanent seal. The contents of the compartments must be mixed immediately before administration by rolling the top of the bag to open the seals.
CLINIMIX is administered to feed adults and children through a tube connected to a vein when normal feeding by mouth is not suitable.
CLINIMIX should only be administered under medical supervision.
2. What you need to know before taking Clinimix
CLINIMIX must not be administered if:
- you are allergic to the active substances or to any of the other components of this medicine (listed in section 6),
- your body has problems using certain amino acids,
- you have too much sugar in your blood (severe hyperglycemia),
- your blood is too acidic (metabolic acidosis due to excess lactate),
In all cases, your doctor will decide whether you should be given this medicine based on factors such as age, weight, and clinical condition, along with the results of all tests performed.
Warnings and precautions
Talk to your doctor or nurse before they administer CLINIMIX to you.
If any abnormal signs or symptoms of an allergic reaction occur, such as fever, chills, skin rash, or difficulty breathing, excessive sweating, nausea, and headache, tell your doctor or nurse: the infusion will be stopped immediately. Your doctor will monitor your condition while you are being given this medicine and may change the dose or add other nutrients, such as lipids, vitamins, electrolytes, and trace elements if considered necessary.
Certain medicines and diseases can increase the risk of developing an infection or sepsis (bacteria in the blood). There is a special risk of infection or sepsis when a tube (intravenous catheter) is placed in your vein. Your doctor will carefully monitor you for any signs of infection. The use of aseptic techniques (germ-free) when placing and maintaining the catheter and when preparing the nutritional formula can reduce the risk of infection.
If you are severely malnourished to the point of needing to receive nutrition through a vein, it is recommended that parenteral nutrition be started slowly and with caution.
Your doctor will monitor your condition at the start of the infusion, especially if you currently have liver, kidney, adrenal, heart, or circulation problems. Your doctor should also be aware of serious conditions that affect how your body handles sugars, fats, proteins, or salts (metabolic disorders). If any abnormal signs occur, including venous irritation, the infusion should be stopped.
To check the effectiveness and safety of the administration, your doctor will perform laboratory and clinical tests while you are being given this medicine. If you are given this medicine for several weeks, your blood will be regularly analyzed. In particular, in case of glucose intolerance, blood glucose and urine glucose will be routinely monitored, and if you are a diabetic patient, the insulin dose may need to be adjusted.
Children and adolescents
When used in newborns and children under 2 years of age, the solution (in the bags and administration equipment) must be protected from light exposure until administration is complete. Exposure of Clinimix to ambient light, especially after mixing with trace elements and/or vitamins, generates peroxides and other degradation products that can be reduced by protecting against light exposure.
Interaction of CLINIMIX with other medicines
Tell your doctor or nurse if you are taking or have recently taken or may need to take any other medicines.
Pregnancy, breastfeeding, and fertility
If you are pregnant or breastfeeding, or think you may be pregnant or plan to become pregnant, consult your doctor before using this medicine.
3. How to take Clinimix
Before administering the product, the non-permanent seal between the two compartments must be broken and the contents of both mixed.
CLINIMIX can be administered to adults and children.
When used in children under 2 years of age, the solution (in the bags and administration equipment) must be protected from light exposure until administration is complete (see section 2).
This is a solution for infusion that is administered through a plastic tube connected to a vein in your arm or a large vein in your chest.
Dose – Adults and children
Your doctor will decide the dose you need and the duration of administration, based on age, weight, height, clinical condition, daily fluid volume, and energy and nitrogen needs.
Follow your doctor's instructions for administering CLINIMIX exactly. If you have any doubts, consult your doctor.
Administration can continue for as long as necessary, depending on your clinical condition.
Infusion of a bag usually lasts between 8 and 24 hours.
If you are given too much CLINIMIX
If the administered dose is too high or the infusion too rapid, it can cause your blood circulation volume to increase or your blood to become too acidic. The glucose content can increase your blood and urine glucose levels. Excessive administration can cause nausea, vomiting, tremors, and electrolyte disturbances. In these situations, the infusion must be stopped immediately.
In severe cases, your doctor may need to perform temporary renal dialysis to help your kidneys eliminate excess product.
To avoid these cases, your doctor will regularly monitor your condition and analyze your blood parameters.
If you have any further questions about the use of this product, ask your doctor.
4. Possible side effects
Like all medicines, this medicine can cause side effects, although not everybody gets them. If you notice any change in the way you feel during or after treatment, tell your doctor or nurse immediately.
The tests your doctor will perform while you are being given this medicine should minimize the risk of side effects.
The infusion will be stopped immediately if any abnormal signs or symptoms of an allergic reaction occur, such as abnormally high or low blood pressure, the appearance of a blue or purple skin color, abnormally high heart rate, difficulty breathing, vomiting, nausea, skin rash, increased body temperature, excessive sweating, and chills.
Other side effects have been observed, which occur more or less frequently:
- Anaphylaxis (a severe allergic reaction that can cause death).
- High levels of glucose, ammonia, and nitrogen-containing compounds in the blood.
- Impaired liver function, abnormal liver function blood tests.
- Inflammation of the gallbladder, presence of gallstones in the gallbladder.
- Inflammation of the veins at the infusion site, venous irritation, pain, irritation, burning, swelling.
- Presence of glucose in the urine.
- Diabetic coma
- Formation of small particles that block the pulmonary blood vessels.
Reporting of side effects:
If you experience any side effects, talk to your doctor or nurse, even if they are not listed in this leaflet. You can also report them directly through the Spanish Pharmacovigilance System for Human Use Medicines: https://www.notificaram.es. By reporting side effects, you can help provide more information on the safety of this medicine.
5. Storage of Clinimix
Keep this medicine out of the sight and reach of children.
When used in newborns and children under 2 years of age, the solution (in the bags and administration equipment) must be protected from light exposure until administration is complete (see section 2).
Do not use this medicine after the expiry date which is stated on the packaging and outer packaging (MM/YYYY). The expiry date is the last day of the month indicated.
Do not freeze.
Keep the container in the outer packaging.
Do not throw away any medicines via wastewater or household waste. Ask your pharmacist how to throw away medicines you no longer use. These measures will help protect the environment.
6. Container Contents and Additional Information
Clinimix Composition
The active principles of each bag of the reconstituted solution are:
Active Principles | 1 l | 1.5 l | 2 l |
L-alanine | 7.25 g | 10.87 g | 14.49 g |
L-arginine | 4.03 g | 6.04 g | 8.05 g |
Glycine | 3.61 g | 5.41 g | 7.21 g |
L-histidine | 1.68 g | 2.52 g | 3.36 g |
L-isoleucine | 2.10 g | 3.15 g | 4.20 g |
L-leucine | 2.56 g | 3.83 g | 5.11 g |
L-lysine (as lysine hydrochloride) | 2.03 g (2.54 g) | 3.05 g (3.80 g) | 4.06 g (5.07 g) |
L-methionine | 1.40 g | 2.10 g | 2.80 g |
L-phenylalanine | 1.96 g | 2.94 g | 3.92 g |
L-proline | 2.38 g | 3.57 g | 4.76 g |
L-serine | 1.75 g | 2.63 g | 3.50 g |
L-threonine | 1.47 g | 2.21 g | 2.94 g |
L-tryptophan | 0.63 g | 0.95 g | 1.26 g |
L-tyrosine | 0.14 g | 0.21 g | 0.28 g |
L-valine | 2.03 g | 3.05 g | 4.06 g |
Anhydrous glucose (as glucose monohydrate) | 100 g (110 g) | 150 g (165 g) | 200 g (220 g) |
The other components are:
- acetic acid, hydrochloric acid (for pH adjustment of the solution),
- water for injectable preparations.
Appearance of CLINIMIX and Container Contents
CLINIMIX is an infusion solution presented in a multilayer plastic bag with two chambers. The material of the inner layer (in contact) of the bag is made of polymers (a mixture of polyolefin copolymers) to be compatible with the components and authorized additives. Other layers are made of EVA (polyethylene-vinyl acetate) and a copolyester.
Before reconstitution, the glucose and amino acid solutions are transparent, colorless, or slightly yellowish. After reconstitution, the solution is also transparent, colorless, or slightly yellowish.
To avoid contact with air oxygen, the bag is packaged inside an outer bag that acts as an oxygen barrier, which contains an oxygen absorber.
Container Sizes
1000 ml bag: cardboard box with 8 bags
1 bag of 1000 ml
1500 ml bag: cardboard box with 6 bags
1 bag of 1500 ml
2000 ml bag: cardboard box with 4 bags
1 bag of 2000 ml
Only some container sizes may be marketed.
Marketing Authorization Holder
Baxter S.L.
Pouet de Camilo 2,
46394 Ribarroja del Turia (Valencia) Spain
Manufacturer
Baxter SA, Boulevard René Branquart, 80, 7860 Lessines, Belgium
This medicinal product is authorized in the Member States of the European Economic Area under the following names:
Clinimix N12G20, solution for infusion
The last revision of this leaflet was in September 2021
Detailed information on this medicinal product is available on the website of the Spanish Agency for Medicines and Health Products (AEMPS) http://www.aemps.gob.es/
-------------------------------------------------------------------------------------------------------------------
This information is intended only for healthcare professionals:
- Quantitative composition
After mixing the contents of the two compartments, the composition of the binary mixture for all available bag sizes provides the following:
1 l | 1.5 l | 2 l | |
Nitrogen (g) Amino acids (g) Glucose (g) | 5.8 35 100 | 8.7 53 150 | 11.6 70 200 |
Total calories (kcal) Glucose calories (kcal) | 540 400 | 810 600 | 1080 800 |
Acetate (mmol) Chloride (mmol) | 27 15 | 41 22 | 54 29 |
pH Osmolality (mOsm/l) | 6 920 |
- Dosage and administration.
Before administering the product, the non-permanent seal between the two compartments must be broken and the contents of both must be mixed.
Dose and infusion rate
The dose must be individualized according to the patient's nutritional/liquid needs, energy expenditure, clinical status, body weight, and ability to metabolize Clinimix components, as well as any additional energy or proteins administered orally/enterally. Additionally, daily fluid, nitrogen, and energy needs decrease continuously with age.
In adults, needs range from 0.16 g of nitrogen/kg/day (approximately 1 g of amino acid/kg/day) to 0.32 g of nitrogen/kg/day (approximately 2 g of amino acid/kg/day).
In infants, needs range from 0.16 g of nitrogen/kg/day (approximately 1 g of amino acid/kg/day) to 0.40 g of nitrogen/kg/day (approximately 2.5 g of amino acid/kg/day).
In adults and patients 12 to 18 years old, calorie needs range from 25 kcal/kg/day to 40 kcal/kg/day, depending on the patient's nutritional status and level of catabolism. Patients under 12 years old may have higher requirements.
There may be clinical situations where patients require amounts of nutrients that differ from the composition of Clinimix. In this situation, any volume adjustment (dose) must take into account the resulting effect on the dosing of all other nutritional components of Clinimix. The speed and volume of infusion must be established by a prescribing physician with experience in pediatric intravenous fluid therapy.
This medicinal product does not contain the amino acids cysteine and taurine, considered conditionally essential for neonates and infants.
This medicinal product is not recommended for premature, full-term newborns, and children under 2 years old.
The administration rate must be adjusted based on the dose, the characteristics of the infused solution, the total volume intake in 24 hours, and the duration of the infusion.
The infusion time must be more than 8 hours. Normally, the administration rate is gradually increased during the first hour without exceeding 2.5 ml per kilogram of body weight per hour, and the maximum dose is 40 ml per kilogram of body weight per day.
Administration method
When used in newborns and children under 2 years old, the solution (in bags and administration equipment) must be protected from light exposure until administration is completed.
Route of administration
It will be administered by peripheral or central intravenous route, depending on the final osmolality of the mixture. In general, the accepted limit for peripheral infusion is approximately 800 mOsm/l, but it varies considerably depending on age, patient's general condition, and characteristics of peripheral veins.
- Special warnings and precautions for use
WARNINGS
With CLINIMIX formulations, hypersensitivity/perfusion reactions have been reported, including hypotension, hypertension, peripheral cyanosis, tachycardia, dyspnea, vomiting, nausea, urticaria, skin rash, pruritus, erythema, hyperhidrosis, fever, and chills.
Anaphylaxis has been reported with other parenteral nutrition products.
Special clinical monitoring is necessary when starting any intravenous infusion. If any abnormal sign or symptom occurs, for example, a hypersensitivity reaction or perfusion reaction, the infusion must be interrupted immediately.
Solutions containing glucose should be used with caution, in any case, in patients with known allergy to corn or corn-derived products.
Vascular pulmonary precipitates have been reported in patients receiving parenteral nutrition.
In some cases, fatal outcomes have occurred. Excessive addition of calcium and phosphate increases the risk of calcium phosphate precipitate formation. Precipitates have been reported even in the absence of phosphate salt in the solution. Distal precipitation in the in-line filter has also been reported and is suspected in vivo precipitate formation.
If signs of pulmonary distress occur, the infusion must be interrupted and a medical evaluation initiated.
In addition to inspecting the solution, the infusion equipment and catheter must also be periodically checked for precipitates.
The use of intravenous catheters to administer parenteral formulations, poor catheter maintenance, or contaminated solutions can lead to infection and sepsis.
Immunosuppression and other factors, such as hyperglycemia, malnutrition, and/or underlying disease, may predispose patients to infectious complications.
Symptomatic care and laboratory monitoring of fever/chills, leukocytosis, technical complications with the access device, and hyperglycemia can help recognize early infections.
The occurrence of septic complications can be reduced by placing greater emphasis on using aseptic technique in catheter placement, maintenance, and preparation of the nutritional formula.
Refeeding severely malnourished patients can lead to refeeding syndrome, characterized by changes in potassium, phosphorus, and magnesium intracellularly as the patient becomes anabolic. Thiamine deficiency and fluid retention may also occur. Strict monitoring and gradual intake of nutrients, avoiding overfeeding, can prevent these complications.
Hypertonic solutions can cause venous irritation if infused through a peripheral vein. The choice of a peripheral or central vein depends on the final osmolality of the mixture.
The generally accepted limit for peripheral infusion is around 800 mOsm/l, but it varies considerably with age and the patient's general condition and characteristics of peripheral veins.
Do not connect plastic containers in series to avoid gaseous embolism due to possible residual air contained in the primary container.
PRECAUTIONS
Before starting the infusion, severe alterations in water and electrolyte balance, severe fluid overload, and severe metabolic disorders must be corrected.
Metabolic complications can occur if nutrient intake is not adapted to the patient's requirements or the metabolic capacity of any food component is not accurately assessed. Adverse metabolic effects can occur due to inadequate or excessive administration of nutrients or an inappropriate mixture composition for the patient's specific needs.
Frequent clinical evaluations and laboratory tests are essential for proper control during administration. These will include ionogram determination and kidney and liver function tests.
The electrolyte needs of patients receiving these solutions must be carefully determined and controlled, especially in the case of solutions without electrolytes.
Glucose intolerance is a common metabolic complication in severely stressed patients. Infusion of this solution can cause hyperglycemia, glucosuria, and hyperosmolar syndrome. Blood and urine glucose must be routinely monitored, and if necessary, the insulin dose must be adjusted for diabetics.
Use with caution in patients with renal insufficiency, especially if hyperkalemia is present, due to the risk of metabolic acidosis and hyperazotemia if extra-renal waste elimination is not performed. The state of fluids and electrolytes must be carefully monitored in these patients. In case of severe renal insufficiency, specially formulated amino acid solutions should be chosen.
Cautious administration of Clinimix is recommended in patients with adrenal insufficiency.
Circulatory overload should be avoided, especially in patients with pulmonary edema, insufficiency, and/or heart failure. The fluid status must be carefully monitored.
In addition to routine liver function tests, in patients with pre-existing liver disease or liver insufficiency, possible symptoms of hyperammonemia must be monitored.
It is known that in some patients with parenteral nutrition, hepatobiliary disorders, including cholestasis, hepatic steatosis, fibrosis, and cirrhosis, can occur, which can lead to liver failure, as well as cholecystitis and cholelithiasis. The etiology of these disorders is believed to be multifactorial and may differ between patients. Those who develop abnormal laboratory parameters or other signs of hepatobiliary disorders must be rapidly evaluated by a clinical expert in liver diseases to identify possible causal and contributing factors and potential therapeutic and prophylactic interventions.
In patients receiving amino acid solutions, an increase in blood ammonia levels and hyperammonemia can occur. In some patients, this may indicate the presence of a congenital disorder of amino acid metabolism (see Section 4.3 of the Summary of Product Characteristics) or liver insufficiency.
Blood ammonia should be frequently measured in newborns and infants to detect hyperammonemia, which may indicate the presence of a congenital abnormality of amino acid metabolism.
Depending on the degree and etiology, hyperammonemia may require immediate intervention.
Too rapid infusion of amino acids can cause nausea, vomiting, and chills. In these cases, the infusion must be interrupted immediately.
In general, the dose for elderly patients should be cautious, taking into account the higher frequency of liver, kidney, or heart insufficiency and concomitant diseases or pharmacotherapy.
Pediatric population
- No studies have been conducted in the pediatric population.
- See above regarding monitoring of hyperammonemia in pediatric patients.
Exposure of parenteral nutrition solutions for intravenous use, especially after mixing with trace elements or vitamins, can have adverse effects on the clinical outcome of newborns due to the generation of peroxides and other degradation products. When used in newborns and children under 2 years old, Clinimix must be protected from ambient light until administration is completed.
- Practical information on preparation and handling
Caution: Administer the product only after breaking the seal and mixing the contents of the two compartments
1. |
| 2. |
| 3. |
|
Break from the top to open the outer bag. | Remove the front of the outer bag to access the Clinimix bag. Discard the outer bag and the packet with the oxygen absorber. | Place the bag on a horizontal and clean surface with the handle in front of you. | |||
4. |
| 5. |
| 6. |
|
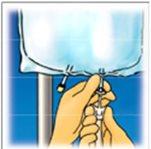
Lift the hanger area to remove the solution from the top of the bag. Roll the bag firmly until the seal is completely open (approximately halfway). | Mix the contents by inverting the bag at least 3 times. | Hang the bag. Turn the protector to remove it from the administration port. Firmly connect the spike connector. |
Use the solution only if it is transparent, colorless, or slightly yellowish, and if the container is not damaged.
CLINIMIX must be at room temperature before use.
Activation of CLINIMIX can be performed in the outer bag or once it has been removed.
For single use.
Do not store partially used containers and discard all equipment after use.
Do not reconnect a partially used bag.
Do not connect in series.
When used in newborns and children under 2 years old, it must be protected from light exposure until administration is completed. Exposure of Clinimix to ambient light, especially after mixing with trace elements or vitamins, generates peroxides and other degradation products that can be reduced if the product is protected from light exposure.
Supplementation
Lipids, vitamins, and trace elements should be provided to patients receiving parenteral nutrition for a long period.
If administration is necessary,
When adding additives, compatibilities should be checked and the stability of the mixtures controlled.
Supplementation can be done after opening the non-permanent seals for all additives (once the two solutions have been mixed). CLINIMIX can be supplemented with:
- Lipid emulsions (e.g. ClinOleic) at a rate of 50 to 250 ml per liter of CLINIMIX
CLINIMIX N12G20 1 l + 100 ml of Lipids 20% | CLINIMIX N12G20 1.5 l + 250 ml of Lipids 20% | CLINIMIX N12G20 2 l + 250 ml of Lipids 20% | |
Nitrogen (g) Amino acids (g) Glucose (g) Lipids (g) | 5.8 35 100 20 | 8.7 53 150 50 | 11.6 70 200 50 |
Total calories (kcal) Glucose calories (kcal) Lipid calories (kcal) Glucose/lipid ratio | 740 400 200 67/33 | 1310 600 500 55/45 | 1580 800 500 62/38 |
Acetate (mmol) Chloride (mmol) | 27 15 | 41 22 | 54 29 |
pH Osmolarity (mOsm/l) | 6 860 | 6 830 | 6 850 |
- Electrolytes: per liter of CLINIMIX
Up to a final concentration of | Sodium | Potassium | Magnesium | Calcium |
80 mmol | 60 mmol | 5.6 mmol | 3.0 mmol |
- Trace elements: per liter of CLINIMIX
Up to a final concentration of | Copper | 10 μmol | Zinc | 77 μmol |
Chromium | 0.14 μmol | Manganese | 2.5 μmol | |
Fluorine | 38 μmol | Cobalt | 0.0125 μmol | |
Selenium | 0.44 μmol | Molybdenum | 0.13 μmol | |
Iodine | 0.5 μmol | Iron | 10 μmol |
- Vitamins: per liter of CLINIMIX
Up to a final concentration of | Vitamin A | 1750 IU | Biotin | 35 μg |
Vitamin B6 | 2.27 mg | Vitamin B1 | 1.76 mg | |
Vitamin D | 110 IU | Folic acid | 207 μg | |
Vitamin B12 | 3.0 μg | Vitamin B2 | 2.07 mg | |
Vitamin E | 5.1 mg | Vitamin C | 63 mg | |
Vitamin PP | 23 mg | Vitamin B5 | 8.63 mg | |
Vitamin K | 75 μg |
Stability data for the supplementation of CLINIMIX with other commercially available lipid emulsions and other additives or nutrients are available upon request.
If a slight cream formation is observed, mix the mixture completely by gentle agitation to obtain a uniform emulsion before perfusion.
Additions should be made under aseptic conditions.
Additions can be made with a syringe or with a transfer equipment.
- Addition with syringe or transfer equipment with needle.
- Prepare the injection point (the single tube, see figure 1).
- Puncture the tube and inject.
- Mix the solution and additives.
Incompatibilities
Additives may be incompatible; consult the manufacturer for more details.
If it is necessary to add additives, compatibilities should be reviewed and the stability of the mixtures controlled.
The solution should not be administered with, before, or after a blood transfusion through the same equipment, given the possibility of pseudoagglutination.
As with any parenteral nutrition mixture, the proportions of calcium and phosphate should be taken into account. The addition of excess calcium and phosphate, especially in the form of mineral salts, can lead to the formation of calcium phosphate precipitates.
- Validity period
2 years if stored in the overbag.
From a microbiological point of view, mixtures should be used immediately after additions are made. If not used immediately, the storage time and conditions before use are the responsibility of the user and should not exceed 24 hours at 2-8°C, unless the additions were made under controlled and validated aseptic conditions. If longer storage periods are required under exceptional conditions, the company can be contacted as it has data on physical and chemical stability in use for 7 days at 2-8°C followed by 48 hours at a temperature below 25°C for the products indicated in the previous section.
- Country of registration
- Active substance
- Prescription requiredYes
- Manufacturer
- This information is for reference only and does not constitute medical advice. Always consult a doctor before taking any medication. Oladoctor is not responsible for medical decisions based on this content.
- Alternatives to CLINIMIX N12G20 SOLUTION FOR INFUSIONDosage form: INJECTABLE INFUSION, 3.5 g / 200 g / 5.22 g / 1.88 g / 3.92 g / 1.26 g / 7.21 g / 3.36 g / 4.2 g / 5.11 g / 2.94 g / 2.8 g / 662 mg / 1.02 g / 4.76 g / 5.15 g / 5.07 g / 4.06 g / 14.49 g / 0.28 g / 8.05 gActive substance: combinationsManufacturer: Baxter S.L.Prescription requiredDosage form: INJECTABLE PERFUSION, 4.25 g / 300 g / 5.22 g / 1.54 g / 4.76 g / 1.53 g / 8.76 g / 4.08 g / 5.1 g / 6.2 g / 3.57 g / 3.4 g / 662 mg / 1.02 g / 5.78 g / 5.94 g / 6.16 g / 4.93 g / 17.6 g / 0.34 g / 9.78 gActive substance: combinationsManufacturer: Baxter S.L.Prescription requiredDosage form: INJECTABLE PERFUSION, 2.75 g / 150 g / 5.22 g / 2.24 g / 3.08 g / 0.99 g / 5.66 g / 2.64 g / 3.3 g / 4.02 g / 2.31 g / 2.2 g / 662 mg / 1.02 g / 3.74 g / 4.31 g / 4 g / 3.19 g / 11.38 g / 0.22 g / 6.32 gActive substance: combinationsManufacturer: Baxter S.L.Prescription required
Online doctors for CLINIMIX N12G20 SOLUTION FOR INFUSION
Discuss questions about CLINIMIX N12G20 SOLUTION FOR INFUSION, including use, safety considerations and prescription review, subject to medical assessment and local regulations.
Frequently Asked Questions