
BREYANZI 1.1-70 × 10⁶ cells/mL / 1.1-70 × 10⁶ cells/mL Dispersion for Infusion

How to use BREYANZI 1.1-70 × 10⁶ cells/mL / 1.1-70 × 10⁶ cells/mL Dispersion for Infusion
Translated with AI
This page provides general information and does not replace a doctor’s consultation. Always consult a doctor before taking any medication. Seek urgent medical care if symptoms are severe.
Show originalContents of the leaflet
Introduction
Package Leaflet: Information for the Patient
Breyanzi 1.1-70 × 106cells/ml / 1.1-70 × 106cells/ml dispersion for infusion
lisocabtagene maraleucel (chimeric antigen receptor (CAR) positive viable T lymphocytes
)
This medicine is subject to additional monitoring, which will allow for quicker identification of new safety information. You can help by reporting any side effects you may get. The last section of the leaflet contains information on how to report side effects.
Read all of this leaflet carefully before you are given this medicine because it contains important information for you.
- Keep this leaflet, you may need to read it again.
- Your doctor will give you a patient card. Read the card carefully and follow the instructions it contains.
- Always show the patient card to your doctor or nurse when you see them or if you go to hospital.
- If you have any further questions, ask your doctor or nurse.
- If you experience any side effects, talk to your doctor or nurse, even if they are not listed in this leaflet. See section 4.
Contents of the pack
- What is Breyanzi and what is it used for
- What you need to know before you are given Breyanzi
- How Breyanzi is given
- Possible side effects
- Storage of Breyanzi
- Contents of the pack and other information
1. What is Breyanzi and what is it used for
What is Breyanzi
Breyanzi contains the active substance lisocabtagene maraleucel, a type of treatment called “genetically modified cellular therapy”.
Breyanzi is made from your own white blood cells. This involves taking some of your blood, separating out the white blood cells and sending them to a laboratory so they can be modified to make Breyanzi.
What Breyanzi is used for
Breyanzi is used to treat adults with a type of blood cancer called lymphoma that affects your lymph tissue and causes your white blood cells to grow out of control. Breyanzi is used for:
- diffuse large B-cell lymphoma;
- high-grade B-cell lymphoma;
- primary mediastinal large B-cell lymphoma;
- follicular lymphoma.
How Breyanzi works
- The cells in Breyanzi have been genetically modified to recognize the lymphoma cells in your body.
- When these cells are put back into your blood, they will recognize and attack the lymphoma cells.
2. What you need to know before you are given Breyanzi
Do not receive Breyanzi
- if you are allergic to any of the ingredients of this medicine (listed in section 6). If you think you may be allergic, talk to your doctor
- if you cannot receive a treatment called lymphodepleting chemotherapy, which reduces the number of white blood cells in your blood (see also section 3 “How Breyanzi is given”).
Warnings and precautions
Before receiving Breyanzi, tell your doctor if
- you have lung or heart problems
- you have low blood pressure
- you have an infection or other inflammatory conditions. The infection will be treated before you receive Breyanzi
- you have received a hematopoietic stem cell transplant from another person in the last 4 months. The transplanted cells may attack your own body (graft-versus-host disease), causing symptoms such as skin rash, nausea, vomiting, diarrhea, and blood in the stool
- you notice that your cancer symptoms are getting worse. These symptoms are fever, feeling weak, night sweats, or sudden weight loss
- you have had hepatitis B or C, or human immunodeficiency virus (HIV) infection
- you have been vaccinated in the last 6 weeks or are planning to receive a vaccine in the coming months. See “Live vaccines” below for more information.
If you are in any of these situations (or are unsure), talk to your doctor before receiving Breyanzi.
Patient treated with Breyanzi may develop new types of cancer. Cases have been reported of patients developing cancer, which starts in a type of white blood cell called T lymphocytes, after treatment with Breyanzi and similar medicines. Talk to your doctor if you experience any new swelling of the glands (lymph nodes) or changes in the skin, such as new rashes or lumps.
Tests and examinations
Before receiving Breyanzi, your doctor
- will examine your lungs, heart, and blood pressure
- will look for signs of infection (any infection will be treated before you receive Breyanzi)
- will look for signs of graft-versus-host disease, which can occur after a hematopoietic stem cell transplant from another person
- will do a blood test to check for uric acid and to determine the number of cancer cells in your blood. This will show if you are likely to have a condition called tumor lysis syndrome. You may be given medicines to prevent this condition
- will check if your cancer is getting worse
- will do a test to check for hepatitis B and C and HIV infection.
- After receiving Breyanzi
- If you experience certain serious side effects, you should tell your doctor or nurse right away because you may need treatment for them. See “serious side effects” in section 4
- Your doctor will do regular blood tests to check your blood cell counts, as the number of blood cells may decrease
- You should stay near the treatment center where you received Breyanzi for at least 4 weeks. See sections 3 and 4
- You must not donate blood, organs, tissues, or cells for transplantation.
You will be asked to enroll in a registry for at least 15 years to better understand the long-term effects of Breyanzi.
Children and adolescents
Breyanzi must not be given to children and adolescents under 18 years of age.
Other medicines and Breyanzi
Tell your doctor or pharmacist if you are taking, have recently taken, or might take any other medicines, including those bought without a prescription.
For information on medicines that will be given to you before Breyanzi, see section 3.
Medicines that affect the immune system
Before receiving Breyanzi, tell your doctor or nurse if you are taking medicines that weaken the immune system, such as:
- corticosteroids.
You should do this because these medicines may reduce the effect of Breyanzi.
Other cancer medicines
Some cancer medicines may reduce the effect of Breyanzi. Your doctor will decide if you need other cancer treatments.
Live vaccines
You must not receive certain vaccines, specifically live vaccines:
- in the 6 weeks before receiving the short course of chemotherapy (called lymphodepleting chemotherapy) that is given to prepare your body for Breyanzi;
- during treatment with Breyanzi;
- after treatment, while your immune system is recovering.
Talk to your doctor if you need to receive any vaccine.
Pregnancy and breastfeeding
If you are pregnant or breastfeeding, think you may be pregnant, or plan to become pregnant, talk to your doctor before receiving this medicine or lymphodepleting chemotherapy. The effects of Breyanzi in pregnant or breastfeeding women are not known and may be harmful to the unborn baby or breastfed child.
- If you are pregnant or think you may be pregnant after treatment with Breyanzi, talk to your doctor right away.
- You will have a pregnancy test before starting treatment. Breyanzi should only be given if the test results show you are not pregnant.
Talk to your doctor about the need for contraception.
If you have received Breyanzi, talk to your doctor about becoming pregnant.
Driving and using machines
Do not drive, use machines, or take part in activities where you need to be alert for at least 8 weeks after treatment. Breyanzi may cause drowsiness, reduce your level of alertness, and cause confusion and seizures (fits).
Breyanzi contains sodium, potassium, and dimethyl sulfoxide (DMSO)
This medicine contains up to 12.5 mg of sodium (main component of cooking/table salt) per vial. This is equivalent to 0.6% of the maximum recommended daily intake of sodium for an adult. Up to 8 vials of this medicine may be given per dose, which is a total of 100 mg of sodium or 5% of the maximum recommended daily intake of sodium for an adult.
This medicine contains up to 0.2 mmol (or 6.5 mg) of potassium per dose. Your doctor will take this potassium content into account if your kidneys are not working properly or if you are on a low-potassium diet.
This medicine also contains DMSO, which may cause severe hypersensitivity reactions.
3. How Breyanzi is given
Patient card
- Your doctor will give you a patient card. Read the card carefully and follow the instructions it contains.
- Always show the patient card to your doctor or nurse when you see them or if you go to hospital.
Donation of blood to make Breyanzi from your white blood cells
Breyanzi is made from your white blood cells.
- Your doctor will take some of your blood through a line (catheter) that is put into a vein. Some of your white blood cells will be separated from your blood. The rest of the blood will be returned to your body. This procedure is called “leukapheresis” and may take 3 to 6 hours. You may need to have this procedure repeated.
- Your white blood cells will then be sent to make Breyanzi.
Other medicines you will receive before Breyanzi
- A few days before receiving Breyanzi, you will be given a short course of chemotherapy. The goal of this is to remove your white blood cells.
- Just before receiving Breyanzi, you will be given paracetamol and an antihistamine. The goal of these is to reduce the risk of infusion reactions and fever.
How Breyanzi is given
- Your doctor will check that Breyanzi has been prepared from your own blood, by checking that the patient identity information on the medicine labels matches your details.
- Breyanzi is given through a drip (infusion) into a vein through a line.
- You will receive infusions of the CD8 positive cells, followed immediately by infusions of the CD4 positive cells. The infusion time will vary, but it is usually less than 15 minutes for each of the 2 types of cells.
After receiving Breyanzi
- You should stay near the treatment center where you received Breyanzi (for at least 4 weeks).
- During the first week after treatment, you will need to go back to the treatment center 2 to 3 times so your doctor can check if the treatment is working and help you with any side effects. See sections 2 and 4.
If you miss an appointment
Call your doctor or treatment center as soon as possible to make another appointment.
4. Possible side effects
Like all medicines, this medicine can cause side effects, although not everybody gets them.
Serious side effects
Tell your doctor right away if you experience any of the following side effects after treatment with Breyanzi:
- fever, chills or shaking, feeling tired, fast or irregular heartbeats, dizziness, and shortness of breath, which can be signs of a serious condition called “cytokine release syndrome”
- confusion, decreased level of alertness (reduced consciousness), difficulty speaking or slurred speech, shaking, feeling anxious, feeling dizzy, and headache, which can be symptoms of a condition called immune effector cell-associated neurotoxicity syndrome (ICANS) or signs of problems with the nervous system
- feeling hot, fever, chills or shaking, which can be signs of infection.
Infections can be due to:
- low levels of white blood cells, which help fight infections, or
- low levels of antibodies called “immunoglobulins”.
- blurred vision, loss of vision, or double vision, difficulty speaking, weakness or clumsiness in an arm or leg, a change in the way you walk or balance problems, changes in personality, changes in thinking, memory, and orientation that can cause confusion. These can be symptoms of a serious and potentially life-threatening condition of the brain called progressive multifocal leukoencephalopathy (PML). These symptoms can start several months after finishing treatment and usually develop slowly and gradually over weeks or months. It is important that your family members or caregivers also know about these symptoms, as they may notice symptoms that you are not aware of.
- feeling very tired, weak, or short of breath, which can be signs of low levels of red blood cells (anemia)
- bleeding or bruising more easily, which can be signs of low levels of blood cells called platelets.
Tell your doctor right away if you experience any of the above side effects after receiving Breyanzi, as you may need urgent medical treatment.
Other possible side effects
Very common: may affect more than 1 in 10 people
- difficulty sleeping
- low blood pressure, including signs such as dizziness, fainting, or vision changes
- cough
- nausea or vomiting
- diarrhea or constipation
- stomach pain
- swelling of the ankles, arms, legs, and face
- skin rash
Common: may affect up to 1 in 10 people
- balance or walking problems
- high blood pressure, which can include signs such as severe headache, sweating, or sleep problems
- changes in vision
- changes in taste
- numbness or tingling in the feet or hands
- blood clots or bleeding problems
- bleeding in the gut
- less urine
- infusion reactions, such as feeling dizzy, fever, or shortness of breath
- low levels of phosphate in the blood
- low levels of oxygen in the blood
Uncommon: may affect up to 1 in 100 people
- a new type of cancer that starts in a type of white blood cell called T lymphocytes (secondary T-cell neoplasia)
- rapid breakdown of cancer cells, which releases toxic waste products into the bloodstream: a sign may be dark-colored urine with symptoms of nausea or pain on one side of the stomach
- severe inflammatory condition: symptoms may include fever, skin rash, enlargement of the liver, spleen, and lymph nodes
- heart weakness, which causes shortness of breath and swelling of the ankles
- fluid around the lungs
- stroke or mini-stroke
- seizures or fits (epileptic seizures)
- weakness of the muscles of the face, vocal cords, or weakness of the body
- swelling of the brain.
Reporting of side effects
If you experience any side effects, talk to your doctor or nurse, even if they are not listed in this leaflet. You can also report side effects directly through the national reporting system listed in Appendix V. By reporting side effects, you can help provide more information on the safety of this medicine.
5. Storage of Breyanzi
Keep this medicine out of the sight and reach of children.
Do not use this medicine after the expiry date which is stated on the carton and vial label after “EXP”.
Store in the vapor phase of liquid nitrogen (≤ –130 °C).
6. Container Contents and Additional Information
Composition of Breyanzi
- The active substance is lisocabtagene maraleucel. Each 4.6 ml vial contains a dispersion of viable CAR-positive T lymphocytes (CD8-positive or CD4-positive cellular component) with a concentration of 1.1 × 10^6 to 70 × 10^6 viable CAR-positive T lymphocytes/ml of each cellular component. There may be up to 4 vials of each of the CD8-positive or CD4-positive cellular components, depending on the concentration of the cryopreserved drug.
- The other components (excipients) are Cryostor CS10 (contains dimethyl sulfoxide or DMSO), sodium chloride, sodium gluconate, sodium acetate trihydrate, potassium chloride, magnesium chloride, human albumin, N-acetyl-DL-tryptophan, capric acid, and water for injectable preparations. See section 2, "Breyanzi contains sodium, potassium, and dimethyl sulfoxide (DMSO)".
This medicinal product contains genetically modified human blood cells.
Appearance and Container Contents of the Product
Breyanzi is a cellular dispersion for infusion. It is supplied in vials with a slightly opaque to opaque, colorless to yellowish or yellow-brown dispersion. Each vial contains 4.6 ml of cellular dispersion of the CD8-positive or CD4-positive cellular component.
Marketing Authorization Holder
Bristol-Myers Squibb Pharma EEIG
Plaza 254
Blanchardstown Corporate Park 2
Dublin 15, D15 T867
Ireland
Manufacturer
Celgene Distribution B.V.
Orteliuslaan 1000
3528 BD Utrecht
Netherlands
BMS Netherlands Operations B.V.
Francois Aragostraat 2
2342 DK Oegstgeest
Netherlands
For further information, please contact the local representative of the marketing authorization holder:
België/Belgique/Belgien N.V. Bristol-Myers Squibb Belgium S.A. Tél/Tel: + 32 2 352 76 11 | Lietuva Swixx Biopharma UAB Tel: + 370 52 369140 |
| Luxemburg/Luxembourg N.V. Bristol-Myers Squibb Belgium S.A. Tél/Tel: + 32 2 352 76 11 |
Ceská republika Bristol-Myers Squibb spol. s r.o. Tel: + 420 221 016 111 | Magyarország Bristol-Myers Squibb Kft. Tel.: + 36 1 301 9797 |
Danmark Bristol-Myers Squibb Denmark Tlf: + 45 45 93 05 06 | Malta A.M. Mangion Ltd Tel: + 356 23976333 |
Deutschland Bristol-Myers Squibb GmbH & Co. KGaA Tel: 0800 0752002 (+ 49 89 121 42 350) | Nederland Bristol-Myers Squibb B.V. Tel: + 31 (0)30 300 2222 |
Eesti Swixx Biopharma OÜ Tel: + 372 640 1030 | Norge Bristol-Myers Squibb Norway AS Tlf: + 47 67 55 53 50 |
Ελλáδα Bristol-Myers Squibb A.E. Τηλ: + 30 210 6074300 | Österreich Bristol-Myers Squibb GesmbH Tel: + 43 1 60 14 30 |
España Bristol-Myers Squibb, S.A. Tel: + 34 91 456 53 00 | Polska Bristol-Myers Squibb Polska Sp. z o.o. Tel.: + 48 22 2606400 |
France Bristol-Myers Squibb SAS Tél: + 33 (0)1 58 83 84 96 | Portugal Bristol-Myers Squibb Farmacêutica Portuguesa, S.A. Tel: + 351 21 440 70 00 |
Hrvatska Swixx Biopharma d.o.o. Tel: + 385 1 2078 500 | România Bristol-Myers Squibb Marketing Services S.R.L. Tel: + 40 (0)21 272 16 19 |
Ireland Bristol-Myers Squibb Pharmaceuticals uc Tel: 1 800 749 749 (+ 353 (0)1 483 3625) | Slovenija Swixx Biopharma d.o.o. Tel: + 386 1 2355 100 |
Ísland Vistor hf. Sími: + 354 535 7000 | Slovenská republika Swixx Biopharma s.r.o. Tel: + 421 2 20833 600 |
Italia Bristol-Myers Squibb S.r.l. Tel: + 39 06 50 39 61 | Suomi/Finland Oy Bristol-Myers Squibb (Finland) Ab Puh/Tel: + 358 9 251 21 230 |
Κúπρος Bristol-Myers Squibb A.E. Τηλ: 800 92666 (+ 30 210 6074300) | Sverige Bristol-Myers Squibb Aktiebolag Tel: + 46 8 704 71 00 |
Latvija Swixx Biopharma SIA Tel: + 371 66164750 |
Date of Last Revision of this Leaflet:
Other Sources of Information
Detailed information on this medicinal product is available on the European Medicines Agency website: https://www.ema.europa.eu.
-------------------------------------------------------------------------------------------------------------------
This information is intended for healthcare professionals only:
Precautions to be taken before handling or administering the medicinal product
Breyanzi should be transported within the facility in closed, break-resistant, and leak-proof containers.
This medicinal product contains human blood cells. Healthcare professionals handling Breyanzi should take appropriate precautions (wear gloves, protective clothing, and eye protection) to avoid possible transmission of infectious diseases.
Pre-treatment Preparation
Beforethawing the vials
- Confirm the patient's identification data with the patient identifiers on the shipping box.
- Breyanzi consists of viable CAR-positive T lymphocytes formulated as separate CD8+ and CD4+ cellular components; there is a separate Release for Infusion Certificate (RfIC) for each cellular component. Read the RfIC (attached to the inside of the shipping box) for information on the number of syringes needed and the volume to be administered of the CD8+ and CD4+ cellular components (syringe labels are provided with the RfIC).
- Confirm the infusion time in advance and adjust the start time of Breyanzi thawing so that it is available for infusion when the patient is ready.
Note:once the vials of viable CAR-positive T lymphocytes (CD8+ and CD4+ cellular components) are removed from the cryopreserved storage container, thawing should be carried out to completion and the cells should be administered within 2 hours.
Thawing of the vials
- Confirm the patient's identification data with the patient identifiers on the outer box and the Release for Infusion Certificate (RfIC).
- Remove the CD8+ cellular component box and the CD4+ cellular component box from the outer box.
- Open each inner box and visually inspect the vials for damage. If the vials are damaged, contact the company.
- Carefully remove the vials from the boxes, place the vials on a protector or absorbent paper, and thaw at room temperature. Thaw all vials at the same time.
Be careful to keep the CD8+ and CD4+ cellular components separate.
Dose Preparation
- Depending on the concentration of viable CAR-positive T lymphocytes of each component, more than one vial of each of the CD8+ and CD4+ cellular components may be required to complete a dose. A separate syringe should be prepared for each vial of CD8+ or CD4+ cellular component received.
Note: the volume to be extracted and infused may be different for each component.
- Each 5 ml vial contains a total extractable volume of 4.6 ml of CD8+ or CD4+ T lymphocytes. The RfIC for each component indicates the volume (ml) of cells to be extracted into each syringe. Use the smallest Luer Lock syringe (1 ml to 5 ml) necessary to extract the specified volume from each vial. Do not use a 5 ml syringe for volumes less than 3 ml.
- Prepare the CD8+ cellular component syringe(s) first.Confirm that the patient identifiers on the CD8+ cellular component syringe label match the patient identifiers on the CD8+ cellular component vial label. Affix the CD8+ cellular component syringe labels to the syringe(s) before extracting the required volume into the syringe(s).
- Repeat the process for the CD4+ cellular component.
Note:it is important to confirm that the extracted volume of each cellular component matches the volume specified in the corresponding Release for Infusion Certificate (RfIC).
Extracting the required volume of cells from each vial into a separate syringe should be performed according to the following instructions:
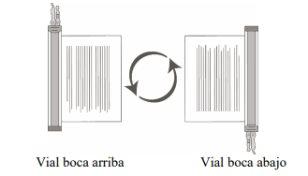
- Holding the thawed vial(s) upright, gently invert the vial(s) upside down/upside up to mix the cellular product. If clumps are observed, continue inverting the vial(s) upside down/upside up until the clumps have dispersed and the cells appear to be uniformly resuspended.
- Visually inspect the thawed vial(s) for damage or leakage. Do not use the vial if it is damaged or if the clumps do not disperse; contact the company. The liquid in the vials should be slightly opaque to opaque, colorless to yellowish or yellow-brown.
- Remove the aluminum cap (if present) from the bottom of the vial and clean the septum with an alcohol wipe. Allow it to air dry before proceeding.
NOTE:the absence of the aluminum cap does not affect the sterility of the vial.
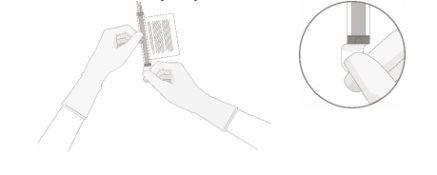
- With the vial(s) upright, cut the seal at the tube line at the top of the vial immediately above the filter to open the vial vent.
NOTE:be careful to select the correct tube line with the filter. Cut ONLY the tube with the filter.

- Pick up a 20-gauge, 1-1½ inch needle with the needle tip bevel facing away from the septum of the access port.
- Insert the needle into the septum at a 45°-60° angle to penetrate the septum of the access port.
- Gradually increase the angle of the needle as it enters the vial.
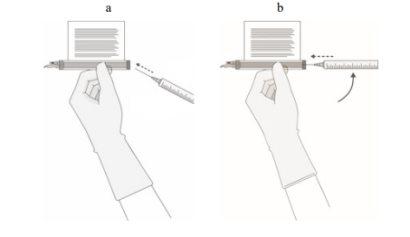
- Without aspirating air into the syringe, slowly extract the target volume (as specified in the Release for Infusion Certificate [RfIC]).
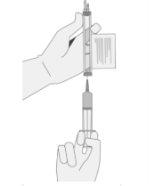
- Carefully inspect the syringe for signs of foreign particles before proceeding. If foreign particles are present, contact the company.
- Verify that the volume of the CD8+/CD4+ cellular component matches the volume specified for the corresponding component in the Release for Infusion Certificate (RfIC).
Once the volume is verified, turn the vial and syringe to a horizontal position and remove the syringe/needle from the vial.
Carefully separate the needle from the syringe and place the cap on the syringe.

- Still holding the vial horizontally, return it to the box to prevent vial leakage.
- Discard any unused portion of Breyanzi.
Administration
- DO NOTuse a leukocyte-reducing filter.
- Ensure that tocilizumab and emergency equipment are available before infusion and during the recovery period. In the exceptional case where tocilizumab is not available due to a shortage listed in the European Medicines Agency's shortage catalog, ensure that adequate alternative measures are available at the center, instead of tocilizumab, to treat CRS.
- Before infusion, confirm that the patient's identity matches the patient identifiers on the syringe label provided in the corresponding RfIC.
- Once Breyanzi has been introduced into the syringes, proceed to its administration as soon as possible. The total time from removal of Breyanzi from the cryopreserved storage container to administration to the patient should not exceed 2 hours.
- Use a 9 mg/ml (0.9%) sodium chloride injectable solution to flush all infusion lines before and after administration of each CD8+ or CD4+ cellular component.
- Administer the CD8+ cellular component first. The entire volume of the CD8+ cellular component is administered intravenously at an infusion rate of approximately 0.5 ml/minute, using the closest port or Y-branch (piggyback).
- If more than one syringe is required for a complete dose of the CD8+ cellular component, administer the volume in each syringe consecutively without delay between the administration of the syringe contents (unless there is a clinical reason to withhold the dose, e.g., infusion reaction). Once the CD8+ cellular component has been administered, flush the line with a 9 mg/ml (0.9%) sodium chloride injectable solution.
- Administer the CD4+ cellular component immediately after completion of the CD8+ cellular component administration, following the same steps and infusion rate described for the CD8+ cellular component. After administration of the CD4+ cellular component, flush the line with a 9 mg/ml (0.9%) sodium chloride injectable solution, using a sufficient amount to flush the line and the length of the intravenous catheter. The infusion time will vary and will normally be less than 15 minutes for each component.
Measures to be taken in case of accidental exposure
In case of accidental exposure, local guidelines for handling human-derived materials should be followed. Work surfaces and materials that may have come into contact with Breyanzi should be decontaminated with an appropriate disinfectant.
Precautions to be taken for the disposal of medicinal products
The unused medicinal product and all materials that have come into contact with Breyanzi (solid and liquid waste) should be handled and disposed of as potentially infectious waste in accordance with local guidelines for handling human-derived materials.
- Country of registration
- Active substance
- Prescription requiredYes
- Manufacturer
- This information is for reference only and does not constitute medical advice. Always consult a doctor before taking any medication. Oladoctor is not responsible for medical decisions based on this content.
- Alternatives to BREYANZI 1.1-70 × 10⁶ cells/mL / 1.1-70 × 10⁶ cells/mL Dispersion for InfusionDosage form: INJECTABLE PERFUSION, 260 - 500 × 10^6 cellsActive substance: idecabtagene vicleucelManufacturer: Bristol-Myers Squibb Pharma EeigPrescription requiredDosage form: INJECTABLE PERFUSION, 3.2 x 10^6 - 1 x 10^8 cellsActive substance: ciltacabtagene autoleucelManufacturer: Janssen-Cilag International N.VPrescription requiredDosage form: INJECTABLE, 2.8×10^7 - 7.3×10^7 cells/mlActive substance: tabelecleucelManufacturer: Pierre Fabre MedicamentPrescription required
Online doctors for BREYANZI 1.1-70 × 10⁶ cells/mL / 1.1-70 × 10⁶ cells/mL Dispersion for Infusion
Discuss questions about BREYANZI 1.1-70 × 10⁶ cells/mL / 1.1-70 × 10⁶ cells/mL Dispersion for Infusion, including use, safety considerations and prescription review, subject to medical assessment and local regulations.
Frequently Asked Questions







