
BENEFIX 1000 IU, POWDER AND SOLVENT FOR INJECTABLE SOLUTION

How to use BENEFIX 1000 IU, POWDER AND SOLVENT FOR INJECTABLE SOLUTION
Translated with AI
This page provides general information and does not replace a doctor’s consultation. Always consult a doctor before taking any medication. Seek urgent medical care if symptoms are severe.
Show originalContents of the leaflet
Introduction
Package Leaflet: Information for the User
BeneFIX 250UI powder and solvent for solution for injection
BeneFIX 500UI powder and solvent for solution for injection
BeneFIX 1000UI powder and solvent for solution for injection
BeneFIX 1500UI powder and solvent for solution for injection
BeneFIX 2000UI powder and solvent for solution for injection
BeneFIX 3000UI powder and solvent for solution for injection
nonacog alfa (recombinant coagulation factor IX)
Read all of this leaflet carefully before you start using this medicine because it contains important information for you.
- Keep this leaflet, you may need to read it again.
- If you have any further questions, ask your doctor, pharmacist, or nurse.
- This medicine has been prescribed for you only. Do not pass it on to others. It may harm them, even if their signs of illness are the same as yours.
- If you get any side effects, talk to your doctor, pharmacist, or nurse. This includes any possible side effects not listed in this leaflet. See section 4.
Contents of the pack
- What BeneFIX is and what it is used for
- What you need to know before you use BeneFIX
- How to use BeneFIX
- Possible side effects
- Storing BeneFIX
- Contents of the pack and other information
1. What BeneFIX is and what it is used for
BeneFIX is an injectable coagulation factor IX product obtained by recombinant DNA technology. The active substance of BeneFIX is nonacog alfa. People born with hemophilia B (Christmas disease) do not have enough factor IX to control bleeding. BeneFIX works by replacing factor IX in patients with hemophilia B to allow their blood to clot.
BeneFIX is used for the treatment and prevention of bleeding in patients with hemophilia B (congenital factor IX deficiency) in all age groups.
2. What you need to know before you use BeneFIX
Do not use BeneFIX
- if you are allergic to nonacog alfa or any of the other ingredients of this medicine (listed in section 6);
- if you are allergic to hamster proteins.
Warnings and precautions
- Talk to your doctor or pharmacist before starting BeneFIX.
- Tell your doctor immediately if your bleeding does not stop as expected.
- Allergic reactions can occur. The product may contain traces of hamster proteins (see Do not use BeneFIX). Anaphylactic reactions (severe allergic reactions) that can potentially put your life at risk have occurred with factor IX products, including BeneFIX. The first signs of allergic reactions include difficulty breathing, shortness of breath, swelling or swelling, hives, itching, generalized urticaria, chest tightness, wheezing, low blood pressure, blurred vision, and anaphylaxis (a severe allergic reaction that can cause difficulty swallowing and/or breathing, redness or swelling of the face and/or hands).
- If an allergic or anaphylactic reaction occurs stop the infusion immediately and contact a doctor or seek immediate emergency medical help. In case of severe allergic reactions, alternative therapy should be considered.
- The development of neutralizing antibodies (inhibitors) is a rare event in patients who have received previous treatment with products containing factor IX. However, as with all products containing factor IX, you should be carefully monitored for the development of factor IX inhibitors while being treated with BeneFIX.
- Studies have shown a relationship between the development of a factor IX inhibitor and allergic reactions. Therefore, if you experience allergic reactions like those described above, you should be examined to determine the presence of an inhibitor. It should be noted that patients with a factor IX inhibitor may be at increased risk of anaphylaxis in future treatment with BeneFIX.
- The production of factor IX in the body is controlled by the factor IX gene. Patients with specific mutations of the factor IX gene, such as a significant deletion, may be more likely to develop a factor IX inhibitor and/or experience allergic reactions. Therefore, if you know you have such a mutation, your doctor may monitor you more closely for signs of an allergic reaction, especially when you first start taking BeneFIX.
- Given the risk of allergic reactions with factor IX, initial administrations of BeneFIX should be performed under medical supervision, where adequate medical care can be provided for allergic reactions.
- Even in the absence of a factor IX inhibitor, higher doses of BeneFIX may be required than those required for other plasma-derived factor IX products you have previously received. Consequently, close monitoring of plasma factor IX activity (which measures the ability of your blood to form clots) should be performed to adjust the dose accordingly. If bleeding is not controlled with the recommended dose, contact your doctor.
- If you have liver or heart disease or have recently undergone surgery, there is a higher risk of blood clotting complications.
- A kidney disorder (nephrotic syndrome) has been reported after administration of high doses of plasma-derived factor IX in patients with hemophilia B with factor IX inhibitors and a history of allergic reactions.
- Insufficient data have been obtained from clinical trials in previously untreated patients (patients who have never received an infusion with factor IX) with BeneFIX.
- It is recommended that each time you use BeneFIX, you record the name and batch number of the product. You can use one of the detachable labels found on the vial to record the batch number in your diary or to report any adverse reaction.
Other medicines and BeneFIX
Tell your doctor or pharmacist if you are using, have recently used, or might use any other medicines.
Pregnancy, breastfeeding, and fertility
If you are pregnant or breastfeeding, think you may be pregnant, or plan to become pregnant, you should only receive BeneFIX under the specific guidance of your doctor. It is not known whether BeneFIX can cause harm to the fetus when administered to pregnant women. If you are breastfeeding or become pregnant, your doctor may advise you to stop treatment with BeneFIX.
Ask your doctor or pharmacist for advice before using this medicine.
Driving and using machines
BeneFIX has no influence on the ability to drive and use machines.
BeneFIX contains sodium
After reconstitution, BeneFIX contains 0.2 mmol of sodium (4.6 mg) per vial; this is essentially "sodium-free". However, depending on your body weight and BeneFIX dose, you may receive multiple vials. This should be taken into account if you are on a low-salt diet.
3. How to use BeneFIX
Follow the instructions for administration of this medicine exactly as told by your doctor or pharmacist. If you are unsure, consult your doctor or pharmacist again.
Your doctor will decide the dose of BeneFIX you will receive. This dose and its duration will depend on your individual needs for factor IX replacement therapy and how quickly your body uses factor IX, which will be regularly checked. You may notice a difference in the dose you receive if you switch from a plasma-derived factor IX product to BeneFIX.
Your doctor may adjust the dose of BeneFIX you receive over time.
Reconstitution and administration
The instructions below are a guide for the reconstitution and administration of BeneFIX. Patients should follow the specific venipuncture instructions given by their doctor.
BeneFIX is administered by intravenous (IV) infusion after reconstitution of the powder for injection with the solvent included in the pre-filled syringe (sodium chloride solution).
Always wash your hands before performing the following procedures. During the reconstitution procedure, aseptic technique (meaning clean and free of germs) should be followed.
Reconstitution:
BeneFIX will be administered by intravenous (IV) infusion after reconstitution with sterile solvent for injection.
- Allow the lyophilized vial of BeneFIX and the pre-filled syringe of solvent to reach room temperature.
- Remove the cap from the vial of BeneFIX so that the central part of the rubber stopper is visible.
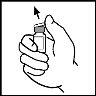
- Clean the top of the vial with the alcohol swab provided or use another antiseptic solution and wait for it to dry. After cleaning, do not touch the rubber stopper with your hand and avoid touching any surface.
- Remove the protective cap from the transparent plastic container of the adapter. Do not remove the adapter from the container.
- Place the vial on a flat surface. While holding the adapter in its container, place it over the vial. Press firmly until the adapter fits onto the top of the vial, with the tip of the adapter penetrating the vial stopper.
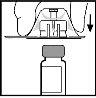
- Remove the container from the adapter and discard it.
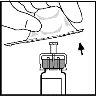
- Fit the plunger rod to the solvent syringe by pushing and turning it firmly.
- Break the plastic cap by bending it up and down until the perforation breaks. Do not touch the inside of the cap or the tip of the syringe. The cap may need to be replaced (if the reconstituted BeneFIX is not administered immediately), so discard it by placing it on its top.
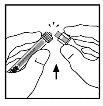
- Place the vial on a flat surface. Connect the solvent syringe to the vial adapter by inserting the tip of the syringe into the adapter opening while pushing and turning the syringe clockwise until it fits perfectly.
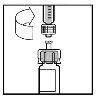
- Slowly push the plunger down to inject all the solvent into the vial of BeneFIX.
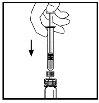
- With the syringe still connected to the adapter, gently turn the vial until the powder is dissolved.
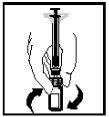
- The final solution should be visually inspected for particulate matter before administration. The solution should appear clear and colorless.
Note: If you use more than one vial of BeneFIX for infusion, each vial must be reconstituted according to the instructions above. The solvent syringe should be discarded, leaving the vial adapter in place, and then a large Luer Lock syringe (a device that connects the syringe to the vial) should be used to withdraw the reconstituted contents from each individual vial.
- Turn the vial ensuring the syringe plunger has been pushed down completely. Slowly aspirate the entire solution into the syringe.
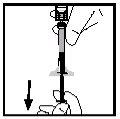
- Release the syringe from the adapter by pushing and slowly turning the syringe counterclockwise. Discard the vial attached to the adapter.
Note: If the solution is not to be used immediately, the cap should be carefully replaced. Do not touch the tip of the syringe or the inside of the cap.
BeneFIX should be administered immediately after reconstitution or within 3 hours. The reconstituted solution can be stored at room temperature before administration.
Administration (Intravenous injection):
BeneFIX should be administered using the pre-filled syringe of solvent provided or a sterile disposable plastic Luer Lock syringe. Additionally, the solution should be withdrawn from the vial using the vial adapter.
BeneFIX should be injected intravenously over several minutes. Your doctor may adjust the recommended infusion rate to make it more comfortable for you.
Cases of red blood cell agglutination in the tube or syringe during administration of BeneFIX have been reported. No adverse reactions have been reported in relation to this observation. To minimize the possibility of agglutination, it is essential to limit the amount of blood that enters the tube. Blood should not enter the syringe. If red blood cell agglutination is observed in the tube or syringe, discard all this material (tube, syringe, and BeneFIX solution) and resume administration with a new package.
Since the use of BeneFIX in continuous infusion (drip-by-drip) has not been evaluated, BeneFIX should not be mixed with infusion solutions or administered drip-by-drip.
Discard unused solution, empty vials, and used needles and syringes in a suitable sharps container for disposing of sharp objects that can cause injury if not handled properly.
If you use more BeneFIX than you should
If you inject more BeneFIX than your doctor recommends, contact your doctor immediately.
If you stop treatment with BeneFIX
Do not stop treatment with BeneFIX without consulting your doctor.
If you have any further questions on the use of this medicine, ask your doctor, pharmacist, or nurse.
4. Possible Adverse Effects
Like all medicines, this medicine may cause adverse effects, although not all people suffer from them.
Hypersensitivity/Allergic Reactions
It is possible that hypersensitivity reactions of an allergic type may occur with BeneFIX. Such reactions may consist of swelling of the face or throat, itching and scratching at the infusion site, chills, flushing (redness of the skin), pruritus, headache, urticarial rash, decreased blood pressure, lethargy, nausea, restlessness, increased heart rate, chest tightness, tingling, vomiting, wheezing (noises when breathing). In some cases, these reactions have progressed to severe anaphylaxis. Allergic reactions may appear along with the development of factor IX inhibitors (see also "Warnings and Precautions").
These reactions can potentially put your life at risk. If anaphylactic/allergic reactions occur, stop the infusion immediately and contact a doctor or seek immediate emergency medical help. The required treatment will depend on the nature and severity of the adverse effects (see also "Warnings and Precautions").
Development of Inhibitors
Patients with hemophilia B may develop neutralizing antibodies (inhibitors) to factor IX. If this occurs, a sign may be an increase in the amount of BeneFIX normally required to treat a hemorrhage, and/or that the hemorrhage continues after treatment. In these cases, it is recommended to contact a specialized hemophilia center. Your doctor may monitor you to control the development of inhibitors (see "Warnings and Precautions").
A kidney alteration has been reported after administration of high doses of plasma-derived factor IX for the induction of immune tolerance in patients with hemophilia B with factor IX inhibitors and a history of allergic reactions (see also "Warnings and Precautions").
Thrombotic Events
BeneFIX may increase the risk of thrombosis (abnormal blood clots) in your body, if you have risk factors for the development of blood clots, including a permanent venous catheter. Serious cases of blood clots, including life-threatening blood clots, have been reported in critically ill babies while receiving BeneFIX by continuous infusion through a central venous catheter. Cases of peripheral thrombophlebitis (pain and redness of the veins) and deep vein thrombosis (blood clots in the limbs) have also been reported; in most of these cases, BeneFIX was administered by continuous infusion, which is an unapproved method of administration.
Very Common Adverse Effects(may affect more than 1 in 10 people)
- Headache
- Cough
- Fever
Common Adverse Effects(may affect up to 1 in 10 people)
- Hypersensitivity or allergic reactions
- Dizziness, altered sense of taste
- Phlebitis (pain and redness of the veins), flushing (redness of the skin)
- Vomiting, nausea
- Rash, urticarial rash
- Chest discomfort (including chest pain)
- Reaction at the infusion site (including itching and redness at the infusion site), pain and discomfort at the infusion site
Uncommon Adverse Effects(may affect up to 1 in 100 people)
- Appearance of neutralizing antibodies (inhibitors)
- Cellulitis at the infusion site (pain and redness of the skin)
- Somnolence, tremors
- Visual disturbance (including blurred vision, appearance of spots or lights)
- Increased heart rate, decreased blood pressure
- Renal infarction (interruption of blood supply to the kidney)
Adverse Effects of Unknown Frequency(cannot be estimated from the available data)
- Anaphylactic reaction
- Thrombotic events (abnormal blood clots)
- Lack of response to treatment (bleeding episodes cannot be stopped or prevented)
Reporting of Adverse Effects
If you experience any type of adverse effect, consult your doctor, pharmacist, or nurse, even if it is a possible adverse effect that is not listed in this leaflet. You can also report them directly through the national reporting system included in Annex V. By reporting adverse effects, you can contribute to providing more information on the safety of this medicine.
5. Storage of BeneFIX
Keep this medicine out of the sight and reach of children.
Do not use this medicine after the expiration date that appears on the carton and on the vial label. The expiration date is the last day of the month indicated.
BeneFIX should be stored below 30°C and used before the expiration date indicated on the label.
Do not freeze the product to avoid damaging the pre-filled syringe.
The reconstituted product should be used immediately or within 3 hours.
Do not use this medicine if you notice that the solution is not transparent or colorless.
For reconstitution, only the pre-filled syringe provided in the carton should be used. For administration, other sterile disposable syringes may be used.
Medicines should not be disposed of via wastewater or household waste. Ask your pharmacist how to dispose of the packaging and medicines that are no longer needed. This will help protect the environment.
6. Package Contents and Additional Information
BeneFIX Composition
- The active ingredient is nonacog alfa (recombinant coagulation factor IX). Each vial of BeneFIX contains nominally 250, 500, 1000, 1500, 2000, or 3000 IU of nonacog alfa.
- The other components are sucrose, glycine, L-histidine, polysorbate 80. A solvent for reconstitution (0.234% sodium chloride solution) is included.
- After reconstitution with the included solvent (0.234% sodium chloride solution), each vial contains 50, 100, 200, 300, 400, or 600 IU, respectively (see Table 1), of nonacog alfa per 1 mL of the prepared injection solution.
Table 1. BeneFIX Concentration per mL of Prepared Solution
Amount of BeneFIX per Vial | Amount of BeneFIX per 1 mL of Prepared Injection Solution |
250 IU | 50 IU |
500 IU | 100 IU |
1000 IU | 200 IU |
1500 IU | 300 IU |
2000 IU | 400 IU |
3000 IU | 600 IU |
Product Appearance and Package Contents
BeneFIX is supplied as a powder for injection in a glass vial and a solvent supplied in a pre-filled syringe.
The pack contains:
- a vial with BeneFIX 250, 500, 1000, 1500, 2000, or 3000 IU powder
- a pre-filled syringe with solvent, 5 mL of 0.234% sodium chloride solution for reconstitution
- a sterile adapter for reconstitution
- a sterile infusion system
- two alcohol swabs
- a adhesive dressing
- a gauze pad
Marketing Authorization Holder
Pfizer Europe MA EEIG
Boulevard de la Plaine 17
1050 Brussels
Belgium
Manufacturer
Wyeth Farma S.A.
Autovía del Norte.A-1, Km. 23. Desvío Algete, Km. 1, 28700 San Sebastián de los Reyes, Madrid
Spain
You can request more information about this medicine by contacting the local representative of the marketing authorization holder.
België/Belgique/Belgien Luxembourg/Luxemburg Pfizer NV/SA Tél/Tel: +32 (0)2 554 62 11 | Lietuva Pfizer Luxembourg SARL filialas Lietuvoje Tel. +3705 2514000 |
България Пфайзер България ЕООД Тел.: +359 2 970 4333 | Magyarország Pfizer Kft. Tel.: + 36 1 488 37 00 |
Česká republika Pfizer, spol. s r.o. Tel: +420 283 004 111 | Malta Vivian Corporation Ltd. Tel: +356 21344610 |
Danmark Pfizer ApS Tlf.: +45 44 20 11 00 | Nederland Pfizer bv Tel: +31 (0)800 63 34 636 |
Deutschland PFIZER PHARMA GmbH Tel: +49 (0)30 550055-51000 | Norge Pfizer AS Tlf: +47 67 52 61 00 |
Eesti Pfizer Luxembourg SARL Eesti filiaal Tel: +372 666 7500 | Österreich Pfizer Corporation Austria Ges.m.b.H. Tel: +43 (0)1 521 15-0 |
Ελλάδα Pfizer Ελλάς Α.Ε. Τηλ: +30 210 6785800 | Polska Pfizer Polska Sp. z o.o., Tel.: +48 22 335 61 00 |
España Pfizer, S.L. Tel: +34 91 490 99 00 | Portugal Laboratórios Pfizer, Lda. Tel: +351 21 423 5500 |
France Pfizer Tél: +33 (0)1 58 07 34 40 | România Pfizer Romania S.R.L. Tel: +40 21 207 28 00 |
Hrvatska Pfizer Croatia d.o.o. Tel: + 385 1 3908 777 | Slovenija Pfizer Luxembourg SARL Pfizer, podružnica za svetovanje s podrocja farmacevtske dejavnosti, Ljubljana Tel: + 386 (0)1 52 11 400 |
Ireland Pfizer Healthcare Ireland Unlimited Company Tel: 1800 633 363 (toll free) Tel: +44 (0)1304 616161 | Slovenská republika Pfizer Luxembourg SARL, organizacná zložka Tel: + 421 2 3355 5500 |
Ísland Icepharma hf. Sími: + 354 540 8000 | Suomi/Finland Pfizer Oy Puh/Tel: +358 (0)9 430 040 |
Italia Pfizer S.r.l. Tel: +39 06 33 18 21 | Sverige Pfizer AB Tel: +46 (0)8 550 520 00 |
Κύπρος Pfizer Ελλάς Α.Ε. (Cyprus Branch) Τηλ: +357 22817690 | |
Latvija Pfizer Luxembourg SARL filiale Latvija Tel: +371 670 35 775 | |
Date of Last Revision of this Leaflet: 03/2025.
Detailed information on this medicine is available on the European Medicines Agency website: http://www.ema.europa.eu. There are also links to other websites on rare diseases and orphan medicines.
- Country of registration
- Active substance
- Prescription requiredYes
- Manufacturer
- This information is for reference only and does not constitute medical advice. Always consult a doctor before taking any medication. Oladoctor is not responsible for medical decisions based on this content.
- Alternatives to BENEFIX 1000 IU, POWDER AND SOLVENT FOR INJECTABLE SOLUTIONDosage form: INJECTABLE, 1,000 IUActive substance: coagulation factor IXManufacturer: Swedish Orphan Biovitrum Ab (Publ)Prescription requiredDosage form: INJECTABLE, 2,000 IUActive substance: coagulation factor IXManufacturer: Swedish Orphan Biovitrum Ab (Publ)Prescription requiredDosage form: INJECTABLE, 250 IUActive substance: coagulation factor IXManufacturer: Swedish Orphan Biovitrum Ab (Publ)Prescription required
Online doctors for BENEFIX 1000 IU, POWDER AND SOLVENT FOR INJECTABLE SOLUTION
Discuss questions about BENEFIX 1000 IU, POWDER AND SOLVENT FOR INJECTABLE SOLUTION, including use, safety considerations and prescription review, subject to medical assessment and local regulations.
Frequently Asked Questions















