
Ticagrelor Holsten

Zapytaj lekarza o receptę na Ticagrelor Holsten

Jak stosować Ticagrelor Holsten
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
1. NAZWA PRODUKTU LECZNICZEGO
Ticagrelor Holsten, 60 mg, tabletki powlekane
2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
Każda tabletka powlekana zawiera 60 mg tikagreloru.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
3. POSTAĆ FARMACEUTYCZNA
Tabletka powlekana.
Okrągłe (8,1 x 8,1 mm), obustronnie wypukłe, różowe tabletki oznaczone liczbą „60” po jednej stronie i gładkie
po drugiej stronie.
4. SZCZEGÓŁOWE DANE KLINICZNE
4.1 Wskazania do stosowania
Produkt leczniczy Ticagrelor Holsten, w skojarzeniu z kwasem acetylosalicylowym (ASA), jest wskazany w celu
zapobiegania zdarzeniom sercowo-naczyniowym u dorosłych pacjentów:
- z ostrym zespołem wieńcowym (OZW) lub
- z zawałem mięśnia sercowego (zawał serca) w wywiadzie i wysokim ryzykiem zdarzeń sercowo- naczyniowych (patrz punkty 4.2 i 5.1).
4.2 Dawkowanie i sposób podawania
Dawkowanie
Pacjenci przyjmujący produkt leczniczy Ticagrelor Holsten powinni codziennie przyjmować również małą dawkę
podtrzymującą kwasu acetylosalicylowego (ASA) 75-150 mg, jeśli nie jest to indywidualnie przeciwwskazane.
Ostre zespoły wieńcowe
Stosowanie produktu leczniczego Ticagrelor Holsten należy rozpocząć od pojedynczej dawki nasycającej 180 mg
(2 tabletki o mocy 90 mg) i kontynuować leczenie dawką 90 mg dwa razy na dobę.
U pacjentów z OZW czas trwania leczenia produktem leczniczym Ticagrelor Holsten 90 mg dwa razy na dobę,
powinien wynosić 12 miesięcy, chyba że istnieją wskazania kliniczne do przerwania leczenia (patrz punkt 5.1).
Odstawienie ASA można rozważyć po 3 miesiącach u pacjentów z OZW, u których wykonano zabieg przezskórnej
interwencji wieńcowej (PCI), i u których występuje zwiększone ryzyko krwawienia. W takim przypadku podawanie
tikagreloru jako jedynego leku przeciwpłytkowego należy kontynuować przez 9 miesięcy (patrz punkt 4.4).
Zawał mięśnia sercowego w wywiadzie
Zalecaną dawką produktu leczniczego Ticagrelor Holsten jest 60 mg dwa razy na dobę, jeśli potrzebne jest
przedłużone leczenie pacjentów z przebytym, co najmniej rok temu, zawałem serca w wywiadzie i z wysokim
ryzykiem zdarzeń sercowo-naczyniowych (patrz punkt 5.1). Leczenie można zacząć bez przerywania jako
kontynuację początkowego rocznego leczenia produktem leczniczym Ticagrelor Holsten 90 mg lub innym lekiem
hamującym receptory difosforanu adenozyny (ADP) u pacjentów z OZW i wysokim ryzykiem zdarzeń sercowo-
naczyniowych. Leczenie można również rozpocząć do 2 lat po zawale serca lub w ciągu roku od zaprzestania
leczenia poprzednim inhibitorem receptora ADP. Dane dotyczące skuteczności i bezpieczeństwa stosowania
tikagreloru ponad 3 lata długotrwałego leczenia są ograniczone.
Jeżeli potrzebna jest zmiana leku, pierwszą dawkę produktu leczniczego Ticagrelor Holsten należy podać 24
godziny po ostatniej dawce innego leku przeciwpłytkowego.
Pominięcie dawki
Należy także unikać błędów w dawkowaniu. W przypadku pominięcia dawki produktu leczniczego Ticagrelor
Holsten pacjent powinien zastosować tylko jedną tabletkę (następną dawkę) zgodnie z przyjętym schematem
dawkowania.
Szczególne grupy pacjentów
Pacjenci w podeszłym wieku
U pacjentów w podeszłym wieku nie jest wymagane dostosowanie dawki (patrz punkt 5.2).
Zaburzenia czynności nerek
Dostosowanie dawki nie jest konieczne u pacjentów z zaburzeniami czynności nerek (patrz punkt 5.2).
Zaburzenia czynności wątroby
Nie prowadzono badań dotyczących stosowania tikagreloru u pacjentów z ciężkimi zaburzeniami czynności
wątroby i z tego powodu jego stosowanie u tych pacjentów jest przeciwwskazane (patrz punkt 4.3). Dostępne są
jedynie ograniczone informacje na temat stosowania produktu u pacjentów z umiarkowanymi zaburzeniami
czynności wątroby. Dostosowanie dawki nie jest konieczne, jednak tikagrelor należy stosować ostrożnie (patrz
punkty 4.4 i 5.2). U pacjentów z łagodnymi zaburzeniami czynności wątroby dostosowanie dawki nie jest
konieczne (patrz punkt 5.2).
Dzieci i młodzież
Nie ustalono bezpieczeństwa i skuteczności stosowania tikagreloru u dzieci w wieku poniżej 18 lat.
Stosowanie tikagreloru u dzieci nie jest właściwe we wskazaniu niedokrwistość sierpowatokrwinkowa (patrz
punkty 5.1 i 5.2).
Sposób podawania
Podanie doustne.
Ticagrelor Holsten może być stosowany podczas posiłku lub niezależnie od posiłku.
W przypadku pacjentów, którzy mają trudność z połknięciem tabletki/tabletek w całości, tabletki można rozgnieść
na drobny proszek, zmieszać z połową szklanki wody i natychmiast wypić. Szklankę należy następnie przepłukać
wodą (kolejne pół szklanki wody) i ponownie wypić zawartość.
Zmieszaną z wodą rozgniecioną tabletkę (lub tabletki) można również podać przez zgłębnik nosowo-żołądkowy
(CH8 lub większy). Ważne jest, aby po podaniu mieszaniny przepłukać zgłębnik nosowo-żołądkowy wodą (pół
szklanki: minimum 50 ml do maksymalnie 125 ml).
4.3 Przeciwwskazania
- Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie
- 6.1 (patrz punkt 4.8).
- Czynne krwawienie patologiczne.
- Krwotok śródczaszkowy w wywiadzie (patrz punkt 4.8).
- Ciężkie zaburzenie czynności wątroby (patrz punkty 4.2, 4.4 i 5.2).
- Jednoczesne stosowanie tikagreloru i silnych inhibitorów enzymu CYP3A4 (np. ketokonazol, klarytromycyna, nefazodon, rytonawir i atazanawir), ponieważ może prowadzić do istotnego zwiększenia narażenia na tikagrelor (patrz punkt 4.5).
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Ryzyko krwawień
U pacjentów, u których stwierdzono zwiększone ryzyko wystąpienia krwawień, należy rozważyć stosunek
zagrożeń do korzyści związanych z zapobieganiem zdarzeniom sercowo-naczyniowym (patrz punkty 4.8 i 5.1). W
przypadku istnienia wskazań klinicznych do stosowania tikagreloru należy stosować go ostrożnie u następujących
grup pacjentów:
- Pacjenci ze skłonnością do krwawień (np. ze względu na niedawne urazy, zabiegi chirurgiczne, zaburzenia krzepnięcia, czynne lub niedawne krwawienia z przewodu pokarmowego) lub u których występuje zwiększone ryzyko urazu. Stosowanie tikagreloru jest przeciwwskazane u pacjentów z czynnym, patologicznym krwawieniem, u pacjentów z krwotokiem śródczaszkowym w wywiadzie oraz u pacjentów z ciężkimi zaburzeniami czynności wątroby (patrz punkt 4.3).
- Pacjenci stosujący jednocześnie leki, które mogą zwiększać ryzyko krwawień (np. niesteroidowe leki przeciwzapalne (NLPZ), doustne leki przeciwzakrzepowe i (lub) leki fibrynolityczne) zastosowane w ciągu 24 godzin przed zażyciem dawki tikagreloru.
W dwóch randomizowanych badaniach z grupą kontrolną (TICO i TWILIGHT) z udziałem pacjentów z OZW, u
których wykonano zabieg PCI z użyciem stentu uwalniającego lek wykazano, że odstawienie ASA po 3
miesiącach dwulekowej terapii przeciwpłytkowej tikagrelorem i ASA, a następnie kontynuowanie leczenia
tikagrelorem jako jedynym lekiem przeciwpłytkowym odpowiednio przez 9 i 12 miesięcy zmniejszyło ryzyko
krwawienia i nie spowodowało zwiększenia obserwowanego ryzyka poważnych niepożądanych zdarzeń sercowo-
naczyniowych (MACE) w porównaniu z kontynuacją dwulekowej terapii przeciwpłytkowej. Decyzję o
odstawieniu ASA po 3 miesiącach i kontynuacji podawania tikagreloru jako jedynego leku przeciwpłytkowego
przez 9 miesięcy u pacjentów ze zwiększonym ryzykiem krwawienia należy podjąć na podstawie oceny klinicznej
biorąc pod uwagę ryzyko krwawienia względem ryzyka zdarzeń zakrzepowych (patrz punkt 4.2).
Transfuzja płytek nie powodowała odwrócenia działania przeciwpłytkowego tikagreloru u zdrowych ochotników i
jest mało prawdopodobne, aby była korzystna klinicznie u pacjentów z krwawieniami.
Ponieważ zastosowanie desmopresyny wraz z tikagrelorem nie skraca standardowego czasu krwawienia, wątpliwe
jest, aby desmopresyna była skuteczna w leczeniu klinicznych incydentów krwawienia (patrz punkt 4.5).
Leczenie przeciwfibrynolityczne (kwas aminokapronowy lub kwas traneksamowy) i (lub) leczenie
rekombinowanym czynnikiem VIIa mogą zwiększać hemostazę. Tikagrelor może być ponownie zastosowany,
jeśli przyczyna krwawienia została zidentyfikowana i opanowana.
Zabiegi chirurgiczne
Należy poinstruować pacjentów, aby przed planowanymi zabiegami chirurgicznymi i zastosowaniem
jakichkolwiek nowych leków informowali lekarzy i lekarzy stomatologów o stosowaniu tikagreloru.
U pacjentów biorących udział w badaniu PLATO, którzy byli poddawani pomostowaniu aortalno-wieńcowemu
(CABG), w grupie leczonej tikagrelorem wystąpiło więcej krwawień niż w grupie leczonej klopidogrelem, jeśli
stosowanie leku przerwano na jeden dzień przed zabiegiem, ale jeśli stosowanie leku przerwano na dwa lub więcej
dni przed zabiegiem, liczba ciężkich krwawień była podobna w obu grupach (patrz punkt 4.8). Jeśli pacjent ma
być poddany planowemu zabiegowi chirurgicznemu i działanie przeciwpłytkowe nie jest pożądane, tikagrelor
należy odstawić na 5 dni przed zabiegiem (patrz punkt 5.1).
Pacjenci po przebytym niedokrwiennym udarze mózgu
Pacjenci z OZW po przebytym niedokrwiennym udarze mózgu mogą być leczeni tikagrelorem przez maksymalnie
12 miesięcy (badanie PLATO).
Do badania PEGASUS nie włączano pacjentów z zawałem serca w wywiadzie i z przebytym niedokrwiennym
udarem mózgu. Dlatego, z uwagi na brak danych, nie zaleca się leczenia tych pacjentów dłużej niż rok.
Zaburzenia czynności wątroby
Stosowanie tikagreloru u pacjentów z ciężkimi zaburzeniami czynności wątroby jest przeciwwskazane (patrz
punkty 4.2 i 4.3). Istnieją jedynie ograniczone doświadczenia ze stosowaniem tikagreloru u pacjentów z
umiarkowaną niewydolnością wątroby, w związku z tym zaleca się zachowanie ostrożności u tych pacjentów
(patrz punkty 4.2 i 5.2).
Pacjenci z ryzykiem wystąpienia zdarzeń bradykardii
Monitorowanie parametrów EKG w badaniu Holtera wykazało zwiększoną częstość występowania w większości
bezobjawowych pauz komorowych podczas leczenia tikagrelorem w porównaniu z klopidogrelem. Pacjenci ze
zwiększonym ryzykiem incydentów bradykardii (np. pacjenci bez rozrusznika z zespołem chorego węzła
zatokowego, z blokiem przedsionkowo-komorowym II lub III stopnia, lub u których występują omdlenia
związane z bradykardią) zostali wykluczeni z głównych badań oceniających bezpieczeństwo i skuteczność
stosowania tikagreloru. Dlatego też, ze względu na ograniczone doświadczenie kliniczne, tikagrelor powinien być
stosowany w tej grupie pacjentów z zachowaniem ostrożności (patrz punkt 5.1).
Dodatkowo należy zachować ostrożność podczas jednoczesnego stosowania tikagreloru z produktami leczniczymi
wywołującymi bradykardię. Jednak nie było dowodów na klinicznie znaczące działania niepożądane
obserwowane w badaniu PLATO po jednoczesnym podaniu z jednym lub więcej produktami leczniczymi
wywołującymi bradykardię (tj. 96% beta-adrenolityki, 33% antagoniści wapnia diltiazem i werapamil oraz 4%
digoksyna) (patrz punkt 4.5).
W badaniu PLATO, w podgrupie poddanej badaniu Holtera, u pacjentów stosujących tikagrelor, częściej niż u
pacjentów przyjmujących klopidogrel, obserwowano pauzy komorowe >3 sekundy w ostrej fazie ostrego zespołu
wieńcowego (OZW). Zwiększenie liczby wykrytych dzięki badaniu Holtera pauz komorowych podczas leczenia
tikagrelorem było wyraźniejsze u pacjentów z przewlekłą niewydolnością serca niż w populacji ogólnej w ostrej
fazie OZW, ale nie w obserwacji jednomiesięcznej stosowania tikagreloru, ani nie w porównaniu z klopidogrelem.
Nie stwierdzono żadnych niepożądanych konsekwencji klinicznych towarzyszących tej dysproporcji (w tym
omdleń lub wszczepień rozrusznika serca) w tej grupie pacjentów (patrz punkt 5.1).
Po wprowadzeniu produktu do obrotu u pacjentów przyjmujących tikagrelor zgłaszano przypadki bradyarytmii i
bloków AV (patrz punkt 4.8), głównie u pacjentów z OZW, gdzie niedokrwienie mięśnia sercowego i stosowane
jednocześnie leki obniżające częstość rytmu serca lub wpływające na przewodzenie w sercu są potencjalnymi
czynnikami zakłócającymi. Przed dostosowaniem leczenia należy ocenić stan kliniczny pacjenta i stosowane
jednocześnie leki jako potencjalne przyczyny.
Duszność
Pacjenci leczeni tikagrelorem zgłaszali występowanie duszności. Duszność jest zwykle łagodna do umiarkowanej i
często ustępuje bez konieczności odstawienia leku. U pacjentów z astmą/przewlekłą obturacyjną chorobą płuc
(POChP) może dojść do zwiększenia bezwzględnego ryzyka duszności podczas stosowania tikagreloru. Tikagrelor
należy stosować ostrożnie u pacjentów z astmą i (lub) POChP w wywiadzie. Mechanizm występowania duszności
nie został wyjaśniony. Jeśli pacjent zgłosi nowe incydenty duszności, wydłuży się czas ich trwania lub pogorszą się
objawy duszności podczas leczenia tikagrelorem, należy przeprowadzić pełną diagnostykę i jeśli pacjent źle znosi
ten stan, należy przerwać leczenie tikagrelorem. Dokładniejsze informacje podano w punkcie 4.8.
Ośrodkowy bezdech senny
Po wprowadzeniu produktu do obrotu u pacjentów przyjmujących tikagrelor zgłaszano występowanie
ośrodkowego bezdechu sennego, w tym oddychanie Cheyne’a-Stokesa. Jeśli podejrzewa się wystąpienie
ośrodkowego bezdechu sennego, należy rozważyć dalszą ocenę kliniczną.
Zwiększenie stężenia kreatyniny
Podczas leczenia tikagrelorem może wzrosnąć stężenie kreatyniny. Mechanizm tego zjawiska nie został ustalony.
Należy wykonywać badania kontrolne czynności nerek zgodnie ze stosowaną praktyką kliniczną. U pacjentów z
OZW zaleca się kontrolę czynności nerek również po miesiącu od rozpoczęcia leczenia tikagrelorem, ze
zwróceniem szczególnej uwagi na pacjentów w wieku ≥75 lat, pacjentów z umiarkowanymi do ciężkich
zaburzeniami czynności nerek i tych, którzy stosują leki z grupy antagonistów receptora angiotensyny (ang.
angiotensin receptor blocker, ARB).
Zwiększenie stężenia kwasu moczowego
W trakcie leczenia tikagrelorem może się rozwinąć hiperurykemia (patrz punkt 4.8). Należy zachować ostrożność
w przypadku pacjentów z hiperurykemią lub dnawym zapaleniem stawów w wywiadzie.
Jako środek ostrożności odradza się stosowanie tikagreloru u pacjentów z nefropatią moczanową.
Zakrzepowa plamica małopłytkowa (ang. thrombotic thrombocytopenic purpura,TTP)
W trakcie leczenia tikagrelorem bardzo rzadko zgłaszano zakrzepową plamicę małopłytkową (TTP).
Charakteryzuje się ona małopłytkowością i mikroangiopatyczną niedokrwistością hemolityczną związaną z
objawami neurologicznymi, zaburzeniami czynności nerek lub gorączką. TTP jest potencjalnie śmiertelnym
schorzeniem wymagającym szybkiego leczenia, w tym plazmaferezy.
Zakłócenia testów czynnościowych płytek krwi wykonywanych w celu zdiagnozowania
małopłytkowości zależnej od heparyny (ang. heparin induced thrombocytopenia, HIT)
W czynnościowym teście aktywacji płytek indukowanej heparyną (ang. heparin induced platelet activation,
HIPA)stosowanym do diagnozowania HIT, przeciwciała przeciwko kompleksowi czynnik płytkowy 4/heparyna
w surowicy pacjenta aktywują płytki krwi zdrowych dawców w obecności heparyny.
U pacjentów przyjmujacych tikagrelor zgłaszano fałszywie ujemne wyniki testów czynnościowych płytek krwi (w
tym m.in. testu HIPA) mających na celu zdiagnozowanie HIT. Jest to związane z hamowaniem receptora P2Y12
na zdrowych płytkach dawcy przez tikagrelor obecny w surowicy / osoczu pacjenta. Informacje na temat
równoczesnego leczenia tikagrelorem są wymagane do interpretacji wyników testów czynnościowych płytek krwi
stosowanych do diagnozy HIT.
U pacjentów, u których rozwinęła się małopłytkowość zależna od heparyny, należy ocenić stosunek korzyści do
ryzyka dalszego leczenia tikagrelorem, biorąc pod uwagę zarówno prozakrzepowy stan HIT, jak i zwiększone
ryzyko wystąpienia krwawienia podczas jednoczesnego leczenia antykoagulantem i tikagrelorem.
Inne
Na podstawie zaobserwowanej w badaniu PLATO zależności pomiędzy dawką podtrzymującą kwasu
acetylosalicylowego a względną skutecznością tikagreloru w porównaniu do klopidogrelu, nie zaleca się
jednoczesnego stosowania tikagreloru i kwasu acetylosalicylowego w dużych dawkach podtrzymujących (>300
mg) (patrz punkt 5.1).
Przedwczesne przerwanie leczenia
Przedwczesne przerwanie jakiegokolwiek leczenia przeciwpłytkowego, również produktem leczniczym Ticagrelor
Holsten, może skutkować zwiększonym ryzykiem zgonu z przyczyn sercowo-naczyniowych, zawału serca lub
udaru spowodowanego chorobą podstawową. Dlatego należy unikać przedwczesnego przerywania leczenia.
Sód
Ticagrelor Holsten zawiera mniej niż 1 mmol sodu (23 mg) na jedną dawkę, tzn., że jest zasadniczo „wolny od
sodu”.
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Tikagrelor jest przede wszystkim substratem izoenzymu CYP3A4, a także jego łagodnym inhibitorem.
Tikagrelor jest również substratem glikoproteiny P (P-gp) i słabym inhibitorem P-gp i może zwiększać narażenie
na substraty P-gp.
Wpływ produktów leczniczych i innych produktów na działanie tikagreloru
Inhibitory CYP3A4
- Silne inhibitory CYP3A4 - jednoczesne stosowanie ketokonazolu z tikagrelorem spowodowało 2,4-krotne zwiększenie C i 7,3-krotne AUC tikagreloru. C i AUC czynnego metabolitu było zmniejszone odpowiednio o 89% i 56%. Przewiduje się, że inne silne inhibitory CYP3A4 (klarytromycyna, nefazodon, rytonawir, atazanawir) wywołują podobne działanie i dlatego jednoczesne podawanie silnych inhibitorów CYP3A4 z tikagrelorem jest przeciwwskazane (patrz punkt 4.3).
- Umiarkowane inhibitory CYP3A4 - jednoczesne zastosowanie diltiazemu i tikagreloru spowodowało zwiększenie C tikagreloru o 69%, a AUC 2,7-krotnie oraz zmniejszenie C czynnego metabolitu o 38%, bez wpływu na jego AUC. Tikagrelor nie wpłynął na stężenie diltiazemu w osoczu. Inne umiarkowane inhibitory CYP3A4 (np. amprenawir, aprepitant, erytromycyna i flukonazol) mogą wykazywać podobne działanie i również mogą być stosowane jednocześnie z tikagrelorem.
- Obserwowano 2-krotne zwiększenie ekspozycji na tikagrelor po codziennym spożywaniu dużych ilości soku grejpfrutowego (3 x 200 ml). Nie należy spodziewać się, by ta wartość zwiększenia ekspozycji na tikagrelor była klinicznie istotna u większości pacjentów.
Induktory CYP3A
Jednoczesne zastosowanie ryfampicyny i tikagreloru zmniejszyło C i AUC tikagreloru odpowiednio o 73% i
86%. C czynnego metabolitu nie uległo zmianie, a jego AUC zmniejszyło się o 46%. Przewiduje się, że inne
induktory CYP3A (np. fenytoina, karbamazepina i fenobarbital) również zmniejszają narażenie na tikagrelor.
Jednoczesne stosowanie tikagreloru i silnych induktorów CYP3A może zmniejszyć stężenie i skuteczność
tikagreloru, dlatego jednoczesne stosowanie ich z tikagrelorem nie jest zalecane.
Cyklosporyna (inhibitor P-gp i CYP3A)
Jednoczesne stosowanie cyklosporyny (600 mg) i tikagreloru podwyższyło 2,3-krotnie C tikagreloru, a AUC –
2,8-krotnie. W obecności cyklosporyny AUC czynnego metabolitu tikagreloru wzrosło o 32% a C zmalało o
15%.
Brak danych dotyczących jednoczesnego stosowania tikagreloru i innych substancji czynnych będących silnymi
inhibitorami glikoproteiny P (P-gp) i umiarkowanymi inhibitorami CYP3A4 (np. werapamil, chinidyna), które
mogą zwiększać narażenie na tikagrelor. Jeśli nie można uniknąć leczenia skojarzonego, ich jednoczesne
stosowanie wymaga zachowania ostrożności.
Inne
Kliniczne badania interakcji wykazały, że jednoczesne stosowanie tikagreloru z heparyną, enoksaparyną i ASA
lub desmopresyną nie wpływało na farmakokinetykę tikagreloru lub jego czynnego metabolitu lub indukowaną
przez ADP agregację płytek w porównaniu ze stosowaniem samego tikagreloru. Jeśli jest to klinicznie wskazane,
produkty lecznicze zmieniające hemostazę powinny być stosowane ostrożnie w skojarzeniu z tikagrelorem.
U pacjentów z ACS leczonych morfiną obserwowano opóźnienie i zmniejszenie ekspozycji na doustne inhibitory
P2Y , w tym tikagrelor i jego aktywny metabolit (zmniejszenie ekspozycji na tikagrelor o 35%). Ta interakcja
może mieć związek z obniżoną motoryką żołądkowo-jelitową i dotyczy także innych opioidów. Kliniczne
znaczenie tego jest nieznane, ale dane wskazują na możliwość zmniejszenia skuteczności tikagreloru u pacjentów
otrzymujących jednocześnie tikagrelor i morfinę.
U pacjentów z ACS, u których nie można wstrzymać podawania morfiny, a szybkie zahamowanie P2Y jest
uważane za krytycznie istotne, można rozważyć stosowanie pozajelitowego inhibitora P2Y .
Wpływ tikagreloru na działanie innych leków
Produkty lecznicze metabolizowane przez CYP3A4
- Symwastatyna - jednoczesne stosowanie tikagreloru z symwastatyną powodowało zwiększenie C symwastatyny o 81% i AUC o 56% oraz zwiększenie C kwasu symwastatyny o 64% i jego AUC o 52% z pojedynczymi przypadkami zwiększenia 2- lub 3-krotnego. Jednoczesne stosowanie tikagrelolu i symwastatyny w dawce większej niż 40 mg na dobę mogłoby spowodować wystąpienie działań niepożądanych symwastatyny i dlatego należy je uwzględnić w ocenie potencjalnych korzyści tego skojarzenia. Nie stwierdzono wpływu symwastatyny na stężenie tikagreloru w osoczu. Tikagrelor może mieć podobny wpływ na stosowanie lowastatyny. Nie zaleca się jednoczesnego stosowania tikagreloru z symwastatyną lub lowastatyną w dawkach większych niż 40 mg.
- Atorwastatyna - jednoczesne stosowanie atorwastatyny i tikagreloru powoduje zwiększenie C i AUC kwasu atorwastatyny odpowiednio o 23% i 36%. Podobne zwiększenie AUC i C obserwowano dla wszystkich metabolitów kwasu atorwastatyny. Uważa się, że nie jest to istotne klinicznie.
- Nie można wykluczyć podobnego wpływu na inne statyny metabolizowane przez CYP3A4. W badaniu PLATO pacjenci przyjmowali jednak różne statyny i u 93% spośród wszystkich pacjentów biorących udział w tym badaniu nie było zastrzeżeń co do bezpieczeństwa wynikającego ze stosowania statyn.
Tikagrelor jest umiarkowanym inhibitorem CYP3A4. Nie zaleca się jednoczesnego stosowania tikagreloru i
substratów CYP3A4 o wąskim indeksie terapeutycznym (tj. cyzapryd i alkaloidy sporyszu), ponieważ tikagrelor
może zwiększać ekspozycję na te produkty lecznicze.
Substraty P-gp (w tym digoksyna, cyklosporyna)
Jednoczesne stosowanie tikagreloru zwiększa C i AUC digoksyny odpowiednio o 75% i 28%. Średnie
minimalne stężenia digoksyny zwiększyły się o około 30% po jednoczesnym zastosowaniu z tikagrelorem, przy
czym pojedyncze maksymalne stężenia wzrosły do 2-krotnego. Obecność digoksyny nie wpływa na C i AUC
tikagreloru i jego czynnego metabolitu. Dlatego zaleca się odpowiednią kontrolę kliniczną i (lub) monitorowanie
parametrów laboratoryjnych podczas jednoczesnego stosowania produktów leczniczych z wąskim indeksem
terapeutycznym, zależnych od P-gp, takich jak digoksyna i tikagrelor.
Tikagrelor nie wpływał na stężenie cyklosporyny we krwi. Nie badano wpływu tikagreloru na inne substraty P-gp.
Produkty lecznicze metabolizowane przez CYP2C9
Jednoczesne stosowanie tikagreloru i tolbutamidu nie spowodowało zmiany stężenia w osoczu żadnego z tych
produktów leczniczych, co sugeruje, że tikagrelor nie jest inhibitorem CYP2C9 i jest mało prawdopodobne, aby
zmieniał metabolizm produktów leczniczych, takich jak warfaryna czy tolbutamid za pośrednictwem CYP2C9.
Rosuwastatyna
Tikagrelor może wpływać na wydalanie rosuwastatyny przez nerki, zwiększając ryzyko akumulacji
rosuwastatyny. Chociaż właściwy mechanizm nie jest znany, w niektórych przypadkach, równoczesne stosowanie
tikagreloru i rosuwastatyny prowadziło do pogorszenia czynności nerek, wzrostu aktywności CPK (kinaza
fosfokreatynowa) i rabdomiolizy.
Doustne leki antykoncepcyjne
Jednoczesne stosowanie tikagreloru i lewonorgestrelu oraz etynyloestradiolu spowodowało około 20%
zwiększenie narażenia na etynyloestradiol, ale nie wpływało na farmakokinetykę lewonorgestrelu. Nie przewiduje
się klinicznie znaczącego wpływu na skuteczność doustnych środków antykoncepcyjnych, w przypadku
jednoczesnego stosowania lewonorgestrelu i etynyloestradiolu z tikagrelorem.
Produkty lecznicze wywołujące bradykardię
W związku z obserwowanymi, zwykle bezobjawowymi, pauzami komorowymi i bradykardią należy zachować
ostrożność podczas jednoczesnego stosowania tikagreloru z produktami leczniczymi wywołującymi bradykardię
(patrz punkt 4.4.). W badaniu PLATO nie zaobserwowano jednak dowodów na występowanie znaczących
klinicznie działań niepożądanych po jednoczesnym zastosowaniu z jednym lub więcej produktami leczniczymi
wywołującymi bradykardię (tj. 96% beta-adrenolityki, 33% inhibitory kanałów wapniowych: diltiazem i
werapamil oraz 4% digoksyna).
Jednoczesne stosowanie z innymi produktami leczniczymi
W badaniach klinicznych tikagrelor był stosowany jednocześnie z ASA, inhibitorami pompy protonowej,
statynami, beta-adrenolitykami, inhibitorami konwertazy angiotensyny (ang. angiotensin converting enzyme,
ACE) i antagonistami receptora angiotensyny, stosowanymi przez długi czas ze względu na konieczność leczenia
schorzeń współistniejących jak również z heparyną, heparyną drobnocząsteczkową i dożylnymi inhibitorami
GpIIb/IIIa przez krótki czas (patrz punkt 5.1). Nie zaobserwowano żadnych istotnych klinicznie interakcji podczas
stosowania tych produktów leczniczych.
Jednoczesne stosowanie tikagreloru i heparyny, enoksaparyny lub desmopresyny nie wpływało na czas częściowej
tromboplastyny po aktywacji (aPTT), aktywowany czas krzepnięcia (ACT) ani na oznaczanie aktywności
czynnika Xa. Jednak ze względu na potencjalne interakcje farmakodynamiczne, należy zachować ostrożność
podczas jednoczesnego stosowania tikagreloru z lekami zmieniającymi hemostazę.
W związku z obserwowanymi podczas stosowania selektywnych inhibitorów wychwytu zwrotnego serotoniny
(ang. selective serotonin reuptake inhibitors, SSRIs) (tj. paroksetyny, sertraliny i cytalopramu), nieprawidłowymi
krwawieniami skórnymi należy zachować ostrożność w przypadku stosowania SSRIs razem z tikagrelorem,
ponieważ może to zwiększyć ryzyko krwawienia.
4.6 Wpływ na płodność, ciążę i laktację
Kobiety w wieku rozrodczym
Kobiety w wieku rozrodczym powinny stosować odpowiednie środki antykoncepcyjne, aby zapobiec zajściu w
ciążę podczas leczenia tikagrelorem.
Ciąża
Nie ma lub jest ograniczona ilość danych dotyczących stosowania tikagreloru w czasie ciąży. Badania na
zwierzętach wykazały szkodliwy wpływ na rozrodczość (patrz punkt 5.3). Nie zaleca się stosowania tikagreloru w
czasie ciąży.
Karmienie piersią
Dostępne dane farmakodynamiczno-toksykologiczne z badań na zwierzętach wykazały, że tikagrelor i jego
czynne metabolity przenikają do mleka (patrz punkt 5.3). Nie można wykluczyć ryzyka dla
noworodków/niemowląt. Należy podjąć decyzję, czy przerwać karmienie piersią, czy zakończyć/przerwać terapię
tikagrelorem, biorąc pod uwagę korzyści karmienia piersią dla dziecka oraz korzyści terapii dla kobiety.
Płodność
U zwierząt tikagrelor nie wpływa na płodność samców ani samic (patrz punkt 5.3).
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Tikagrelor nie ma lub ma nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn Zgłaszano
występowanie zawrotów głowy i splątania u pacjentów leczonych tikagrelorem. W związku z tym pacjenci, u
których wystąpią te objawy, powinni zachować ostrożność podczas prowadzenia pojazdów lub obsługiwania
maszyn.
4.8 Działania niepożądane
Podsumowanie profilu bezpieczeństwa
Profil bezpieczeństwa tikagreloru był oceniany w ramach wyników dwóch dużych badań fazy 3 (PLATO i
PEGASUS), obejmujących ponad 39 000 pacjentów (patrz punkt 5.1).
W badaniu PLATO u pacjentów otrzymujących tikagrelor stwierdzono większą częstość przerwania leczenia z
powodu zdarzeń niepożądanych niż w grupie otrzymującej klopidogrel (7,4% wobec 5,4%).
W badaniu PEGASUS u pacjentów otrzymujących tikagrelor stwierdzono większą częstość przerwania leczenia z
powodu zdarzeń niepożądanych w porównaniu z pacjentami leczonymi ASA w monoterapii (16,1% w grupie
leczonej tikagrelorem w dawce 60 mg w skojarzeniu z ASA wobec 8,5% w grupie otrzymującej ASA w
monoterapii). Najczęstszymi zgłaszanymi działaniami niepożądanymi u pacjentów leczonych tikagrelorem były
krwawienie i duszność (patrz punkt 4.4).
Tabelaryczne zestawienie działań niepożądanych
Poniższe działania niepożądane rozpoznano w wyniku badań lub zgłoszono po wprowadzeniu tikagreloru do obrotu
(tabela 1).
Działania niepożądane wymienione zgodnie z klasyfikacją układów i narządów (ang. System Organ Class, SOC)
MedDRA. W obrębie każdej grupy SOC działania niepożądane uporządkowano według częstości występowania.
Częstość określono następująco: bardzo często (≥1/10), często (≥1/100 do <1><1>podstawie dostępnych danych).
Tabela 1 – Działania niepożądane przedstawione według częstości występowania oraz klasyfikacji układów i
narządów (SOC)
| Klasyfikacja układów i narządów | Bardzo często | Często | Niezbyt często | Częstość nieznana |
| Łagodne, złośliwe i nieokreślone nowotwory (w tym torbiele i polipy) | Krwawienia z guzaa | |||
| Zaburzenia krwi i układu chłonnego | Zaburzenia krwi, krwawieniab | Zakrzepowa plamica małopłytkowac | ||
| Zaburzenia układu immunologicznego | Nadwrażliwość, w tym obrzęk naczynioruchowyc | |||
| Zaburzenia metabolizmu i odżywiania | Hiperurykemiad | Dna moczanowa/Dnawe zapalenie stawów | ||
| Zaburzenia psychiczne | Dezorientacja | |||
| Zaburzenia układu nerwowego | Zawroty głowy, omdlenia, bóle głowy | Krwotok śródczaszkowym | ||
| Zaburzenia oka | Krwotok do okae | |||
| Zaburzenia ucha i błędnika | Zawroty głowy pochodzenia błędnikowego | Krwotok do ucha | ||
| Zaburzenia serca | Bradyarytmia, blok AVc |
| Klasyfikacja układów i narządów | Bardzo często | Często | Niezbyt często | Częstość nieznana |
| Zaburzenia naczyń | Niedociśnienie | |||
| Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Duszność | Krwawienia z układu oddechowegof | ||
| Zaburzenia żołądka i jelit | Krwotok z przewodu pokarmowegog, biegunka, nudności, niestrawność, zaparcia | Krwotok zaotrzewnowy | ||
| Zaburzenia skóry i tkanki podskórnej | Krwawienia podskórne lub do skóry właściwejh, wysypka, świąd | |||
| Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Krwawienia do mięśnii | |||
| Zaburzenia nerek i dróg moczowych | Krwawienie z układu moczowegoj | |||
| Zaburzenia układu rozrodczego i piersi | Krwawienia z układu rozrodczegok | |||
| Badania diagnostyczne | Zwiększone stężenie kreatyniny we krwid | |||
| Urazy, zatrucia i powikłania po zabiegach | Krwotok po zabiegu, krwawienia pourazowel |
Opis wybranych działań niepożądanych
Krwawienia
Wyniki badania PLATO dotyczące krwawień
Ogólny wynik dotyczący częstości krwawień w badaniu PLATO przedstawiono w tabeli 2.
Tabela 2 – Analiza wszystkich zdarzeń krwotocznych, wartości oszacowane metodą
Kaplana-Meiera po 12 miesiącach (PLATO)
| Tikagrelor 90 mg dwa razy na dobę N=9235 | Klopidogrel N=9186 | Wartość p* | |
| Poważne krwawienia ogółem, PLATO | 11,6 | 11,2 | 0,4336 |
| Poważne prowadzące do zgonu/zagrażające życiu, PLATO | 5,8 | 5,8 | 0,6988 |
| Poważne, niezwiązane z CABG, PLATO | 4,5 | 3,8 | 0,0264 |
| Poważne, niezwiązane z zabiegami, PLATO | 3,1 | 2,3 | 0,0058 |
| Poważne + niewielkie ogółem, PLATO | 16,1 | 14,6 | 0,0084 |
| Poważne + niewielkie, niezwiązane z zabiegami, PLATO | 5,9 | 4,3 | <0,0001 |
| Poważne, zdefiniowane wg TIMI | 7,9 | 7,7 | 0,5669 |
| Poważne + niewielkie, zdefiniowane wg TIMI | 11,4 | 10,9 | 0,3272 |
Tikagrelor i klopidogrel nie różniły się pod względem częstości występowania poważnych prowadzących do
zgonu/zagrażających życiu krwawień wg PLATO, poważnych krwawień ogółem wg PLATO, poważnych krwawień
wg TIMI czy niewielkich krwawień wg TIMI (tabela 2). Jednak więcej poważnych i niewielkich krwawień ogółem
wg kryteriów badania PLATO występowało w grupie tikagreloru w porównaniu z klopidogrelem. U jedynie
niewielkiej liczby pacjentów uczestniczących w badaniu PLATO wystąpiły krwawienia prowadzące do zgonu: 20
(0,2%) w grupie otrzymującej tikagrelor i 23 (0,3%) w grupie otrzymującej klopidogrel (patrz punkt 4.4).
Wiek, płeć, masa ciała, rasa, region geograficzny, schorzenia współistniejące, równocześnie stosowane leczenie i
historia choroby, w tym przebyty udar mózgu lub przemijający atak niedokrwienny, nie stanowiły czynników
predykcyjnych poważnych krwawień ogółem lub poważnych krwawień niezwiązanych z zabiegami wg kryteriów
badania PLATO. W związku z tym nie zidentyfikowano żadnej grupy, w której istniałoby zwiększone ryzyko jakiejś
podgrupy krwawień.
Krwawienie związane z CABG:
W badaniu PLATO u 42% z 1584 pacjentów (12% kohorty), u których wykonano zabieg CABG, wystąpiło poważne
prowadzące do zgonu/zagrażające życiu krwawienie wg kryteriów badania PLATO, przy czym nie stwierdzono
różnicy pomiędzy leczonymi grupami. Zakończone zgonem krwawienie po CABG wystąpiło u 6 pacjentów w
każdej grupie badanej (patrz punkt 4.4).
Krwawienia niezwiązane z CABG i krwawienia niezwiązane z zabiegami:
Tikagrelor i klopidogrel nie różniły się pod względem poważnych, niezwiązanych z CABG, prowadzących do
zgonu/zagrażających życiu krwawień wg definicji krwawień PLATO, jednak poważne krwawienia ogółem wg
PLATO, poważne krwawienia wg TIMI oraz poważne + niewielkiekrwawienia wg TIMI występowały częściej w
grupie otrzymującej tikagrelor. Analogicznie, gdy wyeliminowano wszystkie krwawienia związane z zabiegami,
okazało się, że więcej krwawień występowało w grupie otrzymującej tikagrelor niż klopidogrel (tabela 2). Do
przerwania leczenia z powodu krwawień niezwiązanych z zabiegami dochodziło częściej w grupie tikagreloru
(2,9%) niż w grupie klopidogrelu (1,2%; p<0,001).
Krwawienia śródczaszkowe:
W badaniu PLATO stwierdzono większą liczbę krwawień śródczaszkowych niezwiązanych z zabiegami w
przypadku tikagreloru (n=27 krwawień u 26 pacjentów, 0,3%) niż w przypadku klopidogrelu (n=14 krwawień,
0,2%), w tym 11 krwawień w przypadku tikagreloru i 1 w przypadku klopidogrelu prowadziło do zgonu. Nie
stwierdzono różnicy pod względem ogólnej liczby krwawień prowadzących do zgonu.
Wyniki badania PEGASUS dotyczące krwawień
Ogólny wynik dotyczący zdarzeń krwotocznych w badaniu PEGASUS przedstawiono w tabeli 3.
Tabela 3 – Analiza wszystkich zdarzeń krwotocznych, wartości oszacowane metodą
Kaplana-Meiera po 36 miesiącach (PEGASUS)
| Tikagrelor 60 mg dwa razy na dobę + ASA N=6958 | ASA w monoterapii N=6996 | |||
| Punkty końcowe oceny bezpieczeństwa | KM% | Współczynnik ryzyka (95% CI) | KM% | Wartość p |
| Kategorie krwawień zdefiniowane wg TIMI | ||||
| Poważne krwawienie wg TIMI | 2,3 | 2,32 (1,68, 3,21) | 1,1 | <0,0001 |
| Prowadzące do zgonu | 0,3 | 1,00 (0,44, 2,27) | 0,3 | 1,0000 |
| Krwawienie śródczaszkowe (ICH) | 0,6 | 1,33 (0,77, 2,31) | 0,5 | 0,3130 |
| Inne poważne krwawienie wg TIMI | 1,6 | 3,61 (2,31, 5,65) | 0,5 | <0,0001 |
| Poważne lub niewielkie krwawienie wg TIMI | 3,4 | 2,54 (1,93, 3,35) | 1,4 | <0,0001 |
| Poważne lub niewielkie krwawienie wymagające pomocy medycznej wg TIMI | 16,6 | 2,64 (2,35, 2,97) | 7,0 | <0,0001 |
| Kategorie krwawień zdefiniowane w badaniu PLATO | ||||
| Poważne krwawienie w badaniu PLATO | 3,5 | 2,57 (1,95, 3,37) | 1,4 | <0,0001 |
| Prowadzące do zgonu/zagrażające życiu | 2,4 | 2,38 (1,73, 3,26) | 1,1 | <0,0001 |
| Inne poważne krwawienie w badaniu PLATO | 1,1 | 3,37 (1,95, 5,83) | 0,3 | <0,0001 |
| Poważne lub niewielkie krwawienie w badaniu PLATO | 15,2 | 2,71 (2,40, 3,08) | 6,2 | <0,0001 |
W badaniu PEGASUS częstość występowania poważnych krwawień wg TIMI podczas stosowania tikagreloru w
dawce 60 mg dwa razy na dobę była większa niż podczas stosowania ASA w monoterapii. Nie stwierdzono
zwiększenia ryzyka krwawień w przypadku krwawień prowadzących do zgonu i jego jedynie niewielkie
zwiększenie obserwowano w przypadku krwotoków śródczaszkowych, w porównaniu ze stosowaniem ASA w
monoterapii. W badaniu obserwowano nieliczne krwawienia prowadzące do zgonu, 11 (0,3%) podczas stosowania
tikagreloru w dawce 60 mg i 12 (0,3%) podczas stosowania ASA w monoterapii. Obserwowane zwiększenie ryzyka
poważnych krwawień wg TIMI podczas stosowania tikagreloru w dawce 60 mg wynikało przede wszystkim z
większej częstości innych poważnych krwawień wg TIMI, związanych ze zdarzeniami niepożądanymi ze strony
przewodu pokarmowego.
Stwierdzono zwiększenie częstości krwawień, podobne do zwiększenia poważnych krwawień wg TIMI, w
przypadku kategorii poważnych lub niewielkich krwawień wg TIMI i poważnych krwawień w badaniu PLATO i
poważnych lub niewielkich krwawień w badaniu PLATO (patrz tabela 5). Do przerwania leczenia z powodu
krwawień dochodziło częściej podczas stosowania tikagreloru w dawce 60 mg niż podczas stosowania ASA w
monoterapii (6,2% oraz 1,5%). Większość z tych krwawień miała mniejsze nasilenie (klasyfikowano je jako
krwawienia wymagające pomocy medycznej wg TIMI), np. krwotoki z nos, siniaki i krwiaki.
Profil krwawień związanych ze stosowaniem tikagreloru w dawce 60 mg był spójny w szeregu wyodrębnionych
wcześniej podgrup (np. wg wieku, płci, masy ciała, rasy, regionu geograficznego, stanów współistniejących,
równocześnie stosowanego leczenia i historii choroby) w przypadku poważnych krwawień wg TIMI, poważnych
lub niewielkich krwawień wg TIMI i poważnych krwawień wg PLATO.
Krwawienia śródczaszkowe:
Samoistne krwawienia śródczaszkowe (ICH) obserwowano z podobną częstością u pacjentów otrzymujących
tikagrelor w dawce 60 mg i ASA w monoterapii (n=13, 0,2% w obu badanych grupach). W przypadku ICH
urazowych i związanych z zabiegami zaobserwowano niewielkie zwiększenie ich częstości występowania u
pacjentów leczonych tikagrelorem w dawce 60 mg (n=15, 0,2%) w porównaniu z ASA w monoterapii (n=10, 0,1%).
Wystąpiło 6 przypadków krwawienia śródczaszkowego prowadzącego do zgonu podczas leczenia tikagrelorem w
dawce 60 mg i 5 przypadków krwawienia śródczaszkowego prowadzącego do zgonu podczas stosowania ASA w
monoterapii. Częstość występowania krwawień śródczaszkowych była niewielka w obu leczonych grupach, biorąc
pod uwagę znaczne obciążenie badanej populacji chorobami współistniejącymi i czynnikami ryzyka chorób
sercowo-naczyniowych.
Duszność
Pacjenci leczeni tikagrelorem zgłaszają duszność, uczucie braku tchu.
W badaniu PLATO zdarzenia niepożądane zgłaszane jako duszność (duszność, duszność spoczynkowa, duszność
powysiłkowa, duszność napadowa nocna lub nocna duszność), gdy zestawione łącznie, zgłaszało 13,8% pacjentów
leczonych tikagrelorem i 7,8% pacjentów leczonych klopidogrelem. U 2,2% pacjentów leczonych tikagrelorem i u
0,6% leczonych klopidogrelem prowadzący badanie PLATO uznali duszność za przyczynowo związaną z
leczeniem i było kilka przypadków ciężkiej duszności (0,14% tikagrelor; 0,02% klopidogrel), (patrz punkt 4.4).
Większość zdarzeń niepożądanych zgłaszanych jako duszność miała nasilenie łagodne do umiarkowanego i
większość była zgłaszana jako pojedynczy epizod wcześnie na początku leczenia.
W porównaniu z kopidogrelem, pacjenci z astmą/POChP leczeni tikagrelorem mogą mieć zwiększone ryzyko
pojawienia się nie-ciężkiej duszności (3,29 % tikagrelor vs 0,53% klopidogrel) i ciężkiej duszności (0,38%
tikagrelor vs 0,00% klopidogrel). W wartościach bezwzględnych, to ryzyko jest wyższe niż dla całej populacji
badania PLATO. Należy zachować ostrożność stosując tikagrelor u pacjentów z astmą i (lub) POChP w wywiadzie
(patrz punkt 4.4).
Około 30% epizodów duszności ustępowało w ciągu 7 dni. W badaniu PLATO brali udział pacjenci z zastoinową
niewydolnością serca, POChP albo astmą w wywiadzie; ci pacjenci, i pacjenci w podeszłym wieku, częściej
zgłaszali duszność. 0,9% pacjentów w grupie leczonej tikagrelorem zrezygnowało z leczenia z powodu duszności
w porównaniu do 0,1% w grupie leczonej klopidogrelem. Zwiększona częstość epizodów duszności w trakcie
stosowania tikagreloru nie jest związana z nową lub pogarszającą się chorobą serca lub płuc (patrz punkt 4.4).
Tikagrelor nie wpływa na testy czynnościowe płuc.
W badaniu PEGASUS duszność odnotowano u 14,2% pacjentów otrzymujących tikagrelor w dawce 60 mg dwa
razy na dobę i u 5,5% pacjentów otrzymujących ASA w monoterapii. Podobnie jak w badaniu PLATO, większość
przypadków zgłoszonej duszności miała nasilenie lekkie do umiarkowanego (patrz punkt 4.4). Pacjenci, którzy
zgłaszali duszność, byli na ogół starsi i częściej mieli duszność, POChP lub astmę w wywiadzie.
Badania diagnostyczne
Zwiększenie stężenia kwasu moczowego: w badaniu PLATO zwiększenie stężenia kwasu moczowego w surowicy
powyżej górnej granicy normy wystąpiło u 22% pacjentów otrzymujących tikagrelor w porównaniu do 13%
pacjentów stosujących klopidogrel. Odpowiednie liczby w badaniu PEGASUS wynosiły 9,1%, 8,8% i 5,5%
odpowiednio dla tikagreloru w dawce 90 mg, tikagreloru w dawce 60 mg i placebo. Średnie stężenie kwasu
moczowego w surowicy wzrosło o około 15% u osób stosujących tikagrelor w porównaniu do wzrostu o około 7,5%
wśród leczonych klopidogrelem. Po zakończeniu leczenia zaobserwowano zmniejszenie stężenia kwasu
moczowego do około 7% u pacjentów leczonych tikagrelorem, ale nie stwierdzono zmniejszenia w przypadku
klopidogrelu. W badaniu PEGASUS stwierdzono odwracalne zwiększenie średniego stężenia kwasu moczowego w
surowicy o 6,3% i 5,6% w przypadku odpowiednio tikagreloru w dawce 90 mg i 60 mg, wobec zmniejszenia go o
1,5% w grupie placebo. W badaniu PLATO częstość występowania dnawego zapalenia stawów wynosiła 0,2% w
grupie tikagreloru wobec 0,1% w grupie klopidogrelu. Odpowiednie częstości występowania dny/dnawego
zapalenia stawów w badaniu PEGASUS wynosiły 1,6%, 1,5% i 1,1% odpowiednio w przypadku tikagreloru w
dawce 90 mg, tikagreloru w dawce 60 mg i placebo.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych.
Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby
należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za
pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji
Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C
PL-02 222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
4.9 Przedawkowanie
Tikagrelor jest dobrze tolerowany po zastosowaniu pojedynczej dawki do 900 mg. W badaniuz pojedynczą
rosnącą się dawką, działanie toksyczne na przewód pokarmowy było zależne od dawki. Do innych, klinicznie
znaczących działań niepożądanych, które mogą wystąpić po przedawkowaniu, zaliczają się duszność i pauzy
komorowe (patrz punkt 4.8).
W przypadku przedawkowania mogą wystąpić powyższe potencjalne działania niepożądane i należy rozważyć
monitorowanie elektrokardiogramu (EKG).
Obecnie nie jest znane antidotum, które odwraca skutki działania tikagreloru, a tikagrelor nie jest usuwany
podczas dializy (patrz punkt 5.2). Leczenie przedawkowania należy prowadzić zgodne z miejscową standardową
praktyką medyczną. Spodziewanym efektem przedawkowania tikagreloru jest ryzyko przedłużającego się czasu
trwania krwawienia, związanego z zahamowaniem płytek krwi. Jest mało prawdopodobne, aby transfuzja płytek
krwi była korzystna klinicznie u pacjentów z krwawieniami (patrz punkt 4.4). Jeśli wystąpi krwawienie, należy
podjąć inne odpowiednie leczenie wspomagające.
5. WŁAŚCIWOŚCI FARMAKOLOGICZNE
5.1 Właściwości farmakodynamiczne
Grupa farmakoterapeutyczna: leki hamujące agregację płytek z wyłączeniem heparyny, kod ATC:
B01AC24
Mechanizm działania
Ticagrelor Holsten zawiera tikagrelor, należący do chemicznej grupy cyklopentylotriazolopirymidyn (CPTP).
Tikagrelor jest doustnym, bezpośrednio działającym, selektywnym i wiążącym się odwracalnie antagonistą
receptora P2Y12, który zapobiega ADP-zależnej aktywacji i agregacji płytek związanej z receptorem P2Y12.
Tikagrelor nie zapobiega wiązaniu ADP, ale po przyłączeniu się do receptora P2Y12 zapobiega stymulowanemu
przez ADP przekazywaniu sygnału. Ponieważ płytki krwi uczestniczą w inicjowaniu i (lub) progresji
zakrzepowych powikłań miażdżycy, wykazano, że hamowanie czynności płytek krwi zmniejsza ryzyko zdarzeń
sercowo-naczyniowych, takich jak zgon, zawał mięśnia sercowego czy udar mózgu.
Tikagrelor zwiększa także lokalne stężenia endogennej adenozyny na skutek hamowania równowagowego
transportera nukleozydów-1 (ENT-1, ang. equilibrative nucleoside transporter 1).
Wykazano, że tikagrelor nasila następujące, zależne od adenozyny, działania u zdrowych ochotników oraz
pacjentów z OZW: rozszerzenie naczyń krwionośnych (mierzone jako wzrost przepływu wieńcowego u zdrowych
ochotników oraz u pacjentów z OZW; ból głowy), hamowanie czynności płytek krwi (w pełnej krwi ludzkiej w
warunkach in vitro) oraz duszność. Jednak związek pomiędzy obserwowanym zwiększeniem ilości adenozyny a
skutkami klinicznymi (np. zachorowalność-śmiertelność) nie został wyraźnie określony.
Działanie farmakodynamiczne
Początek działania
U pacjentów ze stabilną chorobą wieńcową stosujących kwas acetylosalicylowy tikagrelor wykazuje szybki
początek działania farmakologicznego, czego przejawem jest średnie zahamowanie agregacji płytek (IPA) równe
około 41% po 30 minutach od zastosowania tikagreloru w dawce nasycającej 180 mg z maksymalnym wpływem
IPA równym 89% po upływie 2 do 4 godzin od zastosowania leku, utrzymującym się od 2 do 8 godzin. U 90%
pacjentów największy stopień zahamowania płytek, przewyższający 70%, obserwowany jest po 2 godzinach od
zastosowania leku.
Koniec działania
Jeśli jest planowane wykonanie zabiegu CABG, ryzyko krwawienia związane ze stosowaniem tikagreloru jest
większe w porównaniu z klopidogrelem po zaprzestaniu stosowania na krócej niż 96 godzin przed zabiegiem.
Dane dotyczące zmiany terapii
Zmiana leczenia z klopidogrelu w dawce 75 mg na tikagrelor w dawce 90 mg dwa razy na dobę skutkuje
zwiększeniem IPA o 26,4% w liczbach bezwzględnych, a zmiana z tikagreloru na klopidogrel powoduje
zmniejszenie IPA o 24,5% w liczbach bezwzględnych. Pacjenci mogą przejść z klopidogrelu na tikagrelor bez
zaburzenia działania przeciwpłytkowego (patrz punkt 4.2).
Skuteczność i bezpieczeństwo stosowania w badaniach klinicznych
Dane kliniczne potwierdzające skuteczność i bezpieczeństwo stosowania tikagreloru pochodzą z dwóch badań
fazy 3:
- z badania PLATO [ PLATelet Inhibition and Patient Outcomes], w którym tikagrelor porównywano z klopidogrelem, przy czym oba te leki podawano w skojarzeniu z ASA (kwas acetylosalicylowy) i z innymi standardowymi sposobami leczenia;
- z badania PEGASUS TIMI-54 [ PrEvention with TicaGrelor of SecondAry Thrombotic Events inHigh-RiSk AcUte Coronary Syndrome Patients], w którym tikagrelor w skojarzeniu z ASA porównywano z ASA w monoterapii.
Badanie PLATO (ostre zespoły wieńcowe)
Badanie PLATO objęło 18 624 pacjentów z ostrym zespołem wieńcowym, którzy zgłaszali się w ciągu 24 godzin
od wystąpienia objawów niestabilnej dusznicy (UA), zawału mięśnia sercowego bez uniesienia odcinka ST
(NSTEMI) lub zawału mięśnia sercowego z uniesieniem odcinka ST (STEMI) i którzy byli wstępnie leczeni
farmakologicznie, lub mieli wykonaną przezskórną interwencję wieńcową (PCI), lub mieli wykonane CABG.
Skuteczność kliniczna
W połączeniu z dobową dawką ASA tikagrelor w dawce 90 mg dwa razy na dobę wykazywał przewagę nad
klopidogrelem w dawce 75 mg na dobę w zapobieganiu wystąpieniu złożonego punktu końcowego (zgon z
przyczyn sercowo-naczyniowych, zawał mięśnia sercowego lub udar), przy czym różnica wynikała głównie z
liczby zgonów z przyczyn sercowo-naczyniowych i zawałów mięśnia sercowego. Pacjenci otrzymywali
klopidogrel w dawce początkowej 300 mg (u pacjentów poddawanych przezskórnej interwencji wieńcowej
możliwa była dawka wynosząca 600 mg) lub tikagrelor w dawce 180 mg.
Taki wynik uzyskano wcześnie (bezwzględna redukcja ryzyka [ARR] 0,6% i względna redukcja ryzyka [RRR]
12% w 30. dniu), a skuteczność leczenia utrzymywała się nadal przez cały okres 12 miesięcy, osiągając ARR
1,9% w ciągu roku i RRR 16%. Te wyniki wskazują, że odpowiedni czas leczenia pacjentów tikagrelolem 90 mg
dwa razy na dobę wynosi 12 miesięcy (patrz punkt 4.2).
Leczenie 54 pacjentów z OZW tikagrelolem zamiast klopidogrelem zapobiega 1 incydentowi sercowo-
naczyniowemu; leczenie 91 pacjentów zapobiega 1 zgonowi z przyczyn sercowo-naczyniowych (patrz wykres 1 i
tabela 4).
Lepsze wyniki leczenia tikagrelorem w porównaniu z klopidogrelem są w sposób spójny widoczne w wielu
podgrupach pacjentów, włączając masę ciała, płeć, cukrzycę w wywiadzie, przemijające napady niedokrwienne
lub udar niezwiązany z krwotokiem lub rewaskularyzację; jednoczesne leczenie z zastosowaniem heparyny,
inhibitorów GpIIb/IIIa i inhibitorów pompy protonowej (patrz punkt 4.5); ostateczne rozpoznanie kliniczne
(STEMI, NSTEMI czy UA) i planowany w czasie randomizacji sposób leczenia (leczenie inwazyjne lub
zachowawcze).
Z niewielką znamiennością efekt leczenia różnił się w zależności od regionu, przez co współczynnik ryzyka (HR)
dla pierwszorzędowego punktu końcowego wskazuje na korzyści ze stosowania tikagreloru na całym świecie z
wyjątkiem Ameryki Północnej, która reprezentuje około 10% ogółu badanej populacji, gdzie wynik HR jest
korzystniejszy dla klopidogrelu (obecność interakcji p=0,045).
Analizy czynnikowe wskazują na możliwość istnienia związku z dawką ASA, co oznacza, że obserwowano
zmniejszenie skuteczności tikagreloru wraz ze zwiększeniem dawek ASA. Dawki ASA do przewlekłego
stosowania z tikagrelorem powinny wynosić 75 – 150 mg (patrz punkty 4.2 i 4.4).
Wykres 1 pokazuje szacunkowe ryzyko pierwszego wystąpienia któregokolwiek zdarzenia złożonego punktu
końcowego do oceny skuteczności.
Wykres 1 – Analiza pierwszorzędowego klinicznego złożonego punktu końcowego zgonu z przyczyn sercowo-naczyniowych, zawału mięśnia sercowego i udaru mózgu (PLATO)
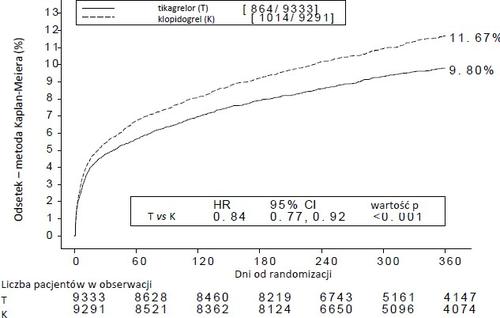
Tikagrelor zmniejszał częstość występowania pierwszorzędowego złożonego punktu końcowego w porównaniu z
klopidogrelem, w obu grupach pacjentów UA/NSTEMI i STEMI (tabela 4). Z tego względu produkt leczniczy
Ticagrelor Holsten w dawce 90 mg dwa razy na dobę łącznie z ASA w małej dawce można stosować u pacjentów
z OZW (niestabilna dusznica bolesna, zawał mięśnia sercowego bez uniesienia odcinka [NSTEMI] lub zawał
mięśnia sercowego z uniesieniem odcinka ST [STEMI]), w tym u pacjentów leczonych farmakologicznie oraz u
pacjentów poddawanych zabiegowi przezskórnej interwencji wieńcowej (PCI) lub pomostowania aortalno-
wieńcowemu (CABG).
Tabela 4 - Analiza pierwszorzędowych i drugorzędowych punktów końcowych oceny skuteczności (PLATO)
| Tikagrelor 90 mg dwa razy na dobę (% pacjent ów, u których | Klopidogrel 75 mg raz na dobę (% pacjentów, u których wystąpiło | ARRa (%/rok) | RRRa (%) (95% CI) | Wartość p |
| wystąpiło zdarzenie) N=9333 | zdarzenie) N=9291 | ||||
| Zgon z przyczyn CV (sercowo- naczyniowych), MI (zawał serca z wyjątkiem niemego MI) lub udar | 8,5 | 10,0 | 1,7 | 16 (6, 25) | 0,0025 |
| Plan leczenia inwazyjnego | 8,5 | 10,0 | 1,7 | 16 (6, 25) | 0,0025 |
| Plan leczenia zachowawczego | 11,3 | 13,2 | 2,3 | 15 (0,3, 27) | 0,0444d |
| Zgon z przyczyn CV | 3,8 | 4,8 | 1,1 | 21 (9, 31) | 0,0013 |
| MI (z wyjątkiem niemego MI)b | 5,4 | 6,4 | 1,1 | 16 (5, 25) | 0,0045 |
| Udar | 1,3 | 1,1 |
|
| 0,2249 |
| Zgon z jakiejkolwiek przyczyny, MI (z wyjątkiem niemego MI) lub udar | 9,7 | 11,5 | 2,1 | 16 (8, 23) | 0,0001 |
| Zgon z przyczyn CV, ogółem MI, udar, SRI, RI, TIA lub inne ATE | 13,8 | 15,7 | 2,1 | 12 (5, 19) | 0,0006 |
| Zgon z jakiejkolwiek przyczyny | 4,3 | 5,4 | 1,4 | 22 (11, 31) | 0,0003d |
| Skrzeplina zamykająca stent | 1,2 | 1,7 | 0,6 | 32 (8, 49) | 0,0123d |
Subanaliza genetyczna w badaniu PLATO
Genotypowanie pod kątem CYP2C19 i ABCB1, wykonane w badaniu PLATO u 10 285 pacjentów, pozwoliło na
określenie relacji między grupami genotypowymi a wynikami badania PLATO.
Wyższość tikagreloru nad klopidogrelem w zmniejszaniu liczby ciężkich incydentów sercowo-naczyniowych nie
była znamiennie zależna od genotypu CYP2C19 lub ABCB1. Podobnie jak w całym badaniu PLATO, całkowita
liczba ciężkich krwawień wg definicji PLATO nie różniła się w grupie tikagreloru i klopidogrelu, niezależnie od
genotypu CYP2C19 lub ABCB1. Krwawienia ciężkie zgodnie z definicją PLATO, niezwiązane z CABG
występowały częściej w grupie tikagrelolu w porównaniu z klopidogrelem u pacjentów z utratą jednego lub
więcej funkcyjnych alleli CYP2C19, ale podobnie do grupy klopidogrelu u pacjentów bez utraty alleli
funkcyjnych.
Łączna ocena skuteczności i bezpieczeństwa stosowania
Łączna ocena skuteczności i bezpieczeństwa stosowania (zgon z przyczyn sercowo-naczyniowych, zawał serca,
udar lub ciężkie krwawienie wg definicji PLATO) wskazuje, że korzyści wynikające ze skuteczności tikagreloru,
w porównaniu z klopidogrelem, nie są utracone z powodu liczby ciężkich krwawień (ARR 1,4%, RRR 8%, HR
0,92; p=0,0257) przez okres 12 miesięcy od wystąpienia OZW.
Bezpieczeństwo kliniczne
Podgrupa z badaniem Holtera
W celu zbadania występowania pauz komorowych i innych arytmii w trakcie badania PLATO badacze
monitorowali metodą Holtera podgrupę blisko 3000 pacjentów, z których u około 2000 wykonano zapisy w ostrej
fazie OZW i po upływie miesiąca. Podstawową obserwowaną zmienną było występowanie pauz komorowych ≥3
sekundy. Większą liczbę pauz komorowych obserwowano w grupie tikagreloru (6,0%) niż w grupie klopidogrelu
(3,5%) w ostrej fazie OZW; i po upływie miesiąca – odpowiednio 2,2% i 1,6% (patrz punkt 4.4). Zwiększona
częstość pauz komorowych w ostrej fazie OZW obserwowana była wyraźniej u pacjentów leczonych tikagrelorem
z zastoinową niewydolnością serca w wywiadzie (9,2% wobec 5,4% pacjentów bez zastoinowej niewydolności
serca w wywiadzie; w przypadku klopidogrelu, 4,0% pacjentów z zastoinową niewydolnością serca w wywiadzie
i 3,6% pacjentów bez zastoinowej niewydolności serca). Ta dysproporcja nie wystąpiła po 1 miesiącu: 2% vs
2,1% w przypadku pacjentów stosujących tikagrelor, odpowiednio z lub bez zastoinowej niewydolności serca; i
3,8% wobec 1,4% w przypadku stosowania klopidogrelu. Nie stwierdzono niekorzystnych konsekwencji
klinicznych towarzyszących tym nieprawidłowościom (włączając zastosowanie rozrusznika) w tej grupie
pacjentów.
Badanie PEGASUS (zawał mięśnia sercowego w wywiadzie)
Badanie PEGASUS TIMI-54 było obejmującym 21 162 pacjentów, randomizowanym, prowadzonym metodą
podwójnie ślepej próby w grupach równoległych, kontrolowanym placebo, międzynarodowym badaniem
wieloośrodkowym o przebiegu zależnym od punktów końcowych, oceniającym zapobieganie zdarzeniom
sercowo-naczyniowym dzięki stosowaniu tikagreloru w 2 dawkach (albo 90 mg dwa razy na dobę, albo 60 mg
dwa razy na dobę) w skojarzeniu z ASA w małej dawce (75-150 mg) w porównaniu z ASA w monoterapii u
pacjentów z zawałem serca w wywiadzie i z dodatkowymi czynnikami ryzyka wystąpienia takich zdarzeń.
Pacjentów kwalifikowano do udziału w badaniu, gdy byli w wieku, co najmniej 50 lat, przebyli w przeszłości
zawał mięśnia sercowego (w okresie od 1 do 3 lat przed randomizacją) i mieli, co najmniej jeden
z następujących czynników ryzyka zdarzeń zakrzepowych o podłożu miażdżycowym: wiek ≥65 lat, cukrzycę
wymagającą leczenia farmakologicznego, drugi przebyty zawał mięśnia sercowego, cechy wielonaczyniowej
choroby wieńcowej lub przewlekłą nie krańcową niewydolność nerek.
Pacjenci nie kwalifikowali się do udziału w badaniu, gdy planowano u nich stosowanie antagonisty receptora
P2Y12, dipirydamolu, cylostazolu lub leczenia przeciwzakrzepowego w okresie badania; jeśli występowało u nich
zaburzenie krwotoczne lub mieli udar niedokrwienny mózgu albo krwawienie śródczaszkowe, guz ośrodkowego
układ nerwowego lub nieprawidłową budowę naczyń śródczaszkowych w wywiadzie; jeśli wystąpiło u nich
krwawienie z przewodu pokarmowego w okresie ostatnich 6 miesięcy lub przebyli poważny zabieg chirurgiczny
w okresie ostatnich 30 dni.
Skuteczność kliniczna
Wykres 2 – Analiza pierwszorzędowego klinicznego złożonego punktu końcowego zgonu z przyczyn sercowo-naczyniowych, zawału mięśnia sercowego i udaru mózgu (PEGASUS)
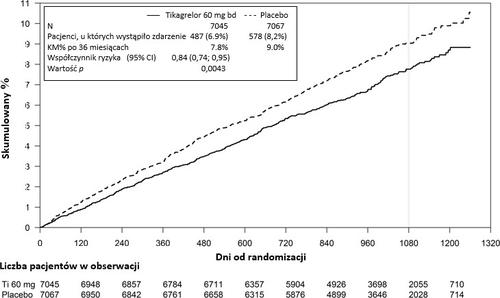
Tabela 5 - Analiza pierwszorzędowych i drugorzędowych punktów końcowych oceny skuteczności (PEGASUS)
| Tikagrelor 60 mg dwa razy na dobę + ASA N = 7045 | ASA w monoterapii N = 7067 | Wartość p | ||||
| Cecha | Pacjenci, u których wystąpiło zdarzenie | KM % | HR (95% CI) | Pacjenci, u których wystąpiło zdarzenie | KM % | |
| Pierwszorzędowy punkt końcowy | ||||||
| Złożony punkt końcowy zgonu z przyczyn CV/MI/udaru mózgu | 487 (6,9%) | 7,8% | 0,84 (0,74, 0,95) | 578 (8,2%) | 9,0% | 0,0043 (s) |
| Zgon z przyczyn CV | 174 (2,5%) | 2,9% | 0,83 (0,68, 1,01) | 210 (3,0%) | 3,4% | 0,0676 |
| MI | 285 (4,0%) | 4,5% | 0,84 (0,72, 0,98) | 338 (4,8%) | 5,2% | 0,0314 |
| Udar mózgu | 91 (1,3%) | 1,5% | 0,75 (0,57, 0,98) | 122 (1,7%) | 1,9% | 0,0337 |
| Tikagrelor 60 mg dwa razy na dobę + ASA N = 7045 | ASA w monoterapii N = 7067 | Wartość p | ||||
| Cecha | Pacjenci, u których wystąpiło zdarzenie | KM % | HR (95% CI) | Pacjenci, u których wystąpiło zdarzenie | KM % | |
| Drugorzędowy punkt końcowy | ||||||
| Zgon z przyczyn CV | 174 (2,5%) | 2,9% | 0,83 (0,68, 1,01) | 210 (3,0%) | 3,4% | |
| Zgon z jakiejkolwiek przyczyny | 289 (4,1%) | 4,7% | 0,89 (0,76, 1,04) | 326 (4,6%) | 5,2% | |
.
Oba schematy leczenia tikagrelorem w skojarzeniu z ASA (z zastosowaniem dawek
tikagreloru 60 mg dwa razy na dobę i 90 mg dwa razy na dobę) wykazywały przewagę nad
ASA w monoterapii pod względem zapobiegania zdarzeniom sercowo-naczyniowym
(złożony punkt końcowy: zgon z przyczyn sercowo-naczyniowych, zawał mięśnia sercowego i
udar mózgu), z niezmiennym skutkiem leczenia w całym okresie badania, co dało
wskaźniki 16% RRR i 1,27% ARR w grupie tikagreloru w dawce 60 mg oraz 15% RRR i
1,19% ARR w grupie tikagreloru w dawce 90 mg.
Chociaż profile skuteczności dawek 90 mg i 60 mg były podobne, istnieją dane
świadczące o tym, że mniejsza dawka wykazuje korzystniejszy profil tolerancji i
bezpieczeństwa w stosunku do ryzyka krwawień i duszności. W związku z tym, tylko
produkt leczniczy Ticagrelor Holsten w dawce 60 mg dwa razy na dobę w skojarzeniu z
ASA jest zalecany w zapobieganiu zdarzeniom sercowo-naczyniowym (zgon z przyczyn
sercowo-naczyniowych, zawał mięśnia sercowego i udar mózgu) u pacjentów z zawałem
mięśnia sercowego w wywiadzie i z wysokim ryzykiem zdarzeń zakrzepowych o podłożu
miażdżycowym.
W porównaniu z ASA w monoterapii, stosowanie tikagreloru w dawce 60 mg dwa razy na
dobę prowadziło do istotnego statystycznie zmniejszenia częstości występowania
pierwszorzędowego złożonego punktu końcowego w postaci zgonu z przyczyn sercowo-
naczyniowych, zawału mięśnia sercowego i udaru mózgu. Każdy z komponentów przyczynił
się do zmniejszenia częstości występowania złożonego punktu końcowego (zgon z
przyczyn sercowo-naczyniowych 17% RRR, zawał mięśnia sercowego 16% RRR i udar mózgu
25% RRR).
Współczynnik RRR złożonego punktu końcowego w okresie od 1. do 360. dnia (17% RRR)
i począwszy od 361. dnia (16% RRR) był podobny. Dane dotyczące skuteczności i
bezpieczeństwa użycia tikagreloru powyżej 3 lat przedłużonego leczenia są ograniczone.
Nie ma danych wskazujących na korzyści stosowania (brak redukcji pierwszorzędowego
złożonego punktu końcowego dotyczącego śmierci sercowo-naczyniowej, zawału mięśnia
sercowego i udaru przy wzroście poważnych krwawień) tikagreloru 60 mg dwa razy na
dobę u pacjentów klinicznie stabilnych powyżej 2 lat od zawału mięśnia sercowego lub
kiedy więcej niż rok upłynął od zaprzestania przyjmowania poprzedniego ADP inhibitora
(patrz punkt 4.2)
Bezpieczeństwo kliniczne
Częstość przerywania leczenia tikagrelorem 60 mg z powodu krwawień i duszności była wyższa u
pacjentów powyżej 75. roku życia (42%) niż u pacjentów młodszych (od 23 do 31% ) z różnicą w
stosunku do placebo większą niż 10% (42% vs 29%) u pacjentów >75 roku życia.
Dzieci i młodzież
W randomizowanym badaniu III fazy prowadzonym w grupach równoległych metodą podwójnie
ślepej próby (HESTIA 3) 193 dzieci i młodzieży (w wieku od 2 do mniej niż 18 lat) z
niedokrwistością sierpowatokrwinkową zostało losowo przydzielonych do grupy otrzymującej placebo
lub tikagrelor w dawkach od 15 mg do 45 mg dwa razy na dobę, w zależności od masy ciała.
Tikagrelor powodował zahamowanie płytek krwi o medianie wynoszącej 35% przed podaniem dawki
i 56% po 2 godzinach od podania dawki w stanie stacjonarnym.
W porównaniu z placebo nie stwierdzono korzyści z leczenia tikagrelorem w odniesieniu do częstości
występowania przełomów naczyniowo-okluzyjnych.
Europejska Agencja Leków uchyliła obowiązek dołączania wyników badań produktu leczniczego
Ticagrelor Holsten we wszystkich podgrupach populacji pediatrycznej w ostrym zespole wieńcowym
(OZW) oraz z zawałem
mięśnia sercowego w wywiadzie (informacje na temat stosowania produktu u dzieci i młodzieży
przedstawiono w punkcie 4.2).
5.2 Właściwości farmakokinetyczne
Tikagrelor wykazuje liniową farmakokinetykę, a ekspozycja na tikagrelor i jego czynny metabolit
(AR-C124910XX) jest w przybliżeniu zależna od dawki, w przedziale do 1260 mg.
Wchłanianie
Wchłanianie tikagreloru jest szybkie, mediana czasu tmax wynosi około 1,5 godziny. Tworzenie się
głównego krążącego metabolitu AR-C124910XX (również czynnego) z tikagreloru jest szybkie,
mediana tmax wynosi około 2,5 godziny. Po podaniu pojedynczej dawki doustnej 90 mg tikagreloru
na czczo zdrowym ochotnikom C wynosi 529 ng/ml, a AUC 3451 ng*h/ml. Dla metabolitu
powiązane z substancją wyjściową współczynniki wynoszą 0,28 dla C i 0,42 dla AUC.
Farmakokinetyka tikagreloru i AR-C124910XX u chorych z zawałem serca w wywiadzie była
zasadniczo podobna do obserwowanej w populacji pacjentów z OZW. Według analizy
farmakokinetyki populacyjnej w badaniu PEGASUS mediana tikagreloru C wynosiła 391 ng/ml i
AUC wynosiło 3801 ng*h/ml w stanie stacjonarnym po podaniu tikagreloru w dawce 60 mg. W
przypadku tikagreloru w dawce 90 mg C wynosiło 627 ng/ml i AUC wynosiło 6255 ng*h/ml w
stanie stacjonarnym.
Średnią bezwzględną biodostępność tikagreloru oszacowano na 36%. Spożycie wysokotłuszczowego
posiłku skutkuje zwiększeniem AUC tikagreloru o 21% i zmniejszeniem C czynnego metabolitu o
22%, ale nie spowodowało zmian C tikagreloru i AUC czynnego metabolitu. Uważa się, że te
niewielkie zmiany mają minimalne znaczenie kliniczne, dlatego też tikagrelor może być zażywany w
trakcie posiłków lub niezależnie od nich. Zarówno tikagrelor, jak i czynny metabolit są substratami
glikoproteiny P (P-gp).
Tikagrelor w postaci rozgniecionych tabletek wymieszanych z wodą, podanych doustnie lub przez
zgłębnik nosowo-żołądkowy ma biodostępność porównywalną do tabletki podawanej w całości w
zakresie AUC i C dla tikagreloru i aktywnego metabolitu. Ekspozycja początkowa (0,5 i 1 godzina
po podaniu) tikagreloru zastosowanego w postaci rozgniecionej tabletki wymieszanej z wodą była
większa niż zastosowanego w postaci całej (niepokruszonej) tabletki, z zasadniczo identycznym
profilem stężeń w późniejszym czasie (od 2 do 48 godzin).
Dystrybucja
Objętość dystrybucji w stanie stacjonarnym wynosi 87,5 l. Tikagrelor i czynny metabolit w znacznym
stopniu wiążą się z białkami osocza ludzkiego (>99,0%).
Biotransformacja
CYP3A4 jest głównym enzymem odpowiedzialnym za metabolizm tikagreloru i tworzenie
czynnego metabolitu a ich interakcje z innymi substratami izoenzymu CYP3A obejmują
zarówno aktywację jak i hamowanie.
Główny metabolit tikagreloru, AR-C124910XX, jest także czynny, co określono w
badaniach in vitro, w których wiąże się on z receptorem płytkowym ADP P2Y .
Ogólnoustrojowe narażenie na czynny metabolit stanowi około 30 ‒ 40% narażenia na
tikagrelor.
Eliminacja
Podstawowa droga eliminacji tikagreloru to metabolizm wątrobowy. Po podawaniu
znakowanego radioaktywnie tikagreloru, średni wychwyt zwrotny radioaktywności wynosił
około 84% (57,8% w kale i 26,5% w moczu). Odzyskany tikagrelor i czynny metabolit w
moczu w obydwu przypadkach stanowiły mniej niż 1% zastosowanej dawki. Główną drogą
eliminacji czynnego metabolitu jest najprawdopodobniej wydzielanie z żółcią. Średni
okres półtrwania wynosił około 7 godzin dla tikagreloru i 8,5 godziny dla czynnego
metabolitu.
Szczególne grupy pacjentów
Osoby w podeszłym wieku
W trakcie analiz farmakokinetycznych w populacjach, u osób w podeszłym wieku (≥75
lat) z OZW obserwowano większe narażenie na tikagrelor (o około 25% dla C i AUC) i
na czynny metabolit w porównaniu do młodszych pacjentów. Uważa się, że różnice te nie
są istotne klinicznie (patrz punkt 4.2).
Dzieci i młodzież
Dostępne są ograniczone dane dotyczące dzieci i młodzieży z niedokrwistością
sierpowatokrwinkową (patrz punkt 4.2 i 5.1).
W badaniu HESTIA 3 pacjentom w wieku od 2 do mniej niż 18 lat, ważącym od ≥ 12 do ≤
24 kg, od >24 do ≤ 48 kg i > 48 kg podawano tikagrelor w postaci 15 mg tabletek
ulegających rozpadowi w jamie ustnej przeznaczonych dla dzieci, w dawkach
wynoszących odpowiednio 15, 30 i 45 mg dwa razy na dobę. Analiza farmakokinetyki
populacyjnej wykazała, że średnie AUC wahało się od 1095 ng*h/ml do 1458 ng*h/ml, a
średnie C wynosiło od 143 ng/ml do 206 ng/ml w stanie stacjonarnym.
Płeć
U kobiet obserwowano większe narażenie na tikagrelor i na czynny metabolit niż u
mężczyzn. Uważa się, że różnice te nie są istotne klinicznie.
Zaburzenia czynności nerek
U pacjentów z ciężkimi zaburzeniami czynności nerek (klirens kreatyniny <30 ml min)
narażenie na tikagrelor było o około 20% mniejsze zaś narażenie na czynny metabolit było
około 17% większe niż w przypadku pacjentów z prawidłową funkcją nerek.
U pacjentów z krańcową chorobą nerek poddawanych hemodializie, wartości AUC i C
tikagreloru w dawce 90 mg podawanego w dniu bez dializy były o 38% i 51% większe niż u
pacjentów z prawidłową czynnością nerek. Podobne zwiększenie ekspozycji
obserwowano, gdy tikagrelor był podawany bezpośrednio przed dializą (odpowiednio o
49% i 61%), co wskazuje, że tikagrelor nie ulega dializie. Ekspozycja na aktywny metabolit
wzrosła w mniejszym stopniu (AUC o 13-14%, a C o 17-36%). Działanie tikagreloru
polegające na hamowaniu agregacji płytek krwi było niezależne od dializy u pacjentów z
krańcową chorobą nerek i podobne, jak u pacjentów z prawidłową czynnością nerek
(patrz punkt 4.2).
Zaburzenia czynności wątroby
C i AUC tikagreloru było odpowiednio 12% i 23% większe u pacjentów z łagodnymi
zaburzeniami czynności wątroby w porównaniu do odpowiadających im zdrowych
osobników, jednak działanie tikagreloru hamujące agregację płytek było podobne w obu
grupach. Nie ma konieczności dostosowania dawek u pacjentów z umiarkowanymi
zaburzeniami czynności wątroby. Nie prowadzono badań dotyczących stosowania
tikagreloru u pacjentów z ciężką niewydolnością wątroby i nie są dostępne informacje na
temat jego farmakokinetyki u pacjentów z umiarkowanymi zaburzeniami czynności
wątroby. U pacjentów z wyjściowym umiarkowanym lub ciężkim zwiększeniem wyników
jednej lub dwóch prób wątrobowych stężenie tikagreloru w osoczu było średnio podobne
lub nieco większe od mierzonego u pacjentów bez wyjściowego zwiększenia tych
parametrów. Nie jest konieczne dostosowanie dawkowania u pacjentów z umiarkowanymi
zaburzeniami czynności wątroby (patrz punkty 4.2 i 4.4).
Różnice rasowe
U pacjentów pochodzenia azjatyckiego obserwuje się o 39% większą średnią
biodostępność w porównaniu z pacjentami rasy kaukaskiej. U pacjentów, którzy określają
swoją rasę jako czarną, biodostępność tikagreloru jest o 18% mniejsza niż u pacjentów
rasy kaukaskiej. W badaniach farmakologii klinicznej wśród Japończyków obserwowano
większe o mniej więcej 40% (a o 20% po dostosowaniu do masy ciała) narażenie na
tikagrelor (C i AUC), w porównaniu do osób rasy kaukaskiej. Narażenie u pacjentów
określających swoją rasę jako latynoską było podobne do pacjentów rasy kaukaskiej.
5.3 Przedkliniczne dane o bezpieczeństwie
Dane przedkliniczne pochodzące z konwencjonalnych badań farmakologicznych
tikagreloru i jego głównego metabolitu, które dotyczyły bezpieczeństwa farmakoterapii,
badań toksyczności po podaniu pojedynczym i wielokrotnym oraz potencjalnej
genotoksyczności nie wykazały niedopuszczalnego ryzyka wystąpienia działań
niepożądanych u ludzi.
Po odpowiadającym warunkom klinicznym narażeniu u kilku gatunków zwierząt
zaobserwowano podrażnienie przewodu pokarmowego (patrz punkt 4.8).
U samic szczurów, którym podawano tikagrelor w dużych dawkach, zaobserwowano
zwiększenie liczby przypadków guzów macicy (gruczolakoraki) i zwiększenie liczby
przypadków gruczolaków wątroby. Mechanizm powstawania guzów macicy u szczurów
polega prawdopodobnie na zaburzeniu równowagi hormonalnej, która może prowadzić do
powstania guzów u szczurów. Mechanizm powstawania gruczolaków wątroby to
prawdopodobnie specyficzne dla gryzoni zwiększenie aktywności enzymatycznej w
wątrobie. Dlatego uważa się za mało prawdopodobne, aby te przypadki rakotwórczości
miały znaczenie dla ludzi.
U szczurów obserwowano niewielkie nieprawidłowości rozwojowe po podawaniu
ciężarnym samicom dawek toksycznych (margines bezpieczeństwa 5,1). U płodów
królików obserwowano niewielkie opóźnienie dojrzewania wątroby i rozwoju układu
szkieletowego, gdy ciężarnym samicom podawano duże dawki bez oznak toksyczności u
ciężarnych samic (margines bezpieczeństwa 4,5).
Badania na szczurach i królikach wykazały toksyczne działanie na rozmnażanie, z
niewielkim zmniejszeniem przyrostu masy ciała ciężarnych samic oraz zmniejszoną
przeżywalnością noworodków i mniejszą wagą urodzeniową oraz opóźnionym wzrostem.
Tikagrelor powodował u samic szczurów nieregularne cykle (w większości wydłużone),
ale nie wpływał na całkowitą płodność u samców i samic szczurów. Badania
farmakokinetyczne przeprowadzone ze znakowanym radioaktywnie tikagrelorem
wykazały, że zarówno sama substancja czynna jak i jej metabolity przenikają do mleka
szczurów (patrz punkt 4.6).
6. DANE FARMACEUTYCZNE
6.1 Wykaz substancji pomocniczych
Rdzeń tabletki
Hypromeloza (E464)
Mannitol (E421)
Celuloza mikrokrystaliczna (E460)
Karboksymetyloskrobia sodowa
Magnezu stearynian (E470b)
Otoczka tabletki
Hypromeloza (E464)
Tytanu dwutlenek (E171)
Makrogol 400 (E1521)
Talk (E553b)
Żelaza tlenek czerwony (E172)
6.2 Niezgodności farmaceutyczne
Nie dotyczy.
6.3 Okres ważności
3 lata
6.4 Specjalne środki ostrożności podczas przechowywania
Ten produkt leczniczy nie wymaga specjalnych warunków przechowywania w określonej
temperaturze; przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
6.5 Rodzaj i zawartość opakowania
Przezroczyste blistry z folii PVC/PVDC/Aluminium i/lub przezroczyste blistry z folii
PVC/PE/PVDC/Aluminium w tekturowym pudełku.
Blistry z folii (z symbolami słońca/księżyca lub bez) w pudełkach tekturowych po 14, 15, 20, 28, 30,
56, 60, 90, 98, 100, 168, 195, 196 i 200 tabletek powlekanych.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
6.6 Specjalne środki ostrożności dotyczące usuwania
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z
lokalnymi przepisami.
7. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
DOPUSZCZENIE DO OBROTU
Holsten Pharma GmbH
Hahnstraße 31-35
60528 Frankfurt nad Menem
Niemcy
8. NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
Pozwolenie nr:
9. DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
I DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:
10. DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- ImporterGenepharm S.A.
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki Ticagrelor HolstenPostać farmaceutyczna: Tabletki, 60 mgSubstancja czynna: ticagrelorWymaga receptyPostać farmaceutyczna: Tabletki, 90 mgSubstancja czynna: ticagrelorWymaga receptyPostać farmaceutyczna: Tabletki, 60 mgSubstancja czynna: ticagrelorProducent: Krka, d.d., Novo mestoWymaga recepty
Odpowiedniki Ticagrelor Holsten w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Ticagrelor Holsten – Hiszpania
Odpowiednik Ticagrelor Holsten – Ukraina
Lekarze online w sprawie Ticagrelor Holsten
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Ticagrelor Holsten – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














