

Phoxilium

Zapytaj lekarza o receptę na Phoxilium

Jak stosować Phoxilium
Ulotka dołączona do opakowania: Informacja dla użytkownika
PHOXILIUM 1,2 mmol/l fosforanów
Roztwór do hemodializy i hemofiltracji
Wapnia chlorek dwuwodny, magnezu chlorek sześciowodny, sodu chlorek, sodu wodorowęglan, potasu
chlorek, disodu fosforan bezwodny
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki:
- 1. Co to jest lek Phoxilium i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Phoxilium
- 3. Jak stosować lek Phoxilium
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Phoxilium
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Phoxilium i w jakim celu się go stosuje
Lek Phoxilium, należący do grupy roztworów do hemofiltracji, zawiera wapnia chlorek dwuwodny,
magnezu wodorowęglan sześciowodny, sodu chlorek, sodu wodorowęglan, potasu chlorek i disodu
fosforan bezwodny.
Lek Phoxilium używany jest w szpitalach w warunkach intensywnej opieki medycznej celem
przywrócenia równowagi chemicznej krwi u pacjentów z uszkodzeniem nerek.
Ciągłe leczenienerkozastępcze ma na celu usunięcie zgromadzonych produktów przemiany materii z
krwi w sytuacji, w której nerki nie pracują.
Roztwór Phoxiliumjest używany do leczenia pacjentów w stanie krytycznym z ostrym uszkodzeniem
nerek, którzy cechują się:
- prawidłowym stężeniem potasu we krwi (normokaliemia)lub
- prawidłowym lub niskim stężeniem fosforanów we krwi (normo- lub hipofosfatemia).
Ten lek można również stosować w przypadku zatrucia lekami zawierającymi substancje ulegające
dializie lub filtracji.
2. Informacje ważne przed zastosowaniem leku Phoxilium
Nie stosować leku Phoxilium w następujących trzech przypadkach:
- jeśli u pacjenta występuje wysokie stężenie potasu we krwi (hiperkaliemia);
- jeśli u pacjenta występuje wysokie stężenie wodorowęglanów we krwi (alkaloza metaboliczna);
- jeśli u pacjenta występuje wysokie stężenie fosforanów we krwi (hiperfosfatemia).
1/8
Nie stosować hemodializy ani hemofiltracji w następujących trzech przypadkach:
- jeśli za pomocą hemofiltracji nie można złagodzić objawów powodowanych przez wysokie stężenie mocznika we krwi (objawy uremii),które są wynikiem uszkodzenia nerek z wyraźnym hiperkatabolizmem (nieprawidłowy wzrost procesów rozpadu substancji);
- niewystarczające ciśnienie tętnicze w dostępie naczyniowym;
- zmniejszona krzepliwość krwi ( antykoagulacja ogólnoustrojowa) przy istniejącym zagrożeniu krwawieniem.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem stosowania leku Phoxilium należy omówić to z lekarzem, farmaceutą lub
pielęgniarką.
Przed leczeniem i w czasie jego trwania sprawdzana będzie krew, tj. kontrolowana będzie równowaga
kwasowo-zasadowa oraz stężenia soli (elektrolitów), w tym objętości płynów podanych (wlewów
dożylnych) i odprowadzonych (wydalanego moczu), nawet tych, które nie są bezpośrednio związane z
leczeniem.
Lek Phoxilium a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach stosowanych przez pacjenta obecnie
lub ostatnio, a także o lekach, które pacjent planuje stosować. Należy to zrobić, ponieważ stężenie
innych przyjmowanych leków może mieć wpływ na leczenie Phoxilium. Lekarz zdecyduje, czy należy
wprowadzić jakiekolwiek zmiany do innych zażywanych leków.
W szczególności należy poinformować o przyjmowaniu:
- fosforanów z dodatkowych źródeł (np. płynów odżywczych), ponieważ mogą one zwiększyć ryzyko wystąpienia wysokiego stężenia fosforanów we krwi ( hiperfosfatemia);
- witaminy D i leków zawierających wapnia chlorek lub wapnia glukonian, ze względu na możliwość wzrostu zagrożenia wystąpienia wysokiego stężenia wapnia we krwi ( hiperkalcemia);
- sodu wodorowęglanu, ponieważ może to zwiększać ryzyko nadmiaru wodorowęglanu we krwi ( zasadowica metaboliczna);
- cytrynianu jako antykoagulantu, ponieważ może on obniżać stężenie wapnia w osoczu.
Ciąża, karmienie piersią i wpływ na płodność
Ciąża i karmienie piersią:
Brak jest udokumentowanych danych klinicznych dotyczących stosowania tego leku w czasie ciąży i
laktacji. Niniejszy lek powinien być podawany kobietom w okresie ciąży i laktacji jedynie w przypadku
istnienia wyraźnej potrzeby.
Płodność:
Nie przewiduje się wpływu leku na płodność, ponieważ wapń, sód, potas, magnez, chlorki,
wodorofosforany i wodorowęglany stanowią normalne składniki organizmu.
Prowadzenie pojazdów i obsługiwanie maszyn
Phoxilium nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
3. Jak stosować lek Phoxilium
Phoxilium jest produktem stosowanym w szpitalach i podawanym wyłącznie przez personel medyczny.
Objętość leku Phoxilium i tym samym dawka zależy od stanu pacjenta. Objętość dawki określi lekarz
odpowiedzialny za leczenie.
Lek Phoxilium może być podawany bezpośrednio do krwiobiegu (dożylnie)za pośrednictwem aparatu
do CRRT lub za pośrednictwem hemodializy, kiedy roztwór przepływa po jednej stronie błony do
dializy a krew po drugiej stronie.
2/8
Ten lek należy zawsze stosować dokładnie według zaleceń lekarza, farmaceuty lub pielęgniarki. W
razie wątpliwości należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
Instrukcja użycia znajduje się w części "Poniższe informacje przeznaczone są wyłącznie dla
pracowników służby zdrowia".
Zastosowanie większej niż zalecana dawki Phoxilium
Lek Phoxilium jest przeznaczony do użycia szpitalnego i podawania wyłącznie przez lekarzy w sytuacji
starannego monitorowania bilansu płynów i składu chemicznego krwi.
Dlatego jest mało prawdopodobne zastosowanie większej niż zalecana dawki Phoxilium.
W mało prawdopodobnym przypadku wystąpienia przedawkowania lekarz prowadzący podejmie
wszelkie niezbędne działania korekcyjne i dostosuje dawkę.
Przedawkowanie może prowadzić do przeładowania płynami, zmniejszenia stężenia wodorowęglanu w
osoczu (kwasicy metabolicznej) i (lub) wysokiego stężenia fosforanów (hiperfosfatemii) u pacjentów z
uszkodzeniem nerek.
Może również prowadzić do poważnych skutków, takich jak zastoinowa niewydolność serca i
zaburzenia składu chemicznego krwi.
W razie wątpliwości związanych ze stosowaniem leku należy zwrócić się do lekarza lub farmaceuty.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Mogą wystąpić trzy działania niepożądane związane z użyciem leku Phoxilium:
- nieprawidłowo duża lub mała zawartość wody w organizmie (przewodnienie lub odwodnienie),
- zmiany zawartości soli mineralnych we krwi (nierównowaga elektrolitowa, taka jakhiperfosfatemia)oraz
- wzrost stężenia wodorowęglanu w osoczu (alkaloza metaboliczna)lub zmniejszenie stężenia wodorowęglanu w osoczu ( kwasica metaboliczna) .
Są także pewne działania niepożądane, które mogą być wywołane przez dializoterapię:
- nudności, wymioty, kurcze mięśni i niskie ciśnienie krwi ( hipotensja).
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Działania niepożądane
można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów
Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów
Biobójczych
Aleje Jerozolimskie 181C
02-222 Warszawa
Tel.: +48 22 4921301
Fax: +48 22 4921309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
3/8
5. Jak przechowywać lek Phoxilium
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na etykiecie i na opakowaniu.
Termin ważności oznacza ostatni dzień danego miesiąca.
Przechowywać w temperaturze od +4 C do +30 C. Nie przechowywać w lodówce ani nie zamrażać.
Wykazano chemiczną i fizyczną stabilność odtworzonego roztworu w ciągu 24 godzin, w temperaturze
+22 ºC. Jeśli roztwór nie zostanie zużyty od razu, za czas i warunki przechowywania przed użyciem
odpowiada użytkownik i czas ten nie powinien przekraczać 24 godzin, łącznie z czasem zabiegu.
Nie stosować tego leku, jeśli zauważy się, że roztwór jest mętny lub zewnętrzne opakowanie ochronne
jest uszkodzone. Wszystkie spawy muszą być nienaruszone.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić
środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek Phoxilium
Substancje czynne przed zmieszaniem i po zmieszaniu (rekonstytucji) przedstawiono poniżej.
Substancje czynne przed zmieszaniem:
1000 ml roztworu w małej komorze Azawiera:
Wapnia chlorek dwuwodny
3,68 g
Magnezu chlorek sześciowodny
2,44 g
1000 ml roztworu w dużej komorze Bzawiera:
Sodu chlorek
6,44 g
Sodu wodorowęglan
2,92 g
Potasu chlorek
0,314 g
Disodu fosforan bezwodny 0,225 g
Substancje czynne po zmieszaniu:
Roztwory w komorach A (250 ml) i B (4750 ml) są mieszane w celu otrzymania jednego odtworzonego
roztworu (5000 ml) zawierającego:
mmol/l
wapń, Ca
1,25
magnez, Mg
0,6
sód, Na
140
chlorki, Cl -
115,9
wodorofosforan, HPO
1,2
wodorowęglan, HCO
30
potas, K
4
Teoretyczna osmolarność: 293 mOsm/l
Pozostałe składniki:
- -dwutlenek węgla (do ustalenia pH), E290;
- kwas solny (do ustalenia pH), E507;
- woda do wstrzykiwań.
4/8
Jak wygląda Phoxilium i co zawiera opakowanie
Phoxilium jest roztworem do hemodializy i hemofiltracji pakowanym w dwukomorowe worki.
Końcowy roztwór odtworzony otrzymuje się po rozerwaniu spawu i zmieszaniu obydwu roztworów.
Odtworzony roztwór jest przezroczysty i bezbarwny. Każdy worek (A+B) zawiera 5000 ml roztworu
do hemofiltracji i hemodializy. Każdy worek jest umieszczony w przezroczystym opakowaniu
zewnętrznym.
W każdym opakowaniu znajdują się dwa worki i ulotka informacyjna.
Podmiot odpowiedzialny:
Vantive Belgium SRL
Boulevard d’Angleterre 2
1420 Braine-l’Alleud
Belgia
Wytwórca:
Bieffe Medital S.p.A., Via Stelvio 94, 23035 Sondalo (SO), WŁOCHY
Vantive Manufacturing Limited, Moneen Road, Castlebar, County Mayo, F23 XR63, Irlandia
Ten lek jest dopuszczony do obrotu w krajach członkowskich Europejskiego Obszaru
Gospodarczego i Wielkiej Brytanii (Irlandii Północnej) pod następującymi nazwami:
Austria, Belgia, Bułgaria, Cypr, Dania, Estonia, Finlandia, Francja, Grecja, Hiszpania, Holandia,
Irlandia, Islandia, Litwa, Luxemburg, Łotwa, Malta, Niemcy, Norwegia, Polska, Portugalia, Rumunia,
Słowacja, Słowenia, Szwecja, Wielka Brytania (Irlandia Północna), Włochy: Phoxilium
Węgry: Phoxil
Data ostatniej aktualizacji ulotki: wrzesień 2024
Poniższe informacje przeznaczone są wyłącznie dla pracowników służby zdrowia:
Phoxilium 1,2 mmol/l fosforanów
Roztwór do hemodializy i hemofiltracji
Środki ostrożności
Należy ściśle przestrzegać instrukcji użycia postępowaniazproduktem leczniczym Phoxilium.
Roztwory z obu komór muszązostać zmieszane przed użyciem.
Użycie zanieczyszczonego roztworu może spowodować sepsę i wstrząs.
Aby zwiększyć komfort pacjenta, Phoxilium można podgrzać do temperatury +37°C. Podgrzanie
roztworu przed użyciem należy wykonać przed odtworzeniem i wyłącznie przy użyciu suchego źródła
ciepła. Roztworów nie należy podgrzewać w łaźni wodnej ani kuchence mikrofalowej. Przed podaniem
należy skontrolować wizualnie Phoxilium w celu wykrycia obecności cząstek stałych oraz zmiany
zabarwienia. Nie podawać, jeśli roztwór nie jest przezroczysty i spaw jest uszkodzony.
Należy regularnie mierzyć stężenie nieorganicznych fosforanów. Nieorganiczne fosforany muszą być
uzupełniane w przypadkach niskiego stężenia fosforanów we krwi.
Dodatkowa substytucja wodorowęglanu sodu może zwiększyć ryzyko zasadowicy metabolicznej.
W przypadku zaburzenia równowagi płynów należy starannie kontrolować stan kliniczny, a równowagę
płynów należy przywrócić:
- W przypadku hiperwolemii można zwiększyć szybkość ultrafiltracji (netto) w aparacie do CRRT i (lub) zmniejszyć szybkość podawania płynów innych niż płyn substytucyjny i (lub) dializat.
5/8
- W przypadku hipowolemii można zmniejszyć szybkość ultrafiltracji (netto) w aparacie do CRRT i (lub) zwiększyć szybkość podawania płynów innych niż płyn substytucyjny i (lub) dializat.
Ostrzeżenia:
Phoxilium nie powinien być stosowany u pacjentów z hiperkaliemią. Stężenie potasu w surowicy krwi
musi być monitorowane przed rozpoczęciem i w trakcie hemofiltracji i (lub) hemodializy.
Ponieważ Phoxilium jest roztworem zawierającym potas, po rozpoczęciu leczenia może przejściowo
wystąpić hiperkaliemia. Należy zmniejszyć szybkość wlewu aż do osiągnięcia właściwego stężenia
potasu. Jeśli hiperkaliemia nie ustąpi, należy niezwłocznie wstrzymać podawanie produktu leczniczego.
Jeśli podczas stosowania produktu leczniczego Phoxilium jako dializatu wystąpi hiperkaliemia,
konieczne może być podanie dializatu niezawierającego potasu w celu zwiększenia szybkości
usuwania potasu.
Ponieważ Phoxilium jest roztworem zawierającym fosforany, po rozpoczęciu leczenia może
przejściowo wystąpić hiperfosfatemia. Należy zmniejszyć szybkość wlewu aż do osiągnięcia
właściwego stężenia fosforanów. Jeśli hiperfosfatemia nie ustąpi, należy niezwłocznie wstrzymać
podawanie produktu leczniczego.
U pacjentów, którym podawany jest produkt leczniczy Phoxilium, należy regularnie kontrolować
elektrolity oraz kwasowość/zasadowość krwi. Phoxilium zawiera wodorofosforan, słaby kwas, który
może wpływać na równowagę kwasowo-zasadową pacjenta. Jeśli w trakcie leczenia produktem
Phoxilium rozwinie się lub pogłębi kwasica metaboliczna, może zaistnieć potrzeba zmniejszenia
szybkości wlewu lub wstrzymania podawania produktu leczniczego.
Ponieważ Phoxilium nie zawiera glukozy, jego podawanie może prowadzić do hipoglikemii. Należy
regularnie monitorować stężenie glukozy we krwi u pacjentów z cukrzycą (szczególnie u pacjentów
przyjmujących insulinę lub inne leki obniżające stężenie glukozy); należy to również rozważyć
u pacjentów bez cukrzycy, na przykład z uwagi na ryzyko wystąpienia bezobjawowej hipoglikemii
podczas leczenia. W przypadku wystąpienia hipoglikemii, należy rozważyć stosowanie roztworu
zawierającego glukozę. Konieczne może być również podjęcie innych środków zaradczych w celu
utrzymania właściwego stężenia glukozy we krwi.
Dawkowanie:
Objętość i szybkość podawania produktu leczniczego Phoxilium zależy od stężenia fosforanów
i innych elektrolitów we krwi, równowagi kwasowo-zasadowej, równowagi płynów oraz ogólnego
stanu klinicznego pacjenta. Objętość roztworu substytucyjnego i (lub) dializatu, jaką należy podać,
będzie również zależała od żądanej intensywności leczenia (dawki). Sposób podawania (dawkę,
szybkość infuzji i całkowitą objętość) produktu leczniczego Phoxilium powinien ustalić wyłącznie
lekarz, mający doświadczenie w zakresie intensywnej terapii oraz ciągłego leczenia nerkozastępczego
(ang. Continuous Renal Replacement Therapy, CRRT).
W związku z tym objętość dawki zależy od decyzji i zaleceń lekarza.
Zakresy szybkości przepływu dla roztworu substytucyjnego w hemofiltracji i hemodiafiltracji wynoszą:
Dorośli: 500 do 3000 ml/godz.
Zakresy szybkości przepływu dla dializatu w ciągłej hemodializie i ciągłej hemodiafiltracji wynoszą:
Dorośli: 500 do 2500 ml/godz.
U dorosłych zwykle stosowana jest łączna szybkość przepływu w przypadku CRRT (dializat i roztwory
substytucyjne) wynosząca od około 2000 do 2500 ml/godz., co odpowiada dobowej objętości płynu
mieszczącej się w zakresie od około 48 do 60 l.
6/8
Dzieci i młodzież:
U dzieci, od noworodków po młodzież do 18 lat, zakres szybkości przepływu podczas stosowania jako
płyn substytucyjny w hemofiltracji i hemodiafiltracji oraz jako roztwór do dializy (dializat) w ciągłej
hemodializie i ciągłej hemodiafiltracji wynosi od 1000 do 4000 ml/godz./1,73 m .
W przypadku gdy u młodzieży (12–18 lat) obliczona dawka dla dzieci przekracza maksymalną dawkę
dla dorosłych, należy zastosować dawkę zalecaną dla dorosłych.
Instrukcja użycia/postępowania
Roztwór z małej komory A jest dodawany do roztworu z dużej komory B po złamaniu łamliwej zatyczki
lub rozerwaniu spawu bezpośrednio przed użyciem. Odtworzony roztwór powinien być przezroczysty
i bezbarwny.
Podczas postępowania oraz podawania produktu leczniczego pacjentowi, należy stosować technikę
aseptyczną.
Używać wyłącznie wtedy, gdy zewnętrzne opakowanie ochronne jest nieuszkodzone, wszystkie spawy
są nienaruszone, rozrywalny spaw nie jest uszkodzony, a roztwór jest przezroczysty. Mocno ścisnąć
worek, aby sprawdzić jego szczelność. W przypadku zauważenia przecieku roztwór należy
niezwłocznie wyrzucić, ponieważ nie można zagwarantować jałowości.
Duża komora B wyposażona jest w port do wstrzykiwań, umożliwiający po odtworzeniu rotworu
dodanie innych niezbędnych produktów leczniczych. Użytkownik odpowiedzialny jest za ocenę
zgodności dodawanego produktu leczniczego z produktem Phoxilium poprzez wykrycie ewentualnej
zmiany barwy i (lub) wytrącenia osadu, obecności nierozpuszczalnych kompleksów lub kryształów.
Przed dodaniem innego produktu leczniczego, należy sprawdzić, czy jest on rozpuszczalny i stabilny w
produkcie leczniczym Phoxilium oraz czy zakres pH produktu Phoxilium jest dla niego odpowiedni
(pH roztworu po rekonstytucji wynosi od 7,0-8,5). Dodatkowe składniki mogą nie być zgodne z
roztworem. Należy zapoznać się z instrukcją dotyczącą stosowania dodawanego produktu leczniczego.
Usunąć płyn z portu do wstrzykiwań, przytrzymać odwrócony worek („do góry nogami”), wstrzyknąć
produkt leczniczy przez port do wstrzykiwań i starannie wymieszać. Wprowadzanie i mieszanie
dodatkowych składników musi zawsze być wykonane przed podłączeniem worka z roztworem do
obwodu pozaustrojowego. Roztwór należy podać niezwłocznie.
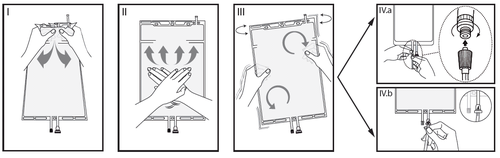
I
Opakowanie zewnętrzne zdjąć bezpośrednio przed użyciem, wyrzucić wszystkie pozostałe
opakowania. Otworzyć spaw, trzymając małą komorę oburącz i ścisnąć do momentu powstania
otworu w rozrywalnym spawie oddzielającym obie komory (Patrz rysunek I poniżej).
II
Dwiema dłońmi nacisnąć dużą komorę do momentu całkowitego otwarcia rozrywalnego spawu
pomiędzy dwiema komorami (Patrz rysunek II poniżej).
III
Dokładne wymieszanie zapewnia się poprzez delikatne wstrząsanie workiem. Teraz roztwór jest
gotowy do użycia i worek można powiesić na stojaku (Patrz rysunek III poniżej).
IV
Do każdego z dwóch portów dostępu można podłączyć linię dializy lub wymiany.
IVaJeśli korzysta się z dostępu typu luer, usunąć zatyczkę, przekręcając ją i pociągając, a następnie
podłączyć męską końcówkę luer lock linii dializy lub wymiany do żeńskiej końcówki typu luer
receptor na worku, dociskając ją i przekręcając. Upewnić się, że połączenie jest całkowicie
osadzone i pewne. Teraz połączenie jest otwarte. Sprawdzić, czy płyn przepływa swobodnie
(Patrz rysunek IV.a poniżej).
Gdy linie dializy lub wymiany są odłączone od złącza typu luer, połączenie zostanie zamknięte i
przepływ płynu wstrzymany. Port typu luer jest bezigłowy i można go przecierać środkami
dezynfekującymi.
IVbW przypadku korzystania z portu do wstrzykiwań najpierw usunąć zatyczkę poprzez jej
odłamanie. Port do wstrzykiwań można przecierać środkami dezynfekującymi. Następnie
przebić kolcem gumową przegrodę. Sprawdzić, czy płyn przepływa swobodnie (Patrz rysunek
IV.b poniżej).
7/8
Odtworzony roztwór powinien zostać niezwłocznie zużyty. Jeśli odtworzony roztwór nie zostanie
natychmiast zastosowany, powinien zostać zużyty w ciągu 24 godzin po dodaniu roztworu A do
roztworu B, włączając w to czas leczenia.
Odtworzony roztwór przeznaczony jest wyłącznie do jednorazowego użytku. Należy wyrzucić
niewykorzystany roztwór natychmiast po zastosowaniu.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z
lokalnymi przepisami.
8/8
Ulotka dołączona do opakowania: Informacja dla użytkownika
PHOXILIUM 1,2 mmol/l fosforanów
Roztwór do hemodializy i hemofiltracji
Wapnia chlorek dwuwodny, magnezu chlorek sześciowodny, sodu chlorek, sodu wodorowęglan, potasu
chlorek, disodu fosforan bezwodny
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki:
- 1. Co to jest lek Phoxilium i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Phoxilium
- 3. Jak stosować lek Phoxilium
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Phoxilium
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Phoxilium i w jakim celu się go stosuje
Lek Phoxilium, należący do grupy roztworów do hemofiltracji, zawiera wapnia chlorek dwuwodny,
magnezu wodorowęglan sześciowodny, sodu chlorek, sodu wodorowęglan, potasu chlorek i disodu
fosforan bezwodny.
Lek Phoxilium używany jest w szpitalach w warunkach intensywnej opieki medycznej celem
przywrócenia równowagi chemicznej krwi u pacjentów z uszkodzeniem nerek.
Ciągłe leczenienerkozastępcze ma na celu usunięcie zgromadzonych produktów przemiany materii z
krwi w sytuacji, w której nerki nie pracują.
Roztwór Phoxiliumjest używany do leczenia pacjentów w stanie krytycznym z ostrym uszkodzeniem
nerek, którzy cechują się:
- prawidłowym stężeniem potasu we krwi (normokaliemia)lub
- prawidłowym lub niskim stężeniem fosforanów we krwi (normo- lub hipofosfatemia).
Ten lek można również stosować w przypadku zatrucia lekami zawierającymi substancje ulegające
dializie lub filtracji.
2. Informacje ważne przed zastosowaniem leku Phoxilium
Nie stosować leku Phoxilium w następujących trzech przypadkach:
- jeśli u pacjenta występuje wysokie stężenie potasu we krwi (hiperkaliemia);
- jeśli u pacjenta występuje wysokie stężenie wodorowęglanów we krwi (alkaloza metaboliczna);
- jeśli u pacjenta występuje wysokie stężenie fosforanów we krwi (hiperfosfatemia).
1/8
Nie stosować hemodializy ani hemofiltracji w następujących trzech przypadkach:
- jeśli za pomocą hemofiltracji nie można złagodzić objawów powodowanych przez wysokie stężenie mocznika we krwi (objawy uremii),które są wynikiem uszkodzenia nerek z wyraźnym hiperkatabolizmem (nieprawidłowy wzrost procesów rozpadu substancji);
- niewystarczające ciśnienie tętnicze w dostępie naczyniowym;
- zmniejszona krzepliwość krwi ( antykoagulacja ogólnoustrojowa) przy istniejącym zagrożeniu krwawieniem.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem stosowania leku Phoxilium należy omówić to z lekarzem, farmaceutą lub
pielęgniarką.
Przed leczeniem i w czasie jego trwania sprawdzana będzie krew, tj. kontrolowana będzie równowaga
kwasowo-zasadowa oraz stężenia soli (elektrolitów), w tym objętości płynów podanych (wlewów
dożylnych) i odprowadzonych (wydalanego moczu), nawet tych, które nie są bezpośrednio związane z
leczeniem.
Lek Phoxilium a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach stosowanych przez pacjenta obecnie
lub ostatnio, a także o lekach, które pacjent planuje stosować. Należy to zrobić, ponieważ stężenie
innych przyjmowanych leków może mieć wpływ na leczenie Phoxilium. Lekarz zdecyduje, czy należy
wprowadzić jakiekolwiek zmiany do innych zażywanych leków.
W szczególności należy poinformować o przyjmowaniu:
- fosforanów z dodatkowych źródeł (np. płynów odżywczych), ponieważ mogą one zwiększyć ryzyko wystąpienia wysokiego stężenia fosforanów we krwi ( hiperfosfatemia);
- witaminy D i leków zawierających wapnia chlorek lub wapnia glukonian, ze względu na możliwość wzrostu zagrożenia wystąpienia wysokiego stężenia wapnia we krwi ( hiperkalcemia);
- sodu wodorowęglanu, ponieważ może to zwiększać ryzyko nadmiaru wodorowęglanu we krwi ( zasadowica metaboliczna);
- cytrynianu jako antykoagulantu, ponieważ może on obniżać stężenie wapnia w osoczu.
Ciąża, karmienie piersią i wpływ na płodność
Ciąża i karmienie piersią:
Brak jest udokumentowanych danych klinicznych dotyczących stosowania tego leku w czasie ciąży i
laktacji. Niniejszy lek powinien być podawany kobietom w okresie ciąży i laktacji jedynie w przypadku
istnienia wyraźnej potrzeby.
Płodność:
Nie przewiduje się wpływu leku na płodność, ponieważ wapń, sód, potas, magnez, chlorki,
wodorofosforany i wodorowęglany stanowią normalne składniki organizmu.
Prowadzenie pojazdów i obsługiwanie maszyn
Phoxilium nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
3. Jak stosować lek Phoxilium
Phoxilium jest produktem stosowanym w szpitalach i podawanym wyłącznie przez personel medyczny.
Objętość leku Phoxilium i tym samym dawka zależy od stanu pacjenta. Objętość dawki określi lekarz
odpowiedzialny za leczenie.
Lek Phoxilium może być podawany bezpośrednio do krwiobiegu (dożylnie)za pośrednictwem aparatu
do CRRT lub za pośrednictwem hemodializy, kiedy roztwór przepływa po jednej stronie błony do
dializy a krew po drugiej stronie.
2/8
Ten lek należy zawsze stosować dokładnie według zaleceń lekarza, farmaceuty lub pielęgniarki. W
razie wątpliwości należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
Instrukcja użycia znajduje się w części "Poniższe informacje przeznaczone są wyłącznie dla
pracowników służby zdrowia".
Zastosowanie większej niż zalecana dawki Phoxilium
Lek Phoxilium jest przeznaczony do użycia szpitalnego i podawania wyłącznie przez lekarzy w sytuacji
starannego monitorowania bilansu płynów i składu chemicznego krwi.
Dlatego jest mało prawdopodobne zastosowanie większej niż zalecana dawki Phoxilium.
W mało prawdopodobnym przypadku wystąpienia przedawkowania lekarz prowadzący podejmie
wszelkie niezbędne działania korekcyjne i dostosuje dawkę.
Przedawkowanie może prowadzić do przeładowania płynami, zmniejszenia stężenia wodorowęglanu w
osoczu (kwasicy metabolicznej) i (lub) wysokiego stężenia fosforanów (hiperfosfatemii) u pacjentów z
uszkodzeniem nerek.
Może również prowadzić do poważnych skutków, takich jak zastoinowa niewydolność serca i
zaburzenia składu chemicznego krwi.
W razie wątpliwości związanych ze stosowaniem leku należy zwrócić się do lekarza lub farmaceuty.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Mogą wystąpić trzy działania niepożądane związane z użyciem leku Phoxilium:
- nieprawidłowo duża lub mała zawartość wody w organizmie (przewodnienie lub odwodnienie),
- zmiany zawartości soli mineralnych we krwi (nierównowaga elektrolitowa, taka jakhiperfosfatemia)oraz
- wzrost stężenia wodorowęglanu w osoczu (alkaloza metaboliczna)lub zmniejszenie stężenia wodorowęglanu w osoczu ( kwasica metaboliczna) .
Są także pewne działania niepożądane, które mogą być wywołane przez dializoterapię:
- nudności, wymioty, kurcze mięśni i niskie ciśnienie krwi ( hipotensja).
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Działania niepożądane
można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów
Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów
Biobójczych
Aleje Jerozolimskie 181C
02-222 Warszawa
Tel.: +48 22 4921301
Fax: +48 22 4921309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
3/8
5. Jak przechowywać lek Phoxilium
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na etykiecie i na opakowaniu.
Termin ważności oznacza ostatni dzień danego miesiąca.
Przechowywać w temperaturze od +4 C do +30 C. Nie przechowywać w lodówce ani nie zamrażać.
Wykazano chemiczną i fizyczną stabilność odtworzonego roztworu w ciągu 24 godzin, w temperaturze
+22 ºC. Jeśli roztwór nie zostanie zużyty od razu, za czas i warunki przechowywania przed użyciem
odpowiada użytkownik i czas ten nie powinien przekraczać 24 godzin, łącznie z czasem zabiegu.
Nie stosować tego leku, jeśli zauważy się, że roztwór jest mętny lub zewnętrzne opakowanie ochronne
jest uszkodzone. Wszystkie spawy muszą być nienaruszone.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić
środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek Phoxilium
Substancje czynne przed zmieszaniem i po zmieszaniu ( rekonstytucji) przedstawiono poniżej.
Substancje czynne przed zmieszaniem:
1000 ml roztworu w małej komorze Azawiera:
Wapnia chlorek dwuwodny
3,68 g
Magnezu chlorek sześciowodny
2,44 g
1000 ml roztworu w dużej komorze Bzawiera:
Sodu chlorek 6,44 g
Sodu wodorowęglan
2,92 g
Potasu chlorek
0,314 g
Disodu fosforan bezwodny 0,225 g
Substancje czynne po zmieszaniu:
Roztwory w komorach A (250 ml) i B (4750 ml) są mieszane w celu otrzymania jednego odtworzonego
roztworu (5000 ml) zawierającego:
mmol/l
wapń, Ca
1,25
magnez, Mg
0,6
sód, Na
140
chlorki, Cl -
115,9
wodorofosforan, HPO
1,2
wodorowęglan, HCO
30
potas, K
4
Teoretyczna osmolarność: 293 mOsm/l
Pozostałe składniki:
- dwutlenek węgla (do ustalenia pH), E290;
- kwas solny (do ustalenia pH), E507;
- woda do wstrzykiwań.
4/8
Jak wygląda Phoxilium i co zawiera opakowanie
Phoxilium jest roztworem do hemodializy i hemofiltracji pakowanym w dwukomorowe worki.
Końcowy roztwór odtworzony otrzymuje się po złamaniu łamliwej zatyczki i zmieszaniu obydwu
roztworów. Odtworzony roztwór jest przezroczysty i bezbarwny. Każdy worek (A+B) zawiera 5000 ml
roztworu do hemofiltracji i hemodializy. Każdy worek jest umieszczony w przezroczystym opakowaniu
zewnętrznym.
W każdym opakowaniu znajdują się dwa worki i ulotka informacyjna.
Podmiot odpowiedzialny:
Vantive Belgium SRL
Boulevard d’Angleterre 2
1420 Braine-l’Alleud
Belgia
Wytwórca:
Bieffe Medital S.p.A., Via Stelvio 94, 23035 Sondalo (SO), WŁOCHY
Vantive Manufacturing Limited, Moneen Road, Castlebar, County Mayo, F23 XR63, Irlandia
Ten lek jest dopuszczony do obrotu w krajach członkowskich Europejskiego Obszaru
Gospodarczego i Wielkiej Brytanii (Irlandii Północnej) pod następującymi nazwami:
Austria, Belgia, Bułgaria, Cypr, Dania, Estonia, Finlandia, Francja, Grecja, Hiszpania, Holandia,
Irlandia, Islandia, Litwa, Luxemburg, Łotwa, Malta, Niemcy, Norwegia, Polska, Portugalia, Rumunia,
Słowacja, Słowenia, Szwecja, Wielka Brytania (Irlandia Północna), Włochy: Phoxilium
Węgry: Phoxil
Data ostatniej aktualizacji ulotki: wrzesień 2024
Poniższe informacje przeznaczone są wyłącznie dla pracowników służby zdrowia:
Phoxilium 1,2 mmol/l fosforanów
Roztwór do hemodializy i hemofiltracji
Środki ostrożności
Należy ściśle przestrzegać instrukcji użycia postępowaniazproduktem leczniczym Phoxilium.
Roztwory z obu komór muszązostać zmieszane przed użyciem.
Użycie zanieczyszczonego roztworu może spowodować sepsę i wstrząs.
Aby zwiększyć komfort pacjenta, Phoxilium można podgrzać do temperatury +37°C. Podgrzanie
roztworu przed użyciem należy wykonać przed odtworzeniem i wyłącznie przy użyciu suchego źródła
ciepła. Roztworów nie należy podgrzewać w łaźni wodnej ani kuchence mikrofalowej. Przed podaniem
należy skontrolować wizualnie Phoxilium w celu wykrycia obecności cząstek stałych oraz zmiany
zabarwienia. Nie podawać, jeśli roztwór nie jest przezroczysty i spaw jest uszkodzony.
Należy regularnie mierzyć stężenie nieorganicznych fosforanów. Nieorganiczne fosforany muszą być
uzupełniane w przypadkach niskiego stężenia fosforanów we krwi.
Dodatkowa substytucja wodorowęglanu sodu może zwiększyć ryzyko zasadowicy metabolicznej.
W przypadku zaburzenia równowagi płynów należy starannie kontrolować stan kliniczny, a równowagę
płynów należy przywrócić:
- W przypadku hiperwolemii można zwiększyć szybkość ultrafiltracji (netto) w aparacie do CRRT i (lub) zmniejszyć szybkość podawania płynów innych niż płyn substytucyjny i (lub) dializat.
5/8
- W przypadku hipowolemii można zmniejszyć szybkość ultrafiltracji (netto) w aparacie do CRRT i (lub) zwiększyć szybkość podawania płynów innych niż płyn substytucyjny i (lub) dializat.
Ostrzeżenia:
Phoxilium nie powinien być stosowany u pacjentów z hiperkaliemią. Stężenie potasu w surowicy krwi
musi być monitorowane przed rozpoczęciem i w trakcie hemofiltracji i (lub) hemodializy.
Ponieważ Phoxilium jest roztworem zawierającym potas, po rozpoczęciu leczenia może przejściowo
wystąpić hiperkaliemia. Należy zmniejszyć szybkość wlewu aż do osiągnięcia właściwego stężenia
potasu. Jeśli hiperkaliemia nie ustąpi, należy niezwłocznie wstrzymać podawanie produktu leczniczego.
Jeśli podczas stosowania produktu leczniczego Phoxilium jako dializatu wystąpi hiperkaliemia,
konieczne może być podanie dializatu niezawierającego potasu w celu zwiększenia szybkości
usuwania potasu.
Ponieważ Phoxilium jest roztworem zawierającym fosforany, po rozpoczęciu leczenia może
przejściowo wystąpić hiperfosfatemia. Należy zmniejszyć szybkość wlewu aż do osiągnięcia
właściwego stężenia fosforanów. Jeśli hiperfosfatemia nie ustąpi, należy niezwłocznie wstrzymać
podawanie produktu leczniczego.
U pacjentów, którym podawany jest produkt leczniczy Phoxilium, należy regularnie kontrolować
elektrolity oraz kwasowość/zasadowość krwi. Phoxilium zawiera wodorofosforan, słaby kwas, który
może wpływać na równowagę kwasowo-zasadową pacjenta. Jeśli w trakcie leczenia produktem
Phoxilium rozwinie się lub pogłębi kwasica metaboliczna, może zaistnieć potrzeba zmniejszenia
szybkości wlewu lub wstrzymania podawania produktu leczniczego.
Ponieważ Phoxilium nie zawiera glukozy, jego podawanie może prowadzić do hipoglikemii. Należy
regularnie monitorować stężenie glukozy we krwi u pacjentów z cukrzycą (szczególnie u pacjentów
przyjmujących insulinę lub inne leki obniżające stężenie glukozy); należy to również rozważyć u
pacjentów bez cukrzycy, na przykład z uwagi na ryzyko wystąpienia bezobjawowej hipoglikemii
podczas leczenia. W przypadku wystąpienia hipoglikemii, należy rozważyć stosowanie roztworu
zawierającego glukozę. Konieczne może być również podjęcie innych środków zaradczych w celu
utrzymania właściwego stężenia glukozy we krwi.
Dawkowanie:
Objętość i szybkość podawania produktu leczniczego Phoxilium zależy od stężenia fosforanów i innych
elektrolitów we krwi, równowagi kwasowo-zasadowej, równowagi płynów oraz ogólnego stanu
klinicznego pacjenta. Objętość roztworu substytucyjnego i (lub) dializatu, jaką należy podać, będzie
również zależała od żądanej intensywności leczenia (dawki). Sposób podawania (dawkę, szybkość
infuzji i całkowitą objętość) produktu leczniczego Phoxilium powinien ustalić wyłącznie lekarz, mający
doświadczenie w zakresie intensywnej terapii oraz ciągłego leczenia nerkozastępczego (ang.
Continuous Renal Replacement Therapy, CRRT).
W związku z tym objętość dawki zależy od decyzji i zaleceń lekarza.
Zakresy szybkości przepływu dla roztworu substytucyjnego w hemofiltracji i hemodiafiltracji wynoszą:
Dorośli: 500 do 3000 ml/godz.
Zakresy szybkości przepływu dla dializatu w ciągłej hemodializie i ciągłej hemodiafiltracji wynoszą:
Dorośli: 500 do 2500 ml/godz.
U dorosłych zwykle stosowana jest łączna szybkość przepływu w przypadku CRRT (dializat i roztwory
substytucyjne) wynosząca od około 2000 do 2500 ml/godz., co odpowiada dobowej objętości płynu
mieszczącej się w zakresie od około 48 do 60 l.
6/8
Dzieci i młodzież:
U dzieci, od noworodków po młodzież do 18 lat, zakres szybkości przepływu podczas stosowania jako
płyn substytucyjny w hemofiltracji i hemodiafiltracji oraz jako roztwór do dializy (dializat) w ciągłej
hemodializie i ciągłej hemodiafiltracji wynosi od 1000 do 4000 ml/godz./1,73 m .
W przypadku gdy u młodzieży (12–18 lat) obliczona dawka dla dzieci przekracza maksymalną dawkę
dla dorosłych, należy zastosować dawkę zalecaną dla dorosłych.
Instrukcja użycia/postępowania
Roztwór z małej komory A jest dodawany do roztworu z dużej komory B po złamaniu łamliwej zatyczki
lub rozerwaniu spawu bezpośrednio przed użyciem. Odtworzony roztwór powinien być przezroczysty
i bezbarwny.
Podczas postępowania oraz podawania produktu leczniczego pacjentowi, należy stosować technikę
aseptyczną.
Używać wyłącznie wtedy, gdy zewnętrzne opakowanie ochronne jest nieuszkodzone, wszystkie spawy
są nienaruszone, łamliwa zatyczka nie jest uszkodzona, a roztwór jest przezroczysty. Mocno ścisnąć
worek, aby sprawdzić jego szczelność. W przypadku zauważenia przecieku roztwór należy
niezwłocznie wyrzucić, ponieważ nie można zagwarantować jałowości.
Duża komora B wyposażona jest w port do wstrzykiwań, umożliwiający po odtworzeniu rotworu
dodanie innych niezbędnych produktów leczniczych. Użytkownik odpowiedzialny jest za ocenę
zgodności dodawanego produktu leczniczego z produktem Phoxilium poprzez wykrycie ewentualnej
zmiany barwy i (lub) wytrącenia osadu, obecności nierozpuszczalnych kompleksów lub kryształów.
Przed dodaniem innego produktu leczniczego, należy sprawdzić, czy jest on rozpuszczalny i stabilny w
produkcie leczniczym Phoxilium oraz czy zakres pH produktu Phoxilium jest dla niego odpowiedni
(pH roztworu po rekonstytucji wynosi od 7,0-8,5). Dodatkowe składniki mogą nie być zgodne z
roztworem. Należy zapoznać się z instrukcją dotyczącą stosowania dodawanego produktu leczniczego.
Usunąć płyn z portu do wstrzykiwań, przytrzymać odwrócony worek („do góry nogami”), wstrzyknąć
produkt leczniczy przez port do wstrzykiwań i starannie wymieszać. Wprowadzanie i mieszanie
dodatkowych składników musi zawsze być wykonane przed podłączeniem worka z roztworem do
obwodu pozaustrojowego. Roztwór należy podać niezwłocznie.
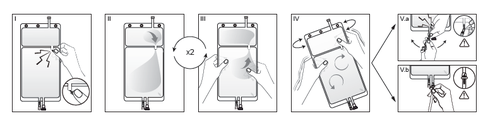
I
Opakowanie zewnętrzne zdjąć bezpośrednio przed użyciem, wyrzucić wszystkie pozostałe
opakowania. Otworzyć spawy pomiędzy obydwiema komorami worka, łamiąc łamliwą zatyczkę.
Łamliwa zatyczka pozostanie w worku (Patrz rysunek I poniżej).
II
Upewnić się, że cały płyn z małej komory A został przelany do dużej komory B (Patrz rysunek
II poniżej).
IIIPrzepłukać dwukrotnie małą komorę A, wyciskając zmieszany roztwór z powrotem do małej
komory A, a następnie ponownie do dużej komory B (Patrz rysunek III poniżej).
IV
Jeśli mała komora A jest pusta: wstrząsnąć dużą komorą B w celu całkowitego wymeszania się
jej zawartości. Teraz roztwór jest już gotowy do użycia i worek można powiesić na stojaku (Patrz
rysunek IV poniżej).
V
Do każdego z dwóch portów dostępu można podłączyć linię dializy lub wymiany.
V.aJeśli korzysta się z dostępu typu luer, należy używać techniki aseptycznej, usunąć zatyczkę i
podłączyć męską końcówkę luer lock linii dializy lub wymiany do żeńskiej końcówki typu luer
receptor na worku; zacisnąć. Używając obu rąk złamać niebieską łamliwą zatyczkę u podstawy i
poruszać nią tam i z powrotem. Nie używać narzędzi. Sprawdzić, czy zatyczka jest całkowicie
rozdzielona i czy płyn przepływa swobodnie. W czasie leczenia zatyczka pozostanie w porcie
typu luer (Patrz rysunek V.a poniżej).
V.bW przypadku korzystania z portu do wstrzykiwań, najpierw usunąć zatyczkę poprzez jej
odłamanie. Port do wstrzykiwań można przecierać środkami dezynfekującymi. Następnie przebić
kolcem gumową przegrodę. Sprawdzić, czy płyn przepływa swobodnie (Patrz rysunek V.b
poniżej).
7/8
Odtworzony roztwór powinien zostać niezwłocznie zużyty. Jeśli odtworzony roztwór nie zostanie
natychmiast zastosowany, powinien zostać zużyty w ciągu 24 godzin po dodaniu roztworu A do
roztworu B, włączając w to czas zabiegu.
Odtworzony roztwór przeznaczony jest wyłącznie do jednorazowego użytku.
Należy wyrzucić niewykorzystany roztwór natychmiast po zastosowaniu.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z
lokalnymi przepisami.
8/8
Ulotka dołączona do opakowania: Informacja dla użytkownika
PHOXILIUM 1,2 mmol/l fosforanów
Roztwór do hemodializy i hemofiltracji
Wapnia chlorek dwuwodny, magnezu chlorek sześciowodny, sodu chlorek, sodu wodorowęglan, potasu
chlorek, disodu fosforan bezwodny
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki:
- 1. Co to jest lek Phoxilium i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Phoxilium
- 3. Jak stosować lek Phoxilium
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Phoxilium
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Phoxilium i w jakim celu się go stosuje
Lek Phoxilium należący do grupy roztworów do hemofiltracji, zawiera wapnia chlorek dwuwodny,
magnezu wodorowęglan sześciowodny, sodu chlorek, sodu wodorowęglan, potasu chlorek i disodu
fosforan bezwodny.
Lek Phoxilium używany jest w szpitalach w warunkach intensywnej opieki medycznej celem
przywrócenia równowagi chemicznej krwi u pacjentów z uszkodzeniem nerek.
Ciągłe leczenienerkozastępcze ma na celu usunięcie zgromadzonych produktów przemiany materii z
krwi w sytuacji, w której nerki nie pracują.
Roztwór Phoxiliumjest używany do leczenia pacjentów w stanie krytycznym z ostrym uszkodzeniem
nerek, którzy cechują się:
- prawidłowym stężeniem potasu we krwi (normokaliemia)lub
- prawidłowym lub niskim stężeniem fosforanów we krwi (normo- lub hipofosfatemia).
Ten lek można również stosować w przypadku zatrucia lekami zawierającymi substancje ulegające
dializie lub filtracji.
2. Informacje ważne przed zastosowaniem leku Phoxilium
Nie stosować leku Phoxilium w następujących trzech przypadkach:
- jeśli u pacjenta występuje wysokie stężenie potasu we krwi (hiperkaliemia);
- jeśli u pacjenta występuje wysokie stężenie wodorowęglanów we krwi (alkaloza metaboliczna);
- jeśli u pacjenta występuje wysokie stężenie fosforanów we krwi (hiperfosfatemia).
1/8
Nie stosować hemodializy ani hemofiltracji w następujących trzech przypadkach:
- jeśli za pomocą hemofiltracji nie można złagodzić objawów powodowanych przez wysokie stężenie mocznika we krwi (objawy uremii),które są wynikiem uszkodzenia nerek z wyraźnym hiperkatabolizmem (nieprawidłowy wzrost procesów rozpadu substancji);
- niewystarczające ciśnienie tętnicze w dostępie naczyniowym;
- zmniejszona krzepliwość krwi ( antykoagulacja ogólnoustrojowa) przy istniejącym zagrożeniu krwawieniem.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem stosowania leku Phoxilium należy omówić to z lekarzem, farmaceutą lub
pielęgniarką.
Przed leczeniem i w czasie jego trwania sprawdzana będzie krew, tj. kontrolowana będzie równowaga
kwasowo-zasadowa oraz stężenia soli (elektrolitów), w tym objętości płynów podanych (wlewów
dożylnych) i odprowadzonych (wydalanego moczu), nawet tych, które nie są bezpośrednio związane z
CRRT.
Lek Phoxilium a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach stosowanych przez pacjenta obecnie
lub ostatnio, a także o lekach, które pacjent planuje stosować. Należy to zrobić, ponieważ stężenie
innych przyjmowanych leków może mieć wpływ na leczenie Phoxilium. Lekarz zdecyduje, czy należy
wprowadzić jakiekolwiek zmiany do innych zażywanych leków.
W szczególności należy poinformować o przyjmowaniu:
- fosforanów z dodatkowych źródeł (np. płynów odżywczych), ponieważ mogą one zwiększyć ryzyko wystąpienia wysokiego stężenia fosforanów we krwi ( hiperfosfatemia);
- witaminy D i leków zawierających wapnia chlorek lub wapnia glukonian, ze względu na możliwość wzrostu zagrożenia wystąpienia wysokiego stężenia wapnia we krwi ( hiperkalcemia);
- sodu wodorowęglanu, ponieważ może to zwiększać ryzyko nadmiaru wodorowęglanu we krwi ( zasadowica metaboliczna);
- cytrynianu jako antykoagulantu, ponieważ może on obniżać stężenie wapnia w osoczu.
Ciąża, karmienie piersią i wpływ na płodność
Ciąża i karmienie piersią:
Brak jest udokumentowanych danych klinicznych dotyczących stosowania tego leku w czasie ciąży i
laktacji. Niniejszy lek powinien być podawany kobietom w okresie ciąży i laktacji jedynie w przypadku
istnienia wyraźnej potrzeby.
Płodność:
Nie przewiduje się wpływu leku na płodność, ponieważ wapń, sód, potas, magnez, chlorki,
wodorofosforany i wodorowęglany stanowią normalne składniki organizmu.
Prowadzenie pojazdów i obsługiwanie maszyn
Phoxilium nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
3. Jak stosować lek Phoxilium
Phoxilium jest produktem stosowanym w szpitalach i podawanym wyłącznie przez personel medyczny.
Objętość leku Phoxilium i tym samym dawka zależy od stanu pacjenta. Objętość dawki określi lekarz
odpowiedzialny za leczenie.
Lek Phoxilium może być podawany bezpośrednio do krwiobiegu (dożylnie)za pośrednictwem aparatu
do CRRT lub za pośrednictwem hemodializy, kiedy roztwór przepływa po jednej stronie błony do
dializy a krew po drugiej stronie.
2/8
Ten lek należy zawsze stosować dokładnie według zaleceń lekarza, farmaceuty lub pielęgniarki. W
razie wątpliwości należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
Instrukcja użycia znajduje się w części "Poniższe informacje przeznaczone są wyłącznie dla
pracowników służby zdrowia".
Zastosowanie większej niż zalecana dawki Phoxilium
Lek Phoxilium jest przeznaczony do użycia szpitalnego i podawania wyłącznie przez lekarzy w sytuacji
starannego monitorowania bilansu płynów i składu chemicznego krwi.
Dlatego jest mało prawdopodobne zastosowanie większej niż zalecana dawki Phoxilium.
W mało prawdopodobnym przypadku wystąpienia przedawkowania lekarz prowadzący podejmie
wszelkie niezbędne działania korekcyjne i dostosuje dawkę.
Przedawkowanie może prowadzić do przeładowania płynami, zmniejszenia stężenia wodorowęglanu w
osoczu (kwasicy metabolicznej) i (lub) wysokiego stężenia fosforanów (hiperfosfatemii) u pacjentów z
uszkodzeniem nerek.
Może również prowadzić do poważnych skutków, takich jak zastoinowa niewydolność serca i
zaburzenia składu chemicznego krwi.
W razie wątpliwości związanych ze stosowaniem leku należy zwrócić się do lekarza lub farmaceuty.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Mogą wystąpić trzy działania niepożądane związane z użyciem leku Phoxilium:
- nieprawidłowo duża lub mała zawartość wody w organizmie (przewodnienie lub odwodnienie),
- zmiany zawartości soli mineralnych we krwi (nierównowaga elektrolitowa, taka jakhiperfosfatemia)oraz
- wzrost stężenia wodorowęglanu w osoczu (alkaloza metaboliczna)lub zmniejszenie stężenia wodorowęglanu w osoczu ( kwasica metaboliczna) .
Są także pewne działania niepożądane, które mogą być wywołane przez dializoterapię:
- nudności, wymioty, kurcze mięśni i niskie ciśnienie krwi ( hipotensja).
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Działania niepożądane
można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów
Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów
Biobójczych
Aleje Jerozolimskie 181C
02-222 Warszawa
Tel.: +48 22 4921301
Fax: +48 22 4921309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
3/8
5. Jak przechowywać lek Phoxilium
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na etykiecie i na opakowaniu.
Termin ważności oznacza ostatni dzień danego miesiąca.
Przechowywać w temperaturze od +4ºC do +30ºC. Nie przechowywać w lodówce ani nie zamrażać.
Wykazano chemiczną i fizyczną stabilność odtworzonego roztworu w ciągu 24 godzin, w temperaturze
+22ºC. Jeśli roztwór nie zostanie zużyty od razu, za czas i warunki przechowywania przed użyciem
odpowiada użytkownik i czas ten nie powinien przekraczać 24 godzin, łącznie z czasem zabiegu.
Nie stosować tego leku, jeśli zauważy się, że roztwór jest mętny lub zewnętrzne opakowanie ochronne
jest uszkodzone. Wszystkie spawy muszą być nienaruszone.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić
środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek Phoxilium
Substancje czynne przed zmieszaniem i po zmieszaniu ( rekonstytucji) przedstawiono poniżej.
Substancje czynne przed zmieszaniem:
1000 ml roztworu w małej komorze Azawiera:
Wapnia chlorek dwuwodny
3,68 g
Magnezu chlorek sześciowodny
2,44 g
1000 ml roztworu w dużej komorze Bzawiera:
Sodu chlorek
6,44 g
Sodu wodorowęglan
2,92 g
Potasu chlorek
0,314 g
Disodu fosforan bezwodny
0,225 g
Substancje czynne po zmieszaniu:
Roztwory w komorach A (250 ml) i B (4750 ml) są mieszane w celu otrzymania jednego odtworzonego
roztworu (5000 ml) zawierającego:
mmol/l
wapń, Ca
1,25
magnez, Mg
0,6
sód, Na
140
chlorki, Cl -
115,9
wodorofosforan, HPO
1,2
wodorowęglan, HCO
30
potas, K
4
Teoretyczna osmolarność: 293 mOsm/l
Pozostałe składniki:
- dwutlenek węgla (do ustalenia pH), E290;
- kwas solny (do ustalenia pH), E507;
- woda do wstrzykiwań.
4/8
Jak wygląda Phoxilium i co zawiera opakowanie
Phoxilium jest roztworem do hemodializy i hemofiltracji pakowanym w dwukomorowe worki.
Końcowy roztwór odtworzony otrzymuje się po złamaniu łamliwej zatyczki i zmieszaniu obydwu
roztworów. Odtworzony roztwór jest przezroczysty i bezbarwny. Każdy worek (A+B) zawiera 5000 ml
roztworu do hemofiltracji i hemodializy. Każdy worek jest umieszczony w przezroczystym opakowaniu
zewnętrznym.
W każdym opakowaniu znajdują się dwa worki i ulotka informacyjna.
Podmiot odpowiedzialny:
Vantive Belgium SRL
Boulevard d’Angleterre 2
1420 Braine-l’Alleud
Belgia
Wytwórca:
Bieffe Medital S.p.A., Via Stelvio 94, 23035 Sondalo (SO), WŁOCHY
Vantive Manufacturing Limited, Moneen Road, Castlebar, County Mayo, F23 XR63, Irlandia
Ten lek jest dopuszczony do obrotu w krajach członkowskich Europejskiego Obszaru
Gospodarczego i Wielkiej Brytanii (Irlandii Północnej) pod następującymi nazwami:
Austria, Belgia, Bułgaria, Cypr, Dania, Estonia, Finlandia, Francja, Grecja, Hiszpania, Holandia,
Irlandia, Islandia, Litwa, Luxemburg, Łotwa, Malta, Niemcy, Norwegia, Polska, Portugalia, Rumunia,
Słowacja, Słowenia, Szwecja, Wielka Brytania (Irlandia Północna), Włochy: Phoxilium
Węgry: Phoxil
Data ostatniej aktualizacji ulotki: wrzesień 2024
Poniższe informacje przeznaczone są wyłącznie dla pracowników służby zdrowia:
Phoxilium 1,2 mmol/l fosforanów
Roztwór do hemodializy i hemofiltracji
Środki ostrożności
Należy ściśle przestrzegać instrukcji użycia postępowania zproduktem leczniczym Phoxilium.
Roztwory z obu komór muszązostać zmieszane przed użyciem.
Użycie zanieczyszczonego roztworu może spowodować sepsę i wstrząs.
Aby zwiększyć komfort pacjenta, Phoxilium można podgrzać do temperatury +37°C. Podgrzanie
roztworu przed użyciem należy wykonać przed odtworzeniem i wyłącznie przy użyciu suchego źródła
ciepła. Roztworów nie należy podgrzewać w łaźni wodnej ani kuchence mikrofalowej. Przed podaniem
należy skontrolować wizualnie Phoxilium w celu wykrycia obecności cząstek stałych oraz zmiany
zabarwienia. Nie podawać, jeśli roztwór nie jest przezroczysty i spaw jest uszkodzony.
Należy regularnie mierzyć stężenie nieorganicznych fosforanów. Nieorganiczne fosforany muszą być
uzupełniane w przypadkach niskiego stężenia fosforanów we krwi.
Dodatkowa substytucja wodorowęglanu sodu może zwiększyć ryzyko zasadowicy metabolicznej.
W przypadku zaburzenia równowagi płynów należy starannie kontrolować stan kliniczny, a równowagę
płynów należy przywrócić:
- W przypadku hiperwolemii można zwiększyć szybkość ultrafiltracji (netto) w aparacie do CRRT i (lub) zmniejszyć szybkość podawania płynów innych niż płyn substytucyjny i (lub) dializat.
5/8
- W przypadku hipowolemii można zmniejszyć szybkość ultrafiltracji (netto) w aparacie do CRRT i (lub) zwiększyć szybkość podawania płynów innych niż płyn substytucyjny i (lub) dializat.
Ostrzeżenia:
Phoxilium nie powinien być stosowany u pacjentów z hiperkaliemią. Stężenie potasu w surowicy krwi
musi być monitorowane przed rozpoczęciem i w trakcie hemofiltracji i (lub) hemodializy.
Ponieważ Phoxilium jest roztworem zawierającym potas, po rozpoczęciu leczenia może przejściowo
wystąpić hiperkaliemia. Należy zmniejszyć szybkość wlewu aż do osiągnięcia właściwego stężenia
potasu. Jeśli hiperkaliemia nie ustąpi, należy niezwłocznie wstrzymać podawanie produktu leczniczego.
Jeśli podczas stosowania produktu leczniczego Phoxilium jako dializatu wystąpi hiperkaliemia,
konieczne może być podanie dializatu niezawierającego potasu w celu zwiększenia szybkości usuwania
potasu.
Ponieważ Phoxilium jest roztworem zawierającym fosforany, po rozpoczęciu leczenia może
przejściowo wystąpić hiperfosfatemia. Należy zmniejszyć szybkość wlewu aż do osiągnięcia
właściwego stężenia fosforanów. Jeśli hiperfosfatemia nie ustąpi, należy niezwłocznie wstrzymać
podawanie produktu leczniczego.
U pacjentów, którym podawany jest produkt leczniczy Phoxilium, należy regularnie kontrolować
elektrolity oraz kwasowość/zasadowość krwi. Phoxilium zawiera wodorofosforan, słaby kwas, który
może wpływać na równowagę kwasowo-zasadową pacjenta. Jeśli w trakcie leczenia produktem
Phoxilium rozwinie się lub pogłębi kwasica metaboliczna, może zaistnieć potrzeba zmniejszenia
szybkości wlewu lub wstrzymania podawania produktu leczniczego.
Ponieważ Phoxilium nie zawiera glukozy, jego podawanie może prowadzić do hipoglikemii. Należy
regularnie monitorować stężenie glukozy we krwi u pacjentów z cukrzycą (szczególnie u pacjentów
przyjmujących insulinę lub inne leki obniżające stężenie glukozy); należy to również rozważyć u
pacjentów bez cukrzycy, na przykład z uwagi na ryzyko wystąpienia bezobjawowej hipoglikemii
podczas leczenia. W przypadku wystąpienia hipoglikemii, należy rozważyć stosowanie roztworu
zawierającego glukozę. Konieczne może być również podjęcie innych środków zaradczych w celu
utrzymania właściwego stężenia glukozy we krwi.
Dawkowanie:
Objętość i szybkość podawania produktu leczniczego Phoxilium zależy od stężenia fosforanów i innych
elektrolitów we krwi, równowagi kwasowo-zasadowej, równowagi płynów oraz ogólnego stanu
klinicznego pacjenta. Objętość roztworu substytucyjnego i (lub) dializatu, jaką należy podać, będzie
również zależała od żądanej intensywności leczenia (dawki). Sposób podawania (dawkę, szybkość
infuzji i całkowitą objętość) produktu leczniczego Phoxilium powinien ustalić wyłącznie lekarz, mający
doświadczenie w zakresie intensywnej terapii oraz ciągłego leczenia nerkozastępczego (ang.
Continuous Renal Replacement Therapy, CRRT).
W związku z tym objętość dawki zależy od decyzji i zaleceń lekarza.
Zakresy szybkości przepływu dla roztworu substytucyjnego w hemofiltracji i hemodiafiltracji wynoszą:
Dorośli: 500 do 3000 ml/godz.
Zakresy szybkości przepływu dla dializatu w ciągłej hemodializie i ciągłej hemodiafiltracji wynoszą:
Dorośli: 500 do 2500 ml/godz.
U dorosłych zwykle stosowana jest łączna szybkość przepływu w przypadku CRRT (dializat i roztwory
substytucyjne) wynosząca od około 2000 do 2500 ml/godz., co odpowiada dobowej objętości płynu
mieszczącej się w zakresie od około 48 do 60 l.
6/8
Dzieci i młodzież:
U dzieci, od noworodków po młodzież do 18 lat, zakres szybkości przepływu podczas stosowania jako
płyn substytucyjny w hemofiltracji i hemodiafiltracji oraz jako roztwór do dializy (dializat) w ciągłej
hemodializie i ciągłej hemodiafiltracji wynosi od 1000 do 4000 ml/godz./1,73 m .
W przypadku gdy u młodzieży (12–18 lat) obliczona dawka dla dzieci przekracza maksymalną dawkę
dla dorosłych, należy zastosować dawkę zalecaną dla dorosłych.
Instrukcja użycia/postępowania
Roztwór z małej komory A jest dodawany do roztworu z dużej komory B po złamaniu łamliwej zatyczki
lub rozerwaniu spawu bezpośrednio przed użyciem. Odtworzony roztwór powinien być przezroczysty
i bezbarwny.
Podczas postępowania oraz podawania produktu leczniczego pacjentowi, należy stosować technikę
aseptyczną.
Używać wyłącznie wtedy, gdy zewnętrzne opakowanie ochronne jest nieuszkodzone, wszystkie spawy
są nienaruszone, łamliwa zatyczka nie jest uszkodzona, a roztwór jest przezroczysty. Mocno ścisnąć
worek, aby sprawdzić jego szczelność. W przypadku zauważenia przecieku roztwór należy
niezwłocznie wyrzucić, ponieważ nie można zagwarantować jałowości.
Duża komora B wyposażona jest w port do wstrzykiwań, umożliwiający po odtworzeniu rotworu
dodanie innych niezbędnych produktów leczniczych. Użytkownik odpowiedzialny jest za ocenę
zgodności dodawanego produktu leczniczego z produktem Phoxilium poprzez wykrycie ewentualnej
zmiany barwy i (lub) wytrącenia osadu, obecności nierozpuszczalnych kompleksów lub kryształów.
Przed dodaniem innego produktu leczniczego, należy sprawdzić, czy jest on rozpuszczalny i stabilny w
produkcie leczniczym Phoxilium oraz czy zakres pH produktu Phoxilium jest dla niego odpowiedni
(pH roztworu po rekonstytucji wynosi od 7,0-8,5). Dodatkowe składniki mogą nie być zgodne z
roztworem. Należy zapoznać się z instrukcją dotyczącą stosowania dodawanego produktu leczniczego.
Usunąć płyn z portu do wstrzykiwań, przytrzymać odwrócony worek („do góry nogami”), wstrzyknąć
produkt leczniczy przez port do wstrzykiwań i starannie wymieszać. Wprowadzanie i mieszanie
dodatkowych składników musi zawsze być wykonane przed podłączeniem worka z roztworem do
obwodu pozaustrojowego. Roztwór należy podać niezwłocznie.
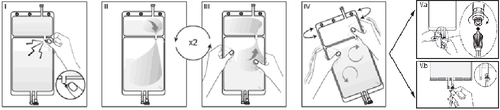
I
Opakowanie zewnętrzne zdjąć bezpośrednio przed użyciem, wyrzucić wszystkie pozostałe
opakowania. Otworzyć spaw pomiędzy obydwiema komorami worka, łamiąc łamliwą zatyczkę.
Łamliwa zatyczka pozostanie w worku (Patrz rysunek I poniżej).
II
Upewnić się, że cały płyn z małej komory A został przelany do dużej komory B (Patrz rysunek
II poniżej).
IIIPrzepłukać dwukrotnie małą komorę A, wyciskając zmieszany roztwór z powrotem do małej
komory A, a następnie ponownie do dużej komory B (Patrz rysunek III poniżej).
IV
Jeśli mała komora A jest pusta: wstrząsnąć dużą komorą B w celu całkowitego wymieszania się
jej zawartości. Teraz roztwór jest już gotowy do użycia, a worek można powiesić na stojaku
(Patrz rysunek IV poniżej).
V
Do każdego z dwóch portów dostępu można podłączyć linię dializy lub wymiany.
V.aJeśli korzysta się z dostępu typu luer, usunąć zatyczkę, przekręcając ją i pociągając, a następnie
podłączyć męską końcówkę luer lock linii dializy lub wymiany do żeńskiej końcówki typu luer
receptor na worku, dociskając ją i przekręcając. Upewnić się, że połączenie jest całkowicie
osadzone i pewne. Teraz połączenie jest otwarte. Sprawdzić, czy płyn przepływa swobodnie
(Patrz rysunek V.a poniżej).
Gdy linie dializy lub wymiany są odłączone od złącza typu luer, połączenie zostanie zamknięte i
przepływ płynu wstrzymany. Port typu luer jest bezigłowy i można go przecierać środkami
dezynfekującymi.
V.bW przypadku korzystania z portu do wstrzykiwań, najpierw usunąć zatyczkę poprzez jej
odłamanie. Port do wstrzykiwań można przecierać środkami dezynfekującymi. Następnie przebić
7/8
kolcem gumową przegrodę. Sprawdzić, czy płyn przepływa swobodnie. (Patrz rysunek V.b
poniżej).
Odtworzony roztwór powinien zostać niezwłocznie zużyty. Jeśli odtworzony roztwór nie zostanie
natychmiast zastosowany, powinien zostać zużyty w ciągu 24 godzin po dodaniu roztworu A do
roztworu B, włączając w to czas leczenia.
Odtworzony roztwór przeznaczony jest wyłącznie do jednorazowego użytku.
Należy wyrzucić niewykorzystany roztwór natychmiast po zastosowaniu.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z
lokalnymi przepisami.
8/8
- Kraj rejestracji
- Wymaga receptyNie
- ImporterBieffe Medital S.p.A. Vantive Manufacturing Limited
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki PhoxiliumPostać farmaceutyczna: Roztwór, 9 mg/mlSubstancja czynna: sodium chlorideWymaga receptyPostać farmaceutyczna: Roztwór, 100 mg/mlSubstancja czynna: dextranProducent: Fresenius Kabi Italia S.r.L.Bez receptyPostać farmaceutyczna: Koncentrat, -Substancja czynna: electrolytes in combination with other drugsProducent: Fresenius Kabi Norge ASBez recepty
Odpowiedniki Phoxilium w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Phoxilium – Ukraina
Odpowiednik Phoxilium – Hiszpania
Lekarze online w sprawie Phoxilium
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Phoxilium – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














