
Infanrix - IPV + Hib

Zapytaj lekarza o receptę na Infanrix - IPV + Hib

Jak stosować Infanrix - IPV + Hib
Ulotka dołączona do opakowania: Informacja dla użytkownika
INFANRIX-IPV+Hib, Proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań
Szczepionka przeciw błonicy (D), tężcowi (T), krztuścowi (bezkomórkowa, złożona) (Pa),
poliomyelitis (inaktywowana) (IPV) i haemophilus typ b (Hib) (skoniugowana), adsorbowana
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem szczepionki, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub farmaceuty.
- Szczepionka ta została przepisana ściśle określonej osobie. Nie należy jej przekazywać innym.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki:
- 1. Co to jest szczepionka INFANRIX-IPV+Hib i w jakim celu się ją stosuje
- 2. Informacje ważne przed zastosowaniem szczepionki INFANRIX-IPV+Hib
- 3. Jak stosować szczepionkę INFANRIX-IPV+Hib
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać szczepionkę INFANRIX-IPV+Hib
- 6. Zawartość opakowania i inne informacje
1. Co to jest szczepionka INFANRIX-IPV+Hib i w jakim celu się ją stosuje
INFANRIX-IPV+Hib jest szczepionką stosowaną w celu zapobiegania błonicy, tężcowi, krztuścowi
(kokluszowi), poliomyelitis (polio, choroba Heinego-Medina) oraz zakażeniom wywołanym przez
Haemophilus influenzaetypu b u dzieci.
Część składowa szczepionki przeciwko błonicy, tężcowi, krztuścowi i polio (DTPa-IPV) jest mętną,
białą zawiesiną w ampułko-strzykawce (0,5 ml).
Część składowa szczepionki przeciwko Hib jest białym proszkiem umieszczonym w szklanej fiolce.
Obie składowe szczepionki muszą być zmieszane razem przed szczepieniem dziecka.
- Błonica:Błonica jest chorobą zakaźną, najczęściej dotyczy dróg oddechowych, a czasami skóry. Zazwyczaj w drogach oddechowych dochodzi do stanu zapalnego i obrzęku, a to powoduje poważne trudności w oddychaniu, a czasami nawet duszenie się. Bakterie błonicy wytwarzają także toksyny (trucizny), które mogą powodować uszkodzenie nerwów, choroby serca, a nawet mogą doprowadzić do zgonu.
- Tężec:Bakterie tężca dostają się do organizmu człowieka w miejscu przecięcia, zadrapania lub rany skóry. Obrażenia, które stwarzają największe ryzyko zakażenia tężcem, to: oparzenia, złamania, rany głębokie lub rany zanieczyszczone glebą, kurzem, odchodami końskimi, drzazgami drzewnymi. Bakterie te produkują toksyny (trucizny), które mogą wywoływać sztywność mięśni, bolesne skurcze mięśni, drgawki, a nawet zgon. Skurcze mięśni mogą być tak silne, że prowadzą do złamania kości kręgosłupa.
- Krztusiec (koklusz):Krztusiec jest chorobą dróg oddechowych o bardzo dużej zakaźności. Powoduje ciężkie napady kaszlu, które mogą utrudniać normalne oddychanie. Kaszel występujący w tej chorobie jest bardzo charakterystyczny - mówi się, że osoby chore na krztusiec „zanoszą się kaszlem”. Kaszel może utrzymywać się przez 1-2 miesiące lub dłużej. Bakterie krztuśca mogą
także wywoływać zakażenia uszu, zapalenie oskrzeli, które może trwać bardzo długo, zapalenie
płuc, drgawki, uszkodzenie mózgu, a nawet zgon.
- Poliomyelitis(choroba Heinego-Medina, polio): Poliomyelitis, czasami po prostu nazywane polio, jest zakażeniem wirusowym, które charakteryzuje się wieloma objawami. Często stanowi ono łagodnie przebiegającą chorobę, ale u niektórych osób może powodować trwałe uszkodzenia, a nawet zgon. W najcięższej postaci tej choroby dochodzi do paraliżu mięśni (mięśnie nie mogą spełniać swoich funkcji), może to być paraliż mięśni oddechowych lub zapewniających możliwość poruszania się o własnych siłach. Kończyny dotknięte tym schorzeniem mogą być zniekształcone i bolesne.
- Haemophilus influenzaetyp b (Hib): Zakażenie Hib najczęściej prowadzi do zapalenia i obrzęku mózgu. Konsekwencją przebytej infekcji Hib może być niedorozwój umysłowy, porażenie mózgowe, głuchota, padaczka lub częściowa ślepota. Zakażenie Hib może także prowadzić do stanu zapalnego i obrzęku gardła. Sporadycznie może nawet prowadzić do zgonu przez uduszenie się. Rzadziej dochodzi do zakażenia krwi, serca, płuc, kości, stawów i tkanek w okolicy oczu oraz ust.
Szczepionka powoduje powstawanie w organizmie własnej odporności (przeciwciał) przeciwko
wymienionym chorobom.
Szczepienie jest najlepszym sposobem zapobiegania omawianym chorobom. Żaden ze składników
szczepionki nie jest zakaźny.
2. Informacje ważne przed zastosowaniem szczepionki INFANRIX-IPV+Hib
Kiedy nie stosować szczepionki INFANRIX-IPV+Hib:
- Jeśli dziecko ma uczulenie na INFANRIX-IPV+Hib lub którykolwiek z pozostałych składników tej szczepionki (wymienionych w punkcie 6) lub na neomycynę, polimyksynę lub formaldehyd (substancje występujące w szczepionce w ilościach śladowych). Wśród objawów uczulenia należy wymienić: swędzącą wysypkę skórną, trudności w oddychaniu, obrzęk twarzy lub języka;
- Jeśli u dziecka kiedykolwiek wystąpiła reakcja alergiczna na którąkolwiek szczepionkę przeciwko błonicy, tężcowi, krztuścowi (kokluszowi), polio lub zakażeniom Haemophilusinfluenzaetyp b;
- Jeśli u dziecka doszło do jakichkolwiek zaburzeń układu nerwowego w ciągu 7 dni po uprzednim podaniu szczepionki przeciwko krztuścowi (kokluszowi);
- Jeśli dziecko ma wysoką gorączkę (powyżej 38,0 C). Łagodna infekcja, taka jak np. przeziębienie, nie powinna być przeciwwskazaniem do szczepienia, ale najpierw należy o tym powiedzieć lekarzowi.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem stosowania szczepionki INFANRIX-IPV+Hib należy omówić to z lekarzem:
- Jeśli u dziecka, kiedykolwiek przedtem po szczepieniu szczepionką INFANRIX-IPV+Hib lub inną szczepionką przeciwko krztuścowi (kokluszowi), wystąpiły problemy zdrowotne, a w szczególności:
- wysoka gorączka (≥ 40,0 C) w ciągu 48 godzin od podania szczepionki,
- zapaść lub stan podobny do wstrząsu w ciągu 48 godzin od podania szczepionki,
- przewlekły, nieustanny płacz trwający co najmniej trzy godziny w ciągu 48 godzin po podaniu szczepionki,
- drgawki lub napady drgawek z towarzyszącą gorączką lub bez w ciągu 3 dni od podania szczepionki,
- Jeśli dziecko choruje na niezdiagnozowaną lub postępującą chorobę mózgu albo na niepoddającą się leczeniu padaczkę. Szczepionka powinna być podana po opanowaniu choroby;
- Jeśli dziecko ma skłonność do drgawek związanych z gorączką, lub takie przypadki miały miejsce w rodzinie;
- Jeśli dziecko miewa krwawienia lub łatwo dochodzi u niego do powstawania siniaków.
W takich przypadkach lekarz zdecyduje o właściwym terminie i sposobie przeprowadzenia
szczepienia u dziecka.
Po lub nawet przed podaniem każdej szczepionki w postaci zastrzyku może dojść do omdlenia. W
związku z tym należy poinformować lekarza lub pielęgniarkę, jeżeli u dziecka wystąpiło omdlenie
podczas podawania zastrzyku.
Stosowanie szczepionki INFANRIX-IPV+Hib u pacjentów z zaburzeniami odporności
U dzieci, u których występują problemy zdrowotne wynikające z zaburzeń odporności, odpowiedź na
szczepienie może być osłabiona. Infekcja HIV nie stanowi przeciwwskazania do szczepienia.
Szczepionka INFANRIX-IPV+Hib a inne leki
Należy powiedzieć lekarzowi o wszystkich lekach przyjmowanych obecnie lub ostatnio oraz o
wykonanych szczepieniach.
U dzieci, u których stosowane są leki obniżające odporność, odpowiedź na szczepienie może być
osłabiona.
Różne szczepionki pediatryczne powinny być podawane w różne miejsca ciała.
Ciąża i karmienie piersią
Ze względu na fakt, iż szczepionka przeznaczona jest dla dzieci, nie ma odpowiednich danych
odnośnie stosowania w czasie ciąży i karmienia piersią u ludzi.
Prowadzenie pojazdów i obsługiwanie maszyn
Nie dotyczy.
Szczepionka INFANRIX-IPV+Hib zawiera kwas para-aminobenzoesowy, fenyloalaninę, sód i potas
INFANRIX-IPV+Hib zawiera kwas para-aminobenzoesowy. Może powodować reakcje alergiczne
(możliwe reakcje typu późnego) i wyjątkowo skurcz oskrzeli.
Ta szczepionka zawiera 0,036 mikrograma fenyloalaniny w każdej dawce. Fenyloalanina może być
szkodliwa dla pacjentów z fenyloketonurią (PKU), rzadką chorobą genetyczną, w której fenyloalanina
gromadzi się w organizmie, ponieważ organizm nie usuwa jej w odpowiedni sposób.
Ta szczepionka zawiera mniej niż 1 mmol (23 mg) sodu na dawkę, to znaczy szczepionkę uznaje się
za „wolną od sodu”.
Ta szczepionka zawiera potas, mniej niż 1 mmol (39 mg) potasu na dawkę, to znaczy szczepionkę
uznaje się za „wolną od potasu”.
3. Jak stosować szczepionkę INFANRIX-IPV+Hib
Dziecko powinno otrzymać w sumie 3 dawki szczepionki w odstępach, co najmniej miesięcznych.
Pierwsza dawka może być podana w drugim miesiącu życia, a pełny cykl szczepienia powinien być
ukończony w ciągu pierwszych 6 miesięcy życia.
Zalecane jest podanie dawki uzupełniającej w drugim roku życia.
Każda dawka podawana jest w czasie oddzielnej wizyty. Lekarz albo pielęgniarka poinformuje, kiedy
należy zgłosić się z dzieckiem na podanie następnej dawki.
Jeżeli dziecko nie otrzyma kolejnej dawki szczepionki w wyznaczonym terminie, to należy koniecznie
porozmawiać z lekarzem i umówić kolejną wizytę.
Należy upewnić się, że dziecko otrzymało pełne szczepienie złożone z trzech dawek szczepionki,
ponieważ w innym przypadku może nie być w pełni chronione przed chorobami zakaźnymi objętymi
szczepieniem.
Szczepionka INFANRIX-IPV+Hib będzie podana jako wstrzyknięcie domięśniowe.
Szczepionka nigdy nie może być podawana dożylnie.
4. Możliwe działania niepożądane
Jak każda szczepionka, INFANRIX-IPV+Hib może powodować działania niepożądane, chociaż nie u
każdego dziecka one wystąpią.
Poniżej przedstawiono działania niepożądane, które mogą wystąpić po szczepieniu:
Bardzo często(mogą wystąpić w 1 przypadku na 10 dawek szczepionki lub częściej): utrata apetytu,
rozdrażnienie, nietypowy płacz, niepokój, senność, ból, zaczerwienienie i zlokalizowany obrzęk (≤ 50
mm) w miejscu podania, gorączka (≥ 38°C).
Często(rzadziej niż w 1 przypadku na 10 dawek szczepionki): wymioty, biegunka, twardy guzek lub
zlokalizowany obrzęk (> 50 mm) w miejscu podania.
Niezbyt często(rzadziej niż w 1 przypadku na 100 dawek szczepionki): zakażenie górnych dróg
oddechowych, obrzęk węzłów chłonnych szyjnych, pachowych i pachwinowych, kaszel, zapalenie
oskrzeli, katar, wysypka, pokrzywka, gorączka (> 39,5°C), zmęczenie, rozlany obrzęk kończyny, w
którą podano szczepionkę, obejmujący czasami sąsiadujący staw.
Rzadko(rzadziej niż w 1 przypadku na 1 000 dawek szczepionki): świąd, zapalenie skóry.
Bardzo rzadko(rzadziej niż w 1 przypadku na 10 000 dawek szczepionki):
Działania niepożądane, które występowały bardzo rzadko po wprowadzeniu do obrotu szczepionki
INFANRIX-IPV+Hib lub innych szczepionek zawierających składnik błoniczy, tężcowy lub
krztuścowy obejmowały:
- Przemijający bezdech (ustanie oddechu)
- U bardzo niedojrzałych wcześniaków (urodzonych przed lub w 28. tygodniu ciąży) w ciągu 2-3 dni po szczepieniu mogą wystąpić dłuższe niż normalnie odstępy pomiędzy oddechami.
- Krwawienia lub łatwiejsze niż zwykle powstawanie siniaków
- Reakcje alergiczne. Tak jak w przypadku innych szczepionek w postaci wstrzyknięć, istnieje bardzo małe ryzyko wystąpienia reakcji alergicznych (uczuleniowych). Stan taki można rozpoznać na podstawie następujących objawów:
- swędząca wysypka na dłoniach i stopach,
- obrzęk okolicy oczu i twarzy,
- trudności w oddychaniu i połykaniu. Objawy takie występują zazwyczaj przed opuszczeniem gabinetu lekarskiego. W każdym takim przypadku należy natychmiast podjąć leczenie.
- Drgawki (z gorączką lub bez gorączki), zapaść, zaburzenia świadomości lub utrata przytomności
- Ograniczony obrzęk najczęściej zlokalizowany w obrębie głowy i szyi (obrzęk naczyniowo- nerwowy)
- Obrzęk całej kończyny, w którą podano szczepionkę
- Pęcherzyki w miejscu podania
Jeżeli objawy te przedłużają się lub nasilają, to należy poinformować o tym lekarza.
Nie należy niepokoić się tą listą możliwych działań niepożądanych. Możliwe, że nie wystąpią żadne
działania niepożądane po szczepieniu.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Działania niepożądane
można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów
Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów
Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: 22 49-21-301, fax: 22 49-21-309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać szczepionkę INFANRIX-IPV+Hib
Przechowywać w lodówce (2 C – 8 C). Nie zamrażać.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
Szczepionkę należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tej szczepionki po upływie terminu ważności zamieszczonego na opakowaniu. Termin
ważności (EXP) oznacza ostatni dzień podanego miesiąca.
Numer serii (Lot).
6. Zawartość opakowania i inne informacje
Co zawiera szczepionka INFANRIX-IPV+Hib:
1 dawka szczepionki (0,5 ml) po rekonstytucji zawiera:
Toksoid błoniczy
nie mniej niż 30 j.m.
Toksoid tężcowy
nie mniej niż 40 j.m.
Antygeny krztuścowe Bordetella pertussis:
Toksoid krztuścowy
25 mikrogramów
Hemaglutynina włókienkowa
25 mikrogramów
Pertaktyna
8 mikrogramów
Poliowirus (inaktywowany):
typ 1 (szczep Mahoney)
40 jednostek antygenu D
typ 2 (szczep MEF-1)
8 jednostek antygenu D
typ 3 (szczep Saukett)
32 jednostki antygenu D
Polisacharyd Haemophilus typ b
(fosforan polirybozylorybitolu)
związany z toksoidem tężcowym jako nośnikiem białkowym
10 mikrogramów
około 25 mikrogramów
adsorbowane na wodorotlenku glinu, uwodnionym
0,5 miligrama Al
namnażany w hodowli komórkowej VERO
Pozostałe składniki to:
laktoza, sodu chlorek (patrz również punkt 2, „Szczepionka INFANRIX-IPV+Hib zawiera sód”),
podłoże 199 (zawierające aminokwasy (w tym fenyloalaninę), sole mineralne (w tym sód i potas),
witaminy (w tym kwas para-aminobenzoesowy) i inne substancje), woda do wstrzykiwań.
Jak wygląda szczepionka INFANRIX-IPV+Hib i co zawiera opakowanie:
Liofilizowany składnik Haemophilus influenzaetyp b (Hib) ma postać białego proszku.
Zawiesina (DTPa-IPV) zawierająca toksoid błoniczy, toksoid tężcowy, antygeny krztuścowe i
inaktywowany poliowirus jest białą, mętną zawiesiną.
Przed podaniem proszek i zawiesina są mieszane ze sobą.
Szczepionka INFANRIX-IPV+Hib dostępna jest w postaci 1-dawkowej fiolki + ampułko-strzykawki,
w opakowaniach po 1 lub 10 sztuk, z dołączonymi igłami lub bez igieł.
Nie wszystkie rodzaje opakowań muszą znajdować się w obrocie.
Podmiot odpowiedzialny i wytwórca:
GlaxoSmithKline Biologicals S.A
rue de l’Institut 89
1330 Rixensart, Belgia
W celu uzyskania bardziej szczegółowych informacji należy zwrócić się do przedstawiciela podmiotu
odpowiedzialnego.
GSK Services Sp. z o.o.
ul. Rzymowskiego 53
02-697 Warszawa
Tel. +48 (22) 576 90 00
Data ostatniej aktualizacji ulotki: kwiecień 2023
-------------------------------------------------------------------------------------------------------------------------
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
W trakcie przechowywania zawiesiny może powstawać biały osad i przezroczysty płyn powyżej. Jest
to zjawisko prawidłowe i nie wpływa na działanie szczepionki.
Przed rekonstytucją szczepionki, ampułko-strzykawką zawierającą zawiesinę DTPa-IPV należy
dobrze wstrząsnać, aby uzyskać jednorodną zawiesinę.
Zawiesinę DTPa-IPV w ampułko-strzykawce, proszek Hib w fiolce, jak również szczepionkę po
rekonstytucji należy obejrzeć przed podaniem pod kątem obecności jakichkolwiek zanieczyszczeń i
(lub) nieprawidłowego wyglądu. W przypadku zaobserwowania powyższych nieprawidłowości,
szczepionkę należy zniszczyć.
Szczepionkę należy przygotować poprzez dodanie całej zawiesiny DTPa-IPV do fiolki z proszkiem
Hib. Szczepionkę należy podać niezwłocznie po rekonstutucji. Szczepionka po rekonstytucji jest
bardziej mętna niż zawiesina DTPa-IPV. Po rekonstytucji szczepionki i nabraniu zawiesiny do
strzykawki może wystąpić rozdzielenie zawiesiny na fazę przezroczystą i fazę o konsystencji żelowej.
Nie jest to oznaką obniżenia wartości szczepionki.
W przypadku wystąpienia takiego zjawiska, przed podaniem należy ponownie energicznie
wstrząsnąć zawartością strzykawki.W przypadku zaobserwowania jakichkolwiek innych zmian
wyglądu zawiesiny, szczepionkę należy zniszczyć.
Szczegółowa instrukcja przygotowania szczepionki znajduje się poniżej:
- 1. Wstrząsnąć ampułko-strzykawką zawierającą zawiesinę DTPa-IPV;
- 2. Założyć igłę na ampułko-strzykawkę z zawiesiną DTPa-IPV i wprowadzić jej zawartość do fiolki z proszkiem Hib;
- 3. Nie wyjmując igły, wstrząsnąć energicznie fiolką i sprawdzić, czy nastąpiło rozpuszczenie;
- 4. Nabrać mieszaninę z powrotem do ampułko-strzykawki;
- 5. Zmienić założoną igłę na igłę do wstrzykiwań i niezwłocznie podać szczepionkę;
- 6. Jeżeli szczepionka nie została podana natychmiast po rekonstytucji, przed podaniem należy ponownie energicznie wstrząsnąć zawartością ampułko-strzykawki.
Instrukcje dotyczące ampułko-strzykawki
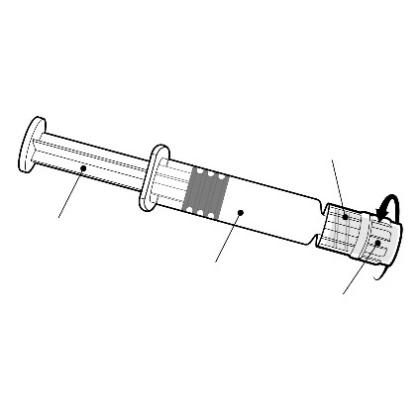
Adapter
typu Luer Lock
Należy trzymać ampułko-strzykawkę za
korpus, a nie za tłok.
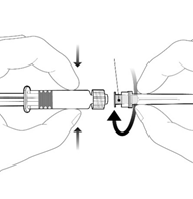
Należy odkręcić nasadkę ampułko-
strzykawki poprzez przekręcenie jej w
kierunku przeciwnym do ruchu
wskazówek zegara.
Tłok
Korpus
Nasadka
Nasadka igły
Należy przymocować igłę do ampułko-
strzykawki poprzez przyłączenie nasadki igły do
adaptera Luer Lock (ang. Luer Lock Adaptor,
LLA) i obrócenie jej ćwierć obrotu w kierunku
zgodnym z ruchem wskazówek zegara, do chwili
aż poczuje się zablokowanie igły.
Należy dokonać rekonstytucji szczepionki
zgodnie z instrukcją powyżej.
Nie wolno wyciągać tłoka z korpusu ampułko-
strzykawki. Jeśli tak się stanie, nie należy
podawać szczepionki.
Usuwanie
Wszelkie resztki niewykorzystanego produktu lub jego odpady należy usunąć w sposób zgodny z
lokalnymi przepisami.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Producent
- ImporterGlaxoSmithKline Biologicals S.A.
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki Infanrix - IPV + HibPostać farmaceutyczna: Zawiesina, 0,5 mlSubstancja czynna: diphtheria-pertussis-poliomyelitis-tetanusProducent: Sanofi-Aventis Zrt.Wymaga receptyPostać farmaceutyczna: Zawiesina, 0,5 ml (1 dawka)Substancja czynna: diphtheria-pertussis-poliomyelitis-tetanusProducent: GlaxoSmithKline Biologicals S.A.Wymaga receptyPostać farmaceutyczna: Zawiesina, nie mniej niż 2 j.m. + nie mniej niż 20 j.m. + 40 jednostek antygenu D + 8 jednostek antygenu D + 32 jednostki antygenu D/0,5 ml, 1 dawka (0,5 ml)Substancja czynna: diphtheria-poliomyelitis-tetanusProducent: Sanofi Pasteur Sanofi-Aventis Zrt.Wymaga recepty
Odpowiedniki Infanrix - IPV + Hib w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Infanrix - IPV + Hib – Украина
Odpowiednik Infanrix - IPV + Hib – Испания
Lekarze online w sprawie Infanrix - IPV + Hib
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Infanrix - IPV + Hib – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














