

FANHDI

Zapytaj lekarza o receptę na FANHDI

Jak stosować FANHDI
- 1.3.1. SPC, labelling and package leaflet
ULOTKA DOŁ Ą CZONA DO OPAKOWANIA: INFORMACJA DLA
U Ż YTKOWNIKA
FANHDI
1000 j.m. FVIII + 1200 j.m. VWF
Proszek i rozpuszczalnik do sporz ą dzania roztworu do wstrzykiwa ń i infuzji
Zespół ludzkiego czynnika krzepni ę cia VIII i ludzkiego czynnika von Willebranda
Nale ż y uwa ż nie zapozna ć si ę z tre ś ci ą ulotki przed zastosowaniem leku, poniewa ż zawiera ona informacje ważne dla pacjenta.
- Nale ż y zachowa ć t ę ulotk ę , aby w razie potrzeby móc j ą ponownie przeczyta ć .
- W razie jakichkolwiek w ą tpliwo ś ci nale ż y zwróci ć si ę do lekarza lub farmaceuty.
- Lek ten przepisano ś ci ś le okre ś lonej osobie.Nie nale ż y go przekazywa ć innym. Lek mo ż e zaszkodzi ć innej osobie, nawet je ś li objawy jej choroby s ą takie same.
- Je ś li u pacjenta wyst ą pi ą jakiekolwiek objawy niepo żą dane, w tym wszelkie objawy niepo żą dane niewymienione w tej ulotce, nale ż y powiedzie ć o tym lekarzowi lub farmaceucie. Patrz punkt 4.
Spis tre ś ci ulotki:
- 1. Co to jest lek FANHDI i w jakim celu si ę go stosuje
- 2. Informacje wa ż ne przed zastosowaniem leku FANHDI
- 3. Jak stosowa ć lek FANHDI
- 4. Mo ż liwe działania niepo żą dane
- 5. Jak przechowywa ć lek FANHDI
- 6. Zawarto ść opakowania i inne informacje
1. CO TO JEST LEK FANHDI I W JAKIM CELU SI Ę GO STOSUJE
FANHDI, wyst ę puje w postaci proszku i rozpuszczalnika do sporz ą dzania roztworu do
wstrzykiwa ń i infuzji w fiolkach zawieraj ą cych nominalnie 1000 j.m. ludzkiego VIII
czynnika krzepni ę cia (FVIII) i 1200 j.m. ludzkiego czynnika von Willebranda (VWF).
Po rozpuszczeniu w odpowiedniej ilo ś ci rozpuszczalnika (wody do wstrzykiwa ń ) produkt
zawiera 100 j.m./ml FVIII i 120 j.m./ml VWF.
Grupa farmakoterapeutyczna: leki przeciwkrwotoczne, poł ą czenie VIII czynnika krzepni ę cia
krwi i czynnika von Willebranda..
FANHDI stosowany jest w zapobieganiu i opanowywaniu krwawie ń u chorych na
hemofili ę A (wrodzony niedobór VIII czynnika krzepni ę cia).
- 1.3.1. SPC, labelling and package leaflet
Stosowanie FANHDI jest równie ż wskazane w zapobieganiu i opanowywaniu krwawie ń (w
tym krwawie ń podczas zabiegów chirurgicznych) u chorych z chorob ą von Willebranda
(VWD), gdy leczenie desmopresyn ą (DDAVP) jest nieskuteczne lub przeciwwskazane.
Produkt mo ż e by ć stosowany w leczeniu nabytego niedoboru ludzkiego VIII czynnika
krzepni ę cia.
2. INFORMACJE WA Ż NE PRZED ZASTOSOWANIEM LEKU FANHDI
Kiedy nie stosowa ć leku Fanhdi
- Gdy u pacjenta wyst ę puje uczulenie (nadwra ż liwo ść ) na zespół VIII czynnika krzepni ę cia i czynnika von Willebranda lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6).
Nale ż y zwróci ć si ę do lekarza, gdy potrzebna jest rada lub dodatkowa informacja.
Ostrze ż enia i ś rodki ostro ż no ś ci
- W rzadkich przypadkach mog ą wyst ą pi ć reakcje anafilaktyczne (nagłe silne reakcje alergiczne). Uczulenie na FANHDI mo ż e objawia ć si ę wysypk ą , uogólnion ą pokrzywk ą , uczuciem ucisku w klatce, zawrotami głowy równie ż w pozycji stoj ą cej. W przypadku wyst ą pienia tych objawów nale ż y zaprzesta ć podawania leku i powiadomi ć o tym lekarza.
- Aby ustali ć dawk ę FANHDI zapewniaj ą c ą osi ą gni ę cie i utrzymanie si ę odpowiedniego poziomu czynnika VIII, lekarz mo ż e zleci ć wykonanie szeregu bada ń .
- Je ś li krwawienie nie ust ę puje, pomimo podawania FANHDI, nale ż y powiadomi ć o tym lekarza. Mo ż e by ć to spowodowane wytwarzaniem inhibitora czynnika VIII, co wymaga potwierdzenia w badaniach. Inhibitory czynnika VIII to przeciwciała, które blokuj ą działanie podawanego czynnika VIII. W rezultacie dochodzi do obni ż enia efektywno ś ci czynnika VIII w powstrzymywaniu krwawie ń .
- Je ś li wcze ś niej ju ż doszło do tworzenia si ę inhibitora czynnika VIII a nast ę pnie zmieniono leczenie na inny produkt zawieraj ą cy czynnik VIII to istnieje wi ę ksze ryzyko nawrotu tego powikłania.
- Podczas leczenia choroby von Willebranda ze znanymi klinicznymi lub laboratoryjnymi czynnikami ryzyka wyst ę puje zagro ż enie powstania zakrzepów. Z tego powodu, konieczne jest wykonanie odpowiednich bada ń w celu wczesnego wykrycia objawów nimi spowodowanych oraz zastosowanie aktualnie zalecanego leczenia powikła ń zakrzepowo-zatorowych.
- W chorobie von Willebranda, w szczególno ś ci typu 3-go, mog ą wytworzy ć si ę przeciwciała neutralizuj ą ce (inhibitory) czynnik von Willebranda. Inhibitory czynnika
- 1.3.1. SPC, labelling and package leaflet
von Willebranda to znajdujace si ę we krwi przeciwciała, które mog ą blokowa ć
podawany czynnik. W tych przypadkach, w których w leczeniu nie osi ą ga si ę
spodziewanych poziomów aktywno ś ci czynnika von Willebranda w osoczu lub nie
udaje si ę opanowa ć krwawie ń pomimo stosowania odpowiednich dawek, nale ż y
wykona ć badania maj ą ce na celu wykrycie obecno ś ci inhibitora czynnika von
Willebranda. U pacjentów z wysokim poziomem inhibitora leczenie czynnikiem von
Willebranda mo ż e by ć nieskuteczne.
- Je ś li do podawania FANHDI b ę dzie konieczne zastosowanie centralnego doj ś cia ż ylnego, lekarz powinien liczy ć si ę z mo ż liwo ś ci ą pojawienia si ę miejscowego zaka ż enia, bakteriemii (zaka ż enie krwi przez bakterie) oraz powstania zakrzepu w naczyniu ż ylnym w miejscu wprowadzonego cewnika.
W procesie wytwarzania produktów pochodz ą cych z ludzkiej krwi lub osocza, stosuje si ę
nast ę puj ą ce działania maj ą ce na celu zabezpieczenie przed przeniesieniem czynników
zaka ź nych:
- dokładna selekcja dawców w celu wykluczenia nosicieli czynników zaka ź nych,
- badanie ka ż dej donacji i puli osocza w kierunku obecno ś ci wirusów,
- stosowanie procedur inaktywacji/usuwania wirusów z krwi i osocza w procesie wytwarzania.
Pomimo to nie mo ż na w pełni wykluczy ć przeniesienia czynników zaka ź nych podczas
stosowania produktów leczniczych otrzymywanych z ludzkiej krwi lub osocza. Odnosi si ę to
tak ż e do nieznanych lub nowo pojawiaj ą cych si ę wirusów i innych patogenów.
Zastosowane metody uwa ż a si ę za skuteczne w stosunku do wirusów osłonkowych takich jak
wirus ludzkiego niedoboru odporno ś ci (HIV), zapalenia w ą troby typu B (HBV), zapalenia
w ą troby typu C (HCV) i bezosłonkowego wirusa zapalenia w ą troby typu A. Skuteczno ść tych
metod wobec wirusów bezosłonkowych jak parvowirus B19 mo ż e by ć ograniczona.
Zaka ż enie parwowirusem B19 mo ż e by ć szczególnie gro ź ne u kobiet w ci ąż y (zaka ż enie
płodu) oraz u osób z obni ż on ą odporno ś ci ą lub pewnymi rodzajami anemii (np. w anemii
sierpowatej lub w anemii hemolitycznej).
U pacjentów otrzymuj ą cych regularnie powtarzane dawki produktów osoczopochodnych
zawieraj ą cych czynnik VIII , lekarz prowadz ą cy mo ż e zaleci ć zastosowanie odpowiednich
szczepie ń (przeciwko wirusowi zapalenia w ą troby typu A i B.
Zdecydowanie zaleca si ę , aby przy ka ż dym podaniu pacjentowi leku FANHDI odnotowa ć
nazwisko pacjenta i numer serii produktu, aby móc powi ą za ć pacjenta z seri ą leku.
Patrz tak ż e punkt 4.
Dzieci i młodzie ż
Wymienione ostrze ż enia i ś rodki ostro ż no ś ci dotycz ą zarówno dorosłych jak i dzieci.
- 1.3.1. SPC, labelling and package leaflet
FANHDI a inne leki
Nale ż y powiedzie ć lekarzowi o wszystkich lekach przyjmowanych przez pacjenta obecnie lub
ostatnio, a tak ż e o lekach, które pacjent planuje przyjmowa ć .
Interakcje zespołu ludzkiego VIII czynnika krzepni ę cia i czynnika von Willebranda z innymi
lekami nie s ą znane.
Ci ąż a i karmienie piersi ą
Ze wzgl ę du na to, ż e hemofilia A wyst ę puje u kobiet rzadko, brak jest do ś wiadcze ń
dotycz ą cych stosowania zespołu czynnika FVIII/VWF w okresie ci ąż y i karmienia piersi ą .
Nale ż y zwróci ć si ę do lekarza lub farmaceuty, zanim zacznie si ę stosowa ć jakikolwiek lek.
Prowadzenie pojazdów i obsługiwanie maszyn
FANHDI nie ma wpływu na zdolno ść prowadzenia pojazdów i obsługiwania maszyn.
3. JAK STOSOWA Ć LEK FANHDI
Lek musi by ć podawany do ż ylnie. Szybko ść podawania nie mo ż e przekroczy ć 10 ml/min.
Nale ż y zastosowa ć si ę do instrukcji lekarza lub pracownika słu ż by zdrowia z o ś rodka
leczenia hemofilii. W razie wyst ą pienia w ą tpliwo ś ci nale ż y zwróci ć si ę do lekarza lub
farmaceuty.
Wielko ść stosowanej dawki FANHDI zale ż y od wielu czynników jak wielko ść masy ciała,
stan kliniczny oraz typ i wielko ść krwawienia. W celu osi ą gni ę cia odpowiedniego poziomu
czynnika VIII i czynnika von Willebranda we krwi, lekarz okre ś li wielko ść dawki FANHDI i
cz ę sto ść jej podawania.
Lekarz ustala długo ść leczenia lekiem FANHDI.
Nie przechowywa ć pozostało ś ci do pó ź niejszego stosowania, nawet gdy maj ą by ć
przechowywane w lodówce.
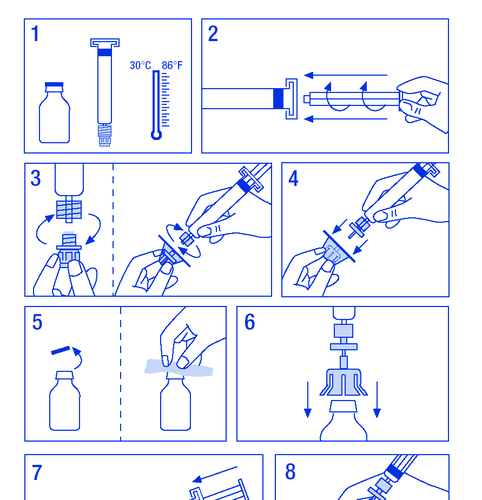
Przygotowanie roztworu:
Nale ż y upewni ć si ę , ż e czynno ś ci b ę d ą wykonywane w warunkach zapobiegaj ą cych
powstawaniu zanieczyszcze ń .
- 1. Ogrza ć fiolki do temperatury nie wy ż szej ni ż 30 ºC (rycina Nr 1).
- 2. Umocowa ć tłok w ampułko-strzykawce z rozpuszczalnikiem (rycina Nr 2).
- 3. Wyj ąć filtr z opakowania. Zdj ąć plastikow ą osłon ę z ko ń ca ampułko-strzykawki i umocowa ć filtr (rycina Nr 3).
- 1.3.1. SPC, labelling and package leaflet
- 4. Wyj ąć ł ą cznik mocuj ą cy do fiolki i poł ą czy ć ampułko-strzykawk ę z filtrem (rycina Nr 4).
- 5. Zdj ąć plastikowy kapturek z fiolki i odsłoni ę ty gumowy korek odkazi ć ś rodkiem dezynfekuj ą cym (rycina Nr 5).
- 6. Przebi ć korek w fiolce igł ą ł ą cznika (rycina Nr 6).
- 7. Wstrzykn ąć cały rozpuszczalnik do fiolki (rycina Nr 7).
- 8. Delikatnie wstrz ą sa ć fiolk ą a ż do rozpuszczenia proszku (rycina Nr 8). Tak jak w przypadku innych produktów podawanych do ż ylnie nie stosowa ć , gdy produkt jest nie rozpuszczony lub widoczne s ą cz ą stki.
- 9. Rozł ą czy ć na chwil ę ampułko-strzykawk ę z filtrem od fiolki aby wpu ś ci ć powietrze (rycina Nr 9).
- 10. Odwróci ć do góry dnem fiolk ę i aspirowa ć roztwór do ampułko-strzykawki (rycina Nr
- 10).
- 11. Przygotowa ć miejsce do iniekcji, odł ą czy ć strzykawk ę i wstrzykn ąć produkt przez zał ą czon ą igł ę motylkow ą lub inn ą steryln ą igł ę . Podawa ć powoli do ż ylnie z szybko ś ci ą 3 ml/min i nigdy nie przekracza ć 10 ml/min aby unikn ąć reakcji naczynioruchowych (rycina Nr 11).
- 1.3.1. SPC, labelling and package leaflet
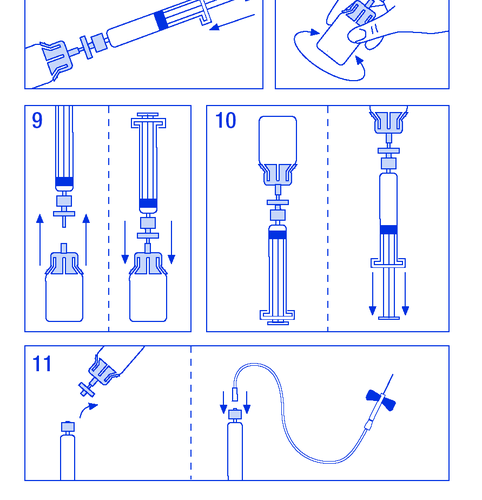
- 1.3.1. SPC, labelling and package leaflet
Nie u ż ywa ć ponownie zestawu do podawania.
Wszelkie pozostało ś ci niezu ż ytego produktu i inne odpady nale ż y usun ąć zgodnie z
lokalnymi przepisami.
Zastosowanie wi ę kszej ni ż zalecana dawki FANHDI
Nie zgłoszono objawów ż adnego przypadku przedawkowania zespołu ludzkiego VIII
czynnika krzepni ę cia i czynnika von Willebranda. Po znacznym przedawkowaniu mog ą
wystapi ć powikłania zakrzepowo-zatorowe. Niezale ż nie od tego, ka ż dy przypadek
przekroczenia zalecanej dawki FANHDI nale ż y natychmiast skonsultowa ć z farmaceut ą lub
lekarzem.
Pomini ę cie zastosowania FANHDI
- Je ś li dawka zostanie pomini ę ta, nale ż y natychmiast poda ć nast ę pn ą i kontynuowa ć leczenie w sposób regularny zgodnie z zaleceniami lekarza.
- Nie nale ż y stosowa ć dawki podwójnej w celu uzupełnienia pomini ę tej dawki.
4. MO Ż LIWE DZIAŁANIA NIEPO ŻĄ DANE
Jak ka ż dy lek, lek ten mo ż e powodowa ć działania niepo żą dane, chocia ż nie u ka ż dego one
wyst ą pi ą .
Nadwra ż liwo ść lub reakcje alergiczne (obrz ę k naczynioruchowy, pieczenie lub uczucie kłucia
w miejscu wstrzykni ę cia, dreszcze, zaczerwienienie twarzy, uogólniona pokrzywka, ból
głowy, wysypka, spadek ci ś nienia krwi, letarg, nudno ś ci, niepokój, tachykardia, uczucie
ucisku w klatce piersiowej, ś wi ą d, wymioty, ś wisty) były obserwowane rzadko i tylko w
niektórych przypadkach prowadziły do rozwoju ci ęż kiej reakcji anafilaksji (wł ą czaj ą c w to
wstrz ą s).
W rzadkich przypadkach obserwowano wzrost temperatury ciała.
W przypadku reakcji anafilaktycznej lub alergicznej nale ż y wstrzyma ć podawanie leku i
natychmiast powiadomi ć lekarza.
Nie mo ż na całkowicie wykluczy ć mo ż liwo ś ci wyst ą pienia reakcji alergicznych po podaniu
tego leku.
Chorzy na hemofili ę A mog ą wytworzy ć przeciwciała neutralizuj ą ce (inhibitory) przeciw
czynnikowi
VIII.
W
przypadku
wyst ą pienia
takich
inhibitorów
obserwuje
si ę
niewystarczaj ą c ą odpowied ź kliniczna na leczenie.
W bardzo rzadkich przypadkach u pacjentów z chorob ą von Willebranda, w szczególno ś ci
typu 3-go, mog ą wytworzy ć si ę przeciwciała neutralizuj ą ce (inhibitory) czynnik von
- 1.3.1. SPC, labelling and package leaflet
Willebranda. Je ż eli pojawi ą si ę tego typu inhibitory, obserwuje si ę niewystarczaj ą c ą
odpowied ź kliniczn ą na leczenie.
Inhibitory mog ą wpływa ć na wzrost ryzyka wyst ę powania reakcji alergicznych (wstrz ą su
anafilaktycznego). W przypadku wyst ę powania reakcji alergicznych nale ż y przeprowadzi ć
badania na obecno ść inhibitorów.
W takich przypadkach zaleca si ę kontakt z wyspecjalizowanym o ś rodkiem leczenia zaburze ń
hemostazy.
Podczas stosowania leku u pacjentów z chorob ą von Willebranda ze znanymi klinicznymi lub
laboratoryjnymi czynnikami ryzyka wyst ę puje istnieje zagro ż enie powstania wyst ą pienia
zakrzepówpowikła ń zakrzepowych.
Utrzymywanie si ę nadmiernie wysokiego poziomu F:VIII podczas leczenia czynnikiem VIII
zawieraj ą cym
czynnik
von
Willebranda
zwi ę ksza
ryzyko
wyst ą pienia
powikła ń
zakrzepowych.
Podczas kilku bada ń klinicznych przeprowadzonych z udziałem 164 chorych podano ogółem
7000 infuzji FANHDI. Uzyskane wyniki z obu bada ń wskazuj ą na dobr ą tolerancje leku i
mał ą cz ę sto ść wyst ę powania działa ń niepo żą danych. Obserwowane jedynie 2 przypadki, w
których wyst ą piły działania niepo żą dane zwi ą zane z podawanym produktem leczniczym. W
tych przypadkach odnotowano wyst ą pienie podwy ż szonej temperatury ciała.
Tabelaryczny wykaz działa ń niepo żą danych
Poni ż sza tabela zawiera kategorie układów i narz ą dów (SOC oraz Preferred Term Level)
zgodnie z klasyfikacj ą MedDRA.
Cz ę sto ść wyst ę powania oceniano stosuj ą c nast ę puj ą ce kryteria:
- bardzo cz ę sto ( ≥ 1/10)
- cz ę sto ( ≥ 1/100 do <1>
- niezbyt cz ę sto ( ≥ 1/1000 do <1>
- rzadko ( ≥ 1/10 000 do <1>
- bardzo rzadko (<1>
- nieznana (cz ę sto ść nie mo ż e by ć okre ś lona na podstawie dost ę pnych danych).
W ka ż dej kategorii cz ę sto ś ci, objawy niepo żą dane s ą wymienione poczynaj ą c od objawów
najci ęż szych do najl ż ejszych.
| Klasyfikacja układów i narządów | Działania niepożądane | Częstość występowania |
| Zaburzenia ogólne i stany w miejscu podania | Podwyższona temperatura ciała. | Rzadko |
- 1.3.1. SPC, labelling and package leaflet
Dzieci i młodzie ż
Cz ę sto ść wyst ę powania, rodzaj oraz nasilenie działa ń niepo żą danych spodziewanych u dzieci
nie ró ż ni si ę od tych wyst ę puj ą cych u dorosłych.
Zgłaszanie podejrzewanych działa ń niepo żą danych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych
działa ń niepo żą danych. Umo ż liwia to nieprzerwane monitorowanie stosunku korzy ś ci do
ryzyka stosowania produktu leczniczego. Osoby nale żą ce do fachowego personelu
medycznego powinny zgłasza ć wszelkie podejrzewane działania niepo żą dane za
po ś rednictwem:
Departament Monitorowania Niepo żą danych Działa ń Produktów Leczniczych Urz ę du
Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: +48 222 49 21 301
Faks: +48 222 49 21 309
e-mail: [email protected]
Dzi ę ki zgłaszaniu działa ń niepo żą danych mo ż na b ę dzie zgromadzi ć wi ę cej informacji na
temat bezpiecze ń stwa stosowania leku.
Informacje dotycz ą ce zabezpiecze ń przed przeniesieniem czynników zaka ź nych, patrz punkt
- 2.
5. JAK PRZECHOWYWA Ć LEK FANHDI
Lek nale ż y przechowywa ć w miejscu niewidocznym i niedost ę pnym dla dzieci.
Nie przechowywa ć w temperaturze powy ż ej 30°C. Nie zamra ż a ć .
Nie nale ż y stosowa ć leku po upływie terminu wa ż no ś ci.
Roztwór powinien by ć przezroczysty i lekko opalizuj ą cy.
Nie stosowa ć roztworów, w których wyst ę puj ą kłaczki lub osad.
Nie stosowa ć , gdy w produkcie po rozpuszczeniu widoczne s ą cz ą stki lub roztwór zmienił
kolor.
Po odtworzeniu, trwało ść chemiczna i fizyczna produktu utrzymuje si ę do 12 godzin w
temperaturze 25 ºC. Z mikrobiologicznego punktu widzenia, produkt powinien zosta ć zu ż yty
natychmiast. Je ś li po odtworzeniu produkt nie został zu ż yty, mo ż e by ć przechowywany nie
dłu ż ej ni ż przez 24 godziny w temperaturze 2 ºC – 8 ºC, ale tylko wtedy, gdy
- 1.3.1. SPC, labelling and package leaflet
odpowiedzialno ść za to we ź mie u ż ytkownik a przygotowanie roztworu odbyło si ę zgodnie z
zasadami jałowo ś ci.
Leków nie nale ż y wrzuca ć do kanalizacji. Nale ż y zapyta ć farmaceut ę , jak usun ąć leki,
których si ę ju ż nie u ż ywa. Takie post ę powanie pomo ż e chroni ć ś rodowisko.
Okres wa ż no ś ci
3 lata,
Nie nale ż y stosowa ć leku po upływie terminu wa ż no ś ci, zamieszczonego na etykiecie.
6. ZAWARTO ŚĆ OPAKOWANIA I INNE INFORMACJE
Co zawiera lek FANHDI
Substancja czynna to zespół ludzkiego VIII czynnika krzepni ę cia i czynnika von Willebranda.
Ka ż da fiolka z proszkiem zawiera 1000 j.m. ludzkiego VIII czynnika krzepni ę cia i 1200 j.m.
czynnika von Willebranda.
Po rozpuszczeniu w 10 ml wody do wstrzykiwa ń produkt zawiera 100 j.m./ml FVIII i
120 j.m./ml VWF.
Inne składniki to: Ludzka albumina, histydyna i arginina.
Ka ż da ampułko-strzykawka zawiera 10 ml wody do wstrzykiwa ń .
Jak wygl ą da lek FANHDI i co zawiera opakowanie
Fiolka z białym lub jasno- ż ółtym proszkiem oraz ampułko-strzykawka z wod ą do
wstrzykiwa ń .
Ka ż de opakowanie FANHDI zawiera fiolk ę po 1000 j.m. ludzkiego VIII czynnika
krzepni ę cia i 1200 j.m. czynnika von Willebranda (proszek do wstrzykiwa ń i infuzji) oraz 1
ampułko-strzykawk ę po 10 ml wody do wstrzykiwa ń (rozpuszczalnik).
Zestaw do przygotowania roztworu i podania zał ą czony do opakowania FANHDI: ł ą cznik
mocuj ą cy do fiolki, filtr i zestaw do infuzji.
Dost ę pne opakowania:
FANHDI 250 j.m. FVIII + 300 j.m. VWF
FANHDI 500 j.m. FVIII + 1200 j.m. VWF
Nie wszystkie opakowania mog ą znajdowa ć si ę w obrocie.
- 1.3.1. SPC, labelling and package leaflet
Podmiot odpowiedzialny i wytwórca
Instituto Grifols, S.A.
Can Guasc, 2 - Parets del Vallès
08150 Barcelona, Hiszpania
W celu uzyskania bardziej szczegółowych informacji nale ż y zwróci ć si ę do lokalnego
przedstawiciela podmiotu odpowiedzialnego:
Grifols Polska Sp. z o. o.
Ul. Grzybowska 87, 00-844 Warszawa
Tel: +48 22 378 85 61
Data ostatniej aktualizacji ulotki:
…………………………………………………………………………………………………
Informacje przeznaczone wył ą cznie dla fachowego personelu medycznego:
Dawkowanie
Niedobór VIII czynnika krzepni ę cia
Dawkowanie oraz czas leczenia substytucyjnego zale żą od stopnia niedoboru czynnika VIII,
umiejscowienia i rozległo ś ci krwawienia oraz stanu klinicznego pacjenta.
Podawan ą dawk ę VIII czynnika krzepni ę cia wyra ż a si ę w jednostkach mi ę dzynarodowych
(j.m.) zgodnie z aktualnymi normami WHO obowi ą zuj ą cymi dla produktów leczniczych
zawieraj ą cych ludzki VIII czynnik krzepni ę cia. Aktywno ść VIII czynnika krzepni ę cia w
osoczu mo ż e by ć podana w procentach (w stosunku do aktywno ś ci w normalnym osoczu)
lub w jednostkach mi ę dzynarodowych (zgodnie z mi ę dzynarodowym standardem dla VIII
czynnika krzepni ę cia w osoczu).
Jedna jednostka mi ę dzynarodowa (j.m.) aktywno ś ci VIII czynnika krzepni ę cia odpowiada
ilo ś ci VIII czynnika krzepni ę cia w jednym ml normalnego osocza ludzkiego.
Leczenie dora ź ne
Obliczanie potrzebnej kawki VIII czynnika krzepni ę cia, opiera si ę na obserwacji
empirycznej, ż e podanie 1 j.m. na kg masy ciała powoduje wzrost aktywno ś ci VIII czynnika
krzepni ę cia w osoczu o 1,7% do 2,5% normalnej aktywno ś ci. Dawk ę oblicza si ę na
podstawie nast ę puj ą cego wzoru:
Wymagana liczba jednostek = masa ciała (kg) x po żą dany wzrost aktywno ś ci VIII czynnika krzepnięcia (%) (j.m./dl) x 0,5
- 1.3.1. SPC, labelling and package leaflet
Wielko ść dawek i cz ę sto ść ich podawania nale ż y zawsze dostosowa ć indywidualnie dla
ka ż dego przypadku w zale ż no ś ci od odpowiedzi pacjenta na leczenie.
W leczeniu krwawie ń , w zale ż no ś ci od ich przyczyny i umiejscowienia, nale ż y utrzymywa ć
przez zalecany okres leczenia odpowiedni poziom aktywno ś ci VIII czynnika krzepni ę cia (w
% normy lub j.m./dl).
Przy ustalaniu dawki w zale ż no ś ci od rodzaju krwawienia i zabiegu chirurgicznego mo ż na
posłu ż y ć si ę nast ę puj ą c ą tabel ą :
| Nasilenie krwawienia/rodzaj zabiegu chirurgicznego | Wymagany poziom czynnika VIII (%) (j.m./dl) | Częstość dawkowania (godziny)/okres leczenia (dni) |
| Krwawienie Świeże krwawienie do stawów, mięśni lub krwawienie z jamy ustnej. Bardziej nasilone krwawienie do stawów, mięśni lub krwiak. Krwawienia zagrażające życiu. |
| Powtarzać co 12-24 godz. co najmniej przez 1 dzień, aż do ustąpienia bólu spowodowanego przez krwawienie lub zagojenia się rany. Powtarzać infuzje co 12-24 godz. przez 3-4 dni lub dłużej, aż do ustąpienia bólu lub zaburzenia czynności. Powtarzać infuzje co 8-24 godz. aż do ustąpienia zagrożenia |
| Zabiegi chirurgiczne Mniejsze Łącznie z ekstrakcją zęba Większe |
| Co 24 godz., co najmniej przez 1 dzień, aż do wygojenia rany. Powtarzać infuzje co 8-24 godz. aż do uzyskania odpowiedniego zagojenia rany, następnie kontynuować leczenie przez kolejne 7 dni, utrzymując aktywność czynnika VIII na poziomie od 30% do 60% (j.m./dl) |
Leczenie profilaktyczne
W długoterminowej profilaktyce krwawie ń u pacjentów z ci ęż k ą postaci ą hemofilii A, stosuje
si ę zwykle dawk ę od 20 do 40 j.m. na kg. masy ciała w odst ę pach 2 do 3 dni. W niektórych
- 1.3.1. SPC, labelling and package leaflet
przypadkach, szczególnie u pacjentów w młodym wieku mo ż e zaistnie ć konieczno ść
skrócenia odst ę pów czasowych mi ę dzy wstrzykni ę ciami lub zwi ę kszenie dawki.
Podczas leczenia, w celu ustalenia dawki i cz ę sto ś ci podawania infuzji, zaleca si ę
odpowiednie oznaczanie poziomów czynnika VIII w osoczu. Szczególnie w przypadkach
du ż ych zabiegów chirurgicznych niezb ę dne jest dokładne monitorowanie leczenia
substytucyjnego za pomoc ą bada ń układu krzepni ę cia (aktywno ść czynnika VIII w osoczu).
Pacjenci mog ą indywidualnie reagowa ć na leczenie czynnikiem VIII co znajduje
odzwierciedlenie w ró ż nych poziomach odzysku in vivo i w ró ż nych okresach półtrwania u
poszczególnych pacjentów.
Choroba von Willebranda
Ogólnie przyjmuje si ę , ż e podanie 1 j.m.VWF:RCo/kg masy ciała powoduje wzrost poziomu
VWF:RCo o 2% w kr ąż eniu. Celem leczenia jest uzyskanie poziomu VWF:RCo > 0,6 j.m./ml
(60%) oraz FVIII:C > 0,4 j.m./ml (40%) w osoczu.
W wi ę kszo ś ci przypadków, w celu uzyskania hemostazy, zaleca si ę dawk ę 40 – 80 j.m./kg
masy ciała czynnika von Willebranda oraz 20 – 40 j.m./kg masy ciała czynnika FVIII:C.
Pacjenci z chorob ą von Willebranda typu 3, u których w celu utrzymanie odpowiednich
poziomów czynnika mo ż e by ć konieczne podawanie wi ę kszych dawek, mog ą wymaga ć
podania pocz ą tkowej dawki czynnika von Willebranda 80 j.m./kg masy ciała.
Dobran ą dawk ę nale ż y podawa ć co 12 – 24 godziny. Dawkowanie oraz czas leczenia zale żą
od stanu klinicznego pacjenta, umiejscowienia i rozległo ś ci krwawienia oraz poziomu
zarówno VWF:RCo jak i FVIII:C.
W okresie stosowania produktów leczniczych z czynnikiem VIII zawieraj ą cych czynnik von
Willebranda, lekarz lecz ą cy pacjenta powinien bra ć pod uwag ę mo ż liwo ść nadmiernego
wzrostu poziomu FVIII:C. W celu unikni ę cia nadmiernego wzrostu poziomu FVIII:C, po
- 24 – 48 godzinach leczenia nale ż y rozwa ż y ć zmniejszenie dawki lub wydłu ż enie okresu pomi ę dzy kolejnymi dawkami lub zastosowanie produktów leczniczych zwieraj ą cych VWF i mniejsz ą ilo ść czynnika VIII.
Dzieci i młodzie ż
W powy ż szym wskazaniu dost ę pne s ą tylko ograniczone dane z bada ń klinicznych u dzieci
poni ż ej 6 roku ż ycia i z tego powodu nie ma zalece ń do stosowania produktu leczniczego w
tej grupie wiekowej.
U dzieci, w wy ż ej wymienionych wskazaniach dostosowywanie dawki do skuteczno ś ci
klinicznej polega równie ż jak u dorosłych na obliczaniu dawki w zale ż no ś ci od masy ciała.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Producent
- ImporterInstituto Grifols, S.A.
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki FANHDIPostać farmaceutyczna: Proszek, 50 j.m./ml; 500 j.m. + 60 j.m./ml; 600 j.m.Substancja czynna: von Willebrand factor and coagulation factor VIII in combinationProducent: Instituto Grifols S.A.Wymaga receptyPostać farmaceutyczna: Proszek, 25 j.m./ml; 250 j.m. + 30 j.m./ml; 300 j.m.Substancja czynna: von Willebrand factor and coagulation factor VIII in combinationProducent: Instituto Grifols S.A.Wymaga receptyPostać farmaceutyczna: Proszek, 1000 j.m. + 2400 j.m./15 mlSubstancja czynna: von Willebrand factor and coagulation factor VIII in combinationProducent: CSL Behring GmbHWymaga recepty
Odpowiedniki FANHDI w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik FANHDI – Ukraina
Odpowiednik FANHDI – Hiszpania
Lekarze online w sprawie FANHDI
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na FANHDI – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














