
Curosurf

Zapytaj lekarza o receptę na Curosurf

Jak stosować Curosurf
Ulotka dołączona do opakowania: informacja dla rodziców i opiekunów
Uwaga! Należy zachować ulotkę. Informacja na opakowaniu bezpośrednim w obcym języku.
Curosurf, 80 mg/ml (120 mg/1,5 ml), zawiesina do stosowania dotchawiczego i dooskrzelowego
(Poractant alfa)
Frakcja fosfolipidów z płuc świni
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub pielęgniarce. Patrz punkt 3.
Spis treści ulotki:
- 1. Co to jest lek Curosurf i w jakim celu się go stosuje
- 2. Jak stosować lek Curosurf
- 3. Możliwe działania niepożądane
- 4. Jak przechowywać lek Curosurf
- 5. Zawartość opakowani i inne informacje
1. CO TO JEST LEK CUROSURF I W JAKIM CELU SIĘ GO STOSUJE
Lek Curosurf stosowany jest w leczeniu i zapobieganiu zespołu zaburzeń oddychania (ang.
Respiratory Dissteress Syndrome: RDS) u noworodków. U większości noworodków w płucach obecna
jest substancja zwana surfaktantem (czynnik powierzchniowo czynny). Substancja ta pokrywa
pęcherzyki płucne, zapobiega ich sklejaniu i umożliwia normalne oddychanie. Jednakże, niektóre
noworodki, zwłaszcza wcześniaki, rodzą się z niedoborem surfaktantu, co prowadzi do wystąpienia
RDS. Lek Curosurf jest naturalnym surfaktantem, który działa w ten sam sposób, jak surfaktant
wytwarzany przez noworodki i dlatego pomaga noworodkom normalnie oddychać do momentu, aż
zaczną wytwarzać swój naturalny surfaktant.
U noworodka mogą wystąpić inne schorzenia, które mogą wymagać innego leczenia.
2. JAK STOSOWANY JEST LEK CUROSURF
Dawkowanie:
Lekarz dobiera odpowiednią dawkę leku, w zależności od masy ciała dziecka. Jeżeli dziecku podaje
się lek Curosurf, aby zapobiec wystąpieniu RDS, lek należy podać w ciągu 15 minut po urodzeniu.
Jeżeli dziecku podaje się lek Curosurf w celu leczenia RDS, lek należy podać jak najszybciej po
zdiagnozowaniu schorzenia. Jeżeli dziecko potrzebuje dodatkowej dawki leku Curosurf, podaje się ją
12 godzin po podaniu pierwszej dawki. W razie konieczności, po kolejnych 12 godzinach można
podać trzecią dawkę.
Stosowanie leku Curosurf u wcześniaków z niewydolnością wątroby lub nerek nie było badane.
Sposób podawania leku:
Lek Curosurf podawany jest dziecku w inkubatorze przez lekarza lub pielęgniarkę. Lek zostanie
podgrzany do temperatury pokojowej, a następnie podany przy pomocy strzykawki poprzez rurkę
intubacyjną do tchawicy dziecka. W tym celu niezbędne może być odłączenie dziecka na kilka minut
od respiratora.
Może zostać również zastosowana metoda mniej inwazyjnego podania surfaktantu przez cienki
cewnik (LISA – ang. Less Invasive Surfactant Administration).
Lek Curosurf zawiera sód
Lek zawiera mniej niż 1 mmol (23 mg) sodu w jednej fiolce, to znaczy lek uznaje się za „wolny od
sodu”.
3. MOŻLIWE DZIAŁANIA NIEPOŻĄDANE
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Możliwe działania niepożądane zostały wymienione poniżej w zależności od częstości występowania:
W przypadku wątpliwości dotyczących działań niepożądanych, należy skontaktować się z lekarzem.
Niezbyt często(występują u mniej niż 1 na 100 pacjentów):
- infekcja
- krwawienie do mózgu
- powietrze w klatce piersiowej spowodowane uszkodzeniem płuc
Rzadko(występują u mniej niż 1 na 1000 pacjentów):
- spowolnienie czynności serca
- niskie ciśnienie krwi
- przewlekła choroba płuc
- zmniejszona ilość tlenu w organizmie
Ponadto zgłoszono następujące działania niepożądane:
- zwiększona ilość tlenu w organizmie
- niebieskie zabarwienie skóry lub dziąseł spowodowane niedoborem tlenu
- zatrzymanie oddychania
- powikłania w następstwie umieszczenia rurek w płucach
- obniżenie aktywności mózgowej
Podczas podawania leku Curosurf przez cienki cewnik były raportowane niektóre łagodne i
krótkotrwałe działania niepożądane: bradykardia, bezdech, zmniejszenie wysycenia krwi tlenem, piana
na ustach, kaszel, dławienie się i kichanie.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w ulotce, należy powiedzieć o tym lekarzowi lub pielęgniarce.
Działania niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych,
Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: +
48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
4. JAK PRZECHOWYWAĆ LEK CUROSURF
- Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
- Przechowywać w lodówce (2°C - 8°C). Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem. Przed podaniem dziecku, należy podgrzać do temperatury pokojowej.
- Nieotwarte i nieużyte fiolki leku Curosurf, które zostały ogrzane do temperatury pokojowej, w ciągu 24 godzin można umieścić z powrotem w lodówce w celu późniejszego użycia. Leku nie należy ogrzewać do temperatury pokojowej i umieszczać w lodówce więcej niż jeden raz.
- Nie stosować tego leku po upływie terminu ważności zamieszczonego na pudełku i fiolce. Termin ważności oznacza ostatni dzień podanego miesiąca.
- Jeden pojemnik należy wykorzystać raz, a pozostałości wyrzucić. Szpital powinien zapewnić bezpieczne usunięcie niewykorzystanych pozostałości leku Curosurf.
- Leków nie należy wyrzucać do kanalizacji. Należy zapytać farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić środowisko
5. ZAWARTOŚĆ OPAKOWANIA I INNE INFORMACJE
Co zawiera lek Curosurf
- Substancją czynną jest mieszanina lipidów i protein otrzymywanych z pęcherzyków płucnych świni.
- Pozostałe składniki to: sodu chlorek, woda do wstrzykiwań.
Jak wygląda lek Curosurf i co zawiera opakowanie
Lek Curosurf jest to sterylna zawiesina. Jest on dostępny w jednorazowych szklanych fiolkach,
zawierających 1,5 ml (120 mg) frakcji fosfolipidów pochodzących z pęcherzyków płucnych świni.
Każdy ml sterylnej zawiesiny zawiera 80 mg frakcji fosfolipidów z pęcherzyków płucnych świni. W
jednym opakowaniu znajdują się 2 fiolki po 1,5 ml zawiesiny leku Curosurf.
W celu uzyskania bardziej szczegółowych informacji należy zwrócić się do podmiotu
odpowiedzialnego lub importera równoległego.
Podmiot odpowiedzialny w Rumunii, kraju eksportu:
CHIESI FARMACEUTICI SpA
Via Palermo 26/A, 43122 Parma, Włochy
Wytwórca:
CHIESI FARMACEUTICI SpA
Via Palermo 26/A, 43122 Parma, Włochy
CHIESI FARMACEUTICI S.p.A
Via San Leonardo 96, 43122 Parma, Włochy
CHIESI PHARMACEUTICALS GmbH
Gonzagagasse 16/16, 1010 Wiedeń, Austria
Importer równoległy:
Delfarma Sp. z o.o.
ul. Św. Teresy od Dzieciątka Jezus 111
91-222 Łódź
Przepakowano w:
Delfarma Sp. z o.o.
ul. Św. Teresy od Dzieciątka Jezus 111
91-222 Łódź
Nr pozwolenia w Rumunii, kraju eksportu: 272/2007/01
Nr pozwolenia na import równoległy: 85/19
Data zatwierdzenia ulotki:12.02.2024
[Informacja o zastrzeżonym znaku towarowym]
Prosimy przeczytać informację na odwrocie ulotki
------------------------------------------------------------------------------------------------------------------------
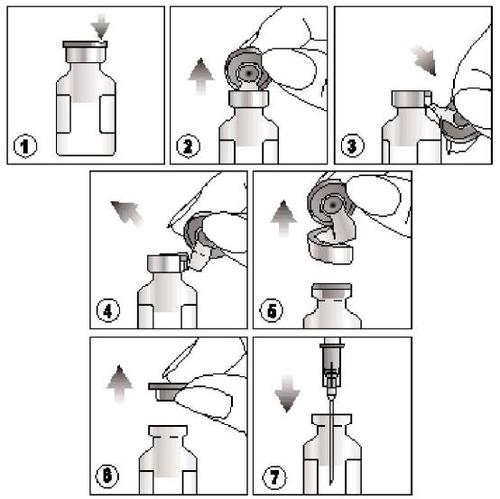
Jak pobrać produkt?
- 1) Odnaleźć nacięcie znajdujące się na kolorowym, plastikowym kapslu,
- 2) Unieść kapsel w miejscu nacięcia i pociągnąć go do góry,
- 3) Pociągnąć w dół plastikową część kapsla razem z jego częścią aluminiową,
- 4) i 5) Usunąć cały kapsel ściągając aluminiowy pierścień
- 6) i 7) Zdjąć gumowy korek przed pobraniem zawartości fiolki.
Do jednorazowego użytku. Niewykorzystaną zawiesinę, jaka pozostała w fiolce, należy wyrzucić.
Nie przechowywać niewykorzystanej zawiesiny do ponownego stosowania.
Wszelkie resztki niewykorzystanego produktu lub jego odpady należy usunąć w sposób zgodny z
przepisami.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyNie
- Podmiot odpowiedzialny (MAH)Chiesi Farmaceutici S.p.A.
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki CurosurfPostać farmaceutyczna: Zawiesina, 80 mg, co odpowiada około 74 mg całej zawartości fosfolipidów i 0,9 mg niskocząsteczkowych hydrofobowych protein.Substancja czynna: natural phospholipidsBez receptyPostać farmaceutyczna: Zawiesina, 80 mg/mlSubstancja czynna: natural phospholipidsBez receptyPostać farmaceutyczna: Pastylki, 1500 mg + 125 mgSubstancja czynna: nikethamideBez recepty
Odpowiedniki Curosurf w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Curosurf – Украина
Odpowiednik Curosurf – Испания
Lekarze online w sprawie Curosurf
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Curosurf – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














