WILATE 500 IU FvW/500 IU FVIII, POWDER AND SOLVENT FOR INJECTABLE SOLUTION


How to use WILATE 500 IU FvW/500 IU FVIII, POWDER AND SOLVENT FOR INJECTABLE SOLUTION
Translated with AI
This page provides general information and does not replace a doctor’s consultation. Always consult a doctor before taking any medication. Seek urgent medical care if symptoms are severe.
Show translationContents of the leaflet
Introducción
PROSPECTO: INFORMACION PARA EL USUARIO
WILATE,500 UI FvW y 500 UI FVIII, polvo y disolvente para solución inyectable.
WILATE,1000 UI FvW y 1000 UI FVIII, polvo y disolvente para solución inyectable.
Factor von Willebrand humano y factor VIII de coagulación humano .
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene información importante para usted.
- Conserve este prospecto. Puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado a usted, y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
- Qué es Wilate y para qué se utiliza
- Qué necesita saber antes de usar Wilate
- Cómo usar Wilate
- Posibles efectos adversos
- Conservación de Wilate
- Contenido del envase e información adicional
1. Qué es Wilate y para qué se utiliza
Wilate pertenece al grupo farmacoterapéutico de medicamentos denominados factores de coagulación, contiene factor von Willebrand (FvW) humano y factor VIII de coagulación humano .
Estas dos proteínas juntas intervienen en la coagulación sanguínea.
Enfermedad de von Willebrand
Wilate se utiliza para tratar y prevenir las hemorragias en pacientes con enfermedad de von Willebrand (EvW), que es un conjunto de enfermedades relacionadas. La EvW es una anomalía en la coagulación de la sangre por la que una hemorragia puede prolongarse más de lo esperado. Esto puede ser debido a una falta de FvW en la sangre o a que el FvW no funciona como debería.
Hemofilia A
Wilate se utiliza para tratar y prevenir las hemorragias en pacientes con hemofilia A. Esta es una enfermedad en la cual las hemorragias pueden durar más de lo esperado. Se debe a una falta innata de factor VIII en la sangre.
2. Qué necesita saber antes de usar Wilate
No use Wilate
- Si es alérgico (hipersensible) al factor von Willebrand humano, al factor VIII de coagulación humano o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a usar Wilate
- Cualquier medicamento, como Wilate, que está preparado a partir de sangre humana (que contiene proteínas) y que se inyecta en una vena (administrado por vía intravenosa) puede producir reacciones alérgicas. Preste atención a los primeros signos de reacciones alérgicas (hipersensibilidad), como urticaria, erupción cutánea, opresión en el pecho, dificultad para respirar, tensión arterial baja ó anafilaxis (cuando alguno de los síntomas anteriores ó todos ellos se desarrollan rápidamente y son intensos).
Si presenta estos síntomas debe interrumpir inmediatamente la inyección y contactar con su médico.
- Cuando se administran medicamentos derivados de plasma o sangre humano, hay que llevar a cabo ciertas medidas para evitar que las infecciones pasen a los pacientes. Tales medidas incluyen una cuidadosa selección de los donantes de sangre y plasma que garantice la exclusión de aquellos con riesgo de ser portadores de infecciones, el análisis de los signos de virus/infecciones en las donaciones individuales y en las mezclas de plasma, así como la inclusión de etapas en el procesado de la sangre o del plasma capaces de inactivar o eliminar los virus. A pesar de estas medidas, cuando se administran medicamentos preparados a partir de sangre o plasma humanos, no se puede excluir totalmente la posibilidad de transmisión de infección. Esto también se refiere a todos los virus desconocidos o emergentes u otros tipos de infecciones.
Las medidas tomadas se consideran eficaces para virus envueltos como son el virus de inmunodeficiencia humana (VIH), el virus de la hepatitis B y el virus de la hepatitis C y para el virus no envuelto, virus de la hepatitis A . Las medidas tomadas pueden tener un valor limitado frente a virus no envueltos, tales como el parvovirus B19.
La infección por parvovirus B19 puede ser grave para una mujer embarazada (infección en el bebé) y para las personas con el sistema inmunitario deprimido o que tienen algún tipo de anemia (ej. enfermedad de las células en hoz ó una destrucción anormal de los glóbulos rojos).
- Se recomienda encarecidamente que cada vez que usted reciba una dosis de Wilate se anote el nombre y número de lote del producto con el fin de mantener un registro de los lotes utilizados.
Es posible que su médico le recomiende vacunarse frente a la hepatitis A y B si a usted se le administra de forma regular/repetida productos FvW/factor VIII derivados de plasma humano.
Enfermedad de von Willebrand (EvW)
- Vea el apartado 4. (Enfermedad de von Willebrand (EvW) para los efectos secundarios relacionados con el tratamiento de la EvW.
Hemofilia A
La formación de inhibidores (anticuerpos) es una complicación conocida que puede producirse durante el tratamiento con todos los medicamentos compuestos por factor VIII. Estos inhibidores, especialmente en grandes cantidades, impiden que el tratamiento funcione correctamente, por lo que se les supervisará cuidadosamente a usted y a su hijo por si desarrollan dichos inhibidores. Si su hemorragia o la de su hijo no se está controlando con Wilate, consulte a su médico inmediatamente.
- Vea el apartado 4. (Hemofilia A) para los efectos secundarios relacionados con el tratamiento de la hemofilia A.
Usode Wilate conotros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Aunque no se conocen interacciones de Wilate con otros medicamentos, informe a su médico o farmacéutico si está utilizando o ha utilizado recientemente otros medicamentos, incluso los adquiridos sin receta.
No mezcle Wilate con otros medicamentos durante la inyección.
Embarazo, lactancia y fertilidad
Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento.
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Wilate contiene sodio
Este medicamento contiene hasta 58,7 mg de sodio (componente principal de la sal de mesa/para cocinar) en cada vial de 500 UI FvW y FVIII y hasta 117,3 mg en cada vial de 1000 UI FvW y FVIII. Esto equivale al 2,94 % y al 5,87 %, respectivamente, de la ingesta diaria máxima de sodio recomendada para un adulto.
3. Cómo usar Wilate
Wilate debe ser inyectado en una vena (administrado por vía intravenosa) después de la reconstitución con el disolvente proporcionado. El tratamiento debe ser iniciado con control médico.
Dosis
Su doctor le recomendará su dosis individual y la frecuencia con la que debe utilizar Wilate. Siga exactamente las instrucciones de administración de Wilate indicadas por su médico. Consulte a su médico o farmacéutico si tiene dudas.
Si usa más Wilate del que debiera
No se han descrito síntomas de sobredosis con FvW ó factor VIII humanos. Sin embargo, no debe excederse de la dosis recomendada.
Si olvidó usar Wilate
No se administre una dosis doble para compensar las dosis olvidadas.
Si tiene cualquier otra duda sobre el uso de este producto, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, Wilate puede producir efectos adversos, aunque no todas las personas los sufran.
- Aunque con poca frecuencia,se han observado reacciones de hipersensibilidad o alérgicas. Estas reacciones pueden incluir:
irritación y escozor en el lugar de la inyección, escalofríos, sofocos, dolor de cabeza, erupciones (urticaria), disminución de la tensión arterial (hipotensión), cansancio (letargia), mareos (náuseas), inquietud, aumento del ritmo cardiaco (taquicardia), opresión en el pecho, pinchazos (hormigueos), vómitos, dificultad respiratoria, hinchazón repentino en varias partes del cuerpo (angioedema).
Si sufre alguno de los síntomas mencionados anteriormente, informe a su médico.
Usted debe interrumpir el uso de Wilate y ver a su médico inmediatamente, si experimenta síntomas de angioedema, tales como:
- cara, lengua o garganta (faringe) hinchadas
- dificultad para tragar
- urticaria y dificultad para respirar
- Aunque de forma poco frecuente, también, se ha observado fiebre.
- También se puede producir dolor abdominal, dolor de espalda, dolor de pecho, tos y mareos, pero se desconoce la frecuencia de estas reacciones adversas.
- En muy raroscasos, la hipersensibilidad puede desembocar en una reacción alérgica grave denominada anafilaxis (cuando alguno de los síntomas anteriores o todos ellos se desarrollan rápidamente y son intensos), que puede incluir shock. En caso de shock anafiláctico, es esencial el tratamiento usando las recomendaciones médicas vigentes para el shock.
Enfermedad de Von Willebrand (EvW)
- Cuando se usa un producto FvW que contiene factor VIII para tratar la EvW, el tratamiento continuado puede producir un aumento excesivo de factor VIII en la sangre. Esto puede incrementar el riesgo de que su flujo sanguíneo se altere (trombosis).
Si usted es un paciente con factores de riesgo conocidos clínicos o de laboratorio, le tienen que controlar los primeros signos de trombosis. Su médico debe establecer una prevención (profilaxis) de los episodios trombóticos, conforme a las recomendaciones actuales.
- Los pacientes con EvW (especialmente los pacientes de tipo 3) pueden desarrollar inhibidores (anticuerpos neutralizantes) del FvW durante el tratamiento con FvW. En estos casos muy raroslos inhibidores pueden interrumpir el buen funcionamiento de Wilate.
En el caso de que su hemorragia continúe, hay que analizar la presencia de estos inhibidores en su sangre.
Los inhibidores pueden incrementar el riesgo de sufrir reacciones alérgicas graves (shock anafiláctico). Si usted sufre una reacción alérgica, tienen que analizarle la presencia de inhibidores.
Una vez que se han detectado los inhibidores en su sangre, contacte con un médico con experiencia en la atención de pacientes con trastornos hemorrágicos. En pacientes con altas cantidades de inhibidores, podría ser útil otro tipo de tratamiento y debe tenerse en cuenta.
Hemofilia A
- En los niños que no han recibido tratamiento previo con medicamentos compuestos por factor VIII pueden producirse anticuerpos inhibidores (ver sección 2) muy frecuentemente (más de 1 de cada 10 pacientes); sin embargo, en los pacientes que han recibido tratamiento previo con factor VIII (más de 150 días de tratamiento), el riesgo es poco frecuente (menos de 1 de cada 100 pacientes). Si esto sucede, los medicamentos que toman usted o su hijo pueden dejar de funcionar correctamente y usted o su hijo pueden sufrir una hemorragia persistente. En ese caso, contacte con su médico inmediatamente.
Los inhibidores pueden aumentar el riesgo de sufrir reacciones alérgicas graves (shock anafiláctico). Si usted sufre una reacción alérgica, deben analizarle la presencia de inhibidores.
Poco frecuentes:pueden afectar hasta 1 de cada 100 pacientes. Raros:pueden afectar hasta 1 de cada 1.000 pacientes. Muy raros:pueden afectar hasta 1 de cada 10.000 pacientes. |
No hay datos suficientes para recomendar el uso de Wilate en pacientes no tratados con anterioridad.
La experiencia del tratamiento con Wilate en niños menores de 6 años de edad es limitada.
Para información sobre seguridad viral ver el apartado 2 (Advertencias y precauciones).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaRAM.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Wilate
Mantener este medicamento fuera de la vista y del alcance de los niños.
Conservar el polvo y el vial del disolvente en la nevera (2ºC - 8°C).
No congelar.
Conservar los viales en el embalaje exterior para protegerlos de la luz.
No utilice Wilate después de la fecha de caducidad que aparece en el envase después de Cad: La fecha de caducidad es el último día del mes que se indica.
Wilate puede conservarse a una temperatura por debajo de 25ºC durante 2 meses. En este caso el periodo de validez es de 2 meses después de que se ha sacado el producto de la nevera por primera vez. Usted debe anotar el nuevo periodo de validez en la caja.
El polvo solo debe disolverse inmediatamente antes de la inyección. La solución ha demostrado ser estable durante 4 horas a una temperatura por debajo de 25ºC. Sin embargo, para evitar la contaminación, la solución debe utilizarse inmediatamente y solo en una ocasión. Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Wilate
- El principio activo es el factor von Willebrand humano y el factor VIII de coagulación humano.
- Los demás componentes son cloruro de sodio, glicina, sacarosa, citrato de sodio, cloruro de calcio. Disolvente: agua para preparaciones inyectables con 0,1% polisorbato 80.
Aspecto del producto y contenido del envase
Polvo liofilizado: polvo blanco o amarillo pálido o sólido pulverizado.
Solución reconstituida: debe ser transparente o ligeramente opalescente.
Wilate se suministra como polvo y disolvente para solución inyectable. Se presenta en 2 tamaños de envase:
- Wilate, 500 UI FvW y 500 UI FVIII, polvo y disolvente para solución inyectable, contiene nominalmente 500 UI de factor von Willebrand humano y 500 UI de factor VIII de coagulación humano por vial. El producto contiene aproximadamente 100 UI/ml de factor von Willebrand humano y 100 UI/ml de factor VIII de coagulación humano cuando se reconstituye con 5 ml de agua para preparaciones inyectables con un 0,1% de polisorbato 80 (disolvente).
- Wilate, 1000 UI FvW y 1000 UI FVIII, polvo y disolvente para solución inyectable, contiene nominalmente 1000 UI de factor von Willebrand humano y 1000 UI de factor VIII de coagulación humano por vial. El producto contiene aproximadamente 100 UI/ml de factor von Willebrand humano y 100 UI/ml de factor VIII de coagulación humano cuando se reconstituye con 10 ml de agua para preparaciones inyectables con un 0,1% de polisorbato 80 (disolvente).
Contenido del envase
1 vial de polvo liofilizado
1 vial de disolvente
1 caja con el equipo para inyección intravenosa (1 equipo de transferencia, 1 equipo de perfusión, 1 jeringa desechable)
2 apósitos con alcohol
Titular de la autorización de comercialización y responsable de la fabricación
Octapharma S.A
Avda. Castilla, 2. (P.E. San Fernando)
Ed. Dublin – 2ª Planta , 28830 San Fernando de Henares
Madrid
Responsable de la fabricación:
Octapharma Dessau GmbH
Otto-Reuter-Str. 3
D-06847 Dessau-Roßlau
Alemania
u
Octapharma Pharmazeutika Produktionsges.m.b.H.
Oberlaaerstr. 235
A-1100 Vienna
Austria
u
Octapharma GmbH
Elisabeth-Selberst-Str. 11
40764 Langenfeld
Alemania
Fecha de la última revisión de este prospecto: 02/2021
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo con los siguientes nombres:
Austria, Bélgica, Bulgaria, Croacia, Chipre, República Checa, Estonia, Alemania, Hungría, Irlanda, Italia, Letonia, Lituania, Luxemburgo, Malta, Países Bajos, Polonia, Portugal, Rumanía, Eslovenia, República Eslovaca, España, Reino Unido: Wilate 500/Wilate 1000
Finlandia, Noruega, Suecia: Wilate
Dinamarca: Wilnativ
Francia: Eqwilate 500/ Eqwilate 1000
Instrucciones para el tratamiento ambulatorio
- Lea todas las instrucciones y sígalas cuidadosamente.
- No utilice Wilate después de la fecha de caducidad que aparece en el envase.
- Durante el procedimiento descrito a continuación, debe mantenerse la esterilidad.
- El medicamento reconstituido se debe inspeccionar visualmente para detectar partículas o cambios de color antes de su administración.
- La solución debe ser límpida o ligeramente opalescente. No usar soluciones turbias o que contengan sedimentos.
- Utilizar inmediatamente la solución preparada, para evitar una contaminación microbiana.
- Utilizar únicamente el equipo que se incluye. El uso de otro equipo de inyección/perfusión puede ocasionar un riesgo adicional y el fracaso del tratamiento.
Instrucciones para preparar la solución:
- No utilizar el producto directamente de la nevera. Dejar el disolvente y el polvo en los viales cerrados hasta alcanzar la temperatura ambiente.
- Retirar las cápsulas flip offde los viales y limpiar los tapones de goma con uno de los algodones impregnados en alcohol que se incluyen.
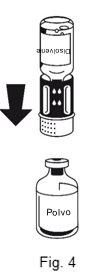
- El equipo de transferencia está representado en la Fig. 1. Colocar el vial de disolvente sobre una superficie plana y sujetarlo con firmeza. Coger el equipo de transferencia y darle la vuelta. Colocar la parte azul del equipo de transferencia sobre la parte superior del vial del disolvente y presionar con firmeza hasta que se oiga un chasquido (Fig. 2 + 3). No girarlo al acoplarlo.
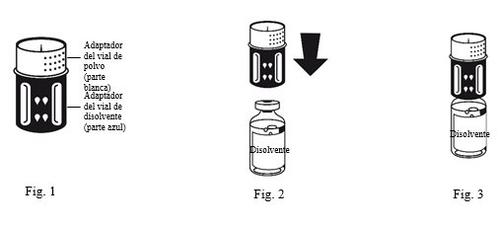
|
|
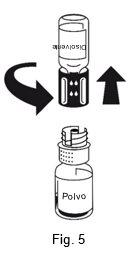
La disolución es completa en menos de 10 minutos a temperatura ambiente. Podría aparecer una ligera espuma durante la preparación. Desenroscar las dos partes del equipo de transferencia (Fig. 5). Desaparecerá la espuma. Desechar el vial de disolvente vacío junto con la parte azul del equipo de transferencia. |
|
Instrucciones para la inyección:
Como precaución, se debe medir la velocidad de su pulso antes y durante la inyección. Si la velocidad de su pulso aumenta mucho, reducir la velocidad de la inyección o interrumpir la administración durante un breve periodo de tiempo.
- Acoplar la jeringa a la parte blanca del equipo de transferencia. Darle la vuelta al vial y extraer la solución al interior de la jeringa (Fig.6). La solución debe ser límpida o ligeramente opalescente.Una vez que la solución ha sido transferida, sujetar con firmeza el émbolo de la jeringa (manteniéndolo hacia abajo) y extraer la jeringa del equipo de transferencia (Fig. 7). Desechar el vial vacío junto con la parte blanca del equipo de transferencia.
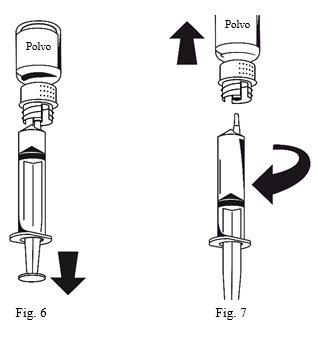
- Limpiar la zona donde se va a poner la inyección con uno de los apósitos con alcohol que se incluyen.
- Acoplar el equipo de perfusión que se incluye a la jeringa.
- Insertar la aguja de inyección en la vena escogida. Si ha empleado un torniquete para ver la vena con más facilidad, este torniquete debe ser liberado antes de empezar a inyectar Wilate.
No debe fluir sangre al interior de la jeringa debido al riesgo de formación de coágulos de fibrina.
- Inyectar la solución dentro de la vena a una velocidad lenta, no superior a 2-3 ml por minuto.
Si usa más de un vial de polvo de Wilate para un tratamiento, puede emplear la misma aguja de inyección y la misma jeringa. El equipo de transferencia es de un solo uso.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
Wilate no debe mezclarse o inyectarse (con el mismo equipo de perfusión) con otros medicamentos. Utilizar solo el equipo de perfusión que se proporciona. El uso de otros equipos de inyección/perfusión puede causar riesgos adicionales y el fracaso del tratamiento (adsorción de FvW/factor VIII en las superficies internas de algunos equipos de perfusión).
La información detallada y actualizada de este medicamento está disponible en la página web de la Agencia Española del Medicamento y Productos Sanitarios (AEMPS)http://www.aemps.gob.es/
- Country of registration
- Active substance
- Prescription requiredYes
- Manufacturer
- This information is for reference only and does not constitute medical advice. Always consult a doctor before taking any medication. Oladoctor is not responsible for medical decisions based on this content.
- Alternatives to WILATE 500 IU FvW/500 IU FVIII, POWDER AND SOLVENT FOR INJECTABLE SOLUTIONDosage form: INJECTABLE, 100 IU FVIII/ 120 IU FVW per mlActive substance: von Willebrand factor and coagulation factor VIII in combinationManufacturer: Instituto Grifols S.A.Prescription requiredDosage form: INJECTABLE, 25 IU FVIII/ 30 IU FVW per mlActive substance: von Willebrand factor and coagulation factor VIII in combinationManufacturer: Instituto Grifols S.A.Prescription requiredDosage form: INJECTABLE, 50 IU FVIII/60 IU vWF per mlActive substance: von Willebrand factor and coagulation factor VIII in combinationManufacturer: Instituto Grifols S.A.Prescription required
Online doctors for WILATE 500 IU FvW/500 IU FVIII, POWDER AND SOLVENT FOR INJECTABLE SOLUTION
Discuss questions about WILATE 500 IU FvW/500 IU FVIII, POWDER AND SOLVENT FOR INJECTABLE SOLUTION, including use, safety considerations and prescription review, subject to medical assessment and local regulations.
Frequently Asked Questions