REFIXIA 500 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE

Consulta con un médico sobre la receta médica de REFIXIA 500 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE

Cómo usar REFIXIA 500 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Introducción
Prospecto: información para el usuario
Refixia500UI polvo y disolvente para solución inyectable
Refixia 1000UI polvo y disolvente para solución inyectable
Refixia 2000UI polvo y disolvente para solución inyectable
Refixia 3000UI polvo y disolvente para solución inyectable
nonacog beta pegol
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Refixia y para qué se utiliza
- Qué necesita saber antes de empezar a usar Refixia
- Cómo usar Refixia
- Posibles efectos adversos
- Conservación de Refixia
- Contenido del envase e información adicional
1. Qué es Refixia y para qué se utiliza
Qué es Refixia
Refixia contiene el principio activo nonacog beta pegol. Es una versión del factor IX de acción prolongada. El factor IX es una proteína que se encuentra de forma natural en la sangre y que ayuda a detener el sangrado.
Para qué se utilizaRefixia
Refixia se utiliza para tratar y prevenir episodios de sangrado en pacientes de todos los grupos de edad con hemofilia B (deficiencia congénita del factor IX).
En los pacientes con hemofilia B, el factor IX falta o bien no funciona correctamente. Refixia sustituye este factor IX que falta o no funciona correctamente y ayuda a que la sangre forme coágulos en el lugar del sangrado.
2. Qué necesita saber antes de empezar a usar Refixia
No use Refixia
- si es alérgico al principio activo o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
- si es alérgico a las proteínas de hámster.
Si se encuentra en alguna de las situaciones anteriores o no está seguro de ello, consulte a su médico antes de usar este medicamento.
Advertencias y precauciones
Trazabilidad
Es importante mantener un registro del número de lote de Refixia. Por lo que, cada vez que obtenga una nueva caja de Refixia, debe apuntar la fecha y el número de lote (que figura en el envase después de Lote) y guardar esta información en un lugar seguro.
Reacciones alérgicas y desarrollo de inhibidores
Existe un riesgo mínimo de que se pueda producir una reacción alérgica repentina y grave (p. ej., una reacción anafiláctica) a Refixia. Detenga la inyección y póngase en contacto con su médico o con el servicio de urgencias de inmediato si presenta signos de una reacción alérgica, como erupción, habones, ronchas, picor en amplias zonas de la piel, enrojecimiento y/o hinchazón de los labios, la lengua, la cara o las manos, dificultad para tragar o respirar, falta de aire, sibilancias, opresión en el pecho, piel pálida y fría, palpitaciones y/o mareo.
Es posible que su médico deba tratarle rápidamente estas reacciones. Es posible que su médico también le haga un análisis de sangre para comprobar si ha desarrollado inhibidores del factor IX (anticuerpos neutralizantes) frente a su medicamento, ya que los inhibidores se pueden desarrollar junto con reacciones alérgicas. Si desarrolla dichos inhibidores, podría tener un mayor riesgo de experimentar reacciones alérgicas repentinas y graves (p. ej., una reacción anafiláctica) durante el tratamiento futuro con factor IX.
Debido al riesgo de experimentar reacciones alérgicas con el factor IX, su tratamiento inicial con Refixia se debe llevar a cabo en un centro sanitario o en presencia de un profesional sanitario que pueda proporcionarle la atención sanitaria adecuada a reacciones alérgicas si fuera necesario.
Hable con su médico inmediatamente si el sangrado no se detiene como se esperaba o si debe aumentar de forma significativa la cantidad de Refixia que necesita para detener un sangrado. Su médico le hará un análisis de sangre para comprobar si ha desarrollado inhibidores (anticuerpos neutralizantes) frente a Refixia. El riesgo de desarrollar inhibidores es mayor en las personas a las que no se ha tratado antes con medicamentos con factor IX, generalmente en los niños pequeños.
Coágulos de sangre
Informe a su médico si le ocurre alguna de las siguientes circunstancias, ya que el riesgo de formación de coágulos de sangre aumenta durante el tratamiento con Refixia:
- se ha sometido a una intervención quirúrgica recientemente
- tiene alguna otra enfermedad grave, como enfermedad hepática, enfermedad cardiaca o cáncer
- presenta factores de riesgo de desarrollar una enfermedad cardiaca, como tensión arterial alta, obesidad o tabaquismo.
Enfermedad renal (síndrome nefrótico)
Existe un riesgo mínimo de desarrollar una enfermedad renal específica llamada “síndrome nefrótico” tras la administración de dosis elevadas de factor IX en pacientes con hemofilia B e inhibidores del factor IX, así como con antecedentes de reacciones alérgicas.
Complicaciones relacionadas con el catéter
Si tiene un dispositivo de acceso venoso central (DAVC), podría desarrollar infecciones o coágulos de sangre en el lugar de inserción del catéter.
Otros medicamentos y Refixia
Informe a su médico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar Refixia.
Conducción y uso de máquinas
La influencia de Refixia sobre la capacidad para conducir y utilizar máquinas es nula.
Refixia contiene sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por vial; esto es, esencialmente “exento de sodio”. En caso de tratamiento con viales múltiples, se debe tener en consideración el contenido total de sodio.
3. Cómo usar Refixia
Un médico con experiencia en el tratamiento de pacientes con hemofilia B iniciará el tratamiento con Refixia. Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico sobre cómo utilizar Refixia.
Su médico calculará su dosis adecuada en función de su peso y de para qué se esté utilizando el medicamento.
Prevención del sangrado
La dosis normal de Refixia es 40 unidades internacionales (UI) por kg de peso corporal. Se administra mediante inyección una vez a la semana. Su médico puede elegir otra dosis o cambiar la frecuencia con la que debe administrarse las inyecciones, de acuerdo a sus necesidades.
Tratamiento del sangrado
La dosis normal de Refixia es 40 unidades internacionales (UI) por kg de peso corporal. Es posible que, en función de la localización y la gravedad del sangrado, necesite una dosis mayor (80 UI por kg) o inyecciones adicionales. Consulte con su médico la dosis y el número de inyecciones que necesita.
Uso en niños y adolescentes
Refixia se puede utilizar en niños y adolescentes de todas las edades. La dosis en niños y adolescentes también se calcula en función del peso corporal y es la misma dosis que para los adultos.
Cómo se administra Refixia
Refixia está disponible en polvo y disolvente para preparar una solución (reconstitución) y se debe inyectar en una vena. Ver “Instrucciones para utilizar Refixia” para obtener más información.
Si usa más Refixia del que debe
Si usa más Refixia del que debe, contacte con su médico.
Si debe aumentar de forma significativa la cantidad de Refixia que necesita para detener un sangrado, informe a su médico inmediatamente. Para más información, ver sección 2 “Reacciones alérgicas y desarrollo de inhibidores”.
Si olvidó usar Refixia
Si olvidó una dosis, inyéctese la dosis omitida en cuanto se acuerde. No se administre una dosis doble para compensar la dosis olvidada. Si tiene alguna duda contacte con su médico.
Si interrumpe el tratamiento con Refixia
Si interrumpe el tratamiento con Refixia dejará de estar protegido frente al sangrado o es posible que un sangrado ya existente no se detenga. No interrumpa el tratamiento con Refixia sin hablar antes con su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Es posible que se produzcan reacciones alérgicas con este medicamento.
Si se producen reacciones alérgicas repentinas y graves (p. ej., reacciones anafilácticas), es necesario detener la inyección inmediatamente. Si presenta alguno de los siguientes síntomas tempranos de una reacción alérgica grave (reacción anafiláctica), póngase en contacto con su médico o con el servicio de urgencias inmediatamente:
- dificultad para tragar o respirar
- falta de aire o sibilancias
- opresión en el pecho
- enrojecimiento y/o hinchazón de los labios, la lengua, la cara o las manos
- erupciones, habones, ronchas o picor
- piel pálida y fría, palpitaciones y/o mareos (presión sanguínea baja).
Para niños no tratados previamente con medicamentos de factor IX, la generación de inhibidores (ver sección 2) es frecuente (hasta 1 de cada 10 pacientes). Si esto ocurre, la medicación puede dejar de funcionar adecuadamente y su hijo puede experimentar un sangrado persistente. Si esto ocurre, debe contactar a su médico inmediatamente.
Se han observado los siguientes efectos adversos con Refixia:
Efectos adversos frecuentes(pueden afectar hasta 1 de cada 10 personas)
- reacciones alérgicas (hipersensibilidad). Esto puede llegar a ser grave y podría poner en peligro su vida (reacciones anafilácticas)
- picor (prurito)
- reacciones cutáneas en el lugar de inyección
- náuseas
- sentirse muy cansado
- sarpullido
- los niños no tratados previamente con medicamentos de factor IX: anticuerpos neutralizantes (inhibidores), reacciones anafilácticas.
Efectos adversos poco frecuentes(pueden afectar hasta 1 de cada 100 personas)
- palpitaciones
- sofocos.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Refixia
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice Refixia después de la fecha de caducidad que aparece en el envase y en las etiquetas del vial y de la jeringa precargada después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2 °C y 8 °C). No congelar. Conservar el vial en el embalaje exterior para protegerlo de la luz.
Refixia puede estar fuera de la nevera durante un periodo máximo de 1 año y conservarse a temperatura ambiente (hasta 30 °C). Anote en el envase la fecha en la que sacó Refixia de la nevera y lo puso a temperatura ambiente. La nueva fecha de caducidad nunca debe ser posterior a la que aparece en el cartonaje. Tire este medicamento si no lo ha utilizado antes de la nueva fecha de caducidad. Después de conservar el medicamento a temperatura ambiente, no vuelva a meterlo en la nevera.
Use la inyección inmediatamente después de preparar la solución (reconstitución). Si no puede utilizarla inmediatamente, debe usarla en un plazo de 24 horas si la conserva en nevera entre 2 °C y 8 °C o en un plazo de 4 horas si la conserva fuera de la nevera a una temperatura máxima de 30 °C.
El polvo del vial es un polvo de blanco a blanquecino. Si el color del polvo ha cambiado, no lo utilice.
La solución reconstituida es transparente e incolora a ligeramente amarilla. No utilice la solución reconstituida si observa que contiene partículas o decoloración.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Refixia
- El principio activo es nonacog beta pegol (factor IX de coagulación humano [ADNr] pegilado). Cada vial de Refixia contiene 500 UI, 1 000 UI, 2 000 UI o 3 000 UI de nonacog beta pegol, que se corresponden con aproximadamente 125 UI/ml, 250 UI/ml, 500 UI/ml o 750 UI/ml respectivamente tras la reconstitución con el disolvente de histidina.
- Los demás componentes del polvo son cloruro de sodio, histidina, sacarosa, polisorbato 80, manitol, hidróxido de sodio y ácido clorhídrico. Ver sección 2 “Refixia contiene sodio”.
- Los componentes del disolvente esterilizado son histidina, agua para preparaciones inyectables, hidróxido de sodio y ácido clorhídrico.
Aspecto de Refixia y contenido del envase
- Refixia se suministra como polvo y disolvente para solución inyectable (500 UI, 1 000 UI, 2 000 UI o 3 000 UI de polvo en un vial y 4 ml de disolvente en una jeringa precargada, una varilla de émbolo con un adaptador de vial; tamaño de envase de 1).
- El polvo es de blanco a blanquecino y el disolvente es transparente e incoloro.
Titular de la autorización de comercialización y responsable de la fabricación
Novo Nordisk A/S
Novo Allé
DK-2880 Bagsværd, Dinamarca
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
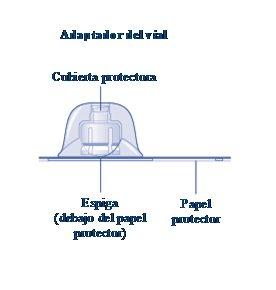
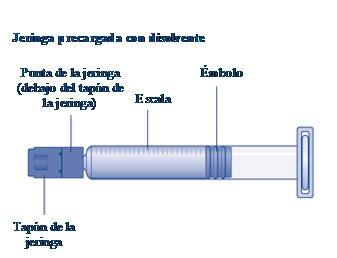
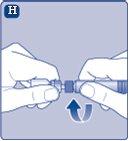
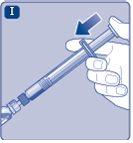
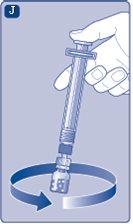
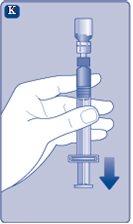
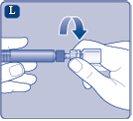
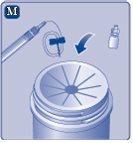
Instrucciones para utilizarRefixia Lea atentamente estas instrucciones antes de usar Refixia. Refixia se suministra en forma de polvo. Antes de la inyección se debe preparar una solución (reconstituida) con el disolvente suministrado en la jeringa. El disolvente es una solución de histidina. La solución reconstituida se debe inyectar en una vena (inyección intravenosa [IV]). Los elementos de este envase están diseñados para reconstituir e inyectar Refixia. También necesitará un equipo de infusión intravenosa (tubos y aguja mariposa), toallitas estériles con alcohol, gasas y tiritas. Estos materiales no se incluyen en el envase de Refixia. No utilice el equipo sin haber recibido la formación adecuada de su médico o enfermero. Lávese siempre las manos y asegúrese siempre de que el área a su alrededor esté limpia. Al preparar e inyectar el medicamento directamente en las venas, es importante usar una técnica limpia y sin gérmenes (aséptica).Una técnica incorrecta puede introducir gérmenes capaces de infectar la sangre. No abra el equipo hasta que esté listo para usarlo. No utilice el equipo si se ha caído o si está dañado.Utilice un envase nuevo en su lugar. No utilice el equipo si ha caducado.Utilice un envase nuevo en su lugar. La fecha de caducidad está impresa en el embalaje exterior, el vial, el adaptador del vial y la jeringa precargada. No utilice el equipo si sospecha que está contaminado.Utilice un envase nuevo en su lugar. No deseche ningún elemento hasta que se haya inyectado la solución reconstituida. El equipo es de un solo uso. | |
Contenido El envase contiene:
| |
| |
|
|
|
|
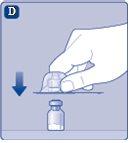
Si el papel protector no está totalmente sellado o si está roto, no utilice el adaptador del vial. No saque el adaptador del vial de la cubierta protectora con los dedos.Si toca la espiga del adaptador del vial, puede transferirle gérmenes de sus dedos. |
|
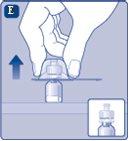
Una vez unido, no retire del vial el adaptador del vial. |
|
Quite la cubierta protectoradel adaptador del vial. No quite el adaptador del vial del vialal quitar la cubierta protectora. |
|
|
|
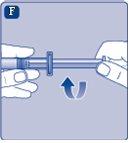
Si eltapónde la jeringa está suelto o falta, no utilice la jeringa precargada. |
|
|
|
|
|
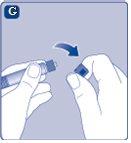
No agite el vial, ya que esto produciría espuma.
|
|
Se recomienda usar Refixia inmediatamente después de reconstituirlo,ya que, si se deja, el medicamento puede dejar de ser estéril y podría causar infecciones. Si no puede usar la solución de Refixia reconstituida inmediatamente, debe usarla en un plazo de 4 horas si está conservada a temperatura ambiente (hasta 30 °C) y en un plazo de 24 horas si está conservada en nevera (entre 2 °C y 8 °C). Conserve el producto reconstituido en el vial. No congele la solución de Refixia reconstituida ni la guarde en jeringas. Guarde la solución de Refixia reconstituida alejada de la luz directa. Si su dosis requiere más de un vial, repita los pasos Aa Jcon más viales, adaptadores de vial y jeringas precargadas hasta alcanzar la dosis necesaria. | |
Si en algún momento hay aire en la jeringa, inyecte el aire de nuevo en el vial.
|
|
|
|
Ahora Refixia está listo para ser inyectado en una vena.
Inyección de Refixia a través de conectores sin aguja para catéteres intravenosos (IV) Precaución:la jeringa precargada es de cristal y está diseñada para ser compatible con conexiones luer-lock estándar. Algunos conectores sin aguja que presentan una espiga interna son incompatibles con la jeringa precargada. Esta incompatibilidad puede impedir la administración del medicamento y/u originar un daño del conector sin aguja. Inyección de la solución a través de un dispositivo de acceso venoso central (DAVC) como un catéter venoso central o un puerto subcutáneo:
| |
Eliminación
No lo tire a la basura doméstica. |
|
No desmonte el equipo antes de eliminarlo. No reutilice el equipo. |
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a REFIXIA 500 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLEForma farmacéutica: INYECTABLE, 1.000 UIPrincipio activo: Factor de coagulación de la sangre humana IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requiere recetaForma farmacéutica: INYECTABLE, 2.000 UIPrincipio activo: Factor de coagulación de la sangre humana IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requiere recetaForma farmacéutica: INYECTABLE, 250 UIPrincipio activo: Factor de coagulación de la sangre humana IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requiere receta
Alternativas a REFIXIA 500 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a REFIXIA 500 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE en Polska
Alternativa a REFIXIA 500 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE en Ukraina
Médicos online para REFIXIA 500 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de REFIXIA 500 UI POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE – sujeta a valoración médica y normativa local.