
RATIOGRASTIM 30 MU/0,5 ml SOLUCION INYECTABLE O PARA PERFUSION

Cómo usar RATIOGRASTIM 30 MU/0,5 ml SOLUCION INYECTABLE O PARA PERFUSION
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Ratiograstim 30MUI/0,5ml solución inyectable o paraperfusión
Ratiograstim 48MUI/0,8ml solución inyectable o paraperfusión
Filgrastim
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Ratiograstim y para qué se utiliza
- Qué necesita saber antes de empezar a usar Ratiograstim
- Cómo usar Ratiograstim
- Posibles efectos adversos
- Conservación de Ratiograstim
- Contenido del envase e información adicional
- Información para auto-inyectarse
- Esta información está destinada únicamente a profesionales del sector sanitario
1. Qué es Ratiograstim y para qué se utiliza
Qué es Ratiograstim
Ratiograstim contiene el principio activo filgrastim. Filgrastim es una proteína producida por biotecnología en una bacteria llamada Escherichia coli.Pertenece a un grupo de proteínas llamado citoquinas y es muy similar a una proteína natural producida por su propio organismo ?factor estimulante de colonias de granulocitos (GCSF)?.
Ratiograstim estimula la medula ósea (es el tejido donde se fabrican las células sanguíneas) para producir más células sanguíneas, especialmente ciertos tipos de glóbulos blancos. Los glóbulos blancos son importantes porque ayudan a su cuerpo a luchar contra las infecciones.
Para qué se utiliza Ratiograstim
Su médico le ha recetado Ratiograstim para ayudar a su cuerpo a fabricar más glóbulos blancos. Su médico le explicará porque esta siendo tratado con Ratiograstim. Ratiograstim es útil en diferentes situaciones tales como:
- quimioterapia;
- transplante de médula ósea;
- neutropenia crónica grave (recuento bajo de glóbulos blancos);
- neutropenia en pacientes con infección por VIH;
- movilización de las células progenitoras de la sangre periférica (para la donación de células progenitoras de la sangre).
2. Qué necesita saber antes de empezar a usar Ratiograstim
No use Ratiograstim
- si es alérgico al filgrastim o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Ratiograstim
- si nota tos, fiebre y dificultada para respirar. Esto podría ser consecuencia de un trastorno pulmonar (ver sección 4. “Posibles efectos adversos”);
- si ha padecido anemia las células falciformes (una enfermedad hereditaria que se caracteriza por glóbulos rojos en forma de hoz).
- si tiene dolor en la parte superior izquierda del abdomen o en el hombro. Esto podría ser consecuencia de un trastorno del bazo (ver sección 4. “Posibles efectos adversos”).
- si tiene alteraciones sanguíneas específicas (p. ej. síndrome de Kostman, síndrome mielodisplástico o diferentes tipos de leucemia).
- si tiene osteoporosis. Su médico podría revisar regularmente su densidad ósea.
- si padece cualquier otra enfermedad, especialmente si cree que tiene una infección.
Informe a su médico o enfermero de que está siendo tratado con Ratiograstim si se está sometiendo a
pruebas óseas por imagen.
Durante el tratamiento con Ratiograstim deberá someterse, regularmente a análisis de sangre para contar el número de neutrófilos y otros glóbulos blancos en su sangre. Esto le indicará a su médico como esta funcionando el tratamiento y si necesita continuar con el.
Uso deRatiograstim conotros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
No use Ratiograstim en las 24 horas previas o subsiguientes a su tratamiento con quimioterapia.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
El uso de Ratiograstim en mujeres embarazadas no se ha investigado. Por lo tanto, su médico decidirá si es conveniente que no utilice este medicamento.
Se desconoce si filgrastim pasa a la leche materna. Por lo que su médico decidirá si es conveniente que no utilice este medicamento mientras este dando el pecho.
Conducción y uso de máquinas
Si experimenta cansancio, no conduzca ni utilice herramientas o máquinas.
Ratiograstimcontienesorbitol y sodio
Si su médico le ha indicado que padece una intolerancia a ciertos azúcares, consulte con él antes de usar este medicamento.
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por jeringa precargada; esto es, esencialmente “exento de sodio”.
3. Cómo usar Ratiograstim
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
La dosis recomendada es…
La cantidad de Ratiograstim que necesita dependerá de su enfermedad y de su peso corporal. Su médico le indicará cuando interrumpir el tratamiento con Ratiograstim. Es bastante normal tener varios ciclos de tratamiento.
Ratiograstim y quimioterapia
La dosis habitual es de 0,5 millones de unidades (MU) por kilogramo de peso corporal al día. Por ejemplo si pesa 60 kg, su dosis diaria será de 30 millones de unidades (MU). Normalmente recibirá su primera dosis a partir de las 24 horas siguientes a la finalización de la quimioterapia. Normalmente su tratamiento durará 14 días. Sin embargo en algunos tipos de enfermedades, puede que sea necesario un tratamiento mas largo con una duración cercana a un mes.
Ratiograstim y trasplante de médula ósea
La dosis inicial habitual es de 1 millón de unidades (MUI) por kilogramo de peso corporal al día. Por ejemplo si pesa 60 kg su dosis diaria será de 60 millones de unidades (MUI). Normalmente recibirá su primera dosis a partir de las 24 horas siguientes a la finalización de la quimioterapia pero dentro de las 24 horas siguientes a la transfusión de su médula ósea. Su médico entonces le hará análisis de sangre diarios para ver como esta funcionando el tratamiento y encontrar la dosis más adecuada para usted. El tratamiento se interrumpirá cuando sus glóbulos blancos hayan alcanzado un cierto número en su sangre.
Ratiograstim y neutropenia crónica grave
La dosis inicial habitual esta comprendida entre 0,5 millones de unidades y 1,2 millones de unidades (MUI) por kilogramo de peso corporal al día como dosis única o dividida en dos dosis. Su medico entonces le hará análisis de sangre para informarle de como esta funcionando el tratamiento y la duración del mismo. En el caso de neutropenia se requiere un tratamiento a largo plazo con Ratiograstim.
Ratiograstim y neutropenia en pacientes con infección por VIH
La dosis inicial habitual esta comprendida entre 0,1 millones de unidades y 0,4 millones de unidades (MUI) por kilogramo de peso corporal al día. Su medico entonces le hará análisis de sangre para informarle de como esta funcionando el tratamiento. En cuanto su número de glóbulos blancos haya vuelto a su valor normal, puede que se reduzca a la frecuencia de dosis a menos de una vez al día. Su medico continuará realizándole análisis de sangre y le recomendara la dosis más adecuada para usted. Para mantener el valor normal de glóbulos blancos en su sangre, puede que sea necesario un tratamiento a largo plazo con Ratiograstim.
Ratiograstim y movilización de las células progenitoras de sangre periférica
Si usted es su propio donante de células progenitoras, la dosis habitual es de 0,5 millones de unidades (MUI) por kilogramo de peso corporal al día. El tratamiento con Ratiograstim durará al menos 2 semanas y en algunos casos será más largo. Su médico controlará sus valores sanguíneos para establecer cual es el mejor momento para recoger las células progenitoras.
Si es donante de células progenitoras para otra persona, la dosis habitual es de 1 millón de unidades (MUI) por kilogramo de peso corporal al día. El tratamiento con Ratiograstim durará entre 4 y 5 días.
Forma de administración
Este medicamento se administra por inyección, bien por medio de perfusión intravenosa (IV) (un gotero) o de inyección subcutánea (SC) (en el tejido justo debajo de la piel). Si recibe el tratamiento por vía subcutánea, su médico podrá sugerirle que aprenda a inyectarse usted mismo. Su médico o un enfermero le darán instrucciones de cómo hacerlo. No intente auto‑inyectarse sin estas instrucciones. Parte de la información que requiere aparece al final de este prospecto, pero para un tratamiento óptimo de su enfermedad se requiere una estrecha y constante co‑operación con su médico.
Si usa más Ratiograstim del que debe
Si ha utilizado más Ratiograstim del que debe, póngase en contacto con su médico, o farmacéutico tan pronto como sea posible.
Si olvidó usar Ratiograstim
No utilice una dosis doble para compensar las dosis olvidadas.
Si interrumpe el tratamiento con Ratiograstim
Antes de interrumpir el tratamiento con Ratiograstim, consulte con su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos importantes
- Se ha informado de reacciones alérgicas tales como erupción, zonas inflamadas de la piel con picor y reacciones alérgicas graves acompañadas de sensación de debilidad, descenso de la tensión sanguínea, dificultad para respirar o hinchazón de la cara. Si piensa que está teniendo este tipo de reacción, deberá dejar de administrarse Ratiograstim y buscar ayuda médica inmediatamente.
- Se ha informado de incremento del tamaño del bazo y de rupturas del bazo. En algunos casos la ruptura del bazo tuvo un desenlace mortal. Es importante que consulte inmediatamente a su médico, si experimenta dolor en la parte superior izquierda del abdomen o en su hombro izquierdoya que puede estar relacionado con un problema de bazo.
- La tos, la fiebre, la dificultad y dolor al respirar pueden ser signo de un efecto adverso pulmonar grave, como neumonía o síndrome de distrés respiratorio agudo, el cual puede ser mortal. Si tiene fiebre o cualquiera de estos síntomas, busque ayuda médica inmediatamente.
- Busque ayuda médica inmediatamente si experimenta alguno o una combinación de los siguientes efectos adversos:
hinchazón que puede estar asociado con orinar con una menor frecuencia, dificultad para respirar, hinchazón y sensación de plenitud abdominal y una sensación general de cansancio. Estos síntomas generalmente se desarrollan muy rápidamente.
Estos pueden ser síntomas de una enfermedad que ocurre poco frecuentemente (que puede afectar hasta 1 de cada 100 personas) llamada “síndrome de fuga capilar” y que puede causar que la sangre se escape de un pequeño vaso sanguíneo hacia otros lugares de su cuerpo y necesite atención médica urgente.
- Si padece anemia de células falciformes, asegúrese de comunicarlo a su médico antes de empezar a utilizar el tratamiento con Ratiograstim. Se han producido casos de crisis de anemia de células falciformes en pacientes con anemia de células falciformes que estaban usando filgrastim.
- Filgrastim puede producir dolor muscular y óseo como efecto adverso muy frecuente (puede afectar a más de 1 de cada 10 personas). Pregunte a su médico que medicamentos puede tomar para ayudarle con esto.
Adicionalmente, puede experimentar los siguientes efectos adversos:
En pacientes con cáncer
Muy frecuentes(pueden afectar a más de 1 de cada 10 personas):
- incremento de algunas enzimas del hígado o sanguíneas; aumento del acido úrico en sangre;
- náuseas; vómitos;
- dolor en el pecho.
Frecuentes(pueden afectar hasta 1 de cada 10 personas):
- dolor de cabeza;
- tos; dolor de garganta;
- estreñimiento; pérdida de apetito; diarrea; mucositis, que es una inflamación dolorosa y úlceras en el revestimiento de las membranas mucosas del tracto digestivo;
- pérdida de cabello; erupción;
- cansancio; debilidad generalizada.
Poco frecuentes(pueden afectar hasta 1 de cada 100 personas):
- dolor inespecífico.
Raros(pueden afectar hasta 1 de cada 1.000 personas):
- trastornos vasculares, que puede causar dolor, enrojecimiento e hinchazón de las extremidades.
Muy raros(pueden afectar hasta 1 de cada 10.000 personas):
- llagas dolorosas, con relieve y de color púrpura en las extremidades, y a veces en cara y cuello, junto con fiebre (Síndrome de Sweet); inflamación de los vasos sanguíneos, a menudo con erupción cutánea;
- empeoramiento de las condiciones reumáticas;
- dolor o dificultad para orinar.
Frecuencia no conocida(la frecuencia no puede estimarse a partir de los datos disponibles):
- rechazo de la médula ósea trasplantada;
- descenso transitorio de la tensión sanguínea;
- dolor e hinchazón de las articulaciones, similar a la gota.
En donantes de células progenitoras hematopoyéticas normales
Muy frecuentes(pueden afectar a más de 1 de cada 10 personas):
- aumento del número de glóbulos blancos; disminución del número de plaquetas en sangre, lo que aumenta el riesgo de hemorragias o hematoma;
- dolor de cabeza.
Frecuentes(pueden afectar hasta 1 de cada 10 personas):
- incremento de algunas enzimas sanguíneas.
Poco frecuentes(pueden afectar hasta 1 de cada 100 personas):
- incremento de algunas enzimas del hígado; aumento del acido úrico en sangre;
- empeoramiento de las condiciones reumáticas.
Frecuencia no conocida(la frecuencia no puede estimarse a partir de los datos disponibles):
- tos; fiebre y dificultad al respirar o tos con sangre.
En pacientes con neutropenia crónica grave
Muy frecuentes(pueden afectar a más de 1 de cada 10 personas):
- disminución del número de glóbulos rojos que puede hacer que se ponga pálido y sentirse cansado o con falta de aliento;
- disminución de los niveles de glucosa en sangre; incremento de algunas enzimas sanguíneas; aumento del acido úrico en sangre;
- sangrado nasal.
Frecuentes(pueden afectar hasta 1 de cada 10 personas):
- disminución del número de plaquetas en sangre, lo que aumenta el riesgo de hemorragias o hematoma;
- dolor de cabeza;
- diarrea;
- aumento del tamaño del hígado;
- pérdida de cabello; inflamación de los vasos sanguíneos, a menudo con erupción cutánea; dolor en el lugar de inyección; erupción;
- pérdida ósea de calcio; dolor en las articulaciones.
Poco frecuentes(pueden afectar hasta 1 de cada 100 personas):
- sangre en la orina; proteínas en la orina.
Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Ratiograstim
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en la jeringa precargada después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2 °C y 8 °C).
No utilice este medicamento si observa turbidez o partículas en el interior.
Los medicamentos no se deben tirar por los desagües. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Ratiograstim
- El principio activo es filgrastim. Cada ml de solución inyectable o para perfusión contiene 60 millones de unidades internacionales (MUI) (600 microgramos) de filgrastim.
Ratiograstim 30 MUI/0,5 ml: cada jeringa precargada contiene 30 millones de unidades internacionales ?MUI? (300 microgramos) de filgrastim en 0,5 ml de solución.
Ratiograstim 48 MUI/0,8 ml: cada jeringa precargada contiene 48 millones de unidades internacionales ?MUI? (480 microgramos) de filgrastim en 0,8 ml de solución.
- Los demás componentes son: hidróxido de sodio, ácido acético glacial, sorbitol, polisorbato 80, agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Ratiograstim es una solución inyectable o para perfusión en una jeringa precargada con o sin dispositivo de seguridad. Ratiograstim es una solución transparente e incolora. Cada jeringa precargada contiene 0,5 ml o 0,8 ml de solución.
Ratiograstim se suministra en envases de 1, 5 o 10 jeringas precargadas o en envases múltiples que contienen 10 jeringas precargadas (2 envases de 5). Puede que no se comercialicen todos los formatos.
Titular de la autorización de comercialización
ratiopharm GmbH
Graf-Arco-Strasse 3
89079 Ulm
Alemania
Responsable de la fabricación
Teva Biotech GmbH
Dornierstrasse 10
89079 Ulm
Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien Teva Pharma Belgium N.V./S.A./AG Tél/Tel: +32 3 820 73 73 | Lietuva UAB "Sicor Biotech" Tel: +370 5 266 0203 |
???????? ???? ????????????? ???????? ???? Te?: +359 2 489 95 82 | Luxembourg/Luxemburg ratiopharm GmbH Allemagne/Deutschland Tél/Tel: +49 731 402 02 |
Ceská republika Teva Pharmaceuticals CR, s.r.o. Tel: +420 251 007 111 | Magyarország Teva Gyógyszergyár Zrt. Tel.: +36 1 288 64 00 |
Danmark Teva Denmark A/S Tlf: +45 44 98 55 11 | Malta Teva Pharmaceuticals Ireland L‑Irlanda Tel: +353 51 321740 |
Deutschland ratiopharm GmbH Tel: +49 731 402 02 | Nederland Teva Nederland B.V. Tel: +31 800 0228 400 |
Eesti UAB "Sicor Biotech" Eesti filiaal Tel: +372 661 0801 | Norge Teva Norway AS Tlf: +47 66 77 55 90 |
Ελλ?δα Teva Ελλ?ς Α.Ε. Τηλ: +30 210 72 79 099 | Österreich ratiopharm Arzneimittel Vertriebs‑GmbH Tel: +43 1 97 007 |
España Teva Pharma, S.L.U. Tél: +34 91 387 32 80 | Polska Teva Pharmaceuticals Polska Sp. z o.o. Tel.: +48 22 345 93 00 |
France Teva Santé Tél: +33 1 55 91 78 00 | Portugal ratiopharm, Comércio e Indústria de Produtos Farmacêuticos, Lda Tel: +351 21 476 75 50 |
Hrvatska Pliva Hrvatska d.o.o. Tel: +385 1 37 20 000 | România Teva Pharmaceuticals S.R.L Tel: +40 21 230 65 24 |
Ireland Teva Pharmaceuticals Ireland Tel: +353 51 321740 | Slovenija Pliva Ljubljana d.o.o. Tel: +386 1 58 90 390 |
Ísland ratiopharm Oy, Finnland Sími: +358 20 180 5900 | Slovenská republika TEVA Pharmaceuticals Slovakia s.r.o. Tel: +421 2 57 26 79 11 |
Italia Teva Italia S.r.l. Tel: +39 02 89 17 98 1 | Suomi/Finland ratiopharm Oy Puh/Tel: +358 20 180 5900 |
Κ?προς Teva Ελλ?ς Α.Ε., Ελλ?δα Τηλ: +30 210 72 79 099 | Sverige Teva Sweden AB Tel: +46 42 12 11 00 |
Latvija UAB "Sicor Biotech" filiale Latvija Tel: +371 673 23 666 | UnitedKingdom Teva UK Limited Tel: +44 1977 628500 |
Fecha de la última revisión de esteprospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
- Información para auto-inyectarse
Esta sección contiene información de cómo administrarse a uno mismo una inyección de Ratiograstim. Es importante que no trate de administrarse una inyección sin haber recibido el curso necesario por su médico o enfermero. Si no esta seguro de poder inyectarse o si tiene cualquier duda, consulte a su médico o enfermero.
Cómo auto‑inyectarse Ratiograstim
Deberá inyectarse en el tejido justo bajo la piel. Esto se conoce como inyección subcutánea. La inyección deberá administrarse todos los días aproximadamente a la misma hora.
Equipo necesario para la administración
Para la administración de la inyección subcutánea, se necesita lo siguiente:
- una jeringa precargada de Ratiograstim,
- algodón o similar con alcohol.
Qué debo hacer antes de administrarme una inyección subcutánea de Ratiograstim
- Procurar administrar la inyección aproximadamente a la misma hora todos los días.
- Sacar la jeringa precargada de Ratiograstim del frigorífico.
- Comprobar la fecha de caducidad que indica la jeringa precargada (CAD). No usarla si la fecha es superior al último día del mes que aparece.
- Comprobar la apariencia de Ratiograstim. Debe ser un líquido transparente e incoloro. Si hay partículas en el interior, no debe utilizarlo.
- Para una inyección más cómoda, deje reposar la jeringa precargada durante 30 minutos a temperatura ambiente o tome la jeringa precargada con suavidad en sus manos durante unos minutos. No caliente Ratiograstim de otra manera (por ejemplo, no lo caliente en un microondas ni en agua caliente)
- No retire la tapa de la jeringa hasta que este listo para la inyección
- Lávese las manos cuidadosamente.
- Buscar un lugar cómodo y bien iluminado y colocar todo lo necesario al alcance (la jeringa precargada de Ratiograstim y el algodón).
Cómo debo preparar mi inyección de Ratiograstim
Antes de inyectar Ratiograstim hay que:
- Coger la jeringa y quitar la cubierta protectora de la aguja suavemente sin inclinarla. Separar tal como se indica en las imágenes 1 y 2. No toque la aguja ni empuje el embolo.
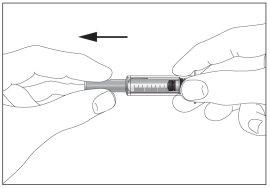 1
1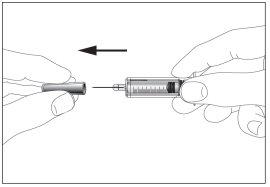 2
2
- Puede aparecer una pequeña burbuja de aire en la jeringa precargada. Si hay burbujas, de golpecitos con sus dedos en la jeringa hasta que las burbujas vayan al final de la jeringa. Con la jeringa apuntando hacia arriba extraiga el aire de la jeringa empujando el embolo.
- La jeringa tiene una escala. Empuje el embolo hasta el número (ml) de la jeringa que corresponde con la dosis de Ratiograstim prescrita por su medico.
- Compruebe de nuevo que la dosis de Ratiograstim es la correcta.
- Ahora puede utilizar la jeringa precargada.
En qué lugar debo poner la inyección
Los sitios más adecuados para la inyección son:
- la parte superior de los muslos; y
- el abdomen, excepto la zona alrededor del ombligo (ver imagen 3).
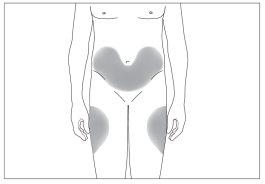 3
3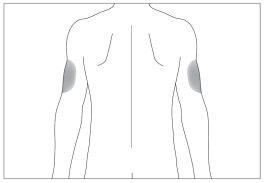 4
4
Si alguien le administra la inyección también podrá utilizar la parte posterior de sus antebrazos (ver imagen 4)
Para evitar el riesgo de dolor en un punto dado es mejor cambiar cada día el lugar de la inyección.
Cómo debo inyectarme
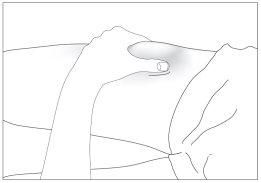
- Desinfecte su piel usando un algodón con alcohol y pellizcar la piel entre el pulgar y el índice, sin apretar (ver imagen 5).
- Insertar completamente la aguja en la piel tal como le indicó su enfermero o médico (ver imagen 6).
- Tirar ligeramente del émbolo para asegurarse de que no se ha pinchado una vena. Si se ve sangre en la jeringa, retirar la aguja e insertarla en otro lugar.
- Inyectar el líquido lenta y regularmente, manteniendo siempre la piel pellizcada.
- Inyecte únicamente la dosis prescrita por su médico.
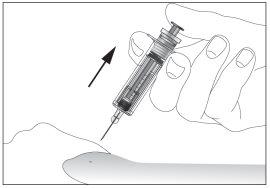
- Retirar la aguja del lugar de la inyección mientras mantiene su dedo en el émbolo (ver imagen 7). Oriente la aguja lejos de usted y de los que le rodean y active el dispositivo de seguridad presionando firmemente el émbolo (ver imagen 8). Usted oirá un “click”, lo que confirma la activación del dispositivo de seguridad. La aguja se cubrirá con una funda protectora para que usted no pueda pincharse.
 5
5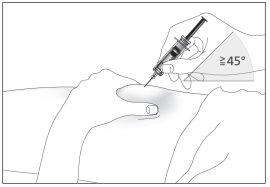 6
6
 7
7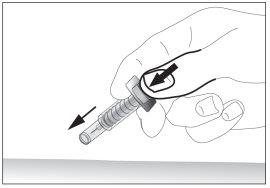 8
8
Recuerde
Si tiene cualquier duda, pida ayuda o consejos a su médico o su enfermero.
Cómo deshacerse de las jeringas usadas
- El dispositivo de seguridad previene las lesiones causadas por pinchazos con la aguja tras el uso, por lo que no se necesitan precauciones especiales de eliminación. Deposite las jeringas con el dispositivo de seguridad según las indicaciones del médico, enfermero o farmacéutico.
- Esta información está destinada únicamente a profesionales del sector sanitario
Ratiograstim no contiene conservantes. En vista de un posible riesgo de contaminación microbiana, las jeringas precargadas de Ratiograstim son para un solo uso.
La exposición accidental a temperaturas de congelación no afecta negativamente a la estabilidad de Ratiograstim.
Ratiograstim no debe diluirse con cloruro de sodio. Este medicamento no debe mezclarse con otros medicamentos excepto con los mencionados a continuación. La dilución de filgrastim puede ser adsorbida por el vidrio y materiales plásticos excepto si se diluye como se menciona a continuación.
Ratiograstim se puede diluir, si es necesario, en una solución para perfusión de glucosa 50 mg/ml (al 5%). No se recomienda en ningún caso diluir a concentraciones finales inferiores a 0,2 MUI (2 μg) por ml. La solución debe inspeccionarse visualmente antes de usarla. Solamente deben utilizarse soluciones transparentes sin partículas. En pacientes tratados con filgrastim diluido a concentraciones inferiores de 1,5 MUI (15 μg) por ml, debe añadirse albúmina sérica humana (ASH) a una concentración final de 2 mg/ml. Ejemplo: si el volumen de inyección final es de 20 ml y la dosis total de filgrastim inferior a 30 MUI (300 μg), deben administrarse 0,2 ml de una solución de albúmina humana 200 mg/ml (al 20%). Cuando se diluye Ratiograstim en una solución para perfusión de glucosa 50 mg/ml (al 5%), es compatible con el vidrio y diversos plásticos como PVC, poliolefina (copolímero de polipropileno y polietileno) y polipropileno.
Tras la dilución: la estabilidad química y física de la solución diluida para perfusión ha sido demostrada durante 24 horas almacenada entre 2 y 8 °C. Desde el punto de vista microbiológico, el producto debe ser usado inmediatamente. Si no se usa inmediatamente, el tiempo y las condiciones de almacenamiento de la solución diluida son responsabilidad del usuario y normalmente no deberían sobrepasar las 24 horas entre 2 y 8 °C, a no ser que la dilución se haya realizado en condiciones de asepsia validadas y controladas.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a RATIOGRASTIM 30 MU/0,5 ml SOLUCION INYECTABLE O PARA PERFUSIONForma farmacéutica: INYECTABLE, 12 MU/0,2 mlPrincipio activo: FilgrastimFabricante: Accord Healthcare S.L.U.Requiere recetaForma farmacéutica: INYECTABLE, 0,3 mg / jeringa precargadaPrincipio activo: FilgrastimFabricante: Accord Healthcare S.L.U.Requiere recetaForma farmacéutica: INYECTABLE, 0,3 mg / jeringa precargadaPrincipio activo: FilgrastimFabricante: Accord Healthcare S.L.U.Requiere receta
Médicos online para RATIOGRASTIM 30 MU/0,5 ml SOLUCION INYECTABLE O PARA PERFUSION
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de RATIOGRASTIM 30 MU/0,5 ml SOLUCION INYECTABLE O PARA PERFUSION, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes






