
CUTAQUIG 165 MG/ML SOLUCION PARA INYECCION SUBCUTANEA

Cómo usar CUTAQUIG 165 MG/ML SOLUCION PARA INYECCION SUBCUTANEA
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
Cutaquig 165mg/mlsolución para inyección subcutánea
Inmunoglobulina normal humana (IgSC)
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico,incluso si se trata de efectos adversos que no aparecen en este prospecto.Ver sección 4.
Contenido del prospecto
- Qué es Cutaquig y para qué se utiliza
- Qué necesita saber antes de empezar a usar Cutaquig
- Cómo usar Cutaquig
- Posibles efectos adversos
- Conservación de Cutaquig
- Contenido del envase e información adicional
1. Qué es Cutaquig y para qué se utiliza
Qué es Cutaquig
Cutaquig pertenece a una clase de medicamentos llamados «inmunoglobulinas normales humanas». Las inmunoglobulinas también se conocen como anticuerpos y son proteínas que se encuentran en la sangre de las personas sanas. Los anticuerpos forman parte del sistema inmunitario (las defensas naturales del organismo) y ayudan a su cuerpo a combatir las infecciones.
Cómo funciona Cutaquig
Cutaquig contiene inmunoglobulinas que se han preparado a partir de sangre de personas sanas. El medicamento funciona exactamente de la misma forma que las inmunoglobulinas que se encuentran de forma natural en su sangre.
Para qué se usa Cutaquig
Cutaquig se utiliza en pacientes que no tienen suficientes anticuerpos para combatir las infecciones y, por tanto, tienden a sufrir infecciones frecuentes. La administración regular de dosis suficientes de Cutaquig puede incrementar los niveles de inmunoglobulinas anormalmente bajos de su sangre hasta unos niveles normales (tratamiento de restitución).
Cutaquig se prescribe a adultos y niños (de edades entre 0 y 18 años) en las siguientes situaciones:
Tratamiento de pacientes que han nacido con una menor capacidad o con una incapacidad para producir anticuerpos (inmunodeficiencia primaria).
Pacientes con deficiencia adquirida de anticuerpos (inmunodeficiencia secundaria) debido a enfermedades y/o tratamientos específicos y que experimentan infecciones graves o recurrentes.
2. Qué necesita saber antes de empezar a usar Cutaquig
No use Cutaquig:
- si es alérgico a la inmunoglobulina normal humana o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
NO inyecte Cutaquig en un vaso sanguíneo.
Advertencias y precauciones:
Consulte a su médico o farmacéutico antes de empezar a usar Cutaquig.
Puede que, sin saberlo, sea alérgico (hipersensible) a las inmunoglobulinas.
Las reacciones alérgicas verdaderas, como la caída repentina de la tensión arterial o el shock anafiláctico (una caída brusca de la tensión arterial con otros síntomas como hinchazón de la garganta, dificultad para respirar y erupción cutánea) son poco frecuentes, pero se pueden producir de manera ocasional, incluso si recibió inmunoglobulinas humanas con anterioridad y las toleró bien. Se pueden producir especialmente si no tiene suficiente cantidad de inmunoglobulina tipo A (IgA) en la sangre (deficiencia de IgA) y tiene anticuerpos contra la IgA.
- Informe a su médico o profesional sanitario antes del tratamiento para saber si tiene una deficiencia de inmunoglobulina tipo A (IgA). Cutaquig contiene cantidades residuales de IgA que podrían causar una reacción alérgica.
En estos casos poco frecuentes, se pueden producir reacciones alérgicas, como una caída repentina de la tensión arterial o un shock (ver también la sección 4).
Los signos y síntomas de estas reacciones alérgicas poco frecuentes incluyen
- Sensación de desvanecimiento, mareo o debilidad
- Erupción cutánea y picazón, hinchazón de la boca o garganta, dificultad para respirar, sibilancias
- Ritmo cardíaco anómalo, dolor en el pecho, coloración azulada de los labios o de los dedos de manos y pies
- Visión borrosa
Si observa estos signos durante la perfusión de Cutaquig, informe a su médico de inmediato.
Él o ella decidirá si disminuye la velocidad de la perfusión o si la detiene por completo.
- Informe a su médico si tiene antecedentes de enfermedad cardíaca o enfermedad de los vasos sanguíneos, o coágulos sanguíneos, sangre espesa o si ha estado inmóvil durante algún tiempo. Estas cosas pueden aumentar su riesgo de tener un coágulo de sangre después de usar Cutaquig. Además, comunique a su médico qué medicamentos está usando, ya que algunos medicamentos, como los que contienen estrógenos (por ejemplo, las píldoras anticonceptivas), pueden aumentar su riesgo de desarrollar un coágulo de sangre. Póngase en contacto con su médico inmediatamente si después de recibir Cutaquig experimenta signos y síntomas como respiración difícil, dolor en el pecho, dolor e hinchazón de una extremidad, debilidad o entumecimiento en un lado del cuerpo.
- Póngase en contacto con su médico si después de recibir Cutaquig experimenta los siguientes signos y síntomas: dolor de cabeza intenso, rigidez en el cuello, somnolencia, fiebre, fotofobia, náuseas y vómitos. Estos podrían ser signos de meningitis aséptica. Su médico decidirá si son necesarios más análisis y si se debe continuar con Cutaquig.
- Cutaquig contiene anticuerpos del grupo sanguíneo que pueden causar la destrucción de los glóbulos rojos y, por lo tanto, anemia (número bajo de glóbulos rojos).
Su profesional sanitario evitará posibles complicaciones asegurándose:
- de que usted no es sensible a la inmunoglobulina normal humana
El medicamento se debe perfundir lentamente al principio. Se debe seguir estrechamente la velocidad de perfusión recomendada que se indica en la sección 3.
- de que se le controla cuidadosamente para detectar cualquier síntoma durante el período de perfusión, especialmente si:
- Recibe inmunoglobulina humana normal por primera vez
- Ha cambiado de un medicamento diferente a Cutaquig
- Ha transcurrido un largo intervalo de tiempo (más de ocho semanas) desde la última perfusión
En estos casos, se recomienda que se le vigile durante la primera perfusión y durante una hora después. Si los puntos anteriores no se aplican en su caso, se recomienda que lo observen durante al menos 20 minutos después de la administración.
Niños y adolescentes
Las advertencias y precauciones enumeradas se aplican tanto a adultos como a niños.
Uso de Cutaquig con otros medicamentos
- Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
- No debe mezclar Cutaquig con ningún otro medicamento.
- Antes de la vacunación, informe al médico encargado de vacunarle sobre su tratamiento con Cutaquig. Cutaquig (como todas las soluciones de inmunoglobulina normal humana) puede interferir con el efecto de algunas vacunas de virus vivos como el sarampión, la rubéola, las paperas o la varicela. Por lo tanto, después de recibir Cutaquig, es posible que deba esperar hasta 3 meses antes de recibir su vacuna atenuada. En el caso de la vacunación contra el sarampión, esta circunstancia puede persistir durante un año.
- Prueba de glucosa en sangre
Algunos tipos de sistemas de análisis de glucosa en sangre (denominados glucómetros) interpretan de forma errónea la maltosa contenida en Cutaquig como glucosa. Esto puede provocar lecturas elevadas de glucosa falsas durante una perfusión o un periodo de unas 15 horas tras finalizar la perfusión y, como consecuencia, la inapropiada administración de insulina, dando lugar a una hipoglucemia (es decir, el descenso del nivel de azúcar en sangre) que podría provocar la muerte. De igual modo, los casos de hipoglucemia auténtica, pueden no ser tratados, si el estado hipoglucémico es enmascarado por unas falsas lecturas elevadas de glucosa.
Como consecuencia, a la hora de administrar Cutaquig u otros productos que contengan maltosa, la medición de la glucosa en sangre deberá realizarse con un sistema de analísis que utilice un método específico para la glucosa. Los sistemas basados en los métodos de la glucosa deshidrogenasa pirroloquinolinequinona (GDH PQQ) o la glucosa-colorante-oxidorreductasa no deben utilizarse.
Debe revisarse detenidamente la información del producto del sistema de análisis de glucosa en sangre, incluyendo la de las tiras reactivas, para determinar si el sistema es apropiado para utilizarlo con productos parenterales que contengan maltosa. En caso de duda, consulte al médico que le está tratando para determinar si el sistema de análisis de glucosa que está utilizando es apropiado para utilizarlo con productos parenterales que contengan maltosa.
Uso de Cutaquig con alimentos, bebidas y alcohol
No se han observado efectos.
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento. Este producto solo debe utilizarse durante el embarazo o la lactancia después de consultarlo con su médico o farmacéutico.
No se han realizado estudios clínicos con Cutaquig en mujeres embarazadas. Sin embargo, los medicamentos que contienen inmunoglobulinas se han utilizado en mujeres embarazadas y en periodo de lactancia durante años, y no se han observado efectos nocivos en el desarrollo del embarazo ni en el bebé.
Si está amamantando y recibe Cutaquig, las inmunoglobulinas del medicamento también se pueden encontrar en la leche materna. Por lo tanto, su bebé puede estar protegido de ciertas infecciones.
La experiencia con las inmunoglobulinas sugiere que no se esperan efectos nocivos sobre la fertilidad.
Conducción y uso de máquinas
La capacidad para conducir y utilizar máquinas puede verse afectada por algunas reacciones adversas asociadas a Cutaquig. Los pacientes que experimenten reacciones adversas durante el tratamiento deben esperar a que se resuelvan antes de conducir o utilizar máquinas.
Cutaquig contiene Sodio
Este medicamento contiene 33,1 mg de sodio (componente principal de la sal de mesa/para
cocinar) por vial de 48 ml y 13,8 mg por vial de 20 ml. Esto equivale al 1,7 % y 0,7 % respectivamente de la ingesta diaria máxima recomendada de sodio para un adulto.
Información sobre la composición de Cutaquig
Cutaquig está hecho de plasma sanguíneo humano (esta es la parte líquida de la sangre). Cuando los medicamentos están hechos de sangre o plasma humanos, se aplican ciertas medidas para evitar que las infecciones se transmitan a los pacientes. Estas incluyen:
- selección cuidadosa de los donantes de sangre y plasma para garantizar que se excluya a los que corren riesgo de ser portadores de infecciones,
- análisis de cada donación y de los grupos de plasma para detectar signos de virus/infecciones,
- la inclusión de pasos en el procesamiento de la sangre o del plasma que pueden desactivar o eliminar virus.
A pesar de estas medidas, cuando se administran medicamentos preparados a partir de sangre o plasma humano, no se puede excluir totalmente la posibilidad de transmitir una infección. Esto también se aplica a cualquier virus desconocido o emergente u otros tipos de infecciones.
Las medidas tomadas se consideran efectivas para virus con envoltura, como el virus de inmunodeficiencia humana (VIH, el virus que causa el SIDA), el virus de la hepatitis B y el virus de la hepatitis C.
Las medidas tomadas pueden tener un valor limitado contra virus sin envoltura, como el virus de la hepatitis A y el parvovirus B19.
Las inmunoglobulinas no se han asociado con infecciones por hepatitis A o parvovirus B19, tal vez porque los anticuerpos contra estas infecciones, que se encuentran contenidos en el producto, son protectores.
Se recomienda encarecidamente que cada vez que reciba una dosis de Cutaquig, se registren el nombre y el número de lote del medicamento para mantener un registro de los lotes utilizados (consulte también el Anexo I: Directrices sobre la administración).
3. Cómo usar Cutaquig
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Cutaquig se debe administrar por debajo de la piel (administración subcutánea o s.c.).
El tratamiento lo iniciará su médico o enfermero con experiencia en el tratamiento de pacientes con un sistema inmunitario débil.
Una vez que el médico/enfermero haya encontrado la dosis y la velocidad de perfusión adecuadas para usted y una vez que haya recibido las primeras perfusiones bajo supervisión, se le puede permitir que usted se administre el tratamiento en su domicilio o que su cuidador (capacitado) se lo administre. Su médico o enfermero con experiencia en guiar a los pacientes en su tratamiento domiciliario, se asegurará de que usted o su cuidador reciban formación e información precisa sobre
- la técnica de perfusión sin gérmenes (aséptica)
- el uso del dispositivo de perfusión (si es necesario)
- el mantenimiento de un diario de tratamiento
- qué medidas tomar en caso de efectos adversos graves (consulte también la sección 4).
Tan pronto como pueda tratarse usted mismo, y si no han aparecido efectos adversos durante el tratamiento, es posible que su médico le permita continuar el tratamiento en casa.
Posología
Su médico determinará su dosis individual y la velocidad de perfusión, y adaptará la dosis especialmente para usted, teniendo en cuenta su peso, cualquier tratamiento anterior que haya recibido y su respuesta al tratamiento. Siga siempre las instrucciones de su médico.
Tratamiento de restitución en síndromes de inmunodeficiencia primaria:
Su médico determinará si necesita una dosis de carga (para adultos y niños) de al menos 1,2 a 3,0 ml/kg de peso corporal dividida en varios días. Tras ello, recibirá Cutaquig de forma regular, desde diariamente a hasta cada dos semanas. La dosis acumulada por mes será de aproximadamente 2,4 a 4,8 ml/kg de peso corporal. Su profesional sanitario puede ajustar su dosis dependiendo de su respuesta al tratamiento.
Tratamiento de restitución en inmunodeficiencias secundarias:
La dosis recomendada de Cutaquig es una dosis mensual acumulada de 1,2 – 2,4 ml/kg administrada a intervalos repetidos (aproximadamente una vez por semana). Puede que sea necesario inyectar cada dosis individual en diferentes lugares anatómicos. Su profesional sanitario podrá ajustar la dosis en función de su respuesta al tratamiento.
No cambie la dosis o el intervalo de administración sin consultar a su médico. Si cree que debería recibir Cutaquig con mayor o menor frecuencia, hable con su médico. Si cree que ha olvidado una dosis, hable con su médico lo antes posible.
Forma y vía de administración
Selección del/de los sitio(s) de las perfusiones:
Las zonas recomendadas para la perfusión subcutánea de Cutaquig son el abdomen, los muslos, la parte superior de los brazos o la zona superior de la pierna/cadera. Se pueden usar múltiples sitios para las perfusiones subcutáneas al mismo tiempo. El número de sitios de perfusión es ilimitado, pero estos deben tener una separación de al menos 5 cm. Rote los sitios con cada administración según lo recomiende su médico o enfermero.
La cantidad perfundida por sitio es variable, pero se recomienda dividir grandes volúmenes de perfusión (>30 ml) y realizar la perfusión en varios sitios. En lactantes y niños, los sitios de perfusión pueden cambiarse cada 5 a 15 ml.
Velocidad de perfusión:
Su médico determinará la velocidad de perfusión adecuada para usted teniendo en cuenta su dosis individual, la frecuencia de dosificación y la tolerabilidad del producto.
La velocidad de perfusión inicial recomendada es de 15 ml/h/sitio si no ha recibido antes tratamiento con IGSC. Si ya está en tratamiento con IGSC y va a cambiar a Cutaquig, se recomienda utilizar las velocidades de administración empleadas anteriormente para las perfusiones iniciales. Para las perfusiones posteriores, si se tolera bien, puede aumentar gradualmente la velocidad de perfusión en aproximadamente 10 ml/h/sitio cada 2-4 semanas en adultos (≥ 40 kg) y en hasta 10 ml/h/sitio cada 4 semanas en pacientes pediátricos (<40 kg).
A partir de entonces, si tolera las perfusiones iniciales a la dosis completa por sitio y a la velocidad máxima, se puede considerar un aumento de la velocidad de perfusión para las perfusiones sucesivas hasta alcanzar un flujo máximo de 67,5 ml/h/sitio para adultos (≥ 40 kg) y 25 ml/h/sitio para pacientes pediátricos (<40 kg).
A continuación se proporcionan las instrucciones detalladas para el uso.
Cutaquig está destinado solo para la administración subcutánea (debajo de la piel). No inyectar en un vaso sanguíneo.
Use Cutaquig únicamente en casa cuando su profesional sanitario le haya enseñado y capacitado adecuadamente.
Siga paso a paso las instrucciones de administración que se encuentran al final del prospecto (Anexo I) y utilice una técnica aséptica/estéril al administrar Cutaquig.
Al preparar la perfusión use guantes, si le han indicado que lo haga.
Uso en niños y adolescentes
Para niños y adolescentes (de 0 a 18 años) se aplican las mismas indicaciones, dosis y frecuencia de perfusión que en adultos.
Si usa más Cutaquig del que debe
Si piensa que se ha perfundido demasiado Cutaquig, póngase en contacto con su profesional sanitario lo antes posible.
Si olvidó usar Cutaquig
Si olvidó una dosis, informe de ello a su médico o profesional sanitario tan pronto como sea posible. No se perfunda una dosis doble de Cutaquig para compensar la dosis olvidada.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, como escalofríos, dolor de cabeza, mareos, fiebre, vómitos, reacciones alérgicas, náuseas, dolor en las articulaciones, tensión arterial baja y dolor moderado en la parte baja de la espalda, aunque no todas las personas los sufran.
Ciertos efectos adversos, como dolor de cabeza, escalofríos o dolores corporales, pueden reducirse al disminuir la velocidad de perfusión.
No se observaron reacciones adversas graves relacionadas con los medicamentos en los sujetos tratados con Cutaquig durante los estudios clínicos que evaluaron su seguridad.
Puede que usted sea alérgico (hipersensible) a las inmunoglobulinas y se pueden producir reacciones alérgicas, como una caída repentina de la tensión arterial y, en casos aislados, shock. Los médicos son conscientes de estos posibles efectos adversos y lo vigilarán durante y después de las perfusiones iniciales.
Informe a su médico de inmediato si observa alguno de los siguientes síntomas:
- Sensación de desvanecimiento, mareo o debilidad
- Erupción cutánea y picazón, hinchazón de la boca o garganta, dificultad para respirar, sibilancias
- Ritmo cardíaco anómalo, dolor en el pecho, coloración azulada de los labios o de los dedos de manos y pies
- Visión borrosa
Cuando use Cutaquig en su domicilio, puede realizar la perfusión en presencia de su cuidador, quien lo ayudará a observar los signos de una reacción alérgica. En caso de cualquier síntoma de una reacción alérgica, detenga la perfusión y busque ayuda si es necesario.
Consulte también la sección 2 de este prospecto acerca del riesgo de reacciones alérgicas.
Los siguientes efectos adversos son muy frecuentes (pueden afectar a más de 1 de cada 10 perfusiones):
- Reacciones en el lugar de la inyección, como enrojecimiento, hinchazón, picazón y malestar.
Los siguientes efectos adversos son poco frecuentes (pueden afectar entre a más de 1 de cada 1.000 y a menos de 1 de cada 100 perfusiones):
- Dolor de cabeza
- Ganas de vomitar
- Cansancio
Los siguientes efectos adversos son raras (pueden afectar a más de 1 en 10.000 perfusiones):
- Mareos
- Dolor abdominal
- Distensión abdominal
- Vómitos
- Arcadas
- Dolor muscular
- Dolor en las articulaciones
- Fiebre
- Escalofríos
- Malestar en el pecho
- Enfermedad similar a la gripe
- Dolor
- Sensación de malestar general
- Análisis de sangre positivos para anticuerpos
- Resultados irregulares en los análisis de sangre que muestran la destrucción de los glóbulos rojos
- Aumento de la hemoglobina
- Aumento de la creatinina en sangre
- Erupción
- Reacciones en la piel
- Niveles elevados de ciertas enzimas del hígado llamadas transaminasas
Otros efectos adversos que no se produjeron en los estudios clínicos, pero que también se han notificado, son:
- Hipersensibilidad (por ejemplo, eritema, urticaria)
- Aumento de la tensión arterial
- Problemas debidos a la formación de coágulos sanguíneos en los vasos sanguíneos (por ejemplo, trombosis venosa profunda, ictus)
- Coágulos en los vasos sanguíneos (consulte también la sección 2 “Advertencias y precauciones”)
- Picazón
- Dolor de espalda
Efectos adversos observados con medicamentos similares
Se han observado los siguientes efectos adversos adicionales con la perfusión de inmunoglobulina normal humana subcutánea.Es posible que alguien que use este medicamento pueda experimentarlos.
- palidez
- escalofríos
- diarrea
- dolor en el lugar de inyección
- enrojecimiento rápido de cuello/cara
- sensación de calor
- sensación de frío
- debilidad
- opresión en la garganta
- dificultad para respirar
- síntomas similares al asma
- tos
- hinchazón de la cara
- un síndrome llamado meningitis aséptica (consulte también la sección 2 “Advertencias y precauciones”)
Informe a su médico de inmediato si presenta alguno de los siguientes síntomas. Podrían ser signos de un problema grave.
- Dolor de cabeza intenso con náuseas, vómitos, rigidez del cuello, fiebre y sensibilidad a la luz. Estos podrían ser signos de una inflamación no infecciosa, temporal y reversible de las membranas que rodean el cerebro y la médula espinal (meningitis).
- Dolor, hinchazón, calor, enrojecimiento, o presencia de un bulto en las piernas o los brazos, respiración difícil inexplicable, dolor en el pecho o malestar que empeora con la respiración profunda, pulso rápido inexplicable, entumecimiento o debilidad en un lado del cuerpo, confusión repentina o problemas para hablar. Estos podrían ser signos de un coágulo de sangre.
Se pueden producir efectos adversos como estos incluso cuando ha recibido inmunoglobulina humana con anterioridad y la ha tolerado bien.
Consulte también la sección 2 para obtener información adicional sobre las circunstancias que aumentan el riesgo de efectos adversos.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es
Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Cutaquig
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que figura en la etiqueta y el envase después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (2 °C – 8 ?C). No congelar. Conservar el vial en la embalaje exterior para protegerlo de la luz.
Dentro de su periodo de validez, el producto se puede conservar a temperatura ambiente (no conservar a más de 25 °C) hasta un máximo de 9 meses, sin refrigerarse nuevamente durante este período, y debe desecharse si no se usa pasado este periodo.
Después de la primera apertura, el producto debe utilizarse inmediatamente.
No use Cutaquig si la solución está turbia o contiene partículas.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Cutaquig
El principio activo es inmunoglobulina normal humana 165 mg/ml (al menos el 95 % es inmunoglobulina G)
- IgG1 ……….. 71 %
- IgG2 ……….. 25 %
- IgG3 ……….. 3 %
- IgG4………… 2 %
Los demás excipientes son maltosa, polisorbato 80 y agua para preparaciones inyectables.
El contenido máximo de IgA es de 300 microgramos/ml
Cutaquig contiene ≤30 mmol/l de sodio
Aspecto del producto y contenido del envase
Cutaquig es una solución inyectable.
La solución es transparente e incolora.
Durante su conservación, el líquido se puede volver ligeramente opalescente y amarillo pálido.
Cutaquig está disponible como:
6, 10, 12, 20, 24 o 48 ml de solución en un vial (vidrio tipo I) con un tapón de caucho de bromobutilo: tamaño del envase de 1, 10 ó 20 viales
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización:
Octapharma, S.A.
Av. Castilla, 2 (P.E. San Fernando)
Ed. Dublín - 2ª Planta
28830 San Fernando de Henares
Madrid
España
Fabricantes:
Octapharma Pharmazeutika Produktionsges.m.b.H.
Oberlaaer Strasse 235
1100 Viena
Austria
Octapharma ABLars Forssells gata 23112 75 EstocolmoSuecia
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo con los siguientes nombres:
Alemania, Austria, Bélgica, Bulgaria, Croacia, Dinamarca, Eslovaquia, Eslovenia, España, Estonia, Finlandia, Francia, Hungría, Irlanda, Islandia, Italia, Letonia, Lituania, Luxemburgo, Malta, Noruega, Países Bajos, Polonia, Portugal, Reino Unido (Irlanda del Norte), República Checa, Rumanía, Suecia: | Cutaquig® |
Fecha de la última revisión de este prospecto: 11/2023.
Anexo I: Directrices sobre la administración
- Preparar el número necesario de viales de Cutaquig
- Si se almacena en nevera, coloque los viales a temperatura ambiente al menos 90 minutos antes de la perfusión.
- No caliente los viales ni los ponga en el microondas.
- No agite los viales para evitar la formación de espuma.
- Prepararse para la perfusión
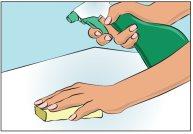 Elija y prepare un área de trabajo limpia con toallitas antisépticas o solución desinfectante (Figura 1).
Elija y prepare un área de trabajo limpia con toallitas antisépticas o solución desinfectante (Figura 1).

- Reúna su equipo de perfusión:
- Bomba de perfusión (opcional) y jeringa(s) compatible(s)
- Aguja (para extraer el producto del vial)
- Set de perfusión
- Tubo de perfusión y conector en Y (en caso necesario)
- Alcohol y toallitas con alcohol/toallitas antisépticas
- Gasa o apósito transparente y cinta adhesiva
- Recipiente para objetos cortopunzantes
- Diario y pluma de tratamiento
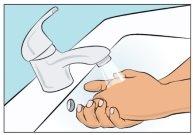
- Lávese bien las manos y deje que se sequen (Figura 2). Use gel desinfectante como se le ha mostrado durante la formación.
- Si es necesario, programe la bomba de acuerdo con el manual del usuario y como su profesional sanitario le ha mostrado durante la formación.
- Verificar y abrir los viales
- Inspeccione cuidadosamente cada vial para:
- Corregir la dosis etiquetada de acuerdo con su receta.
- Comprobar el aspecto de la solución (debe ser transparente e incolora a amarillo pálido o marrón claro).
- Asegurarse de que la tapa protectora no se haya roto ni falte.
- Verificar la fecha de caducidad y el número de lote.
- No use la solución si está turbia o contiene partículas.
- Retire la cápsula de cierre protectora.
- Desinfecte el tapón de goma con un paño antiséptico y deje que se seque (Figura 3).


- Preparar y llenar la jeringa
- Abra la jeringa y la aguja estériles.
- Conecte la aguja a la jeringa enroscándola.
- Retraiga el émbolo para llenar la jeringa con aire que debería ser aproximadamente igual a la cantidad de solución necesaria del vial.
- Inserte la aguja en el vial y ponga el vial boca abajo. Inyecte aire: asegúrese de que la punta de la aguja no esté dentro de la solución para evitar la formación de espuma.
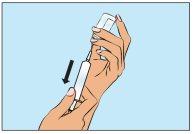 A continuación, asegurándose de que la aguja permanezca siempre en la solución, extraiga lentamente el Cutaquig (Figura 4).
A continuación, asegurándose de que la aguja permanezca siempre en la solución, extraiga lentamente el Cutaquig (Figura 4).

- Retire la aguja del vial.
- Es posible que este procedimiento deba repetirse si necesita varios viales para la dosis calculada.
- Cuando haya terminado, retire la aguja y colóquela en el recipiente para objetos cortopunzantes.
- Continúe inmediatamente con el siguiente paso, ya que la solución de IgG debe usarse de inmediato.
- Preparar la bomba de perfusión y el tubo (opcional)
- Siga las instrucciones del fabricante para preparar la bomba de perfusión.
- Para cebar el tubo de administración, coloque la jeringa llena en el tubo de perfusión y presione suavemente el émbolo para llenar el tubo con Cutaquig y para eliminar todo el aire. (Figura 5).
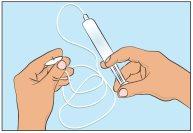

- Decidir los sitios de perfusión e insertar la(s) aguja(s) de perfusión
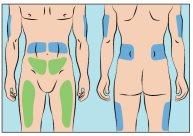 Cutaquig se puede perfundir en las siguientes zonas: abdomen, muslo, parte superior del brazo y/o parte superior de la pierna/zona de la cadera (Figura 6).
Cutaquig se puede perfundir en las siguientes zonas: abdomen, muslo, parte superior del brazo y/o parte superior de la pierna/zona de la cadera (Figura 6).

- Los sitios de perfusión deben tener una separación de al menos 5 cm.
- Use diferentes sitios de perfusión a los que usó para la administración anterior.
- Evite insertar la aguja en cicatrices, tatuajes, estrías o zonas donde la piel esté lesionada/inflamada/roja.
- Limpie la piel del (de los) sitio(s) de perfusión seleccionado(s) con un paño antiséptico y deje que la piel se seque.
- Pellizque la piel entre el pulgar y el dedo índice alrededor del lugar de la inyección (Figura 7), retire con cuidado la cubierta de la aguja e inserte la aguja en la piel (Figura 8). El ángulo de la aguja dependerá del tipo de equipo de perfusión que se utilice.
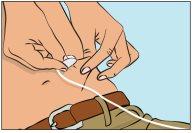
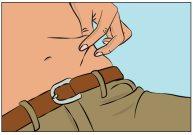


- Verificar la perfusión
- La solución no se debe perfundir en un vaso sanguíneo.
- Fije la aguja en su lugar colocando una gasa estéril y una cinta adhesiva o un apósito transparente (Figura 9).
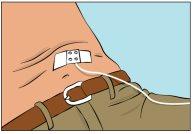

- Iniciar la perfusión
- Inicie la perfusión. Si se utiliza una bomba de perfusión para la administración, siga las instrucciones del fabricante.
- Registrar la perfusión
- En cada vial de Cutaquig encontrará una etiqueta despegable con los detalles del número de lote. Pegue esta etiqueta en el diario de tratamiento de su paciente o en el libro de registro de perfusión. Registre los detalles de la dosis, la fecha, la hora, la ubicación del lugar de perfusión y cualquier infección, efectos secundarios u otros comentarios relacionados con esta perfusión.
- Tras finalizar la perfusión
- Retire suavemente la(s) aguja(s) y colóquela(s) inmediatamente en el recipiente para objetos cortopunzantes.
- Si es necesario, presione con un trozo pequeño de gasa en el sitio donde ha penetrado la aguja y aplique un apósito.
- Deseche todos los suministros desechables usados, así como cualquier producto no utilizado y el(los) frasco(s) vacío(s) según lo recomendado por su profesional sanitario y de acuerdo con los requisitos locales.
Ordene y almacene de forma segura todo el equipo reutilizable (por ejemplo, la bomba) hasta la siguiente perfusión.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a CUTAQUIG 165 MG/ML SOLUCION PARA INYECCION SUBCUTANEAForma farmacéutica: INYECTABLE, 200 mg/mlPrincipio activo: immunoglobulins, normal human, for extravascular adm.Fabricante: Baxalta Innovations GmbhRequiere recetaForma farmacéutica: INYECTABLE, 200 mg/mlPrincipio activo: immunoglobulins, normal human, for extravascular adm.Fabricante: Csl Behring GmbhRequiere recetaForma farmacéutica: INYECTABLE, 200 mg proteina plasmatica humana/ mlPrincipio activo: immunoglobulins, normal human, for extravascular adm.Fabricante: Csl Behring GmbhRequiere receta
Médicos online para CUTAQUIG 165 MG/ML SOLUCION PARA INYECCION SUBCUTANEA
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de CUTAQUIG 165 MG/ML SOLUCION PARA INYECCION SUBCUTANEA, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes















