

Xeomin

Consulta con un médico sobre la receta médica de Xeomin

Cómo usar Xeomin
Hoja de instrucciones del paquete: Información para el usuario
XEOMIN, 50 unidades, polvo para solución inyectable
XEOMIN, 100 unidades, polvo para solución inyectable
XEOMIN, 200 unidades, polvo para solución inyectable
La toxina botulínica del tipo A (150 kD) de Clostridium botulinum, libre de proteínas de complejidad
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de recibir el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico o farmacéutico.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es XEOMIN y para qué se utiliza
- 2. Información importante antes de utilizar XEOMIN
- 3. Cómo utilizar XEOMIN
- 4. Posibles efectos adversos
- 5. Cómo conservar XEOMIN
- 6. Contenido del paquete y otra información
1. Qué es XEOMIN y para qué se utiliza
XEOMIN es un medicamento que contiene la toxina botulínica del tipo A como principio activo, que, dependiendo del lugar de inyección, relaja los músculos o reduce la producción de saliva.
XEOMIN se utiliza para tratar los siguientes trastornos en adultos:
- blefarospasmo (contracción del párpado) y hemifacial (contracción de una mitad de la cara),
- torcicollis (contracción del cuello),
- aumento de la tensión muscular / rigidez muscular no controlada de los brazos, manos y / o dedos (espasticidad del miembro superior),
- salivación excesiva crónica (sialorrea) debido a trastornos neurológicos.
XEOMIN se utiliza para tratar el siguiente trastorno en niños y adolescentes de 2 a 17 años, con un peso corporal ≥ 12 kg:
- salivación excesiva crónica (sialorrea) debido a trastornos neurológicos y / o del desarrollo neurológico.
2. Información importante antes de utilizar XEOMIN
Cuándo no utilizar XEOMIN
- si el paciente es alérgico a la toxina botulínica del tipo A o a cualquiera de los demás componentes de este medicamento (enumerados en el punto 6),
- si el paciente tiene una enfermedad generalizada que afecta la función muscular (por ejemplo, miastenia gravis, síndrome de Lambert-Eaton),
- si el paciente tiene una infección o inflamación en el lugar de la inyección planificada.
Advertencias y precauciones
Los efectos adversos pueden ser el resultado de la inyección de la toxina botulínica del tipo A en un lugar incorrecto, lo que puede provocar una parálisis temporal de los grupos musculares cercanos. Muy raramente, se han informado efectos adversos que ocurren en relación con la propagación de la toxina a lugares alejados del lugar de inyección, lo que provoca síntomas compatibles con el efecto de la toxina botulínica del tipo A (por ejemplo, debilidad muscular excesiva, dificultad para tragar y / o atragantamiento accidental con alimentos o bebidas). Los pacientes que reciben las dosis recomendadas pueden experimentar debilidad muscular excesiva.
Si la dosis es demasiado grande o el medicamento se administra con demasiada frecuencia, el riesgo de producción de anticuerpos puede aumentar. La producción de anticuerpos puede provocar el fracaso del tratamiento con la toxina botulínica del tipo A, independientemente de la razón de la administración del medicamento.
Antes de comenzar a utilizar XEOMIN, debe discutir lo siguiente con su médico o farmacéutico:
- si el paciente tiene un trastorno de coagulación,
- si el paciente está tomando sustancias que evitan la formación de coágulos (por ejemplo, cumarina, heparina, ácido acetilsalicílico, clopidogrel),
- si el paciente tiene una debilidad o disminución significativa de la masa muscular en el músculo al que se administrará el medicamento,
- si el paciente tiene esclerosis lateral amiotrófica (ELA), que puede provocar una atrofia muscular generalizada,
- si el paciente tiene una enfermedad que altera la interacción entre los nervios y los músculos esqueléticos (trastorno de la función neuromuscular),
- si el paciente tiene dificultad para tragar,
- si el paciente tiene convulsiones,
- si el paciente ha tenido problemas previos relacionados con la inyección de la toxina botulínica del tipo A,
- si el paciente va a someterse a una cirugía programada.
Debe comunicarse con su médico o buscar ayuda médica si el paciente observa los siguientes síntomas:
- dificultad para respirar, tragar o hablar,
- urticaria, edema, incluyendo edema facial o de garganta, respiración sibilante, sensación de debilidad y disminución de la respiración (posibles síntomas graves de reacción alérgica).
Administración repetida de XEOMIN
En caso de administración repetida de XEOMIN, la potencia del medicamento puede aumentar o disminuir. Las posibles causas incluyen:
- diferentes procedimientos de preparación de la solución para inyección por parte del médico,
- diferentes intervalos de tiempo entre las sesiones de tratamiento,
- inyección en un músculo diferente,
- cambio marginal en la eficacia del principio activo de XEOMIN,
- falta de respuesta al tratamiento administrado. Blefarospasmoy hemifacialDebe consultar a su médico antes de utilizar XEOMIN si:
- el paciente ha tenido una operación ocular. El médico tomará medidas de precaución adicionales,
- el paciente está en riesgo de desarrollar un trastorno llamado glaucoma de ángulo estrecho. Esta enfermedad puede provocar un aumento de la presión intraocular, lo que puede dañar el nervio óptico. El médico debe saber si el paciente está en este grupo de riesgo.
Durante el tratamiento, pueden ocurrir pequeñas hemorragias en los tejidos blandos del párpado. El médico puede reducir el riesgo de que ocurran mediante un compresión suave en el lugar de la inyección inmediatamente después de realizarla.
Después de la inyección de XEOMIN en el músculo ocular, la frecuencia de parpadeo puede disminuir, lo que puede provocar una exposición prolongada de la parte transparente delantera del ojo (córnea). Esta exposición puede provocar daños en su superficie y inflamación (úlcera corneal).
Torcicollis
Después de la inyección, el paciente puede experimentar dificultad para tragar, que puede variar desde leve hasta grave. Esto puede provocar problemas para respirar y un mayor riesgo de atragantamiento con sustancias extrañas o líquidos. Las sustancias extrañas en los pulmones pueden provocar infecciones o inflamación (neumonía). El médico puede administrar un tratamiento especial si es necesario (por ejemplo, alimentación artificial). La dificultad para tragar puede durar hasta dos o tres semanas después de la inyección, y en un caso se informó que duró cinco meses.
Si el paciente no ha sido activo durante un período prolongado, su actividad debe comenzar gradualmente después de la inyección de XEOMIN.
Aumento de la tensión muscular / rigidez muscular no controlada
XEOMIN puede utilizarse para tratar el aumento de la tensión muscular / rigidez muscular no controlada que ocurre en diferentes partes del miembro superior, como la mano o el dedo.
XEOMIN es eficaz en combinación con los métodos de tratamiento estándar habituales.
XEOMIN debe utilizarse con estos otros métodos.
Es poco probable que el medicamento mejore el rango de movimiento en las articulaciones si los músculos circundantes han perdido su capacidad para estirarse.
Si el paciente no ha sido activo durante un período prolongado, su actividad debe comenzar gradualmente después de la inyección de XEOMIN.
Salivación excesiva crónica
Algunos medicamentos (por ejemplo, clozapina, aripiprazol, piridostigmina) pueden provocar una salivación excesiva. Debe considerarse en primer lugar la posibilidad de reemplazar, reducir o incluso interrumpir el tratamiento con el medicamento que provoca la salivación excesiva antes de utilizar XEOMIN para tratar la salivación excesiva.
No se ha estudiado la eficacia y seguridad de XEOMIN en pacientes con salivación excesiva provocada por medicamentos.
En caso de sequedad en la boca asociada con el uso de XEOMIN, el médico puede considerar reducir la dosis.
Como resultado de la disminución de la cantidad de saliva producida después del uso de XEOMIN, pueden ocurrir problemas de salud en la boca, como caries dentales o empeoramiento de problemas dentales existentes.
Antes de comenzar a utilizar XEOMIN para tratar la salivación excesiva crónica, debe consultar a un dentista. El dentista puede decidir utilizar medidas para prevenir la caries dental si es necesario.
Niños y adolescentes
No debe utilizarse este medicamento en niños menores de 2 años, en niños con un peso corporal inferior a 12 kg o en niños y adolescentes para tratar trastornos distintos de la salivación excesiva crónica, ya que no se ha estudiado el uso de XEOMIN en estos grupos de pacientes. Por lo tanto, no se recomienda su uso en estos pacientes.
XEOMIN y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar.
El efecto de XEOMIN puede aumentar:
- con medicamentos utilizados para tratar ciertas infecciones (espectinomicina o antibióticos aminoglucósidos [por ejemplo, neomicina, canamicina, tobramicina]),
- con otros medicamentos que relajan los músculos (por ejemplo, medicamentos relajantes musculares del grupo de los tubocuráreos). Este tipo de medicamentos se utiliza, por ejemplo, en la anestesia general. Antes de la cirugía, debe informar al anestesista de que ha tomado XEOMIN.
- en el caso de la salivación excesiva crónica: con otros medicamentos que reducen la producción de saliva (por ejemplo, medicamentos anticolinérgicos, como la atropina, la glicopirronia o la escopolamina) o como resultado de la radioterapia en la cabeza y el cuello, incluyendo las glándulas salivales. Debe informar a su médico si está recibiendo o va a recibir radioterapia.
En estos casos, el uso de XEOMIN requiere precaución especial.
El efecto de XEOMIN puede disminuir:
- con algunos medicamentos contra la malaria y la artritis (conocidos como aminocinolinas).
Embarazo, lactancia y fertilidad
Si la paciente está embarazada o en período de lactancia, cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de utilizar este medicamento.
No debe utilizarse XEOMIN durante el embarazo, a menos que el médico decida que es absolutamente necesario y que el beneficio esperado del tratamiento supera el posible riesgo para el feto.
No se recomienda el uso de XEOMIN en mujeres en período de lactancia.
Conducción de vehículos y uso de máquinas
No debe conducir vehículos ni realizar otras actividades potencialmente peligrosas en caso de ptosis (caída del párpado), debilidad (astenia), debilidad muscular, mareo o trastornos visuales. En caso de duda, debe consultar a su médico.
3. Cómo utilizar XEOMIN
XEOMIN solo puede ser administrado por médicos con conocimientos especializados en el uso de la toxina botulínica del tipo A.
La dosis óptima, la frecuencia de administración y el número de lugares de inyección serán determinados por el médico para cada paciente de manera individual.
Debe evaluarse el efecto del tratamiento inicial con XEOMIN, lo que puede llevar a una corrección de la dosis hasta lograr el efecto deseado del medicamento. Los intervalos entre las sesiones de tratamiento serán determinados por el médico según las necesidades reales del paciente.
Si el paciente siente que el efecto de XEOMIN es demasiado fuerte o demasiado débil, debe comunicarse con su médico. En caso de que no se observe ningún efecto, debe considerarse otro tratamiento.
Blefarospasmoy hemifacial
La dosis inicial recomendada es de hasta 25 unidades por ojo, y la dosis total recomendada para las sesiones de tratamiento subsiguientes es de hasta 50 unidades por ojo. Por lo general, el inicio del efecto del medicamento se observa dentro de los cuatro días después de la inyección. El efecto del medicamento dura aproximadamente 3-5 meses después de cada administración, pero puede durar significativamente más o menos. El intervalo de tiempo entre las sesiones de tratamiento no debe ser inferior a 12 semanas.
Por lo general, no se obtienen beneficios adicionales con el uso del medicamento con más frecuencia que cada tres meses.
Si el paciente tiene hemifacial, el médico seguirá las recomendaciones para el tratamiento del blefarospasmo limitado a un lado de la cara. El tratamiento del hemifacial será para la parte superior de la cara, ya que la inyección de XEOMIN en la parte inferior de la cara puede provocar un mayor riesgo de efectos adversos, como un mayor riesgo de debilidad muscular local.
Torcicollis
La dosis recomendada por lugar de inyección es de hasta 50 unidades, y la dosis máxima recomendada para la primera sesión de tratamiento es de hasta 200 unidades. El médico puede administrar dosis de hasta 300 unidades en sesiones de tratamiento subsiguientes, dependiendo de la respuesta al tratamiento. Por lo general, el inicio del efecto del medicamento se observa dentro de los siete días después de la inyección. El efecto del medicamento dura aproximadamente 3-4 meses después de cada administración, pero puede durar significativamente más o menos. El tratamiento puede repetirse no antes de 10 semanas.
Aumento de la tensión muscular / rigidez muscular no controlada de los brazos, manos o dedos (espasticidad del miembro superior)
La dosis recomendada es de hasta 500 unidades por sesión de tratamiento. No debe administrarse más de 250 unidades en los músculos del brazo. Los pacientes informaron que sintieron el inicio del efecto del medicamento cuatro días después de la administración. La reducción de la tensión muscular se sintió dentro de las cuatro semanas. En general, el efecto del tratamiento duró 12 semanas, pero puede durar significativamente más o menos. El intervalo de tiempo entre las sesiones de tratamiento debe ser de al menos 12 semanas.
Salivación excesiva crónica (sialorrea, adultos)
La dosis recomendada es de hasta 100 unidades por sesión de tratamiento. No debe superarse la dosis recomendada. El intervalo de tiempo entre las sesiones de tratamiento debe ser de al menos 16 semanas.
Salivación excesiva crónica (sialorrea, niños y adolescentes)
La dosis recomendada por sesión de tratamiento depende del peso corporal. No debe superarse la dosis máxima de 75 unidades. El intervalo de tiempo entre las sesiones de tratamiento debe ser de al menos 16 semanas.
Vía de administración
XEOMIN en forma de polvo se utiliza para inyecciones intramusculares (inyección intramuscular) o en la glándula (en la glándula salival) (véase la información destinada a los profesionales de la salud al final de esta hoja de instrucciones).
En adultos, las glándulas salivales pueden localizarse utilizando puntos de referencia anatómicos o una exploración ultrasonográfica, sin embargo, por razones de seguridad, el método preferido es el ultrasonográfico. En niños y adolescentes, debe utilizarse el método ultrasonográfico.
Antes de la inyección, a los niños y adolescentes se les puede administrar un anestésico local (por ejemplo, crema anestésica local), un sedante o un anestésico en combinación con un sedante.
Uso de una dosis mayor que la recomendada de XEOMIN
Síntomas de sobredosis
Los síntomas de sobredosis no ocurren inmediatamente después de la inyección y pueden incluir debilidad generalizada, ptosis (caída del párpado), visión doble, trastornos de la respiración, trastornos del habla y parálisis de los músculos respiratorios o trastornos de la deglución, lo que puede provocar neumonía.
Procedimiento en caso de sobredosis
En caso de que ocurran síntomas de sobredosis, el paciente o alguien de su entorno debe llamar inmediatamente a los servicios de emergencia, puede ser necesario el ingreso hospitalario. Es posible que se requiera atención médica y apoyo respiratorio durante varios días.
En caso de dudas adicionales sobre el uso de este medicamento, debe consultar a su médico, farmacéutico o enfermera.
4. Posibles efectos adversos
Como cualquier medicamento, XEOMIN puede provocar efectos adversos, aunque no todos los pacientes los experimentarán.
En general, los efectos adversos ocurren dentro de la primera semana después del tratamiento y son de naturaleza transitoria. Los efectos adversos pueden estar relacionados con el medicamento, el procedimiento de inyección o ambos. Los efectos adversos pueden limitarse al área alrededor del lugar de inyección del medicamento (por ejemplo, debilidad muscular local, dolor local, inflamación, sensación de hormigueo (parestesia), disminución de la sensibilidad al tacto (hipestesia), hipersensibilidad al tacto, edema (generalizado), hinchazón de los tejidos blandos (edema), enrojecimiento de la piel (eritema), picazón, infección local, hematoma, sangrado y / o moretón).
La inyección del medicamento puede provocar dolor. El dolor o el miedo a la inyección pueden provocar mareo, náuseas, zumbido en los oídos (tinnitus) o disminución de la presión arterial.
Los efectos adversos, como la debilidad muscular excesiva o los trastornos de la deglución, pueden deberse a una disminución de la tensión muscular en lugares alejados del lugar de inyección de XEOMIN.
Los trastornos de la deglución pueden provocar la aspiración de sustancias extrañas al sistema respiratorio, lo que puede provocar neumonía, y en algunos casos, la muerte.
XEOMIN puede provocar una reacción alérgica. Raramente se han informado reacciones alérgicas graves y / o repentinas (anafilaxia) o reacciones alérgicas a la sericina presente en el medicamento (enfermedad sericina), que pueden provocar, por ejemplo, trastornos de la respiración (disnea), erupciones (urticaria) o hinchazón de los tejidos blandos (edema). Algunas de estas reacciones se han informado después del uso de un complejo de toxina botulínica del tipo A convencional. Ocurrieron cuando la toxina se administró por separado o en combinación con otros medicamentos que provocan reacciones similares. Una reacción alérgica puede provocar los siguientes síntomas:
- trastornos de la respiración, deglución o habla debido a la hinchazón de la cara, los labios, la boca o la garganta,
- hinchazón de las manos, los pies o los tobillos.
En caso de que ocurra alguno de los síntomas anteriores, debe informar inmediatamente a su médico o buscar ayuda en el hospital más cercano.
Se han observado los siguientes efectos adversos durante el uso de XEOMIN.
Blefarospasmo
Muy frecuentes (pueden ocurrir en más de 1 de cada 10 pacientes):
ptosis (caída del párpado)
Frecuentes (pueden ocurrir en hasta 1 de cada 10 pacientes):
síndrome del ojo seco, visión borrosa, trastornos de la visión, sensación de sequedad en la boca, dolor en el lugar de la inyección
Poco frecuentes (pueden ocurrir en hasta 1 de cada 100 pacientes):
dolor de cabeza, debilidad muscular facial (parálisis del nervio facial), visión doble, lagrimeo excesivo, trastornos de la deglución (disfagia), fatiga, debilidad muscular, erupciones
Hemifacial
Se pueden esperar efectos adversos similares a los del blefarospasmo.
Torcicollis
Muy frecuentes (pueden ocurrir en más de 1 de cada 10 pacientes):
trastornos de la deglución (disfagia)
Frecuentes (pueden ocurrir en hasta 1 de cada 10 pacientes):
dolor de cuello, debilidad muscular, dolor muscular (mialgia), rigidez muscular y articular, espasmo muscular, dolor de cabeza, mareo, dolor en el lugar de la inyección, debilidad (astenia), sequedad en la boca, náuseas, sudoración excesiva, infecciones del tracto respiratorio superior, debilidad (estado de predecimiento)
Poco frecuentes (pueden ocurrir en hasta 1 de cada 100 pacientes):
trastornos del habla (disfonía), disnea, erupciones
El tratamiento del torcicollis puede provocar trastornos de la deglución de diferentes grados de severidad. Esto puede provocar la aspiración de sustancias extrañas a los pulmones, lo que puede requerir la intervención del médico. Los trastornos de la deglución pueden durar hasta dos o tres semanas después de la inyección, pero se ha informado un caso que duró cinco meses. La ocurrencia de trastornos de la deglución parece depender de la dosis del medicamento.
Aumento de la tensión muscular / rigidez muscular no controlada de los brazos, manos o dedos (espasticidad del miembro superior)
Frecuentes (pueden ocurrir en hasta 1 de cada 10 pacientes):
sequedad en la boca
Poco frecuentes (pueden ocurrir en hasta 1 de cada 100 pacientes):
dolor de cabeza, disminución de la sensibilidad al tacto (hipestesia), debilidad muscular, dolor en los miembros, fatiga general (astenia), dolor muscular, trastornos de la deglución (disfagia), náuseas
Frecuencia desconocida (la frecuencia no puede determinarse a partir de los datos disponibles):
dolor en el lugar de la inyección
Salivación excesiva crónica (sialorrea, adultos)
Frecuentes (pueden ocurrir en hasta 1 de cada 10 pacientes):
sequedad en la boca, trastornos de la deglución (disfagia), sensación de hormigueo (parestesia)
Poco frecuentes (pueden ocurrir en hasta 1 de cada 100 pacientes):
saliva espesa, trastornos del habla, trastornos del gusto
Se han informado casos de sequedad en la boca grave y prolongada (más de 110 días), que puede provocar trastornos adicionales, como gingivitis, trastornos de la deglución y caries dentales.
Salivación excesiva crónica (sialorrea, niños y adolescentes)
Poco frecuentes (pueden ocurrir en hasta 1 de cada 100 pacientes):
trastornos de la deglución (disfagia)
Frecuencia desconocida (la frecuencia no puede determinarse a partir de los datos disponibles):
sequedad en la boca, saliva espesa, dolor en la boca, caries dentales
Experiencia después de la comercialización
Después de la comercialización, durante el uso de XEOMIN, se han observado los siguientes efectos adversos con una frecuencia desconocida, independientemente del área tratada: síntomas similares a los de la gripe, disminución de la masa muscular después de la inyección y reacciones de hipersensibilidad, como: hinchazón, edema de los tejidos blandos (edema, incluyendo edema en lugares alejados del lugar de inyección), enrojecimiento, picazón, erupciones (localizadas y generalizadas), disnea.
Notificación de efectos adversos
Si ocurren efectos adversos, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad, Consumo y Bienestar Social
- C/ Alcalá 56, 28071 Madrid, Teléfono: +34 91 596 34 00, Fax: +34 91 596 34 01, Correo electrónico: [[email protected]](mailto:[email protected]), Página web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar XEOMIN
Debe conservar este medicamento en un lugar donde no pueda ser visto o alcanzado por los niños.
No debe utilizar este medicamento después de la fecha de caducidad que se indica en el cartón y la etiqueta de la ampolla después de "VTO". La fecha de caducidad es el último día del mes indicado.
La abreviatura "Lote" en el embalaje indica el número de lote.
Ampolla no abierta: No debe conservarse a una temperatura superior a 25°C.
Solución para inyección preparada: Se ha demostrado la estabilidad química y física de la solución durante 24 horas a una temperatura de 2°C a 8°C.
Desde el punto de vista microbiológico, el medicamento debe utilizarse inmediatamente. Si no se utiliza inmediatamente, el usuario es responsable de la duración y las condiciones de conservación antes de su reutilización, y este período no debe ser superior a 24 horas a una temperatura de 2°C a 8°C, a menos que la reconstitución se haya realizado en condiciones de esterilidad controlada.
El médico no debe utilizar XEOMIN si la solución para inyección es turbia o contiene residuos del medicamento que no se han disuelto.
Para obtener información sobre la eliminación del medicamento, debe buscar en la sección destinada a los profesionales de la salud al final de esta hoja de instrucciones.
6. Contenido del paquete y otra información
Qué contiene XEOMIN
- El principio activo de XEOMIN es la toxina botulínica del tipo A (150 kD) de Clostridium botulinum, libre de proteínas de complejidad. XEOMIN, 50 unidades, polvo para solución inyectableUna ampolla contiene 50 unidades de toxina botulínica del tipo A (150 kD) de Clostridium botulinum, libre de proteínas de complejidad*. XEOMIN, 100 unidades, polvo para solución inyectableUna ampolla contiene 100 unidades de toxina botulínica del tipo A (150 kD) de Clostridium botulinum, libre de proteínas de complejidad*. XEOMIN, 200 unidades, polvo para solución inyectableUna ampolla contiene 200 unidades de toxina botulínica del tipo A (150 kD) de Clostridium botulinum, libre de proteínas de complejidad*. * Toxina botulínica del tipo A, purificada a partir de cultivos de Clostridium botulinum(cepas Hall).
- Los demás componentes del medicamento son: albúmina humana, sacarosa.
Cómo se presenta XEOMIN y contenido del paquete
XEOMIN es un polvo para solución inyectable. El polvo es blanco.
Después de la reconstitución del polvo, se obtiene una solución clara e incolora.
XEOMIN, 50 unidades, polvo para solución inyectable: Tamaños de paquete: 1, 2, 3 o 6 ampollas.
XEOMIN, 100 unidades, polvo para solución inyectable: Tamaños de paquete: 1, 2, 3, 4 o 6 ampollas.
XEOMIN, 200 unidades, polvo para solución inyectable: Tamaños de paquete: 1, 2, 3, 4 o 6 ampollas.
No todos los tamaños de paquete pueden estar disponibles en el mercado.
Título de la autorización de comercialización
Merz Pharmaceuticals GmbH
Eckenheimer Landstrasse 100
60318 Frankfurt/Main
Alemania
Tel: +49-69/1503-1
Fax: +49-69/1503-200
Fabricante
Merz Pharma GmbH & Co. KGaA
Eckenheimer Landstrasse 100
60318 Frankfurt/Main
Alemania
Tel: +49-69/1503-1
Fax: +49-69/1503-200
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
XEOMIN: Alemania, Austria, Bélgica, Bulgaria, Chipre, Croacia, Dinamarca, Eslovaquia, Eslovenia, España, Estonia, Finlandia, Francia, Grecia, Hungría, Irlanda, Islandia, Italia, Letonia, Liechtenstein, Lituania, Luxemburgo, Malta, Noruega, Países Bajos, Polonia, Portugal, Reino Unido, República Checa, Rumania, Suecia
Fecha de la última revisión de la hoja de instrucciones: 22.04.2024
Información destinada exclusivamente a los profesionales de la salud: Preparación de la solución para inyección:
XEOMIN se prepara antes de la administración utilizando una solución de cloruro de sodio al 9 mg/ml (0,9%) para inyección.
XEOMIN solo debe utilizarse con fines terapéuticos en un paciente y en una sola sesión de tratamiento.
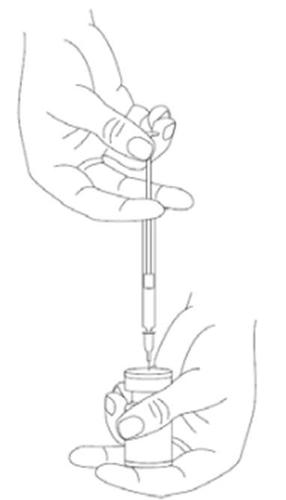
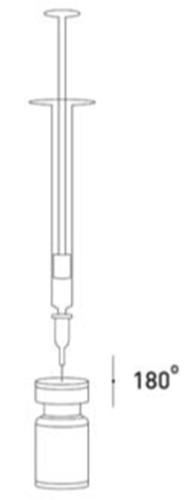
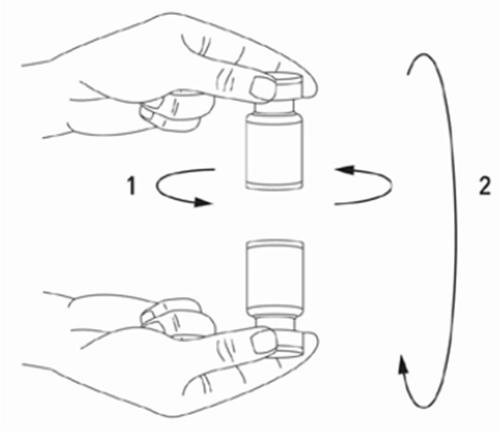
Es una buena práctica preparar la solución y preparar la jeringa sobre un paño de papel cubierto con plástico en caso de derrame del medicamento. Debe extraerse la cantidad adecuada de solución de cloruro de sodio (véase la tabla de diluciones). Para preparar la solución, se recomienda utilizar una aguja corta de 20-27 G. La aguja, en un ángulo recto, debe perforar el tapón de goma, después de lo cual ocurrirá la absorción automática y lenta del diluyente en la ampolla. Debe desecharse la ampolla si no ocurre la absorción del diluyente en la ampolla debido a la presión negativa. Desconecte la jeringa de la ampolla y mezcle XEOMIN con el diluyente, agitando suavemente la ampolla y girándola / golpeándola - no debe realizar movimientos bruscos. Si es necesario, la aguja utilizada para preparar la solución debe permanecer en la ampolla, y la cantidad adecuada de solución debe extraerse utilizando una jeringa nueva y estéril, adecuada para la inyección del medicamento.
Después de la reconstitución, XEOMIN es una solución clara e incolora.
No debe utilizarse XEOMIN si la solución preparada (preparada de la manera descrita anteriormente) es turbia o contiene residuos del medicamento.
Debe tener cuidado para utilizar el volumen correcto de diluyente necesario para preparar la dosis adecuada, para evitar una sobredosis accidental. Si se utilizan diferentes tipos de ampollas de XEOMIN en el mismo procedimiento de inyección, debe tener cuidado para utilizar la cantidad correcta de diluyente necesaria para obtener la cantidad específica de unidades por 0,1 ml. La cantidad de diluyente es diferente para XEOMIN 50 unidades, XEOMIN 100 unidades y XEOMIN 200 unidades. Cada jeringa también debe estar etiquetada adecuadamente.
Las concentraciones posibles para XEOMIN 50, 100 y 200 unidades se encuentran en la siguiente tabla:
| Dosis obtenida (unidades por 0,1 ml) | Diluyente agregado (cloruro de sodio 9 mg/ml (0,9%) solución para inyección) | ||
| Ampolla que contiene 50 unidades | Ampolla que contiene 100 unidades | Ampolla que contiene 200 unidades | |
| 20 unidades | 0,25 ml | 0,5 ml | 1 ml |
| 10 unidades | 0,5 ml | 1 ml | 2 ml |
| 8 unidades | 0,625 ml | 1,25 ml | 2,5 ml |
| 5 unidades | 1 ml | 2 ml | 4 ml |
| 4 unidades | 1,25 ml | 2,5 ml | 5 ml |
| 2,5 unidades | 2 ml | 4 ml | No aplica |
| 2 unidades | 2,5 ml | 5 ml | No aplica |
| 1,25 unidades | 4 ml | No aplica | No aplica |
Precauciones para la eliminación
La solución para inyección conservada durante más de 24 horas y la solución para inyección no utilizada deben desecharse.
Procedimientos para la eliminación segura de las ampollas, jeringas y materiales utilizados
Las ampollas no utilizadas, los restos de la solución preparada y / o las jeringas deben someterse a esterilización en un autoclave. Como alternativa, se puede inactivar cualquier resto del medicamento XEOMIN agregando una de las siguientes soluciones: etanol al 70%, isopropanol al 50%, detergente aniónico al 0,1% SDS, hidróxido de sodio diluido (0,1 N NaOH) o solución de hipoclorito de sodio diluida (al menos 0,1% NaOCl).
Después de la inactivación, los materiales utilizados, las jeringas y las ampollas no deben vaciarse, sino que deben colocarse en contenedores adecuados y eliminarse de acuerdo con las regulaciones locales.
Recomendaciones para los procedimientos en caso de incidentes no previstos durante la administración de la toxina botulínica del tipo A
- Cualquier derrame del medicamento debe eliminarse inmediatamente: en el caso del polvo, con un material absorbente, y en el caso de la solución para inyección, con un material seco absorbente.
- La superficie contaminada debe limpiarse con un material absorbente empapado en una de las soluciones mencionadas anteriormente, y luego secarse.
- Si la ampolla se rompe, debe seguir las instrucciones anteriores. Debe recoger con cuidado los fragmentos de vidrio roto y evitar cortes, y limpiar los restos del medicamento.
- Si el medicamento entra en contacto con la piel, el lugar de contacto debe enjuagarse con grandes cantidades de agua.
- En caso de que el medicamento entre en contacto con los ojos, debe enjuagarse con grandes cantidades de agua o con una solución para enjuagar los ojos.
- Si el medicamento entra en una herida, corte o fisura en la piel, debe enjuagarse con grandes cantidades de agua. Debe tomar las medidas médicas adecuadas según la dosis administrada. Debe seguir estrictamente las instrucciones para la preparación y eliminación del medicamento.
- País de registro
- Principio activo
- Requiere recetaSí
- ImportadorMerz Pharma GmbH & Co. KGaA
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a XeominForma farmacéutica: Solución, 200 U Speywood/mlPrincipio activo: Botulinum toxinRequiere recetaForma farmacéutica: Polvo, 125 unidades SpeywoodPrincipio activo: Botulinum toxinRequiere recetaForma farmacéutica: Polvo, 125 unidades SpeywoodPrincipio activo: Botulinum toxinRequiere receta
Alternativas a Xeomin en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Xeomin en Ucrania
Alternativa a Xeomin en España
Médicos online para Xeomin
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Xeomin – sujeta a valoración médica y normativa local.














