

Plenvu

Consulta con un médico sobre la receta médica de Plenvu

Cómo usar Plenvu
Hoja de instrucciones del paquete: información para el paciente
Plenvu, polvo para preparar solución oral
Makrogol 3350, ascrobato de sodio, sulfato de sodio anhidro, ácido ascórbico, cloruro de sodio y cloruro de potasio.
Es importante leer detenidamente el contenido de la hoja de instrucciones antes de tomar el medicamento, ya que contiene
información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico, farmacéutico o enfermera.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Plenvu y para qué se utiliza
- 2. Información importante antes de tomar Plenvu
- 3. Cómo tomar Plenvu
- 4. Posibles efectos adversos
- 5. Cómo conservar Plenvu
- 6. Contenido del paquete y otra información
1. Qué es Plenvu y para qué se utiliza
Plenvu contiene varias sustancias activas: makrogol 3350, ascrobato de sodio, sulfato de sodio anhidro, ácido ascórbico, cloruro de sodio y cloruro de potasio.
Plenvu es un laxante.
Plenvu está indicado para adultos a partir de 18 años antes de cualquier procedimiento clínico que requiera limpieza intestinal.
Plenvu limpia el intestino mediante la inducción de diarrea.
2. Información importante antes de tomar Plenvu
Cuándo no tomar Plenvu:
- si el paciente es alérgico a las sustancias activas o a cualquiera de los demás componentes de Plenvu (enumerados en el punto 6);
- en caso de obstrucción intestinal (obstrucción intestinal);
- en caso de presencia de un orificio en la pared del estómago o del intestino (perforación intestinal);
- en caso de parálisis intestinal (obstrucción intestinal);
- si el paciente tiene trastornos de la evacuación de alimentos sólidos y líquidos del estómago (por ejemplo, gastroparesia, reflujo gástrico);
- si el paciente padece fenilcetonuria. Es una incapacidad hereditaria del organismo para utilizar ciertos aminoácidos. Plenvu contiene una fuente de fenilalanina.
- si el organismo del paciente no es capaz de producir suficiente cantidad de deshidrogenasa de glucosa-6-fosfato;
- en caso de dilatación significativa del intestino (dilatación tóxica del colon).
Advertencias y precauciones
Antes de tomar Plenvu, debe consultar a su médico, farmacéutico o enfermera en los siguientes casos. Si:
- el paciente tiene problemas cardíacos o trastornos del ritmo cardíaco;
- el paciente padece insuficiencia renal y/o está deshidratado;
- el paciente tiene insuficiencia cardíaca, problemas graves con los riñones o toma medicamentos para regular la presión arterial;
- el paciente tiene problemas estomacales o intestinales, incluyendo la enfermedad de Crohn;
- el paciente tiene dificultades para tragar (véase también "Uso de Plenvu con alimentos y bebidas");
- el paciente tiene un nivel elevado o bajo de sales (por ejemplo, sodio, potasio) en la sangre;
- existe cualquier otra condición médica (por ejemplo, convulsiones);
- el paciente tiene epilepsia o ha tenido convulsiones en el pasado.
Plenvu no debe administrarse a pacientes con trastornos de la conciencia sin supervisión médica.
Los pacientes en mal estado o con enfermedades graves deben prestar especial atención a los posibles efectos adversos enumerados en el punto 4. En caso de dudas, debe consultar a su médico, farmacéutico o enfermera.
Si durante la toma de Plenvu para la limpieza intestinal, el paciente experimenta un dolor abdominal súbito o sangrado rectal, debe consultar a su médico o buscar atención médica de inmediato.
Si durante la toma de Plenvu se producen vómitos (con sangre), seguidos de un dolor súbito en el pecho, cuello o abdomen, dificultad para tragar o dificultad para respirar, debe suspender la toma del medicamento y consultar a su médico de inmediato.
Niños y adolescentes
No se recomienda la administración de Plenvu a niños y adolescentes menores de 18 años.
Plenvu y otros medicamentos
Debe informar a su médico, farmacéutico o enfermera sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar (incluyendo anticonceptivos orales).
Los medicamentos tomados por vía oral pueden ser eliminados del tracto gastrointestinal y pueden no absorberse adecuadamente si se toman una hora antes, durante y una hora después de la toma de Plenvu.
En caso de anticoncepción oral, puede ser necesario utilizar métodos anticonceptivos adicionales (por ejemplo, condones) para evitar el embarazo.
Uso de Plenvu con alimentos y bebidas
El día anterior al procedimiento, puede comer un desayuno y un almuerzo ligeros.
En caso de esquema de dosificación dividido en dos díaso esquema de dosificación en el día anterior al procedimiento, debe terminar de comer el almuerzo al menos 3 horas antes de iniciar la toma de Plenvu, y luego solo puede tomar líquidos.
En caso de esquema de dosificación solo por la mañana, puede comer una sopa clara y/o yogur natural por la noche (que debe terminar antes de las 20:00). Después de la cena de la noche anterior al procedimiento, solo puede tomar líquidos claros.
Nota: La información sobre los esquemas de dosificación se encuentra en el punto 3.
No debe comer el desayuno el día del procedimiento por la mañana.
Debe continuar bebiendo líquidos clarosantes, durante y después de la toma de Plenvu para protegerse contra la deshidratación. Es importante beber cantidades adicionales de líquidos claros recomendados.
Ejemplos de líquidos claros son: agua, sopas claras, té herbal, té negro o café (sin leche), bebidas sin alcohol/sirope diluido y jugos de frutas claros (sin pulpa).
Información importante:
No debe beber alcohol, leche, líquidos de color rojo o púrpura (por ejemplo, jugo de arándano) ni otras bebidas que contengan pulpa.
Durante la toma de Plenvu y hasta que se realice el procedimiento, no debe comer alimentos sólidos.
Debe suspender la ingesta de líquidos al menos:
- 2 horas antes del procedimiento con anestesia general o
- 1 hora antes del procedimiento sin anestesia general.
Plenvu puede inhibir la acción de los productos que espesan los líquidos, utilizados en caso de necesidad de espesar los líquidos para su ingesta segura.
Embarazo, lactancia y fertilidad
No hay datos disponibles sobre el uso de Plenvu durante el embarazo o la lactancia, por lo que no se recomienda. El medicamento solo debe tomarse si el médico considera que es necesario. Si la paciente está embarazada o en período de lactancia, sospecha que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de tomar Plenvu.
Conducción de vehículos y uso de máquinas
Plenvu no afecta la capacidad de conducir vehículos o utilizar máquinas.
Plenvu contiene sodio, potasio y una fuente de fenilalanina
Este medicamento contiene 458,5 mmol (10,5 g) de sodio por ciclo de tratamiento. Debe tenerse en cuenta en pacientes que controlan su ingesta de sodio.
Este medicamento contiene 29,4 mmol (1,1 g) de potasio por ciclo de tratamiento. Debe tenerse en cuenta en pacientes con función renal reducida y en pacientes que controlan su ingesta de potasio.
Plenvu contiene una fuente de fenilalanina. Puede ser perjudicial para pacientes con fenilcetonuria.
También contiene ascrobato, que puede ser perjudicial para pacientes con deficiencia de deshidrogenasa de glucosa-6-fosfato.
3. Cómo tomar Plenvu
Este medicamento debe tomarse siempre según las indicaciones de su médico o farmacéutico. En caso de dudas, debe consultar a su médico, farmacéutico o enfermera.
Antes de tomar Plenvu, debe leer detenidamente las instrucciones que se proporcionan a continuación. Información importante:
- Cuándo tomar Plenvu
- Cómo preparar Plenvu
- Cómo tomar Plenvu
- Qué esperar
Cuándo tomar Plenvu
El tratamiento con Plenvu debe terminarse antes del procedimiento clínico.
El ciclo de tratamiento puede tomarse en dosis separadas según se describe a continuación:
Esquema de dosificación dividido en dos días
La dosis 1 debe tomarse por la noche antes del procedimiento clínico, y la segunda dosis por la mañana del día del procedimiento, aproximadamente 12 horas después del inicio de la toma de la primera dosis o
Esquema de dosificación solo por la mañana
Las dosis 1 y 2 deben tomarse por la mañana del día del procedimiento clínico. La segunda dosis debe tomarse al menos 2 horas después del inicio de la toma de la primera dosis o
Esquema de dosificación en el día anterior al procedimiento
Las dosis 1 y 2 deben tomarse por la noche del día anterior al procedimiento clínico. La segunda dosis debe tomarse al menos 2 horas después del inicio de la toma de la primera dosis.
Su médico le indicará qué esquema de dosificación debe seguir. NO DEBE agregar ningún otro ingrediente al medicamento.
Durante la toma de Plenvu y hasta que se realice el procedimiento, no debe comer alimentos sólidos.
La información sobre los horarios de las comidas antes de la toma de Plenvu se encuentra en la sección 2.
Cómo preparar la dosis 1 de Plenvu
- 1. Abrir el paquete de cartón y sacar la bolsa con la dosis 1.
- 2. Verter el contenido de la bolsa con la dosis 1 en un recipiente con medida que contenga 500 ml de líquido.
- 3. Llenar con agua hasta un volumen de 500 ml y mezclar hasta que todo el polvo se disuelva. Esto puede tardar hasta 8 minutos.
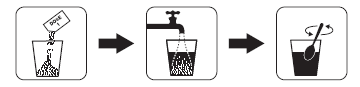
Cómo tomar la dosis 1 de Plenvu
Tomar 500 ml de la dosis 1 y 500 ml de líquido claro en un plazo de 60 minutos. Se permite la ingesta alternada de la solución preparada y líquido claro. Debe tratar de beber un vaso completo de líquido cada 10-15 minutos.
El líquido claro puede incluir agua, sopa clara, sirope diluido/jugo de frutas (sin pulpa), té o café (sin leche).
Cómo preparar la dosis 2 de Plenvu
- 1. Cuando el paciente esté listo para tomar la dosis 2, debe verter el contenido de las bolsas A y B de la dosis 2 en un recipiente con medida que contenga 500 ml de líquido.
- 2. Llenar con agua hasta un volumen de 500 ml y mezclar hasta que todo el polvo se disuelva. Esto puede tardar hasta 8 minutos.
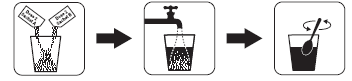
Cómo tomar la dosis 2 de Plenvu
Según las instrucciones del esquema de dosificación recomendado, debe preparar y tomar 500 ml de la dosis 2 y 500 ml de líquido claro en un plazo de 60 minutos. Se permite la ingesta alternada de la solución preparada y líquido claro.
Puede beber líquidos claros adicionales durante el proceso de preparación intestinal, es decir, antes, durante y después de la toma de Plenvu, pero debe suspender la ingesta de líquidos al menos 1 o 2 horas antes del procedimiento clínico. Beber líquidos claros protegerá contra la pérdida de líquidos (deshidratación).
Qué esperar
Después de comenzar a beber la solución de Plenvu, debe permanecer cerca del baño. En algún momento, se producirán heces acuosas. Esto es normal y significa que la solución de Plenvu está funcionando. Antes de la primera evacuación, puede experimentar hinchazón en la zona del estómago.
Si sigue estas instrucciones, el intestino se limpiará, lo que ayudará a realizar el procedimiento con éxito. Debe esperar un tiempo adecuado después de que las evacuaciones hayan cesado antes de viajar al consultorio/hospital.
Toma de una dosis mayor de la recomendada de laxantes
En caso de tomar Plenvu antes o después de tomar otros productos laxantes, puede producirse diarrea excesiva, lo que puede llevar a la deshidratación. Debe beber una gran cantidad de líquido claro. En caso de dudas, debe consultar a su médico o buscar atención médica de inmediato en el departamento de emergencias del hospital más cercano.
Omision de la toma de Plenvu
- En caso de olvidar tomar Plenvu según las indicaciones, debe tomarlo lo antes posible y consultar a su médico, farmacéutico o enfermera para obtener consejo antes de realizar el procedimiento clínico.
- Es importante asegurarse de que haya suficiente tiempo para que Plenvu actúe y limpie el intestino al menos 2 horas antes del procedimiento clínico.
En caso de dudas adicionales sobre el uso de este medicamento, debe consultar a su médico, farmacéutico o enfermera.
4. Posibles efectos adversos
Como cualquier medicamento, Plenvu puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
La aparición de diarrea durante la toma de Plenvu es una reacción normal.
Si no se produce una evacuación en un plazo de 6 horas después de la toma de Plenvu, debe suspender su usoy consultar a su médico de inmediato.
Si se producen alguno de los siguientes efectos adversos, debe suspender la toma de Plenvuy consultar a su médico de inmediato, ya que pueden ser síntomas de una reacción alérgica grave:
- cansancio extremo,
- palpitaciones,
- erupción o picazón,
- dificultad para respirar,
- hinchazón de la cara, tobillos o otras partes del cuerpo. Debe suspender la toma de Plenvu y consultar a su médico de inmediato si se producen alguno de los siguientes efectos adversos:
- convulsiones.
Debe informar a su médico de inmediato si se producen alguno de los siguientes efectos adversos durante la toma de Plenvu, ya que pueden indicar una sobrehidratación o deshidratación:
- mareos,
- dolor de cabeza,
- orina menos frecuente de lo habitual,
- vómitos.
Debe informar a su médico de inmediato si se produce un dolor abdominal severo.
En casos raros, durante el uso de laxantes para la preparación intestinal, especialmente en pacientes con enfermedades cardíacas o trastornos electrolíticos, pueden producirse trastornos graves del ritmo cardíaco (es decir, una sensación de latido cardíaco fuerte, palpitante o irregular que dura varios segundos o incluso varios minutos). En caso de que estos síntomas persistan, debe informar a su médico.
Efectos adversos frecuentes (pueden afectar a hasta 1 de cada 10 personas):
- deshidratación,
- náuseas (vómitos),
- vómitos.
Efectos adversos poco frecuentes (pueden afectar a hasta 1 de cada 100 personas):
- hinchazón y dolor abdominal,
- dolor y malestar,
- reacción alérgica,
- escalofríos,
- cansancio,
- dolor de cabeza o migraña,
- ola de calor,
- aumento del nivel de glucosa en sangre en pacientes con diabetes,
- taquicardia,
- palpitaciones,
- dolor anal,
- insomnio,
- aumento transitorio de la presión arterial,
- aumento transitorio de la actividad de las enzimas hepáticas,
- sensación de sed,
- diversos trastornos electrolíticos,
- debilidad.
Frecuencia desconocida (la frecuencia no puede determinarse a partir de los datos disponibles):
- rotura del esófago debido a vómitos.
Notificación de efectos adversos
Si se producen efectos adversos, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera.
Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Medicamentos de la Agencia de Registros de Medicamentos, Productos Sanitarios y Productos Biocidas
Calle Jerozolimskie 181C
02-222 Varsovia
Tel.: +48 22 49 21 301
Fax: +48 22 49 21 309
Sitio web: https://smz.ezdrowie.gov.pl
Los efectos adversos también pueden notificarse al titular de la responsabilidad.
La notificación de efectos adversos permitirá recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Plenvu
El medicamento debe conservarse en un lugar fuera del alcance de los niños.
No debe usar este medicamento después de la fecha de caducidad que aparece en la bolsa y el paquete después de la mención EXP. La fecha de caducidad es el último día del mes indicado.
Por favor, tenga en cuenta que las fechas de caducidad de las bolsas individuales y del paquete pueden ser diferentes.
Antes de abrir, no debe conservarse a una temperatura superior a 25°C.
Las soluciones preparadas deben conservarse a una temperatura inferior a 25°C y tomarse en un plazo de 24 horas.
Las soluciones pueden conservarse en el refrigerador. Las soluciones deben conservarse cubiertas.
No debe tirar los medicamentos por el desagüe ni por los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Plenvu?
En la bolsa con la dosis 1se encuentran las siguientes sustancias activas:
Makrogol 3350
100 g
Sulfato de sodio anhidro
9 g
Cloruro de sodio
2 g
Cloruro de potasio
1 g
Las concentraciones de iones electrolíticos después de la preparación de 500 ml de la solución de la dosis 1 son las siguientes:
Sodio
160,9 mmol/500 ml
Sulfato
Cloruro
Potasio
63,4 mmol/500 ml
47,6 mmol/500 ml
13,3 mmol/500 ml
La dosis 1 también contiene 0,79 g de sucralosa (E955).
En las bolsas con la dosis 2 (bolsas A y B)se encuentran las siguientes sustancias activas:
Bolsa A:
Makrogol 3350
40 g
Cloruro de sodio
3,2 g
Cloruro de potasio
1,2 g
Bolsa B:
Ascrobato de sodio
48,11 g
Ácido ascórbico
7,54 g
Las concentraciones de iones electrolíticos después de la preparación de 500 ml de la solución de la dosis 2 (con las bolsas A y B) son las siguientes:
Sodio
297,6 mmol/500 ml
Ascrobato
285,7 mmol/500 ml
Cloruro
70,9 mmol/500 ml
Potasio
16,1 mmol/500 ml
Excipientes con efecto conocido
La dosis 2 (bolsa A) también contiene 0,88 g de aspartamo (E951).
Otros componentes:
Sabor a mango que contiene maltodextrina (E1400), glicerina (E422), sustancias aromáticas naturales, goma arábiga (E414) y preparados aromáticos.
Sabor a frutas que contiene maltodextrina (E1400), goma arábiga (E414), sustancias aromáticas y preparados aromáticos.
Para obtener más información, véase el punto 2.
Cómo se presenta Plenvu y qué contiene el paquete?
El paquete contiene tres bolsas: la dosis 1, la bolsa A de la dosis 2 y la bolsa B de la dosis 2.
Plenvu, polvo para preparar solución oral, está disponible en paquetes que contienen 1 conjunto de tratamiento y paquetes que contienen 40, 80, 160 y 320 conjuntos de tratamiento.
No todos los tamaños de paquete pueden estar disponibles en el mercado.
Titular de la responsabilidad:
Norgine B.V.
Calle Antonio Vivaldi 150,
1083 HP Ámsterdam
Países Bajos
Tel: +31 (0)20 567 09 00
Importador:
Norgine B.V.
Calle Antonio Vivaldi 150
1083 HP Ámsterdam
Países Bajos
Norgine Pharma
Calle Ethe Virton 29
Dreux 28100
Francia
Este medicamento está autorizado para su comercialización en los países miembros del Espacio Económico Europeo y en el Reino Unido (Irlanda del Norte) con los siguientes nombres:
Bélgica, Bulgaria, República Checa, Croacia, Dinamarca, Finlandia, Francia, Alemania, Hungría, Islandia, Irlanda, Italia, Luxemburgo, Noruega, Polonia, Portugal, Rumania, Eslovaquia, Eslovenia, Suecia, Reino Unido (Irlanda del Norte): PLENVU
Austria, Países Bajos, España: PLEINVUE
Fecha de la última actualización de la hoja de instrucciones:mayo de 2025
- País de registro
- Requiere recetaSí
- Fabricante
- ImportadorNorgine B.V.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a PlenvuForma farmacéutica: Polvo, 13.7 gPrincipio activo: macrogol, combinationsNo requiere recetaForma farmacéutica: Polvo, -Principio activo: macrogol, combinationsFabricante: Sigma Italia S.p.A.Requiere recetaForma farmacéutica: Comprimidos, 1500 mgPrincipio activo: Fosfato disodioRequiere receta
Alternativas a Plenvu en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Plenvu en Іспанія
Médicos online para Plenvu
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Plenvu – sujeta a valoración médica y normativa local.














