
Piarmavate
Consulta con un médico sobre la receta médica de Piarmavate

Cómo usar Piarmavate
Hoja de instrucciones del paquete: información para el usuario
Pharmavate, 50 UI/ml, polvo y disolvente para la preparación de una solución para inyección
Factor de coagulación sanguínea humano VIII Pharmavate, 100 UI/ml, polvo y disolvente para la preparación de una solución para inyección
Factor de coagulación sanguínea humano VIII
Es importante leer el prospecto antes de utilizar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar este prospecto para poder volver a leerlo si es necesario.
- Debe consultar a su médico, farmacéutico o enfermera si tiene alguna duda adicional.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si se produce un empeoramiento de alguno de los efectos no deseados o si se producen efectos no deseados, incluidos los no mencionados en este prospecto, debe informar a su médico, farmacéutico o enfermera.
Índice del prospecto:
- 1. Qué es Pharmavate y para qué se utiliza
- 2. Información importante antes de utilizar Pharmavate
- 3. Cómo utilizar Pharmavate
- 4. Posibles efectos no deseados
- 5. Cómo conservar Pharmavate
- 6. Contenido del paquete y otra información
1. Qué es Pharmavate y para qué se utiliza
Pharmavate pertenece a un grupo de medicamentos llamados factores de coagulación y contiene factor de coagulación sanguínea humano VIII. Es una proteína especial que aumenta la capacidad de la sangre para coagularse.
Pharmavate se utiliza para el tratamiento y la prevención de hemorragias en pacientes con hemofilia A. Es una condición en la que la hemorragia es más prolongada de lo esperado. Esto se debe a una deficiencia congénita de factor VIII en la sangre.
2. Información importante antes de utilizar Pharmavate
Se recomienda encarecidamente que, cada vez que se administre una dosis de Pharmavate a un paciente, se registre el nombre y el número de lote del producto para mantener la información sobre el lote utilizado.
El médico puede recomendar considerar la vacunación contra la hepatitis viral A y B en caso de recibir regularmente o repetidamente productos de factor VIII de origen humano.
Cuándo no utilizar Pharmavate
- si el paciente es alérgico al factor de coagulación sanguínea humano VIII o a alguno de los demás componentes de este medicamento (enumerados en el punto 6).
Precauciones y advertencias
Antes de comenzar a tomar Pharmavate, debe consultar a su médico, farmacéutico o enfermera.
Pharmavate contiene cantidades residuales de otras proteínas humanas. Cualquier medicamento que contenga proteínas y se administre por vía intravenosa (por inyección en una vena) puede causar reacciones alérgicas (ver punto 4. Posibles efectos no deseados).
La formación de inhibidores (anticuerpos) es una complicación conocida que puede ocurrir durante el tratamiento con todos los medicamentos que contienen factor VIII. Estos inhibidores, especialmente a concentraciones altas, interrumpen el tratamiento efectivo y el paciente será monitoreado de cerca para detectar la formación de estos inhibidores. Si la hemorragia del paciente no se controla adecuadamente con Pharmavate, debe informar de inmediato a su médico.
Información sobre la sangre y el suero utilizados para la fabricación de Pharmavate
Durante la fabricación de medicamentos a partir de sangre o suero humanos, se toman medidas para prevenir la transmisión de infecciones a los pacientes. Estas medidas incluyen la selección cuidadosa de donantes de sangre y suero para garantizar la exclusión de donantes que puedan ser portadores de infecciones, así como la prueba de todas las muestras y pools de suero para detectar la presencia de virus/infecciones. Los fabricantes de estos productos han implementado etapas en el proceso de tratamiento de la sangre o el suero para inactivar o eliminar los virus. A pesar de estas medidas, no se puede excluir completamente la posibilidad de transmisión de una infección cuando se administra un medicamento preparado a partir de sangre o suero humanos. Esto incluye infecciones virales desconocidas o que han aparecido recientemente, o otros tipos de infecciones.
Las medidas tomadas se consideran efectivas contra los virus con envoltura, como el virus de la inmunodeficiencia humana (VIH), el virus de la hepatitis B (VHB) y el virus de la hepatitis C (VHC), así como contra el virus de la hepatitis A (VHA) sin envoltura. Los métodos utilizados pueden tener una eficacia limitada contra los virus sin envoltura, como el parvovirus B19.
La infección por parvovirus B19 puede ser grave para las mujeres embarazadas (infección del feto) y para personas con sistemas inmunitarios debilitados o que padecen ciertos tipos de anemia (como anemia falciforme o destrucción anormal de glóbulos rojos).
Otros medicamentos y Pharmavate
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar, incluidos los que se venden sin receta.
No se conocen interacciones entre el factor de coagulación sanguínea humano VIII y otros productos medicinales.
No obstante, no debe mezclar Pharmavate con otros medicamentos durante la infusión.
Embarazo y lactancia
Si está embarazada, en período de lactancia o si sospecha que está embarazada, o si planea quedarse embarazada, debe consultar a su médico o farmacéutico antes de utilizar este medicamento.
Conducción de vehículos y uso de máquinas
No se ha observado ningún efecto sobre la capacidad de conducir vehículos o utilizar máquinas.
Pharmavate contiene:
En el caso de la ampolla de 250 UI, el producto contiene menos de 1 mmol de sodio (23 mg) por dosis, lo que significa que el medicamento se considera "sin sodio".
En el caso de las ampollas de 500 UI y 1000 UI, el producto contiene como máximo 1,75 mmol de sodio (40 mg) por dosis. Esto equivale al 2% de la dosis diaria máxima recomendada de sodio para adultos. Debe tenerse en cuenta en pacientes que siguen una dieta con contenido controlado de sodio.
3. Cómo utilizar Pharmavate
Pharmavate debe administrarse por vía intravenosa después de la reconstitución con el disolvente proporcionado.
El tratamiento debe iniciarse bajo supervisión médica.
Dosis para la prevención de hemorragias:
En la profilaxis a largo plazo de hemorragias en pacientes con hemofilia A grave, se debe administrar factor VIII en una dosis de 20 a 40 UI por kilogramo de peso corporal cada 2 a 3 días.
La dosis debe ajustarse según la respuesta clínica. En algunos casos, puede ser necesario administrar el medicamento en intervalos de tiempo más cortos o en dosis más altas.
Cálculo de la dosis:
Pharmavate siempre debe utilizarse según las indicaciones de su médico. En caso de duda, debe volver a consultar a su médico o farmacéutico.
La actividad del factor VIII en el suero es equivalente al contenido de factor VIII en el suero. Se expresa como porcentaje (en relación con el suero humano normal) o en unidades internacionales (UI).
La dosis de factor VIII se expresa en UI.
Una Unidad Internacional (UI) de actividad del factor VIII es equivalente a la cantidad de factor VIII en 1 ml de suero humano normal. 1 UI de factor VIII por kilogramo de peso corporal aumenta la actividad del factor VIII en el suero en un 1,5% - 2% de la actividad normal. Para calcular la dosis necesaria, debe determinar la actividad del factor VIII en el suero del paciente. Esto permitirá determinar cuánto debe aumentar la actividad. Debe consultar a su médico en caso de duda sobre cuánto debe aumentar la actividad del factor VIII en el suero y cómo calcular la dosis necesaria.
La dosis necesaria se calcula utilizando la siguiente fórmula:
dosis necesaria = peso corporal (kg) x aumento necesario de la actividad del factor VIII
(%) (UI/ml) x 0,5
La cantidad que debe administrarse y la frecuencia de administración del producto deben ajustarse siempre según la eficacia clínica en cada paciente individual.
En los siguientes casos de hemorragia, la actividad del factor VIII no debe disminuir por debajo del nivel de actividad en suero indicado (en % de los valores normales) durante el período especificado.
| Gravedad de la hemorragia / Tipo de procedimiento quirúrgico | Nivel de factor VIII necesario (%) (UI/ml) | Frecuencia de administración (horas)/ Duración del tratamiento (días) |
| Hemorragia | ||
| Hemorragia temprana en las articulaciones, músculos o boca | 20-40 | Repetir cada 12 a 24 horas. Al menos 1 día hasta que cese el dolor causado por la hemorragia o hasta que se produzca la curación de la herida. |
| Hemorragia más grave en las articulaciones, músculos o hematoma | 30-60 | Repetir la infusión cada 12 a 24 horas durante 3-4 días o más hasta que cese el dolor y se recupere la función. |
| Hemorragias que ponen en peligro la vida | 60-100 | Repetir la infusión cada 8 a 24 horas hasta que cese la amenaza. |
| Operaciones | ||
| Menores, incluyendo extracción de muelas | 30-60 | Cada 24 horas, durante al menos 1 día, hasta la curación. |
| Mayores | 80-100 (pre y postoperatorio) | Repetir la infusión cada 8 a 24 horas hasta que se produzca una curación adecuada de la herida, luego continuar el tratamiento durante al menos 7 días adicionales para mantener la actividad del factor VIII en un nivel del 30% al 60%. |
La dosis y la frecuencia de administración de Pharmavate serán determinadas por su médico.
La respuesta al factor VIII puede variar entre pacientes. Por lo tanto, se recomienda determinar los niveles de factor VIII durante el tratamiento para establecer la dosis y la frecuencia de administración adecuadas.
Uso en niños
En los estudios clínicos, no se encontraron requisitos especiales de dosificación en niños. La dosificación es la misma para adultos y niños, tanto para el tratamiento como para la profilaxis.
Instrucciones para la administración en el hogar
- Debe leer todas las instrucciones y seguirlos cuidadosamente.
- No utilice el producto Pharmavate después de la fecha de caducidad indicada en la etiqueta.
- Debe mantener las condiciones estériles durante el procedimiento descrito a continuación.
- La solución en la jeringa debe ser clara o ligeramente perlada y brillante. No inyecte soluciones que estén turbias o contengan partículas sólidas.
- Debe utilizar la solución preparada de inmediato para evitar la contaminación microbiológica.
- Debe utilizar solo el conjunto de inyección proporcionado. El uso de otro equipo de inyección/infusión puede causar riesgos adicionales y fallas en el tratamiento.
Instrucciones para la preparación de la solución utilizando el sistema Mix2Vial:
- 1. No utilice el producto inmediatamente después de sacarlo del refrigerador. Deje el disolvente y el polvo en los frascos cerrados hasta que alcancen la temperatura ambiente.
- 2. Retire las tapas de los dos frascos y limpie los tapones de goma con uno de los hisopos con alcohol proporcionados.
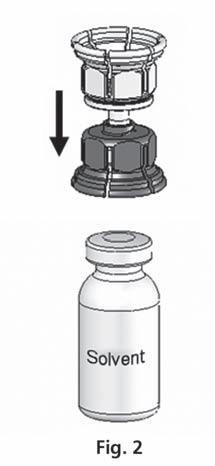
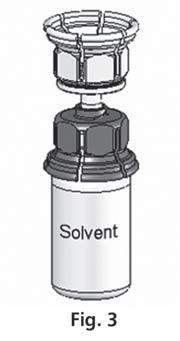
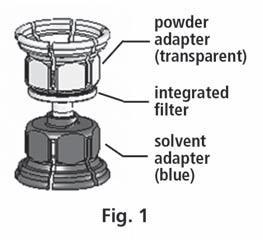
- 3. El sistema Mix2Vial se muestra en la fig. 1. Coloque el frasco con el disolvente sobre una superficie plana y sujételo firmemente. Tome el sistema Mix2Vial y gírelo. Coloque la parte azul del Mix2Vial sobre el frasco con el disolvente y presione firmemente hasta que se bloquee (fig. 2 + 3).
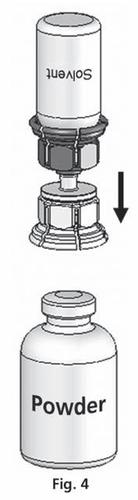
- 4. Coloque el frasco con el polvo sobre una superficie plana y sujételo firmemente. Tome el frasco con el disolvente con el sistema Mix2Vial conectado y gírelo hacia abajo. Coloque la parte transparente del conjunto sobre el frasco con el polvo y presione firmemente hasta que se bloquee (fig. 4). El disolvente fluye automáticamente hacia el frasco con el polvo.
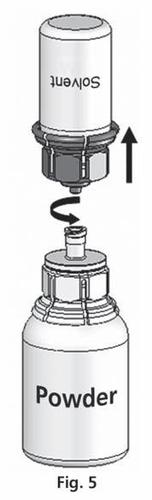
- 5. Con ambos frascos conectados, gire suavemente el frasco con el polvo hasta que el producto se disuelva. La disolución se completa en menos de 10 minutos a temperatura ambiente. Durante la preparación, puede formarse una ligera espuma. Desenrosque el Mix2Vial en dos partes (fig. 5). La espuma desaparecerá.
Deseche el frasco vacío con el disolvente con la parte azul del Mix2Vial.
Instrucciones para la inyección:
Como medida de precaución, debe verificar el pulso antes y durante la inyección.
Si se produce un aumento significativo en la frecuencia del pulso, debe reducir la velocidad de inyección o interrumpir la administración del medicamento durante un breve período.
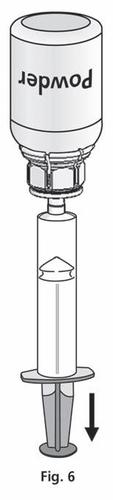
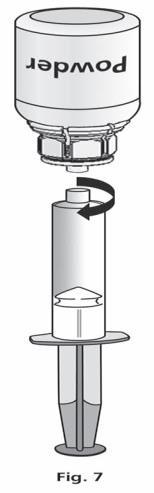
- 1. Conecte la jeringa al conjunto transparente del Mix2Vial. Invierta el frasco y extraiga la solución hacia la jeringa (fig. 6). La solución en la jeringa debe ser clara o ligeramente perlada y brillante. Después de transferir la solución, sujete firmemente el émbolo de la jeringa (dirigiéndolo hacia abajo) y retire la jeringa del Mix2Vial (fig. 7). Deseche el Mix2Vial y el frasco vacío.
- 2. Limpie el lugar de inyección seleccionado con uno de los hisopos con alcohol proporcionados.
- 3. Conecte la aguja para inyecciones proporcionada a la jeringa.
- 4. Introduzca la aguja en la vena seleccionada. Si se utiliza un torniquete para hacer visible la vena, debe aflojarlo antes de comenzar la inyección del producto Pharmavate. La sangre no debe entrar en la jeringa debido al riesgo de formación de coágulos de fibrina.
- 5. Inyecte la solución lentamente en la vena, no más rápido de 2-3 ml por minuto.
Si se utilizan varias ampollas de polvo de Pharmavate durante una sola administración, es posible volver a utilizar la misma aguja y jeringa. El conjunto Mix2Vial está diseñado para un solo uso.
Instrucciones para la preparación de la solución utilizando el conjunto de transferencia (1 aguja de doble punta y 1 aguja filtrante):
- 1. No utilice el producto inmediatamente después de sacarlo del refrigerador. Debe calentar el polvo y el disolvente en los frascos cerrados hasta alcanzar la temperatura ambiente. Debe mantener esta temperatura durante la preparación. Si se utiliza un baño de agua para calentar, debe asegurarse de que el agua no entre en contacto con los tapones de goma (sin látex) o las tapas de los frascos. La temperatura del baño de agua no debe exceder los 37°C.
- 2. Retire las tapas de los frascos con el polvo y el disolvente (fig. 1) y limpie los tapones de goma con uno de los hisopos con alcohol proporcionados (fig. 2).
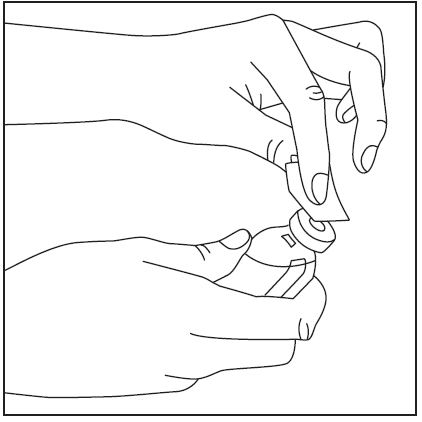
fig.1
fig.2
fig.1
fig.2
- 3. Retire la cubierta protectora del extremo corto de la aguja de doble punta (fig. 3), asegurándose de no tocar la punta expuesta de la aguja. Luego, perforé el centro del tapón de goma del frasco con el disolvente con la aguja en posición vertical (fig. 4). Para retirar completamente el líquido del frasco con el disolvente, la aguja debe introducirse en el tapón de goma de manera que se vea dentro del frasco.
fig. 4
fig.3
fig.4
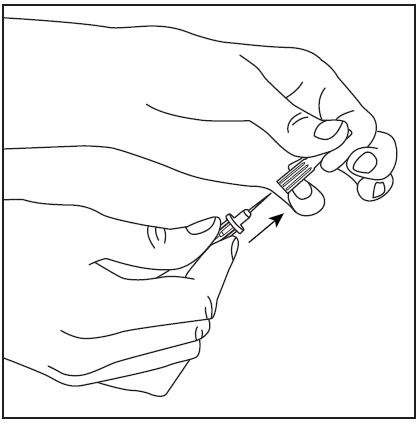
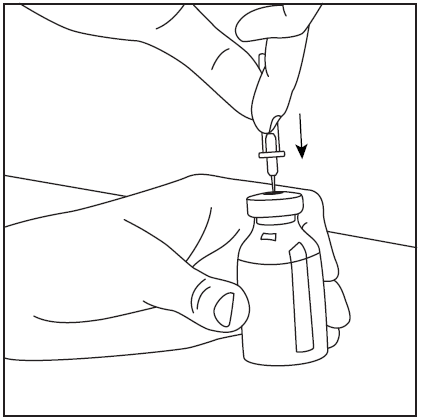
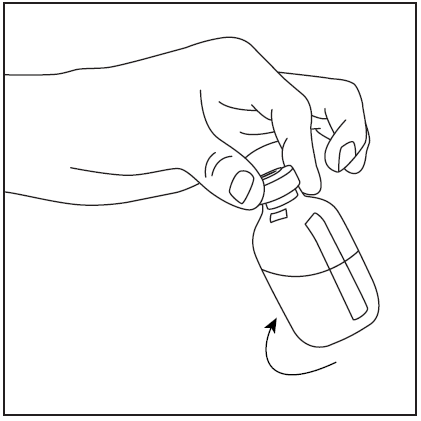
- 4. Retire la cubierta protectora del extremo más largo de la aguja de doble punta, asegurándose de no tocar la punta expuesta de la aguja (fig. 5). Tome el frasco con el disolvente y la aguja insertada y gírelo hacia abajo sobre el frasco con el polvo. Rápidamente, perforé el centro del tapón de goma del frasco con el polvo con la aguja (fig. 6). El vacío dentro del frasco hace que el disolvente fluya hacia el frasco con el polvo.
fig.6
fig.5
fig.6
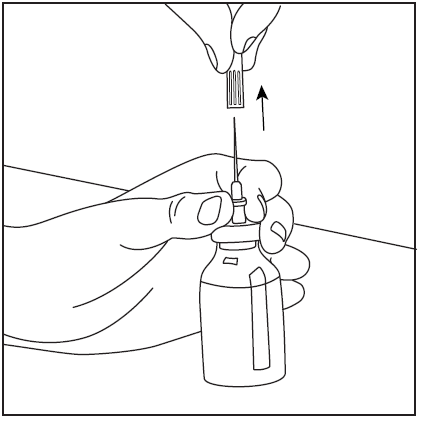
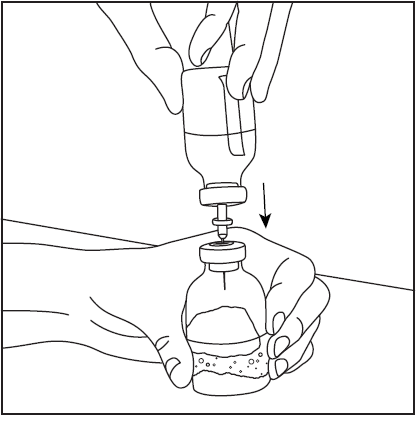
- 5. Retire la aguja de doble punta junto con el frasco vacío de disolvente (fig. 7), luego gire suavemente el frasco con el polvo y el disolvente hasta que el producto se disuelva. Pharmavate se disuelve rápidamente a temperatura ambiente en una solución clara (fig. 8).
fig.8
fig.7
fig.8
Instrucciones para la inyección:
Como medida de precaución, debe verificar el pulso antes y durante la inyección.
Si se produce un aumento significativo en la frecuencia del pulso, debe reducir la velocidad de inyección o interrumpir la administración del medicamento.
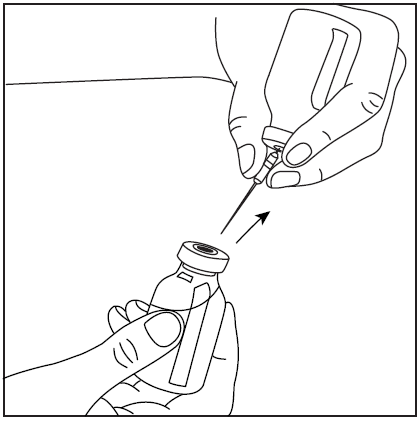
- 1. Después de preparar el polvo como se describe anteriormente, retire la cubierta protectora de la aguja filtrante y perforé el tapón de goma del frasco con el concentrado preparado.
- 2. Retire la punta de la aguja filtrante y conecte la jeringa.
- 3. Invierta el frasco con la jeringa conectada y extraiga la solución hacia la jeringa.
- 4. Limpie el lugar de inyección seleccionado con uno de los hisopos con alcohol proporcionados.
- 5. Retire la aguja filtrante de la jeringa y conecte la aguja para inyecciones a la jeringa.
- 6. Inyecte la solución en la vena, no más rápido de 2-3 ml por minuto.
Debe eliminar cualquier residuo del medicamento o desecho según las regulaciones locales.
Los pacientes que utilizan varias ampollas de concentrado de Pharmavate pueden utilizar la misma aguja para inyecciones y jeringa para la inyección, pero la aguja filtrante está diseñada para un solo uso.
Al extraer la solución hacia la jeringa, siempre debe utilizar la aguja filtrante.
Uso de una dosis mayor de la recomendada de Pharmavate
No se han observado síntomas de sobredosis de factor de coagulación sanguínea humano VIII. Sin embargo, se recomienda no exceder la dosis recomendada.
Omision de una dosis de Pharmavate
No debe tomar una dosis doble para compensar una dosis omitida. Debe continuar con la siguiente dosis según las indicaciones de su médico o farmacéutico.
Debe consultar a su médico o farmacéutico si tiene alguna otra pregunta sobre el uso de este medicamento.
4. Posibles efectos no deseados
Como cualquier medicamento, este medicamento puede causar efectos no deseados, aunque no todos los pacientes los experimentarán.
A pesar de que son poco frecuentes(pueden ocurrir en 1 de cada 1000 pacientes), se han observado reacciones de hipersensibilidad o alérgicas en pacientes tratados con productos que contienen factor VIII.
Debe consultar a su médico si experimenta alguno de los siguientes síntomas:
vómitos, sensación de ardor y dolor punzante en el lugar de la inyección, sensación de opresión en el pecho, escalofríos, taquicardia, náuseas, sensación de hormigueo, enrojecimiento, dolor de cabeza, urticaria, caída de la presión arterial, erupción, ansiedad, hinchazón de la cara, los labios, la boca, la lengua o la garganta, que puede causar dificultad para tragar o respirar (edema angioneurótico), fatiga (letargo), sibilancias.
Muy raramente(pueden ocurrir en 1 de cada 10 000 pacientes), la hipersensibilidad puede causar una reacción alérgica grave y potencialmente mortal llamada anafilaxia, que puede incluir shock, así como alguno o todos los síntomas mencionados anteriormente. En tal caso, debe consultar de inmediato a su médico o llamar a los servicios de emergencia.
Otros efectos no deseados raros (pueden ocurrir en 1 de cada 1000 pacientes)
Fiebre
En el caso de niños no tratados previamente con medicamentos que contengan factor VIII, los anticuerpos bloqueadores (ver punto 2) pueden producirse muy frecuentemente (más de 1 de cada 10 pacientes). Sin embargo, en pacientes que han sido tratados previamente con factor VIII (más de 150 días de tratamiento), el riesgo es poco frecuente (menos de 1 de cada 100 pacientes). Si esto sucede, los medicamentos del paciente pueden dejar de funcionar correctamente y el paciente puede experimentar una hemorragia persistente. Si esto sucede, debe consultar de inmediato a su médico.
Información relacionada con la seguridad viral, ver punto 2. (Debe tener especial cuidado al utilizar Pharmavate).
Notificación de efectos no deseados
Si experimenta alguno de los siguientes efectos no deseados, incluidos cualquier efecto no deseado no mencionado en este prospecto, debe informar a su médico o farmacéutico.
Los efectos no deseados pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad
Calle de Alcalá, 56
28071 Madrid
Teléfono: +34 91 596 24 88
Fax: +34 91 596 24 87
Sitio web: https://www.aemps.gob.es/
Los efectos no deseados también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos no deseados permite recopilar más información sobre la seguridad de este medicamento.
5. Cómo conservar Pharmavate
Debe conservar este medicamento en un lugar que esté fuera del alcance de los niños.
No debe utilizar este medicamento después de la fecha de caducidad indicada en la etiqueta. La fecha de caducidad se refiere al último día del mes indicado.
Debe conservar a una temperatura inferior a 25°C.
No congelar.
Debe conservar en el embalaje exterior para protegerlo de la luz.
La solución reconstituida debe utilizarse de inmediato y solo durante una administración.
No debe utilizar este medicamento si observa que la solución es turbia o no se ha disuelto completamente.
No debe tirar los medicamentos por el desagüe ni a los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no necesita. Este comportamiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Pharmavate
El principio activo de este medicamento es el factor de coagulación sanguínea humano VIII.
Volúmenes y concentraciones
| Tamaño del frasco con polvo de Pharmavate | Tamaño del frasco con disolvente | Concentración nominal de la solución después de la reconstitución |
| 250 UI | 5 ml | 50 UI/ml |
| 500 UI | 10 ml | 50 UI/ml |
| 1000 UI | 10 ml | 100 UI/ml |
Los demás componentes son:
Para el polvo: citrato de sodio, cloruro de sodio, cloruro de calcio, glicina
Para el disolvente: agua para inyección
Cómo se presenta Pharmavate y contenido del paquete
Pharmavate se presenta en forma de polvo y disolvente para la preparación de una solución para inyección.
Polvere blanco o amarillento claro, o masa quebradiza.
El disolvente es un líquido claro e incoloro.
Hay tres tamaños de paquetes disponibles que difieren en el contenido de factor VIII y disolvente:
- 250 UI/frasco: después de la reconstitución en 5 ml, la concentración es de 50 UI/ml
- 500 UI/frasco: después de la reconstitución en 10 ml, la concentración es de 50 UI/ml
- 1000 UI/frasco: después de la reconstitución en 10 ml, la concentración es de 100 UI/ml
Todos los tamaños de paquetes contienen:
1 sistema de transferencia Mix2Vial, 1 jeringa de un solo uso, 1 aguja para inyecciones y 2 hisopos con alcohol
o
1 conjunto de transferencia (1 aguja de doble punta y 1 aguja filtrante), 1 jeringa de un solo uso, 1 aguja para inyecciones y 2 hisopos con alcohol.
No todos los tamaños de paquetes deben estar disponibles en el mercado.
Titular de la autorización de comercialización
Octapharma (IP) SPRL
Ruta de Lennik 451
1070 Anderlecht
Bélgica
Fabricante
Octapharma Pharmazeutika Produktionsges.m.b.H
Oberlaaer Str. 235
1100 Viena
Austria
Octapharma S.A.S
72 Rue du Maréchal Foch
67380 Lingolsheim
Francia
Octapharma AB
112 75 Estocolmo
Suecia
Fecha de la última actualización del prospecto: 01.01.2025
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorOctapharma AB Octapharma Pharmazeutika Produktionsges.m.g.H. Octapharma S.A.S.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a PiarmavateForma farmacéutica: Polvo, 1000 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere recetaForma farmacéutica: Polvo, 2000 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere recetaForma farmacéutica: Polvo, 250 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere receta
Alternativas a Piarmavate en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Piarmavate en España
Alternativa a Piarmavate en Ucrania
Médicos online para Piarmavate
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Piarmavate – sujeta a valoración médica y normativa local.














