

Letibo

Consulta con un médico sobre la receta médica de Letibo

Cómo usar Letibo
Hoja de instrucciones del paquete: información para el usuario
Letybo
Toxina botulínica tipo A
50 unidades, polvo para preparar solución para inyección
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- Si tiene alguna duda, debe consultar a su médico o farmacéutico.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Letybo y para qué se utiliza
- 2. Información importante antes de usar Letybo
- 3. Cómo usar Letybo
- 4. Posibles efectos adversos
- 5. Cómo conservar Letybo
- 6. Contenido del paquete y otra información
1. Qué es Letybo y para qué se utiliza
Letybo contiene la sustancia activa toxina botulínica tipo A. Su acción consiste en bloquear los impulsos nerviosos que se transmiten a los músculos en los que se inyecta. Evita la contracción de los músculos, lo que lleva a su parálisis temporal. Letybo se utiliza en adultos menores de 75 años para mejorar temporalmente la apariencia de arrugas moderadas o profundas verticales entre las cejas, cuando su presencia tiene un impacto significativo en la psique del paciente.
2. Información importante antes de usar Letybo
Cuándo no usar Letybo:
- si el paciente es alérgico a la toxina botulínica tipo A o a cualquier otro componente de este medicamento (enumerado en el punto 6);
- si el paciente tiene trastornos musculares, como miastenia gravis, síndrome de Lambert-Eaton o esclerosis lateral amiotrófica;
- si el paciente tiene una infección aguda o inflamación en el sitio de inyección planificado.
Precauciones y advertencias
Antes de comenzar a usar Letybo, debe discutir con su médico si tiene:
- cualquier trastorno que afecte los músculos o su control directo por el sistema nervioso;
- dificultades para tragar o respirar, actualmente o en el pasado;
- trastornos de coagulación.
Si el paciente tiene estos trastornos en su historial, Letybo no se recomienda. El dolor asociado con la inyección o el miedo a las inyecciones puede causar mareo debido a una caída repentina de la presión arterial. Raramente se han notificado efectos adversos asociados con la propagación de la toxina botulínica a sitios distantes del sitio de inyección, como debilidad muscular excesiva. Los trastornos de deglución y respiración son reacciones graves que pueden causar la muerte. Debe instruir a los pacientes o sus cuidadores para que busquen atención médica de inmediato si experimentan trastornos de deglución, habla o respiración.
Niños y adolescentes
No se debe usar Letybo en niños y adolescentes menores de 18 años.
Letybo y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté usando actualmente o recientemente, así como sobre los medicamentos que planea usar. Pueden ocurrir interacciones entre Letybo y medicamentos:
- que interfieren con la transmisión de impulsos nerviosos a los músculos;
- usados para tratar infecciones bacterianas, como la espectinomicina o los antibióticos aminoglucósidos;
- que contienen toxina botulínica disponible en otros medicamentos.
Embarazo y lactancia
Si la paciente está embarazada o en período de lactancia, o si cree que podría estar embarazada o planea tener un hijo, debe consultar a su médico antes de usar este medicamento. No se recomienda el uso de Letybo durante el embarazo o la lactancia, así como en mujeres en edad reproductiva que no utilicen un método anticonceptivo efectivo.
Conducción de vehículos y uso de maquinaria
La toxina botulínica tipo A puede causar debilidad, mareo y trastornos visuales. En tales casos, con capacidad de reacción limitada, no se debe conducir vehículos ni operar maquinaria.
Letybo contiene sodio
El medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis, es decir, se considera "exento de sodio".
3. Cómo usar Letybo
Las unidades de toxina botulínica mencionadas en esta hoja de instrucciones se refieren exclusivamente a Letybo. No se pueden usar de forma intercambiable con las unidades de toxina botulínica de otros medicamentos. Letybo solo puede ser administrado por un médico calificado que tenga el equipo adecuado para dicho procedimiento. La descripción detallada de la preparación de la solución y las instrucciones de uso se describen en el punto "Información destinada exclusivamente al personal médico especializado" al final de esta hoja de instrucciones.
Dosis recomendada
20 unidades divididas en cinco inyecciones de 0,1 mL (4 unidades). Cada inyección se administra en el músculo situado sobre o entre las cejas. Letybo es un medicamento para inyección intramuscular (i.m.). Después de la preparación de la solución para inyección, el frasco solo puede ser utilizado durante una sesión en un solo paciente. El solución no utilizada debe ser eliminado de acuerdo con la descripción en el punto 6 en la información destinada exclusivamente al personal médico especializado. Se recomienda mantener un intervalo de al menos tres meses entre dos sesiones de tratamiento con Letybo.
Uso de una dosis mayor que la recomendada de Letybo
La sobredosis puede causar parálisis muscular o nerviosa. Los síntomas de sobredosis pueden aparecer inmediatamente después de la inyección. En caso de sobredosis, el médico observará al paciente en busca de síntomas como debilidad general o parálisis muscular. Debe buscar atención médica de inmediato o acudir al hospital si aparecen síntomas de intoxicación por toxina botulínica tipo A, como:
- debilidad general,
- caída del párpado superior o visión doble,
- trastornos de deglución y habla,
- parálisis parcial de los músculos respiratorios.
Si tiene alguna duda adicional sobre el uso de este medicamento, debe consultar a su médico o farmacéutico.
4. Posibles efectos adversos
Como cualquier medicamento, Letybo puede causar efectos adversos, aunque no todos los pacientes los experimentarán. La mayoría de los efectos adversos son de intensidad leve a moderada, ocurren dentro de los primeros días después de la inyección y son de naturaleza transitoria.
Algunos efectos adversos pueden ser muy graves. Si experimenta alguno de los siguientes efectos adversos, debe contactar a su médico de inmediato o pedir a sus familiares que lo hagan y acudir a la sala de emergencias más cercana:
Muy frecuentes, pueden ocurrir en más de 1 de cada 10 pacientes
- dolor de cabeza,
- reacciones en el sitio de inyección.
Frecuentes, pueden ocurrir en más de 1 de cada 100 pacientes
- malestar en la cabeza,
- hinchazón local, como en el párpado, la cara o alrededor de los ojos,
- dolor, moretones, hinchazón, picazón, infiltrados, presión en el sitio de inyección,
- moretones, como alrededor de los ojos,
- infecciones, como infecciones virales del tracto respiratorio superior, como resfriados,
- efecto de Mefistófeles (elevación de las partes laterales de las cejas).
Poco frecuentes, pueden ocurrir en más de 1 de cada 1.000 pacientes
- migraña,
- infección del folículo piloso,
- mareo,
- sensaciones anormales, como pinchazos, hormigueo y picazón,
- náuseas,
- sequedad de la piel, urticaria, picazón,
- dolor facial,
- fiebre,
- herpes labial,
- aumento de potasio en la sangre,
- síntomas similares a los de la gripe.
Notificación de efectos adversos
Si ocurren algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico. Los efectos adversos se pueden notificar directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad, o también al titular del medicamento. Al notificar los efectos adversos, se pueden recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Letybo
El medicamento debe conservarse en un lugar que no sea accesible para los niños. No use este medicamento después de la fecha de caducidad que aparece en el cartón y la etiqueta, después de "EXP". La fecha de caducidad es el último día del mes indicado. Conservar en refrigerador (2°C – 8°C). Solución después de la reconstitución. Se ha demostrado que el producto listo para usar mantiene su estabilidad química y física durante 24 horas a 2°C. Desde el punto de vista microbiológico, se recomienda usar el producto de inmediato. Si el producto no se usa de inmediato, el usuario es responsable del tiempo y las condiciones de almacenamiento de la solución lista para usar, que generalmente no debe exceder las 24 horas a 2°C - 8°C, a menos que la reconstitución/dilución se haya realizado en condiciones asépticas controladas y validadas. La solución para inyección que se almacena durante más de 24 horas debe ser eliminada. Los medicamentos no deben tirarse por el desagüe ni a los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se necesitan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Letybo
- La sustancia activa del medicamento es toxina botulínica tipo A.
- Un frasco contiene 50 unidades de toxina botulínica tipo A producida por Clostridium botulinum.
- Después de la preparación de la solución, cada dosis de 0,1 mL contiene 4 unidades.
- Los excipientes son albumina humana y cloruro de sodio.
Cómo se presenta Letybo y contenido del paquete
Letybo es un polvo blanco para preparar solución para inyección, que se suministra en un frasco de vidrio transparente de 5 mL (vidrio tipo I) con un tapón de goma de clorobutilo, protegido por una cápsula de aluminio, en una caja de cartón. El paquete individual contiene un frasco o dos frascos. El paquete colectivo contiene 2 cajas de cartón; cada caja de cartón contiene un frasco. El paquete colectivo contiene 6 cajas de cartón; cada caja de cartón contiene un frasco. No todas las tallas de paquete deben estar en circulación.
Título del responsable
Croma-Pharma GmbH
Industriezeile 6
2100 Leobendorf
Austria
Correo electrónico: [email protected]
Teléfono: +43 2262 684 68-0
Fabricante
Croma-Pharma GmbH
Cromazeile 2
2100 Leobendorf
Austria
Fecha de la última actualización de la hoja de instrucciones: 07/2023
---------------------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente al personal médico especializado:
Las unidades de toxina botulínica de este producto no pueden ser intercambiadas con las unidades de toxina botulínica de otros productos. Las dosis recomendadas expresadas en unidades son diferentes de las dosis de otros productos que contienen toxina botulínica. Debe seguir estrictamente las instrucciones para la administración, preparación y eliminación del medicamento.
Preparación de la solución
La reconstitución debe realizarse de acuerdo con las normas de buena práctica clínica, en particular con la técnica aséptica. Para la reconstitución, se agrega 1,25 mL de solvente - solución de cloruro de sodio para inyección al 9 mg/mL (0,9%) al medicamento Letybo. Es una buena práctica preparar la solución y preparar la jeringa sobre un paño de papel cubierto con plástico en caso de derrame del producto. La solución de cloruro de sodio al 9 mg/mL (0,9%) para inyección se debe extraer en una jeringa y se debe inyectar suavemente en el frasco para evitar la formación de espuma/burbujas de aire y el mezclado enérgico de la solución, lo que podría causar la denaturación. Debe desechar el frasco si no se produce la succión del solvente en el frasco bajo vacío. La solución reconstituida de Letybo debe ser transparente, incolora y no contener partículas sólidas. Antes de usar, el frasco debe ser inspeccionado para asegurarse de que el producto no contiene partículas sólidas. No debe usar Letybo si la solución reconstituida no es transparente o contiene partículas sólidas. Solución después de la reconstitución. Se ha demostrado que el producto listo para usar mantiene su estabilidad química y física durante 24 horas a 2°C. Desde el punto de vista microbiológico, se recomienda usar el producto de inmediato. Si el producto no se usa de inmediato, el usuario es responsable del tiempo y las condiciones de almacenamiento de la solución lista para usar, que generalmente no debe exceder las 24 horas a 2°C - 8°C, a menos que la reconstitución/dilución se haya realizado en condiciones asépticas controladas y validadas. La solución para inyección que se almacena durante más de 24 horas debe ser eliminada. Todos los residuos del medicamento o desechos deben ser eliminados de acuerdo con las regulaciones locales.
Instrucciones de uso
Las inyecciones intramusculares deben realizarse con una jeringa estéril para insulina o tuberculina de 1 mL con una división cada 0,01 mL y una aguja de 30 a 31 G. Debe extraer 0,5 mL de la solución de Letybo reconstituida en una jeringa estéril y eliminar cualquier burbuja de aire del cilindro. La aguja utilizada para la reconstitución del medicamento debe ser eliminada y reemplazada con una nueva para la administración del medicamento. Debe tener cuidado para no inyectar el medicamento Letybo en un vaso sanguíneo. Para evitar complicaciones en forma de ptosis (caída del párpado), debe evitar inyectar cerca del músculo elevador del párpado superior, especialmente en pacientes con un grupo más grande de músculos que bajan las cejas. Cuando se inyecta en cada uno de los músculos que arrugan las cejas, la primera inyección debe realizarse directamente sobre el borde medial de la ceja. La segunda inyección debe realizarse aproximadamente 1 cm por encima del borde supraorbitario (borde óseo duro palpable por encima de la parte superior del párpado superior), donde se encuentran las líneas medias de ambas cejas. El sitio de inyección en el músculo longitudinal de la nariz se encuentra justo por encima de la línea media de la cresta ósea de la nariz, donde se forman las arrugas horizontales entre los extremos mediales de las cejas. Cuando se realizan inyecciones en los extremos mediales del músculo que arruga las cejas y las líneas medias de las cejas, los sitios de inyección deben estar a una distancia de al menos 1 cm del borde supraorbitario (borde óseo duro palpable por encima de la parte superior del párpado superior).
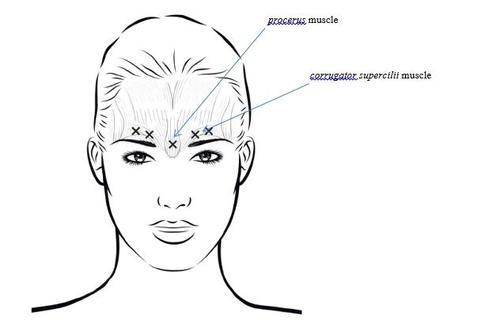
Las inyecciones deben realizarse con cuidado para evitar inyectar el producto en los vasos sanguíneos. Antes de la inyección, se puede colocar el pulgar o el dedo índice debajo del borde de la órbita y presionar firmemente para evitar que el producto se filtre en esta área. La aguja debe estar dirigida hacia arriba y hacia adentro. Si el procedimiento no tiene éxito después de un mes desde la primera serie de procedimientos, es decir, en caso de no encontrar una mejora significativa con respecto al estado inicial, se puede considerar lo siguiente:
- análisis de las causas del fracaso, es decir, inyección en músculos incorrectos, uso de una técnica de inyección inadecuada, formación de anticuerpos que neutralizan la toxina, dosis insuficiente;
- re-evaluación de la justificación para el uso de toxina botulínica tipo A.
Si no ocurren efectos adversos después de la sesión de tratamiento anterior, se puede realizar una sesión adicional siempre que se mantenga un intervalo de al menos tres meses entre ellas.
Procedimiento para la eliminación segura de frascos usados, jeringas y materiales
Para la eliminación segura del producto Letybo no reconstituido, debe someterse a reconstitución en el frasco con una pequeña cantidad de agua y luego someterse a esterilización en un autoclave. Los frascos vacíos, los frascos que contienen restos de solución, las jeringas y los objetos contaminados con la solución deben someterse a esterilización en un autoclave. Como alternativa, se puede inactivar cualquier residuo del producto Letybo mediante la adición de una solución diluida de hidróxido de sodio (0,1 N NaOH) o una solución diluida de hipoclorito de sodio (0,5% o 1% NaOCl). Después de la inactivación, los frascos usados, las jeringas y los materiales no deben ser vaciados sino que deben ser colocados en contenedores adecuados y eliminados de acuerdo con las regulaciones locales.
Recomendaciones para procedimientos en caso de eventos imprevistos durante la administración de toxina botulínica
- Cualquier fuga del producto debe ser eliminada: usando un material absorbente empapado en una solución de hipoclorito de sodio (en el caso del polvo) o un material absorbente seco en el caso del producto después de la reconstitución.
- Las superficies contaminadas deben ser frotadas con un material absorbente empapado en una solución de hipoclorito de sodio y luego secadas.
- Si el frasco se rompe, debe seguir las instrucciones anteriores. Debe recoger con cuidado los fragmentos de vidrio roto y limpiar los restos del producto evitando cortes.
- Si el producto entra en contacto con la piel, debe lavarla con una solución de hipoclorito de sodio y luego enjuagarla abundantemente con agua.
- En caso de que el producto entre en contacto con los ojos, debe enjuagarlos con una gran cantidad de agua o una solución para enjuagar los ojos.
- Si el producto entra en contacto con una herida, corte o fisura en la piel, debe enjuagar la zona con una gran cantidad de agua y luego tomar las medidas médicas adecuadas según la dosis a la que estuvo expuesta la persona.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorCroma-Pharma GmbH
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a LetiboForma farmacéutica: Solución, 200 U Speywood/mlPrincipio activo: Botulinum toxinRequiere recetaForma farmacéutica: Polvo, 125 unidades SpeywoodPrincipio activo: Botulinum toxinRequiere recetaForma farmacéutica: Polvo, 125 unidades SpeywoodPrincipio activo: Botulinum toxinRequiere receta
Alternativas a Letibo en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Letibo en Ucrania
Alternativa a Letibo en España
Médicos online para Letibo
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Letibo – sujeta a valoración médica y normativa local.














