
Immunate 250 Iu Fviii/190 Iu Vvf
Consulta con un médico sobre la receta médica de Immunate 250 Iu Fviii/190 Iu Vvf

Cómo usar Immunate 250 Iu Fviii/190 Iu Vvf
Hoja de instrucciones para el paciente
Immunate 250 IU FVIII/ 190 IU VWF polvo y disolvente para preparar una solución inyectable
Para inyección
factor de coagulación humana VIII / factor de von Willebrand humano
Es importante leer detenidamente el folleto antes de usar el medicamento, ya que contiene información importante para el paciente.
- Conservar este folleto para poder volver a leerlo si es necesario.
- En caso de dudas, consultar al médico o farmacéutico.
- Este medicamento ha sido prescrito específicamente para esta persona. No debe ser transferido a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos todos los efectos adversos no mencionados en este folleto, debe informar a su médico o farmacéutico. Ver punto 4.
Índice del folleto
- 1. Qué es Immunate 250 IU FVIII/ 190 IU VWF y para qué se utiliza
- 2. Información importante antes de usar Immunate 250 IU FVIII/ 190 IU VWF
- 3. Cómo usar Immunate 250 IU FVIII/ 190 IU VWF
- 4. Posibles efectos adversos
- 5. Cómo conservar Immunate 250 IU FVIII/ 190 IU VWF
- 6. Contenido del envase y otra información
1. Qué es Immunate 250 IU FVIII/ 190 IU VWF y para qué se utiliza
Qué es Immunate 250 IU FVIII/ 190 IU VWF
Immunate es un complejo de factor de coagulación VIII/factor de von Willebrand, producido a partir de plasma humano. El factor de coagulación VIII contenido en Immunate reemplaza el factor VIII faltante o defectuoso en la hemofilia A. La hemofilia A es un trastorno hereditario de la coagulación de la sangre, causado por una disminución del nivel de factor VIII. Esto conduce a sangrados graves en las articulaciones, músculos y órganos internos, que ocurren espontáneamente o como resultado de lesiones accidentales o después de cirugías. La administración de Immunate reemplaza temporalmente la falta de factor VIII y reduce la tendencia a sangrar. Además de su acción como proteína protectora del factor VIII, el factor de von Willebrand (VWF) media en el proceso de adhesión de las plaquetas en el sitio de lesión del vaso y juega un papel en la agregación de las plaquetas.
Para qué se utiliza Immunate 250 IU FVIII/ 190 IU VWF
Immunate se utiliza para el tratamiento y la prevención de sangrados en la deficiencia congénita (hemofilia A) o adquirida de factor VIII. Immunate también se utiliza para el tratamiento de sangrados en pacientes con enfermedad de von Willebrand con deficiencia de factor VIII, si no hay disponible ningún producto específico eficaz para la enfermedad de von Willebrand y cuando el tratamiento con solo desmopresina (DDAVP) es ineficaz o contraindicado.
2. Información importante antes de usar Immunate 250 IU FVIII/ 190 IU VWF
Cuándo no usar Immunate 250 IU FVIII/ 190 IU VWF
- Si el paciente es alérgico al factor de coagulación humana VIII o a cualquiera de los demás componentes de este medicamento (enumerados en el punto 6). En caso de duda, consultar al médico.
Precauciones y advertencias
En caso de reacciones alérgicas:
- Existe una pequeña probabilidad de una reacción anafiláctica (reacción alérgica grave) al medicamento Immunate. El paciente debe estar familiarizado con los primeros síntomas de reacciones alérgicas, como enrojecimiento facial repentino, erupción, urticaria, ampollas urticarianas, picazón generalizada, hinchazón de los labios, párpados y lengua, dificultad para respirar, respiración silbante, dolor en el pecho, sensación de opresión en el pecho, malestar general, mareos, taquicardia y presión arterial baja. Estos síntomas pueden ser los primeros signos de un choque anafiláctico, que también puede incluir mareos severos, pérdida de conciencia y dificultad para respirar severa.
- En caso de que ocurra alguno de estos síntomas, debe interrumpirse inmediatamente la inyección/infusión y consultar al médico. Los síntomas graves, incluyendo dificultad para respirar y casi pérdida de conciencia, requieren tratamiento inmediato como en casos de emergencia.
Cuando se requiere monitoreo del tratamiento:
- El médico puede solicitar pruebas para asegurarse de que la dosis actual es suficiente para lograr y mantener los niveles adecuados de factor VIII y factor de von Willebrand.
Si el sangrado continúa:
- La formación de inhibidores (anticuerpos) es una complicación conocida que puede ocurrir durante el tratamiento con todos los medicamentos que contienen factor VIII. Estos inhibidores, especialmente a altas concentraciones, interrumpen el tratamiento efectivo y el paciente será monitoreado cuidadosamente para detectar la formación de estos inhibidores. Si el sangrado del paciente no se controla adecuadamente con el medicamento Immunate, debe informar inmediatamente a su médico. Los pacientes con enfermedad de von Willebrand, especialmente aquellos con tipo 3, pueden producir anticuerpos neutralizantes (inhibidores) contra el factor de von Willebrand. El médico puede solicitar pruebas para confirmar su presencia. Los inhibidores contra el factor de von Willebrand son anticuerpos en la sangre que bloquean el factor de von Willebrand administrado. Por lo tanto, el factor de von Willebrand es menos efectivo para controlar el sangrado. En el caso de medicamentos producidos a partir de sangre o plasma humano, se toman medidas preventivas adecuadas para evitar la transmisión de infecciones a los pacientes. Estas medidas incluyen la selección cuidadosa de donantes de sangre y plasma para asegurarse de que se excluyan personas con riesgo de ser portadoras de infecciones, la prueba de cada lote de sangre donada y plasma para detectar virus/infecciones, y la inclusión en el proceso de procesamiento de sangre o plasma de procedimientos que inactivan o eliminan virus. A pesar de la implementación de estas medidas, al administrar medicamentos derivados de sangre o plasma humano, no se puede excluir completamente la posibilidad de transmisión de infecciones. Esto incluye infecciones desconocidas o recientemente descubiertas.
Las medidas utilizadas se consideran efectivas contra virus envueltos, como el virus de la inmunodeficiencia humana (VIH), el virus de la hepatitis B y C, y el virus de la hepatitis A no envuelto. Las medidas pueden tener una eficacia limitada contra virus no envueltos, como el parvovirus B19. La infección por parvovirus B19 puede tener consecuencias graves para las mujeres embarazadas (infección del feto) y para los pacientes con deficiencias del sistema inmunológico o con ciertos tipos de anemia (por ejemplo, esferocitosis congénita o anemia hemolítica). En caso de administración regular o múltiple de productos que contienen factor VIII derivados de plasma humano, el médico puede recomendar la vacunación contra la hepatitis A y B. Es especialmente recomendable que, en cada administración de una dosis de Immunate, se anote el nombre y el número de lote del producto en el registro del paciente. Immunate contiene isoaglutininas de grupos sanguíneos (anti-A y anti-B). En pacientes con grupo sanguíneo A, B o AB, puede ocurrir hemólisis debido a la administración repetida en un corto período de tiempo o a la administración de dosis muy grandes.
Niños
El producto debe usarse con precaución en niños menores de 6 años que han estado expuestos de manera limitada a productos que contienen factor VIII, ya que los datos clínicos sobre este grupo de pacientes son limitados.
Immunate 250 IU FVIII/ 190 IU VWF y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que está tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar. No se han reportado interacciones entre el medicamento Immunate y otros medicamentos. No se debe mezclar el medicamento Immunate con otros medicamentos o disolventes antes de la administración, excepto con el agua para inyección suministrada, ya que podrían afectar negativamente la eficacia y seguridad del producto. Se recomienda enjuagar el acceso venoso con una solución adecuada, como solución salina, antes y después de la inyección de Immunate.
Immunate 250 IU FVIII/ 190 IU VWF con alimentos y bebidas
No hay recomendaciones especiales sobre la administración de Immunate en relación con las comidas.
Embarazo, lactancia y fertilidad
Dado que la hemofilia A es rara en mujeres, no hay experiencia sobre el uso de Immunate durante el embarazo, la lactancia y su impacto en la fertilidad. Immunate debe usarse durante el embarazo y la lactancia solo si está justificado. Si la paciente está embarazada o en período de lactancia, cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de usar este medicamento.
Conducción de vehículos y uso de máquinas
No hay información sobre el efecto de Immunate en la capacidad para conducir vehículos o operar máquinas.
Immunate 250 IU FVIII/ 190 IU VWF contiene sodio
El medicamento contiene 9,8 mg de sodio (principal componente de la sal común) en cada vial. Esto equivale al 0,5% de la dosis máxima recomendada de sodio en la dieta para adultos.
3. Cómo usar Immunate 250 IU FVIII/ 190 IU VWF
El tratamiento debe ser supervisado por un médico con experiencia en el tratamiento de trastornos de la coagulación.
Este medicamento siempre debe usarse según las indicaciones del médico. En caso de dudas, consultar al médico.
Dosis para la prevención de sangrados
Si el medicamento Immunate se usa para prevenir sangrados, la dosis será calculada por el médico. Esto se hará considerando las necesidades individuales del paciente. La dosis usual es de 20 a 40 UI de factor VIII por kilogramo de peso corporal, administrada en intervalos de 2 a 3 días. Sin embargo, en algunos casos, especialmente en pacientes más jóvenes, pueden ser necesarios intervalos más cortos entre dosis o dosis más altas. Si el paciente siente que el efecto del medicamento Immunate es demasiado débil, debe consultar a su médico.
Dosis para el tratamiento de sangrados
Si el medicamento Immunate se usa para tratar sangrados, la dosis será calculada por el médico. Esto se hará considerando las necesidades individuales del paciente. Si el paciente siente que el efecto del medicamento Immunate es demasiado débil, debe consultar a su médico.
Monitoreo del tratamiento por el médico
Para asegurarse de que los niveles de factor VIII sean suficientes, el médico realizará las pruebas de laboratorio adecuadas. Esto es especialmente importante en caso de cirugías importantes.
Dosis en la enfermedad de von Willebrand
El médico se encargará de controlar los sangrados según las pautas para la hemofilia A.
Vía y/o método de administración
El medicamento Immunate se administra por vía intravenosa después de preparar la solución con el disolvente suministrado. Debe seguirse estrictamente las indicaciones del médico. Para reconstituir el producto, debe usarse solo el kit de administración suministrado con el envase, ya que la adsorción del factor de coagulación humano VIII en las superficies internas de algunos kits de infusión puede llevar a un fallo en la terapia. El medicamento Immunate debe reconstituirse justo antes de la administración. La solución debe usarse de inmediato, ya que no contiene conservantes.
Reconstitución del polvo para preparar la solución inyectable ¡Usar técnica aséptica!
- 1. Calentar el frasco no abierto que contiene el disolvente (agua para inyección) a temperatura ambiente (hasta 37°C).
- 2. Retirar las tapas protectoras de los frascos que contienen el polvo y el disolvente (fig. A) y limpiar los tapones de goma de ambos frascos.
- 3. Colocar el extremo ondulado del kit de transferencia en el frasco del disolvente y presionar (fig. B).
- 4. Retirar la cubierta protectora del otro extremo del kit de transferencia, teniendo cuidado de no tocar el extremo expuesto.
- 5. Invertir el kit de transferencia con el frasco del disolvente conectado sobre el frasco que contiene el polvo y insertar la aguja libre a través del tapón de goma del frasco que contiene el polvo (fig. C). El disolvente será succionado por el vacío en el frasco que contiene el polvo.
- 6. Después de aproximadamente un minuto, separar los frascos retirando el kit de transferencia con el frasco del disolvente del frasco que contiene el polvo (fig. D). Dado que la reconstitución ocurre fácilmente, no se debe agitar enérgicamente el frasco que contiene el concentrado o no agitarlo en absoluto. NO AGITAR EL CONTENIDO DEL FRASCO. NO INVERTIR EL FRASCO QUE CONTIENE EL POLVO HASTA QUE ESTÉ LISTO PARA TRANSFERIR EL CONTENIDO.
- 7. Después de la reconstitución, antes de la administración, inspeccionar la solución preparada para detectar la presencia de partículas no disueltas y cambios de color. La solución debe ser clara o ligeramente opalescente. Sin embargo, incluso si se siguió estrictamente el procedimiento de reconstitución, puede ocurrir que se observe una pequeña cantidad de partículas finas. El kit de filtración suministrado eliminará las partículas, y la potencia del medicamento indicada en el envase no se reducirá. La solución que es turbia o contiene sedimento debe ser descartada. No se debe volver a refrigerar la solución preparada para su uso.
Administración ¡Usar técnica aséptica!
Usar el kit de filtración suministrado para evitar la administración de partículas de goma procedentes del tapón (riesgo de microembolia). Para extraer el producto reconstituido, colocar el kit de filtración en la jeringa de un solo uso y introducirlo a través del tapón de goma (fig. E). Desconectar la jeringa del kit de filtración por un momento. El aire entrará en el frasco que contiene el polvo, y cualquier espuma presente se asentará. A través del kit de filtración (fig. F), extraer la solución a la jeringa. Desconectar la jeringa del kit de filtración y administrar lentamente la solución por vía intravenosa (velocidad máxima de inyección: 2 ml por minuto) utilizando el kit de infusión suministrado - aguja de mariposa (o la aguja de un solo uso suministrada).
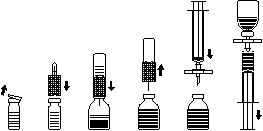
Fig. A
Fig. B
Fig. C
Fig. D
Fig. E
Fig. F
Cualquier residuo no utilizado del producto o sus desechos debe eliminarse de acuerdo con las regulaciones locales. La administración de Immunate debe documentarse, y el número de lote debe registrarse. Con cada frasco se suministra una etiqueta adhesiva que se adjunta a la documentación.
Frecuencia de administración
El médico informará sobre la frecuencia y los intervalos de tiempo para tomar el medicamento Immunate. Esto se determinará considerando la eficacia del tratamiento para cada paciente individual.
Duración del tratamiento
Por lo general, el tratamiento sustitutivo con el medicamento Immunate se administra durante toda la vida.
Uso de una dosis mayor de la recomendada de Immunate 250 IU FVIII/ 190 IU VWF
- No se han reportado síntomas de sobredosis de factor de coagulación VIII. En caso de duda, consultar al médico.
- Pueden ocurrir incidentes tromboembólicos.
- Puede ocurrir hemólisis en pacientes con grupo sanguíneo A, B o AB.
Omision de la administración de Immunate 250 IU FVIII/ 190 IU VWF
- No debe administrarse una dosis doble para compensar una dosis omitida.
- Debe tomarse la siguiente dosis habitual y continuar el tratamiento en los intervalos de tiempo recomendados por el médico.
Interrupción del tratamiento con Immunate 250 IU FVIII/ 190 IU VWF
No debe decidirse interrumpir el tratamiento con Immunate sin consultar al médico. En caso de cualquier otra pregunta relacionada con el uso de este medicamento, debe consultar a su médico.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Efectos adversos graves que pueden ocurrir después del uso de productos de factor VIII derivados de plasma humano
Factor de coagulación VIII
Raramente se han observado reacciones alérgicas, que en algunos casos han llevado a reacciones graves y potencialmente mortales (anafilaxia). Por lo tanto, es importante familiarizarse con los primeros síntomas de reacciones alérgicas, como enrojecimiento facial repentino, erupción, urticaria, ampollas urticarianas, picazón generalizada, hinchazón de los labios y la lengua, dificultad para respirar, respiración silbante, dolor en el pecho, sensación de opresión en el pecho, malestar general, mareos, taquicardia y presión arterial baja. Estos síntomas pueden ser los primeros signos de un choque anafiláctico. En caso de que ocurra cualquier reacción alérgica o anafiláctica, debe interrumpirse inmediatamente la inyección/infusión y notificar al médico. Los síntomas graves requieren tratamiento inmediato como en casos de emergencia. En niños no tratados previamente con medicamentos que contienen factor VIII, los anticuerpos bloqueantes (ver punto 2) pueden desarrollarse con mucha frecuencia (más de 1 de cada 10 pacientes). Sin embargo, en pacientes que han sido tratados previamente con factor VIII (más de 150 días de tratamiento), el riesgo es poco frecuente (menos de 1 de cada 100 pacientes). Si esto ocurre, los medicamentos del paciente pueden dejar de funcionar correctamente y el paciente puede experimentar un sangrado persistente. Si esto ocurre, debe comunicarse inmediatamente con el médico. La formación de anticuerpos neutralizantes contra el factor de von Willebrand es una complicación conocida del tratamiento de personas con enfermedad de von Willebrand. Si se desarrollan anticuerpos neutralizantes (inhibidores), puede manifestarse como un resultado clínico insuficiente del tratamiento (sangrado no controlado con la dosis adecuada) o como una reacción alérgica. En estos casos, se recomienda contactar a un centro especializado en el tratamiento de la hemofilia. Después de la administración de dosis grandes, puede ocurrir hemólisis en pacientes con grupo sanguíneo A, B o AB.
Efectos adversos reportados después del uso de Immunate Muy frecuentes (pueden ocurrir en más de 1 de cada 10 pacientes)
- inhibición del factor VIII (en niños que no han sido tratados previamente con medicamentos que contienen factor VIII). Poco frecuentes (pueden ocurrir en hasta 1 de cada 100 pacientes)
- hipersensibilidad;
- inhibición del factor VIII [en pacientes que han sido tratados previamente con factor VIII (tratamiento que dura más de 150 días)]. Frecuencia desconocida (la frecuencia no puede determinarse a partir de los datos disponibles)
- trastornos de la coagulación (incapacidad para formar coágulos);
- ansiedad;
- parestesia (sensación de hormigueo o picazón);
- mareos;
- dolor de cabeza;
- conjuntivitis;
- taquicardia (frecuencia cardíaca acelerada);
- palpitaciones;
- hipotensión (presión arterial baja);
- enrojecimiento facial repentino;
- palidez (apariencia pálida);
- dificultad para respirar;
- tos;
- vómitos;
- náuseas;
- urticaria (erupción urticariana en todo el cuerpo);
- erupción;
- picazón (sensación de picazón);
- rubor (enrojecimiento de la piel);
- transpiración excesiva;
- dermatitis atópica (piel seca o picazón);
- dolor muscular;
- dolor en el pecho;
- sensación de malestar en el pecho;
- edema (retención de líquidos);
- fiebre;
- escalofríos;
- ardor y picazón en el sitio de inyección (reacciones en el sitio de inyección);
- dolor.
Notificación de efectos adversos
Si ocurren cualquier efecto adverso, incluidos todos los efectos adversos no mencionados en este folleto, debe informar a su médico o farmacéutico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Productos Farmacéuticos de la Agencia de Registro de Productos Farmacéuticos, Dispositivos Médicos y Productos Biocidas Al. Jerozolimskie 181 C 02-222 Varsovia Tel.: +48 22 49 21 301 Fax: +48 22 49 21 309 Sitio web: https://smz.ezdrowie.gov.pl Los efectos adversos también pueden notificarse al titular de la autorización de comercialización. Al notificar los efectos adversos, se puede recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Immunate 250 IU FVIII/ 190 IU VWF
Conservar en un lugar fuera del alcance de los niños. Conservar y transportar en condiciones refrigeradas (2°C – 8°C). No congelar. Conservar en el envase original para proteger del luz. No usar este medicamento después de la fecha de caducidad indicada en la etiqueta y el envase después de EXP. La fecha de caducidad indica el último día del mes indicado. Durante el período de validez, el producto puede conservarse a temperatura ambiente (hasta 25°C) durante un período no superior a 6 meses. Debe anotarse en el envase del producto el momento en que se inició el almacenamiento a temperatura ambiente. Después de almacenar a temperatura ambiente, el medicamento Immunate no debe volver a refrigerarse, sino usarse o desecharse de inmediato. No usar este medicamento si, después de la reconstitución, la solución es turbia o contiene sedimento. Los medicamentos no deben desecharse por el desagüe ni en los contenedores de residuos domésticos. Debe preguntar al farmacéutico cómo eliminar los medicamentos que ya no se necesitan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del envase y otra información
Qué contiene Immunate 250 IU FVIII/ 190 IU VWF
Polvo:
- Los principios activos del medicamento son el factor de coagulación humana VIII y el factor de von Willebrand humano. Cada frasco contiene nominalmente 250 UI de factor VIII y 190 UI de factor de von Willebrand obtenidos a partir de plasma humano. Después de la reconstitución en el disolvente suministrado, el producto contiene aproximadamente 50 UI/ml de factor VIII de plasma humano y 38 UI/ml de factor de von Willebrand de plasma humano.
- Los demás componentes son albúmina humana, glicina, cloruro de sodio, citrato de sodio, clorhidrato de lisina y cloruro de calcio.
Disolvente:
- Agua para inyección
Cómo se presenta Immunate 250 IU FVIII/ 190 IU VWF y qué contiene el envase
Polvo y disolvente para preparar una solución inyectable. Polvo blanco o amarillo claro, o masa cristalizada. El polvo y el disolvente están disponibles en frascos de un solo uso de vidrio, Ph. Eur. (polvo: vidrio tipo II; disolvente: vidrio tipo I), cerrados con tapones de goma de butilo, Ph. Eur. Cada envase contiene: 1 frasco de Immunate 250 IU FVIII/ 190 IU VWF 1 frasco con agua para inyección (5 ml) 1 kit de transferencia o filtración 1 jeringa de un solo uso (5 ml) 1 aguja de un solo uso 1 kit de infusión (aguja de mariposa) Tamaño del envase: 1 x 250 UI FVIII/ 190 UI VWF
Título del responsable y fabricante
Responsable
Takeda Pharma Sp. z o.o. ul. Prosta 68 00-838 Varsovia
Fabricante
Takeda Manufacturing Austria AG Industriestrasse 67 1221 Viena Austria
Este producto farmacéutico está autorizado para su comercialización en los países miembros del Espacio Económico Europeo bajo los siguientes nombres:
Immunate: Austria, Bulgaria, Chipre, Estonia, Finlandia, Alemania, Letonia, Lituania, Malta, Polonia, Portugal, Rumania, Eslovaquia, Eslovenia, Suecia Immunate S/D: Hungría Talate: Italia Fecha de la última actualización del folleto:12/2021 ----------------------------------------------------------------------------------
Otras fuentes de información
Información destinada exclusivamente al personal médico especializado: Dosis en hemofilia ALa dosis y la duración del tratamiento sustitutivo dependen del grado de deficiencia de factor VIII, la ubicación y la extensión del sangrado, así como del estado clínico del paciente. La dosis de factor VIII administrada se expresa en unidades internacionales (UI), referidas al estándar actual de la OMS para productos que contienen factor VIII. La actividad de factor VIII en el suero se expresa como un porcentaje (en relación con el suero humano normal) o en UI (en relación con el Estándar Internacional para el factor VIII en suero). Una unidad internacional (UI) de actividad de factor VIII es igual a la cantidad de factor VIII en un mililitro de suero humano normal. El cálculo de la dosis necesaria de factor VIII se basa en la observación empírica de que 1 UI de factor VIII por kilogramo de peso corporal aumenta la actividad de factor VIII en suero en aproximadamente un 2% de la actividad normal. La dosis necesaria se calcula según la siguiente fórmula:
Dosis necesaria = peso corporal (kg) x aumento deseado de factor VIII (%) x 0,5
La cantidad administrada, así como la frecuencia de administración, deben depender siempre de la eficacia clínica en cada caso individual. Sangrados y cirugíasEn el caso de los siguientes tipos de sangrados, la actividad de factor VIII en el momento adecuado no debe caer por debajo del nivel de actividad en suero (% de la norma o UI/dl) indicado. Al determinar la dosis en función del tipo de sangrado y la cirugía, se puede utilizar la siguiente tabla:
| Gravedad del sangrado / tipo de cirugía | Nivel de factor VIII requerido (en % de la norma) (UI/dl) | Frecuencia de dosificación (horas) / duración del tratamiento (días) |
| Sangrado leve Sangrado temprano en las articulaciones, músculos o sangrado de la boca Sangrado más grave en las articulaciones, músculos o hematoma Sangrados que ponen en peligro la vida | 20–40 30–60 60–100 | Repetir cada 12–24 horas. Al menos 1 día, hasta que el sangrado se controle según la evaluación de la desaparición del dolor o hasta que la herida se haya curado. Repetir las infusiones cada 12–24 horas durante 3–4 días o más, hasta que el dolor y la discapacidad aguda hayan desaparecido. Repetir las infusiones cada 8–24 horas, hasta que el peligro haya pasado. |
| Cirugías menores incluyendo extracción de muelas Cirugías mayores | 30–60 80–100 (pre y postoperatorio) | Cada 24 horas, al menos durante 1 día, hasta que la herida se haya curado. Repetir las infusiones cada 8–24 horas, hasta lograr una curación adecuada de la herida, luego continuar el tratamiento durante al menos 7 días adicionales para mantener la actividad de factor VIII en un nivel de 30–60% (UI/dl). |
En ciertas circunstancias (por ejemplo, en presencia de un título bajo de inhibidor), pueden ser necesarias dosis más altas que las calculadas con la fórmula. Profílaxis a largo plazoEn la profilaxis a largo plazo de sangrados en pacientes con hemofilia A grave, las dosis de factor VIII usualmente administradas son de 20 a 40 UI por kilogramo de peso corporal en intervalos de 2 a 3 días. En algunos casos, especialmente en pacientes más jóvenes, pueden ser necesarios intervalos más cortos entre dosis o dosis más altas. Dosis en la enfermedad de von WillebrandEl tratamiento sustitutivo con Immunate para controlar los sangrados se basa en las pautas para la hemofilia A. Immunate contiene una cantidad relativamente grande de factor VIII en relación con el contenido de factor de von Willebrand, por lo que el médico que lo administra debe ser consciente de que la continuación del tratamiento puede provocar un aumento excesivo de FVIII:C, lo que puede aumentar el riesgo de incidentes tromboembólicos. Niños y adolescentesEl producto debe usarse con precaución en niños menores de 6 años que han estado expuestos de manera limitada a productos que contienen factor VIII, ya que los datos sobre este grupo de pacientes son limitados. La dosis en hemofilia A en niños y adolescentes menores de 18 años se determina en función del peso corporal y, por lo tanto, generalmente se basa en las mismas pautas que para los pacientes adultos. La dosis y la frecuencia de administración deben depender siempre de la eficacia clínica en cada caso individual (ver punto 4.4). En algunos casos, especialmente en pacientes más jóvenes, pueden ser necesarios intervalos más cortos entre dosis o dosis más altas.
- País de registro
- Principio activo
- Requiere recetaNo
- ImportadorTakeda Manufacturing Austria AG
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Immunate 250 Iu Fviii/190 Iu VvfForma farmacéutica: Polvo, 1000 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere recetaForma farmacéutica: Polvo, 2000 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere recetaForma farmacéutica: Polvo, 250 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere receta
Alternativas a Immunate 250 Iu Fviii/190 Iu Vvf en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Immunate 250 Iu Fviii/190 Iu Vvf en España
Alternativa a Immunate 250 Iu Fviii/190 Iu Vvf en Ucrania
Médicos online para Immunate 250 Iu Fviii/190 Iu Vvf
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Immunate 250 Iu Fviii/190 Iu Vvf – sujeta a valoración médica y normativa local.














