
Iaemoctin 1000
Consulta con un médico sobre la receta médica de Iaemoctin 1000

Cómo usar Iaemoctin 1000
Hoja de instrucciones del paquete: información para el usuario
Haemoctin 250
Haemoctin 500
Haemoctin 1000
Polvo y disolvente para la preparación de una solución para inyección
Factor de coagulación VIII humano
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico, farmacéutico o enfermera.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si sus síntomas son los mismos que los suyos.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es Haemoctin y para qué se utiliza
- 2. Información importante antes de usar Haemoctin
- 3. Cómo usar Haemoctin
- 4. Posibles efectos adversos
- 5. Cómo conservar Haemoctin
- 6. Contenido del paquete y otra información
1. Qué es Haemoctin y para qué se utiliza
Haemoctin es un medicamento producido a partir de plasma humano. Contiene factor de coagulación VIII necesario para el proceso de coagulación de la sangre. Después de disolver el polvo en agua para inyección, la solución está lista para ser inyectada en una vena.
Haemoctin se utiliza para el tratamiento y la prevención de hemorragias en pacientes con hemofilia A (deficiencia congénita de factor VIII).
Haemoctin no contiene factor de von Willebrand en cantidades farmacológicamente efectivas, por lo que no está indicado para el tratamiento de la enfermedad de von Willebrand.
2. Información importante antes de usar Haemoctin
Cuándo no usar Haemoctin
- si el paciente es alérgico al principio activo o a alguno de los demás componentes de este medicamento (enumerados en el punto 6). La reacción alérgica puede incluir erupción, picazón, dificultad para respirar o hinchazón de la cara, los labios, la garganta o la lengua.
Advertencias y precauciones
La formación de inhibidores (anticuerpos) es una complicación conocida que puede ocurrir durante el tratamiento con todos los medicamentos que contienen factor VIII. Estos inhibidores, especialmente a concentraciones altas, interrumpen el tratamiento efectivo y el paciente será monitoreado cuidadosamente para detectar la formación de estos inhibidores. Si la hemorragia del paciente no se controla adecuadamente con Haemoctin, debe informar a su médico de inmediato.
Si el paciente tiene factores de riesgo para enfermedades cardiovasculares, el tratamiento con Haemoctin puede aumentar el riesgo cardiovascular. En caso de duda, debe consultar a su médico.
Complicaciones relacionadas con la inserción de un catéter venoso: si se requiere un dispositivo de acceso venoso central (CVAD), debe considerar el riesgo de complicaciones relacionadas con el CVAD, incluyendo infecciones locales, bacteriemia y trombosis en el sitio de inserción del catéter.
Seguridad virológica
Cuando los productos medicinales se producen a partir de sangre o plasma humano, se toman medidas para prevenir la transmisión de infecciones a los pacientes. Estas medidas incluyen:
- selección cuidadosa de donantes de sangre y plasma para garantizar la exclusión de donantes que puedan ser portadores de infecciones,
- pruebas de todas las muestras y pools de plasma para detectar la presencia de virus/infecciones,
- incorporación de etapas de procesamiento de la sangre o el plasma para inactivar o eliminar los virus. A pesar de estas medidas, en el caso de la administración de medicamentos preparados a partir de sangre o plasma humano, no se puede excluir completamente la posibilidad de transmisión de infección. Esto también se aplica a virus desconocidos o recientemente descubiertos o otros tipos de infecciones.
Las medidas adoptadas se consideran efectivas contra los virus con envoltura, como el virus de la inmunodeficiencia humana (VIH), el virus de la hepatitis B y el virus de la hepatitis C, así como contra el virus de la hepatitis A sin envoltura. Las medidas adoptadas pueden tener una eficacia limitada contra los virus sin envoltura, como el parvovirus B19. La infección por parvovirus B19 puede ser grave para las mujeres embarazadas (infección fetal) y para las personas con sistemas inmunitarios debilitados o con ciertos tipos de anemia (como la anemia falciforme o la anemia hemolítica).
Su médico puede recomendar que el paciente considere la vacunación contra el virus de la hepatitis A y B, si el paciente recibe regularmente/múltiples veces productos que contienen factor VIII producido a partir de plasma humano.
Se recomienda encarecidamente que cada vez que se administre una dosis de Haemoctin, se registre el nombre y el número de lote del medicamento, para poder determinar las series de medicamento utilizadas en el futuro.
Niños y adolescentes
Las advertencias y precauciones para el uso en adultos también se aplican a los niños y adolescentes.
Haemoctin y otros medicamentos
Debe informar a su médico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar.
No se han notificado interacciones entre Haemoctin y otros productos medicinales.
Embarazo, lactancia y fertilidad
Si la paciente está embarazada o en período de lactancia, cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico antes de usar este medicamento.
Debido a la rareza de la hemofilia A en mujeres, no hay experiencia disponible sobre el uso de factor VIII durante el embarazo o la lactancia. No se han realizado estudios en animales durante el embarazo y la lactancia.
Conducción de vehículos y uso de máquinas
Haemoctin no tiene efecto o tiene un efecto insignificante en la capacidad para conducir vehículos y usar máquinas.
Haemoctin contiene sodio
Haemoctin 250 contiene como máximo 16,1 mg (0,70 mmol) de sodio (principal componente de la sal de cocina) en cada vial. Esto corresponde al 0,81% de la ingesta diaria máxima recomendada de sodio en la dieta para adultos.
Haemoctin 500/1000 contiene como máximo 32,2 mg (1,40 mmol) de sodio (principal componente de la sal de cocina) en cada vial. Esto corresponde al 1,61% de la ingesta diaria máxima recomendada de sodio en la dieta para adultos.
3. Cómo usar Haemoctin
Haemoctin está indicado para administración intravenosa (inyección en una vena). El tratamiento debe estar bajo la supervisión de un médico con experiencia en el tratamiento de la hemofilia A. Haemoctin siempre debe usarse según las indicaciones de su médico. En caso de duda, debe volver a consultar a su médico.
La dosis y la duración del tratamiento dependen del grado de deficiencia de factor VIII, de la ubicación y la extensión de la hemorragia y del estado clínico del paciente. Su médico determinará la dosis adecuada para usted.
Debe garantizar condiciones estériles durante todos los pasos del procedimiento.
Fig. 1a
Fig. 1b
Fig. 1c
Fig. 2
Fig. 3
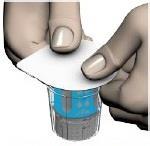

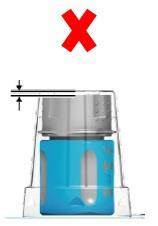


Fig. 4
Fig. 5
Fig. 6
Fig. 7
Fig. 8





Reconstitución del concentrado:
- Llevar el disolvente (agua para inyección) y el producto a temperatura ambiente en frascos no abiertos. Si se utiliza un baño de agua para calentar, tenga mucho cuidado de no permitir que el agua entre en contacto con las tapas o los tapones de los frascos. De lo contrario, puede ocurrir contaminación del medicamento.
- Muy importantepara el uso correcto del sistema de transferencia: antes de abrir, asegúrese de que la parte inferior blanca del sistema de transferencia esté colocada directamente en la base de la caja de blister (fig. 1a: correcto / fig. 1b: incorrecto). Si es incorrecto: presione el sistema de transferencia hacia abajo en la caja de blister hasta que la parte inferior blanca del sistema de transferencia esté colocada directamente en la base de la caja de blister (fig. 1c).
- Retire las tapas de los frascos del disolvente y del producto, para exponer las partes centrales de los tapones de goma (fig. 2). Limpie los tapones de goma de los frascos del producto y del disolvente con un desinfectante.
- Retire la parte superior de la cubierta del sistema de transferencia (fig. 3).
- Coloque el frasco del disolvente en una superficie plana. Coloque la parte azul del sistema de transferencia en la caja de blister directamente sobre el frasco del disolvente en posición vertical (fig. 4). No gire el sistema de transferencia.
- Retire el resto de la caja de blister del sistema de transferencia. No apriete la caja de blister. Ahora se expone la parte blanca del sistema de transferencia (fig. 5).
- Coloque el frasco del producto en una superficie plana.
- Gire el sistema de transferencia conectado y el frasco del disolvente hacia abajo. Inserte la aguja de la parte blanca del adaptador hacia abajo a través del tapón del frasco del producto (fig. 6). El vacío en el frasco del producto hace que el disolvente entre en el frasco del producto.
- Agite suavemente el frasco del producto para ayudar a disolver el polvo. No agite con fuerza, evite la formación de espuma. La solución es transparente o ligeramente opalescente.
- Luego, gire la parte azul del sistema de transferencia junto con el frasco del disolvente en la dirección opuesta a la de las agujas del reloj (fig. 7). Deseche el frasco del disolvente con la parte azul del sistema de transferencia conectada. Ahora se ve la conexión de bloqueo de luer.
La solución reconstituida debe usarse inmediatamente después de la reconstitución. No use soluciones que estén turbias o contengan partículas sólidas.
Administración:
- Después de reconstituir el polvo como se describe anteriormente, conecte la jeringa proporcionada al conector de bloqueo de luer del frasco del producto con la parte blanca del sistema de transferencia (fig. 8). Esto permitirá una fácil extracción de la solución reconstituida a la jeringa. No se requiere un filtro separado, ya que el sistema de transferencia está equipado con un filtro integrado.
- Con cuidado, separe el frasco con la parte blanca del sistema de transferencia de la jeringa. Inyecte lentamente el producto en una vena utilizando la aguja de mariposa proporcionada. Se recomienda no administrar más de 2-3 ml/minuto.
- Después de usar la aguja de mariposa, puede cubrirla con una cubierta de protección.
Uso de una dosis mayor de la recomendada de Haemoctin
Si el paciente cree que ha recibido una dosis demasiado grande de Haemoctin, debe consultar a su médico, quien tomará la decisión sobre el tratamiento posterior.
Omision de la administración de Haemoctin
En tal caso, el médico que lo atiende decidirá si es necesario continuar con el tratamiento.
Interrupción del tratamiento con Haemoctin
No debe interrumpir el tratamiento con Haemoctin sin consultar a su médico.
En caso de dudas adicionales sobre el uso de este medicamento, debe consultar a su médico o farmacéutico.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
En caso de observar alguno de los siguientes síntomas, debe informar a su médico de inmediato:
- enrojecimiento de la piel,
- sensación de ardor y picazón en el lugar de la inyección,
- escalofríos,
- enrojecimiento repentino de la cara,
- dolor de cabeza,
- urticaria,
- hipotensión,
- letargo,
- náuseas,
- inquietud,
- taquicardia,
- opresión en el pecho,
- entumecimiento,
- vómitos,
- respiración sibilante. Esto puede ser una reacción alérgica o una reacción alérgica grave (anafilaxia) o una reacción de hipersensibilidad.
Los siguientes efectos adversos se han observado con el uso de Haemoctin
Frecuencia desconocida: no puede establecerse a partir de los datos disponibles
- anafilaxia (shock), reacción alérgica
- enrojecimiento de la piel, picazón, urticaria
En niños no tratados previamente con medicamentos que contienen factor VIII, los anticuerpos bloqueadores (ver punto 2) pueden ocurrir muy frecuentemente (más de 1 de cada 10 pacientes). Sin embargo, en pacientes que han sido tratados previamente con factor VIII (más de 150 días de tratamiento), el riesgo es poco frecuente (menos de 1 de cada 100 pacientes). Si esto sucede, los medicamentos del paciente pueden dejar de funcionar correctamente y el paciente puede experimentar una hemorragia persistente. Si esto sucede, debe comunicarse de inmediato con su médico.
Efectos adversos en niños y adolescentes
Con la excepción de la formación de inhibidores (anticuerpos), se prevé que los efectos adversos en niños sean los mismos que en adultos.
Notificación de efectos adversos
Si ocurren algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Productos Medicinales de la Agencia de Registro de Productos Medicinales, Dispositivos Médicos y Productos Biocidas
Al. Jerozolimskie 181C
02 222 Varsovia
Tel.: +48 22 49 21 301
Fax: +48 22 49 21 309
Sitio web: https://smz.ezdrowie.gov.pl
Los efectos adversos también pueden notificarse al titular de la responsabilidad.
La notificación de efectos adversos permitirá recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Haemoctin
Debe conservar el medicamento en un lugar que no sea accesible para los niños.
Conservar los frascos en el paquete exterior para protegerlos de la luz.
No conservar a una temperatura superior a 25°C. No congelar.
No usar este medicamento después de la fecha de caducidad que figura en la etiqueta del frasco y en el paquete exterior después de: Fecha de caducidad.
Debe eliminar cualquier resto de producto no utilizado o sus residuos de acuerdo con las regulaciones locales. No debe tirar los medicamentos por el desagüe ni por los contenedores de basura domésticos.
Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Haemoctin?
- El principio activo del medicamento es: factor de coagulación VIII humano.
- Los demás componentes son: glicina, cloruro de sodio, citrato de sodio y cloruro de calcio.
- El frasco del disolvente contiene agua para inyección.
Cómo se presenta Haemoctin y qué contiene el paquete?
Haemoctin se presenta en forma de polvo liofilizado (liofilizado). El agua para inyección se utiliza como disolvente. La solución reconstituida es transparente o ligeramente opalescente.
Haemoctin 250 contiene 1 frasco con 250 UI y 1 frasco con 5 ml de agua para inyección (50 UI/ml)
Haemoctin 500 contiene 1 frasco con 500 UI y 1 frasco con 5 ml de agua para inyección (100 UI/ml)
Haemoctin 1000 contiene 1 frasco con 1000 UI y 1 frasco con 5 ml de agua para inyección (200 UI/ml)
Cada paquete contiene
- 1 jeringa de un solo uso
- 1 sistema de transferencia con filtro integrado
- 1 aguja de mariposa
Titular de la responsabilidad y fabricante:
Biotest Pharma GmbH
Landsteinerstrasse 5
63303 Dreieich
Alemania
Tel.: +49 6103 801-0
Fax: +49 6103 801-150
Correo electrónico: [email protected]
Fecha de la última actualización de la hoja de instrucciones: 12/2022.
Información destinada exclusivamente al personal médico especializado:
Monitoreo del tratamiento
Para determinar la dosis que se debe administrar y la frecuencia de las infusiones repetidas, se recomienda un monitoreo adecuado de los niveles de factor VIII durante el tratamiento. Los pacientes individuales pueden variar en su respuesta al factor VIII, mostrando diferentes valores de vida media y diferentes niveles de recuperación. La dosis basada en el peso corporal puede requerir ajustes en pacientes con bajo peso o sobrepeso. Especialmente en el caso de procedimientos quirúrgicos importantes, es necesario un control preciso del tratamiento de reemplazo a través de pruebas de coagulación (actividad del factor VIII en suero).
En el caso de la prueba de coagulación in vitrode una etapa basada en el tiempo de tromboplastina parcial activada (aPTT) para determinar la actividad del factor VIII en muestras de sangre de pacientes, tanto el tipo de reactivo aPTT como el estándar de referencia utilizado en la prueba pueden tener un impacto significativo en los resultados de la determinación de la actividad del factor VIII en suero. También pueden ocurrir diferencias significativas entre los resultados de la prueba de coagulación de una etapa basada en aPTT y los resultados de la prueba cromogénica de acuerdo con la Farmacopea Europea. Esto es especialmente importante en el caso de cambios en el laboratorio y (o) los reactivos utilizados en la prueba.
Dosificación
La dosis y la duración del tratamiento de reemplazo dependen del grado de deficiencia de factor VIII, de la ubicación y la extensión de la hemorragia y del estado clínico del paciente.
La cantidad de unidades de factor VIII se expresa en unidades internacionales (UI), que se refieren al estándar actual de la OMS para los productos que contienen factor VIII. La actividad del factor VIII en suero se expresa como porcentaje (en relación con el suero humano normal) o mejor en unidades internacionales (en relación con el estándar internacional de factor VIII en suero).
Una unidad internacional (UI) de actividad del factor VIII es igual a la cantidad de factor VIII en 1 mililitro de suero humano normal.
Tratamiento a demanda
El cálculo de la dosis de factor VIII requerida se basó en la observación empírica de que 1 UI de factor VIII por kilogramo de peso corporal produce un aumento de la actividad del factor VIII en suero de 1 a 2% de la actividad normal. La dosis requerida se calcula según la siguiente fórmula:
Dosis requerida = peso corporal (kg) × aumento deseado del factor VIII (%) × 0,5
La cantidad requerida para administrar y la frecuencia de administración siempre deben adaptarse a la eficacia clínica en cada caso.
En el caso de los siguientes tipos de hemorragias, la actividad del factor VIII en suero no debe caer por debajo del nivel de actividad indicado en el siguiente cuadro:
Gravedad de la hemorragia /
Tipo de procedimiento quirúrgico
Nivel de factor VIII requerido (%)
Frecuencia de dosis (horas) /
Duración del tratamiento (días)
Hemorragia
Hemorragia temprana en las articulaciones,
músculos o hemorragia en la boca
- 20 - 40 Repetir cada 12-24 horas. Al menos 1 día, hasta que cese el dolor causado por la hemorragia o hasta que se cure la herida. Hemorragia más severa en las articulaciones, músculos o hemorragia que pone en peligro la vida
- 30 - 60 Repetir cada 12-24 horas durante 3-4 días o más, hasta que cese el dolor y la discapacidad aguda. Hemorragias que ponen en peligro la vida
- 60 - 100 Repetir cada 8-24 horas hasta que cese el peligro.
Procedimientos quirúrgicos
Procedimiento quirúrgico menor
incluyendo la extracción de dientes
- 30 - 60 Cada 24 horas, al menos 1 día, hasta que se cure la herida. Procedimiento quirúrgico mayor
- 80 - 100 (pre y postoperatorio) Repetir cada 8-24 horas hasta que se logre una curación adecuada de la herida, y luego continuar durante al menos 7 días, para mantener la actividad del factor VIII en un nivel de 30-60%.
Profílaxis
En la profilaxis a largo plazo de hemorragias en pacientes con hemofilia A grave, las dosis de factor VIII suelen ser de 20-40 UI/kg de peso corporal cada 2-3 días. En algunos casos, especialmente en pacientes más jóvenes, pueden ser necesarios intervalos más cortos entre dosis o dosis más altas.
Vía de administración:
Administración intravenosa. Se recomienda no administrar más de 2-3 ml/minuto.
Debe usar exclusivamente el conjunto de infusión proporcionado, ya que la adsorción del factor VIII en las superficies internas de algunos conjuntos de infusión puede provocar el fracaso del tratamiento.
No debe mezclar Haemoctin con otros productos medicinales.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorBiotest Pharma GmbH
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Iaemoctin 1000Forma farmacéutica: Polvo, 1000 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere recetaForma farmacéutica: Polvo, 2000 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere recetaForma farmacéutica: Polvo, 250 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere receta
Alternativas a Iaemoctin 1000 en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Iaemoctin 1000 en Іспанія
Alternativa a Iaemoctin 1000 en Україна
Médicos online para Iaemoctin 1000
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Iaemoctin 1000 – sujeta a valoración médica y normativa local.














